元素周期表中主族与零族元素原子结构示意图
- 格式:doc
- 大小:305.50 KB
- 文档页数:2


s区元素的单质均为金属晶体;p区元素的中间部分,其单质的晶体结构较为复杂,有的为原子晶体,有的是过渡型(链状或层状)晶体,有的为分子晶体。
周期系最右方的非金属和稀有气体则全部为分子晶体。
总的来看,同一周期元素的单质,从左到右,一般由典型的金属晶体经过原子晶体、层状晶体或链状晶体等,最后过渡到分子晶体。
同一族元素单质由上而下,常由分子晶体或原子晶体过渡到金属晶体。
副族元素单质均为金属晶体.表9-5 主族及零族元素单质的晶体类型ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 零一H2分子晶体He分子晶体二Li金属晶体Be金属晶体B原子晶体C金刚石原子晶体石墨片状结构晶体富勒烯碳原子簇分子晶体N2分子晶体O2分子晶体F2分子晶体Ne分子晶体三Na金属晶体Mg金属晶体Al金属晶体Si原子晶体P白磷为分子晶体黑磷为层状结构晶体S斜方硫、单斜硫为分子晶体弹性硫为链状结构晶体Cl2分子晶体Ar分子晶体四K金属晶体Ca金属晶体Ga金属晶体Ge原子晶体As黑砷为分子晶体灰砷为层状结构晶体Se红硒为分子晶体灰硒为链状结构晶体Br2分子晶体Kr分子晶体五Rb金属晶体Sr金属晶体In金属晶体Sn灰锡为原子晶体白锡为金属结构晶体Sb黑锑为分子晶体灰锑为层状结构晶体Te灰碲链状结构晶体I2分子晶体Xe分子晶体六Cs金属晶体Ba金属晶体Tl金属晶体Pb金属晶体Bi层状结构晶体(近于金属晶体)Po金属晶体At金属晶体(具有某些金属性)Rn分子晶体单质的晶体结构和物理性质表9-5列出了主族及零族元素单质的晶体类型。
可以看出:s区元素的单质均为金属晶体;p区元素的中间部分,其单质的晶体结构较为复杂,有的为原子晶体,有的是过渡型(链状或层状)晶体,有的为分子晶体。
周期系最右方的非金属和稀有气体则全部为分子晶体。
总的来看,同一周期元素的单质,从左到右,一般由典型的金属晶体经过原子晶体、层状晶体或链状晶体等,最后过渡到分子晶体。
同一族元素单质由上而下,常由分子晶体或原子晶体过渡到金属晶体。

元素周期表和原子结构元素周期表是化学中最重要的工具之一,它以有序的方式展示了所有已知的化学元素。
而原子结构则是解释元素周期表的基础,它涉及到原子的内部构造,包括电子、质子和中子的排列方式。
元素周期表发展历史元素周期表的发展始于19世纪中期。
最初,元素是按照它们的物理和化学性质进行分类的。
然而,随着更多元素的发现,这种分类方法变得混乱不堪。
1869年,俄国化学家门捷列夫提出了现代元素周期表的初步版本,他按照原子量将元素排列成一行,并注意到一些元素具有相似的化学性质。
结构特点现代元素周期表有7个横行,称为周期,和18个纵列,称为族。
周期表中的元素按照原子序数递增的顺序排列。
每个周期代表了一个主能级的电子,而每个族则代表了具有相同价电子数的元素。
周期表中的每个周期都反映了原子核外电子的能级。
第一周期有2个元素,因为它们只具有一个电子层;第二周期有8个元素,因为它们具有两个电子层,依此类推。
第7周期是目前周期表中的最后一个周期,它包含了超过100个元素。
族,也称为族群或列,代表了具有相同价电子数的元素。
价电子是原子中最外层电子,它们参与化学反应。
族可以分为主要族、过渡族和镧系元素。
主要族元素包括1A到8A族,它们分别有1到8个价电子。
过渡族元素位于d区,它们具有不完整的d轨道。
镧系元素位于f区,它们具有不完整的f轨道。
周期表中的元素还可以根据它们的电子排布分为s块、p块、d块和f块。
s块元素包括第1A和2A族,它们的最外层电子属于s轨道。
p块元素包括第13A到18A族,它们的最外层电子属于p轨道。
d块元素包括第3B到12B族,它们的最外层电子属于d轨道。
f块元素包括镧系元素和锕系元素,它们的最外层电子属于f轨道。
原子结构原子是构成物质的基本单元。
它由原子核和核外电子组成。
原子核位于原子的中心,由质子和中子组成,质子带正电,中子不带电。
核外电子则绕着原子核运动,它们带有负电。
电子是原子的最小带电粒子,它们具有负电。







第四章物质结构元素周期律第一节原子结构与元素周期表本章内容是继氧化还原反应和离子反应之后又一个化学的理论知识点,通过本章的学习可以体会化学也是有规律可循的,本节内容是本章的基础,也是整个周期表周期律的基础,这一节学不好,就很难体会化学上结构决定性质的奥秘,也就很难体会化学的规律性,本节内容共有13个重点内容,静下心来慢慢体会吧!一、核外电子排布的表示方法(1)原子结构示意图①小圆圈和圆圈内的符号及数字表示原子核及核内质子数。
②弧线表示电子层。
③弧线内数字表示该层中的电子数。
(2)离子结构示意图①当主族中的金属元素原子失去最外层所有电子变为离子时,电子层数减少一层,形成与少一个电子层的稀有气体元素原子相同的电子层结构。
②非金属元素的原子得电子形成简单离子时,形成与电子层数相同的稀有气体元素原子相同的电子层结构。
(2020·上海市奉贤区奉城高级中学高一期末)有四种微粒的结构示意图,下列叙述中错误的是()它们属于不同种元素它们的核外电子排布相同它们都是离子它们都具有稀有气体原子的稳定结构【答案】C【分析】根据结构示意图分析可得,四种微粒分别为O2-、Ne、Mg2+和Al3+。
【详解】由分析可知,它们属于不同元素,故A不选;根据结构示意图,它们的核外电子排布相同,故B不选;由分析可知,第二种微粒不是离子,是氖原子,故C选;稀有气体原子最外层有8个电子(氦有2个),是稳定结构,第二种微粒就是Ne,其他几种微粒都和Ne的原子结构相同,故D不选;故选C。
二、明确符号A Z X±c n±m中各个字母的含义并了解它们之间的关系(1)质量数(A)=质子数(Z)+中子数(N),质量数可近似地代替原子的相对原子质量。
(2)原子的核外电子总数=质子数=核电荷数=原子序数。
(3)阳离子M n+的核外电子数=质子数-n;阴离子N n-的核外电子数=质子数+n。
(2020·福建南安市·高一期中)科学研究表明,月球上有丰富的He资源,可开发利用作未来的新型能源。
知识网络 中子N原子核 质子Z (带正电荷) → 核电荷数原子结构 :电子数(Z 个): 化学性质及最高正价和族序数核外电子 排布规律 → 电子层数 周期序数及原子半径表示方法 → 原子(离子)的电子式、原子结构示意图随着原子序数(核电荷数)的递增:元素的性质呈现周期性变化①、原子最外层电子的周期性变化(元素周期律的本质)元素周期律 ②、原子半径的周期性变化③、元素主要化合价的周期性变化④、元素的金属性与非金属性的周期性变化①、按原子序数递增的顺序从左到右排列;元素周期律和 排列原则 ②、将电子层数相同的元素排成一个横行; 元素周期表 ③、把最外层电子数相同的元素(个别除外)排成一个纵行。
①、短周期(一、二、三周期)周期(7个横行) ②、长周期(四、五、六周期) 周期表结构 ③、不完全周期(第七周期) 决定原子呈电中性编排依据X)(A Z 七主七副零和八三长三短一不全决定元素种类①、主族(ⅠA~ⅦA共7个)元素周期表族(18个纵行)②、副族(ⅠB~ⅦB共7个)③、Ⅷ族(8、9、10纵行)④、零族(稀有气体)同周期同主族元素性质的递变规律①、核外电子排布②、原子半径性质递变③、主要化合价④、金属性与非金属性⑤、气态氢化物的稳定性⑥、最高价氧化物的水化物酸碱性电子层数相同条件下,电子层越多,半径越大。
判断的依据核电荷数相同条件下,核电荷数越多,半径越小。
最外层电子数相同条件下,最外层电子数越多,半径越大。
微粒半径的比较 1、同周期元素的原子半径随核电荷数的增大而减小(稀有气体除外)如:Na>Mg>Al>Si>P>S>Cl.2、同主族元素的原子半径随核电荷数的增大而增大。
如:Li<Na<K<Rb<Cs具体规律 3、同主族元素的离子半径随核电荷数的增大而增大。
如:F--<Cl--<Br--<I--4、电子层结构相同的离子半径随核电荷数的增大而减小。
知识网络 中子N原子核质子Z原子结构 :电子数(Z 个)核外电子 排布规律 → 电子层数 周期序数及原子半径表示方法 → 原子(离子)的电子式、原子结构示意图随着原子序数(核电荷数)的递增:元素的性质呈现周期性变化①、原子最外层电子的周期性变化(元素周期律的本质)元素周期律 ②、原子半径的周期性变化③、元素主要化合价的周期性变化④、元素的金属性与非金属性的周期性变化①、按原子序数递增的顺序从左到右排列;元素周期律和 排列原则 ②、将电子层数相同的元素排成一个横行;元素周期表 ③、把最外层电子数相同的元素(个别除外)排成一个纵行。
①、短周期(一、二、三周期) 周期(7个横行) ②、长周期(四、五、六周期) 周期表结构 ③、不完全周期(第七周期) ①、主族(ⅠA ~ⅦA 共7个) 元素周期表 族(18个纵行) ②、副族(ⅠB ~ⅦB 共7个) ③、Ⅷ族(8、9、10纵行) ④、零族(稀有气体)同周期同主族元素性质的递变规律①、核外电子排布②、原子半径性质递变 ③、主要化合价④、金属性与非金属性⑤、气态氢化物的稳定性⑥、最高价氧化物的水化物酸碱性电子层数 相同条件下,电子层越多,半径越大。
判断的依据 核电荷数 相同条件下,核电荷数越多,半径越小。
决定原子呈电中性 编排依据 X)(A Z 七主七副零和八三长三短一不全最外层电子数 相同条件下,最外层电子数越多,半径越大。
微粒半径的比较1、同周期元素的原子半径随核电荷数的增大而减小(稀有气体除外)如:Na>Mg>Al>Si>P>S>Cl.2、同主族元素的原子半径随核电荷数的增大而增大。
如:Li<Na<K<Rb<Cs具体规律 3、同主族元素的离子半径随核电荷数的增大而增大。
如:F --<Cl --<Br --<I --4、电子层结构相同的离子半径随核电荷数的增大而减小。
如:F -> Na +>Mg 2+>Al 3+5、同一元素不同价态的微粒半径,价态越高离子半径越小。
元素周期表编稿:房鑫审稿:曹玉婷【学习目标】1.了解原子序数与原子结构间的关系。
2.了解元素周期表的编排原则,知道周期和族的表示方法。
3.了解元素周期表的基本结构,知道主族和副族的概念。
4.能从整体上把握元素周期表的结构,会正确表示元素在周期表中的位置。
5.以碱金属元素和卤族元素为例,了解原子结构与元素性质之间的关系,认识原子结构相似的一族元素在化学性质上表现出的相似性和递变性。
6.知道核素和同位素的含义。
【要点梳理】要点一、元素周期表的编排1.原子序数按照元素在周期表中的顺序给元素所编的序为原子序数。
原子序数=核电荷数=核内质子数=核外电子数(原子中)要点诠释:存在上述关系的是原子而不是离子,因为离子是原子失去或得到电子而形成的,所以在离子中:核外电子数=质子数加上或减去离子的电荷数。
2.现在的元素周期表的科学编排原则(1)将电子层数相同的元素按原子序数递增的顺序从左到右排成一横行,称为周期;(2)把最外层电子数相同(氦除外)的元素按电子层数递增的顺序从上到下排成纵行,称为族。
要点二、元素周期表的结构要点诠释:(1)周期:元素周期表有7个横行,也就是7个周期。
前三周期叫短周期,后四个周期叫长周期。
(2)族:常见的元素周期表共有18个纵行,从左到右分别叫第1纵行、第2纵行……第18个纵行。
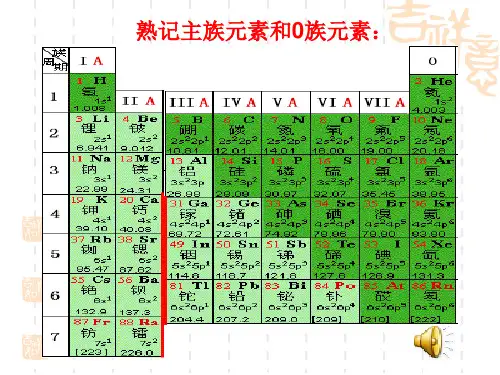
把其中的第8、9、10三个纵行称为第Ⅷ族,其余每一个纵行各称为一族,分为七个主族、七个副族和一个0族,共16个族。
族序数用罗马数字表示,主族用A、副族用B,并标在族序数的后边。
如ⅠA、ⅡA、ⅢA……ⅠB、ⅡB、ⅢB……(3)第18纵行的氦最外层有2个电子,其它元素原子的最外层都有8个电子,它们都已达到稳定结构,化学性质不活泼,化合价都定为0价,因而叫做0族。
(4)元素周期表中从第ⅢB族到第ⅡB族共10个纵行,包括了第Ⅷ族和全部副族,共60多种元素,全部为金属元素,统称为过渡元素。
(5)在周期表中根据组成元素的性质,有些族还有一些特别的名称。
能级组与周期的关系、族与原子的电子组态、元素在周期表中的分区、镧系元素、锕系元素、过渡元素、内过渡元素、有效核电荷、原子半径、元素电负性、电离能、电子亲和能、电负性、s区元素,p区元素,d区元素,ds区元素世界上有多少元素,自从门捷列夫发明元素周期表,人们发现新元素的步伐加快。
现在的元素周期表元素的数量已经排到了118号。
其中中国人修订了周期表中的十个元素(1991年以来十年)。
这些元素按原子量从小到大排列,呈现明显的周期性的规律。
元素性质决定于原子的内部结构,周期系中元素性质呈周期性的变化规律,就是原子结构周期性变化的体现。
元素周期表有7行,即7个周期。
从各元素原子的电子层结构可知,当主量子数n依次增加时,n每增加1个数值就增加一个新的电子层,周期表上就增加一个周期。
因此,元素在周期表中所处的周期数(用阿拉伯数字表示)就等于它的最外电子层数n。
而每一个周期所含原子数目与对应能级组最多能容纳的电子数目一致。
能级组和周期性的关系可参见表9-4。
在第4周期中,从21号钪(Sc)到30号锌(Zn),它们新增的电子都是填充到3d轨道上,这10种元素称为第4周期过渡元素。
从39号元素钇(Y)到48号元素镉(Cd),新增的电子都是填充到4d轨道上,这10种元素称为第5周期过渡元素。
在第6周期中,从57号元素镧(La)到70号元素镱(Yb),新增的电子都是依次填充在4f轨道上,这14种元素习惯上称为镧系元素。
从71号元素镥(Lu)到80号元素汞(Hg),新增加的电子则依次填充到5 d轨道上,这也是过渡元素。
第7周期,从87号元素钫(Fr)到112号元素(未有中文名)Uub,共25种元素是不完全周期,可以预计这一周期也应有32种元素,其中从89号元素锕(Ac)到102号元素锘(No),称为锕系元素。
主族:周期表中共有7个主族,ⅠA~ⅦA,凡内层轨道全充满,最后1个电子填入n s或n p 亚层上的,都是主族元素,价层电子的总数等于族数(用罗马数字表示),即等于n s、n p两个亚层上电子数目的总和。