上海杨浦高三物理复习--气体的性质专题
- 格式:doc
- 大小:351.77 KB
- 文档页数:12

气体的性质
1.气体的状态参量:
温度:宏观上,物体的冷热程度;微观上,物体内部分子无规则运动的剧烈程度的标志
热力学温度与摄氏温度关系:T=t+273 {T:热力学温度(K),t:摄氏温度(℃)}体积V:气体分子所能占据的空间,单位换算:1m3=103L=106mL
压强p:单位面积上,大量气体分子频繁撞击器壁而产生持续、均匀的压力,标准大气压:
1atm=1.013×105Pa=76cmHg(1Pa=1N/m2)
2.气体分子运动的特点:分子间空隙大;除了碰撞的瞬间外,相互作用力微弱;分子运动速率很大
3.理想气体的状态方程:p1V1/T1=p2V2/T2 {PV/T=恒量,T为热力学温度(K)}
注:
(1)理想气体的内能与理想气体的体积无关,与温度和物质的量有关;
(2)公式3成立条件均为一定质量的理想气体,使用公式时要注意温度的单位,t为摄氏温度(℃),而T为热力学温度(K)。

高考物理知识点总结复习 气体的性质19知识要点:基础知识气体的状态:气体状态,指的是某一定量的气体作为一个热力学系统在不受外界影响的条件下,宏观性质不随时间变化的状态,这种状态通常称为热力学平衡态,简称平衡态。
所说的不受外界影响是指系统和外界没有做功和热传递的相互作用,这种热力学平衡,是一种动态平衡,系统的性质不随时间变化,但在微观上分子仍永不住息地做热运动,而分子热运动的平均效果不变。
2、气体的状态参量:(1)气体的体积(V )① 由于气体分子间距离较大,相互作用力很小,气体向各个方向做直线运动直到与其它分子碰撞或与器壁碰撞才改变运动方向,所以它能充满所能达到的空间,因此气体的体积是指气体所充满的容器的容积。
(注意:气体的体积并不是所有气体分子的体积之和)② 体积的单位:米3(m 3) 分米3(dm 3) 厘米3(cm 3) 升(l ) 毫升(ml )(2)气体的温度(T )① 意义:宏观上表示物体的冷热程度,微观上标志物体分子热运动的激烈程度,是气体分子的平均动能大小的标志。
② 温度的单位:国际单位制中,温度以热力学温度开尔文(K )为单位。
常用单位为摄氏温度。
摄氏度(℃)为单位。
二者的关系:T=t+273(3)气体的压强(P )① 意义:气体对器壁单位面积上的压力。
② 产生:由于气体内大量分子做无规则运动过程中,对容器壁频繁撞击的结果。
③单位:国际单位:帕期卡(Pa )常用单位:标准大气压(atm ),毫米汞柱(mmHg )换算关系:1atm=760mmHg=1.013×105Pa1mmHg=133.3Pa3、气体的状态变化:一定质量的气体处于一定的平衡状态时,有一组确定的状态参量值。
当气体的状态发生变化时,一般说来,三个参量都会发生变化,但在一定条件下,可以有一个参量保持不变,另外两个参量同时改变。
只有一个参量发生变化的状态变化过程是不存在的。
4、气体的三个实验定律(1)等温变化过程——玻意耳定律① 内容:一定质量的气体,在温度不变的情况下,它的压强跟体积成反比。

盘点高考物理第二轮复习气体的性质知识要点为方便宽敞考生高考复习,查字典物理网整理了气体的性质知识要点,期望能助各位考生一臂之力。
气体的性质
1.气体的状态参量:外语学习网
温度:宏观上,物体的冷热程度;微观上,物体内部分子无规则运动的剧烈程度的标志
热力学温度与摄氏温度关系:T=t+273 {T:热力学温度(K),t:摄氏温度(℃)}
体积V:气体分子所能占据的空间,单位换算:1m3=103L=106mL
压强p:单位面积上,大量气体分子频繁撞击器壁而产生连续、平均的压力,标准大气压:
1atm=1.013105Pa=76cmHg(1Pa=1N/m2)
2.气体分子运动的特点:分子间间隙大;除了碰撞的瞬时外,相互作用力柔弱;分子运动速率专门大
3.理想气体的状态方程:p1V1/T1=p2V2/T2 {PV/T=恒量,T为热力学温度(K)}
注:
(1)理想气体的内能与理想气体的体积无关,与温度和物质的量有关;
(2)公式3成立条件均为一定质量的理想气体,使用公式时要注意温度的单位,t为摄氏温度(℃),而T为热力学温度(K)。
盘点高考物理第二轮复习气体的性质知识要点是由编辑老师整理的高考复习相关信息,期望对您有所关心,更多信息查找请关注查字典物理网高考频道!。

【高三学习指导】2021年高考物理知识点:气体的性质【摘要】历届
高中三年级
同学都有一个共同体会:高三的专项复习见效最快。
高考一轮复习正是打基础,逐一击破的阶段。
同学们一定要有一颗持之以恒的心,的2021年高考物理知识点:气体的性质,帮助大家有效复习!
气体的性质
1.气体的状态参量:
温度:宏观上,物体的冷热程度;在显微镜下,它是物体内部分子不规则运动强度的标志
热力学温度与摄氏温度关系:t=t+273{t:热力学温度(k),t:摄氏温度(℃)}
体积五:气体分子所占空间,单位换算:1m3=103l=106ml
压强p:单位面积上,大量气体分子频繁撞击器壁而产生持续、均匀的压力,标准大气压:
1atm=1.013×105pa=76cmhg(1pa=1n/m2)
2.气体分子运动的特点:分子间空隙大;除了碰撞的瞬间外,相互作用力微弱;分子运动速率很大
3.理想气体状态方程:p1V1/T1=P2V2/T2{pv/T=常数,T为热力学温度(k)
注:
(1)理想气体的内能与理想气体的体积无关,而与温度和物质的量有关;
(2)公式3成立条件均为一定质量的理想气体,使用公式时要注意温度的单位,t为摄氏温度(℃),而t为热力学温度(k)。
结论:以上是“2022”
高考
相关亮点:。

高考物理第一轮复习知识要点:气体的性质为方便宽敞考生高考复习,查字典物理网整理了2021年高考物理第一轮复习知识要点:气体的性质,期望能助各位考生一臂之力。
气体的性质
1.气体的状态参量:外语学习网
温度:宏观上,物体的冷热程度;微观上,物体内部分子无规则运动的剧烈程度的标志
热力学温度与摄氏温度关系:T=t+273 {T:热力学温度(K),t:摄氏温度(℃)}
体积V:气体分子所能占据的空间,单位换算:1m3=103L=106mL
压强p:单位面积上,大量气体分子频繁撞击器壁而产生连续、平均的压力,标准大气压:
1atm=1.013105Pa=76cmHg(1Pa=1N/m2)
2.气体分子运动的特点:分子间间隙大;除了碰撞的瞬时外,相互作用力柔弱;分子运动速率专门大
3.理想气体的状态方程:p1V1/T1=p2V2/T2 {PV/T=恒量,T为热力学温度(K)}
注:
(1)理想气体的内能与理想气体的体积无关,与温度和物质的量有关;
(2)公式3成立条件均为一定质量的理想气体,使用公式时要注意温度的单位,t为摄氏温度(℃),而T为热力学温度(K)。
2021年高考物理第一轮复习知识要点:气体的性质是由编辑老师整理的高考复习相关信息,期望对您有所关心,更多信息查找请关注查字典物理网高考频道!。
高中物理气体知识点总结一、气体的性质1. 气体的无定形:气体没有固定的形状和体积,能够自由流动。
2. 气体的可压缩性:由于气体分子之间的间距较大,气体易受到外界压力的影响而发生压缩或膨胀。
3. 气体的弹性:气体分子之间存在相互作用力,当气体受到外力作用时,能够产生弹性形变。
二、气体的状态方程1. 理想气体状态方程:PV = nRT,其中P为气体的压强,V为气体的体积,n为气体的物质的量,R为气体常数,T为气体的绝对温度。
2. 理想气体状态方程的应用:可以用于计算气体的压强、体积、物质的量和温度之间的关系,也适用于气体的混合、稀释等情况。
三、气体的压强1. 气体的压强定义:单位面积上气体分子对容器壁的撞击力。
2. 压强的计算公式:P = F/A,其中P为压强,F为气体分子对容器壁的撞击力,A为单位面积。
3. 压强的单位:国际单位制中,压强的单位为帕斯卡(Pa)。
4. 大气压:大气对地面单位面积上的压强,标准大气压为101325Pa。
四、气体的温度1. 气体的温度定义:气体分子的平均动能的度量。
2. 温度的单位:国际单位制中,温度的单位为开尔文(K)。
3. 摄氏度和开尔文度的转换:T(K) = t(℃) + 273.15。
五、气体的分子速率与平均动能1. 气体分子速率的分布:气体分子的速率服从麦克斯韦速率分布定律,速率越高的分子数目越少。
2. 平均动能与温度的关系:气体的平均动能与温度成正比,温度越高,气体分子的平均动能越大。
六、理想气体的压强与温度的关系1. Gay-Lussac定律:在等体积条件下,理想气体的压强与温度成正比,P1/T1 = P2/T2。
2. Charles定律:在等压条件下,理想气体的体积与温度成正比,V1/T1 = V2/T2。
3. 综合气体状态方程和Gay-Lussac定律、Charles定律,可以得到压强、体积和温度之间的关系。
七、气体的扩散和扩散速率1. 气体的扩散:气体分子由高浓度区域向低浓度区域的自由运动过程。
物理高考气体知识点归纳在物理高考中,气体是一个非常重要的知识点。
掌握了气体的基本概念、性质以及气体状态方程等知识,对于理解各类物理问题是至关重要的。
下面将对物理高考中与气体有关的知识点进行归纳总结。
一、气体的基本概念和性质气体是物质的一种状态,具有以下特点:1. 无定形:气体没有固定的形状和容积,它会充满整个容器。
2. 可压缩性:由于气体分子之间的间隙较大,因此气体具有很高的可压缩性。
3. 高速运动:气体分子具有较高的平均动能,它们以高速无规则地运动着。
4. 无固定形状体积:气体的体积可以随着外界条件的变化而改变。
二、理想气体状态方程理想气体状态方程描述了气体的状态随温度、压强和体积的关系,表达式为:PV = nRT其中,P表示气体的压强,V表示气体的体积,n表示气体的摩尔数,R表示气体常数,T表示气体的温度(单位为开尔文)。
三、气体的压强1. 大气压:大气压是指地球表面上空气对单位面积的压强,通常用帕斯卡(Pa)来表示,常用单位还有千帕(kPa)和标准大气压。
2. 海拔高度对气压的影响:随着海拔高度的增加,大气压逐渐降低,这是因为在海拔较高的地方,大气的分子数量变少,分子间的相互碰撞减少,从而导致气压降低。
四、理想气体的性质和实验规律1. 法尔查聊天法则:规定了在恒温下,单位质量的气体在同等条件下相等体积内占据的体积与绝对温度的比值是常数。
2. 查理定律:规定了在恒压下,单位质量的气体在等升温度下升高的温度与其初温的比值是常数。
3. 道尔顿分压定律:规定了混合气体中各个组分的分压之和等于该气体在其中所占比例的总压力。
5. 隔膜法则:气体在容器内只能通过可被视为隔膜的孔进出,这些孔的直径要求较小,以保证气体分子间的平均自由程较大。
六、麦克斯韦速率分布定律麦克斯韦速率分布定律描述了气体分子的速度分布关系。
该定律表明,气体分子的速度服从一个正态分布,并且分子速度的平均值与温度有关。
七、气体的热力学过程1. 绝热过程:绝热过程是指在没有热量交换的情况下,气体的温度、压力和体积发生变化的过程。
高三物理气体知识点总结物理学中的气体是研究物质的一种状态,具有一定的可压缩性和可扩散性。
在高三物理学习中,气体是一个重要且常见的研究对象。
下面将对高三物理中涉及的气体知识点进行总结。
一、理想气体状态方程理想气体状态方程是描述气体状态的重要公式。
该方程可以用来计算理想气体在不同条件下的状态,其表达式为 PV = nRT。
其中,P表示气体的压强,V代表气体的体积,n是物质的物质的摩尔数,R是气体常数,T代表气体的绝对温度。
二、理想气体的性质1. 压强与体积的关系:理想气体的等温变化过程中,压强与体积成反比关系。
这一原理可以由理想气体状态方程推导得出。
2. 温度与分子平均动能的关系:根据气体动理论,理想气体的温度与分子的平均动能成正比,温度越高,分子的平均动能越大。
3. 等压过程的热容:理想气体在等压过程中,吸热量与温度变化成正比。
这可以用来计算理想气体在等压条件下的热容。
4. 等容过程的热容:理想气体在等容过程中,热容与分子自由度相关。
对于单原子分子气体,其热容为常数;对于双原子分子气体,其热容和温度有关。
三、理想气体的内能变化理想气体的内能变化包括两个方面:外部对气体做功和气体吸收或放出的热量。
在等温过程中,理想气体的内能变化仅与吸收或放出的热量有关;在绝热过程中,理想气体的内能变化仅与对外界做功有关。
四、气体的等温变化气体在等温变化过程中,温度保持不变。
根据理想气体状态方程,可以推导出等温过程中压强与体积呈反比的关系。
在等温膨胀和等温压缩过程中,气体吸收或放出的热量与做的功相等。
五、气体的绝热变化气体在绝热变化过程中,没有与外界的热交换。
根据绝热过程的条件,可以推导出绝热过程中的压强和体积的关系。
在绝热膨胀和绝热压缩过程中,气体的内能变化仅由对外界做的功决定。
六、气体混合与溶解1. 理想气体的混合:不同气体可以相容混合,混合后的气体压强为各组分压强之和。
2. 气体的溶解:气体可以溶解在液体中,溶解度受气压的影响。
高三物理气体选修知识点在高三物理学习中,气体是一个重要的知识点。
掌握气体的性质、状态方程、分子运动和热力学过程等方面的知识,对于理解物质的宏观特性以及解决实际问题具有重要意义。
本文将介绍高三物理气体选修知识点,帮助同学们更好地掌握这一部分内容。
一、气体的性质在研究气体的性质时,常用的参数有压力、温度和体积。
压力是气体对容器壁的作用力,可用于描述气体的强弱程度;温度则与气体的分子平均动能直接相关;体积是气体所占据的空间大小。
二、状态方程气体的状态方程描述了气体的状态与压力、温度以及体积之间的关系。
理想气体状态方程可以表示为PV=nRT,其中P为气体的压力,V为气体的体积,n为气体的物质量,R为气体常数,T为气体的温度。
对于理想气体,该状态方程成立;而对于实际气体,可能需要考虑修正。
三、分子运动气体的性质与其中分子的运动方式密切相关。
分子在气体中以高速运动,并作无规则的碰撞。
分子间的碰撞会导致气体的压强,而分子运动的速度与温度直接相关。
分子运动的平均自由程与气体分子数量和体积之间有关,可用于描述气体的稀薄程度。
四、热力学过程热力学过程是气体学习的重点之一,主要包括等温过程、绝热过程、等容过程和等压过程。
在等温过程中,气体的温度保持不变,体积和压力呈反比关系;绝热过程中,气体无法与外界交换热量,体积和压力呈反比关系;等容过程中,体积保持不变,温度和压力呈正比关系;等压过程中,压力保持不变,温度和体积呈正比关系。
五、理想气体与实际气体理想气体是用来简化描述气体行为的模型,其中假设气体分子无体积、无吸引力和无相互作用。
实际气体则考虑了分子间的相互作用和体积,其状态方程需要进行修正,例如范德瓦尔斯方程和爱因斯坦方程。
六、气体的溶解度气体在液体中的溶解度也是气体学习的一部分。
溶解度与气体分压和温度成正比,与液体的性质有关。
亨利定律描述了气体在线性温度范围内的溶解度与分压的关系。
通过对以上知识点的学习,我们能够更好地理解气体的性质和行为规律,掌握气体的状态方程以及热力学过程。
第七章气体和内能专题考试内容和要求知识内容学习水平说明气体和内能固体的微观结构、液体的微观结构 A气体状态参量 B气体实验定律 C温度不变时压强与体积的关系(学生实验)C热力学温标 B理想气体理想气体状态方程A C分子、阿伏加德罗常数 B分子动能、分子势能 A物体的内能 A能量守恒定律 D用单分子油膜估测分子的大小(学生实验)B一.分子动理论与能的转化和能量守恒定律1.分子动理论的主要观点是:(1)物体是由组成的,分子直径的数量级是m;(2)分子永不停息地做运动;(3)分子之间存在相互作用的力和力,我们把分子间的这种作用力叫做。
2.由于分子做无规则热运动,因此分子具有能,分子热运动的平均动能与有关;由于分子间存在相互作用力,分子还具有能,分子势能与物体的和有关;物体内所有分子能和能的总和,叫做物体的能。
3.能够改变物体内能的两种物理过程是和,这两种物理过程虽然等效,但有本质的区别:是其他形式的能和内能之间的转化;而却是物体间内能的转移。
4.能量既不能产生,也不能消失,它只能从转化为,或者从转移,在转化或转移的过程中,其总量保持不变,这就是能的转化和能量守恒定律。
【典型例题】1.下面证明分子间存在引力和斥力的实验,哪个是错误..的()(A)两块铅块压紧以后能连成一块,说明存在引力(B)一般固体、液体很难压缩,说明存在着相互排斥力(C)拉断一根绳子需要一定大小的拉力,说明存在相互引力(D)碎玻璃不能拼在一块,是由于分子间存在斥力2.(1998上海)有关物体内能,以下说法正确的是()(A)1g0℃水的内能比1g0℃冰的内能大(B)电流通过电阻后发热,它的内能增加是通过“热传递”方式实现的(C)气体膨胀,它的内能一定减少(D)橡皮筋被拉伸时,分子间势能增加3.一个水分子的质量约为kg(1995上海),体积约为m3,1kg氢气共有个氢气分子。
4.(1990上海)从下列哪一组数据可以算出阿伏加德罗常数()(A)水的密度和水的摩尔质量(B)水的摩尔质量和水分子的体积(C)水的摩尔质量和水分子的质量(D)水分子的体积和水分子的质量5.(2008上海)体积为V的油滴,滴在平静的水面上,扩展成面积为S的单分子油膜,则该油滴的分子直径约为。
已知阿伏伽德罗常数为N A,油的摩尔质量为M,则一个油分子的质量为。
6.(2008上海)已知理想气体的内能与温度成正比。
如图所示的实线为汽缸内一定质量的理想气体由状态I到状态II的变化曲线,则在整个过程中汽缸内气体的内能()(A)先增大后减小(B)先减小后增大(C)单调变化(D)保持不变二.气体的状态和状态参量一定质量的气体的状态,是由、和三个参量决定的,对一定质量的气体来说,如果这三个量都不变,我们就说气体处于一定的状态中。
1.气体的体积(V)气体总要充满整个容器,因而气体的体积就是指气体所充满的容器的容积。
在标准状态下,1摩尔的任何气体所占的体积为。
1升(L)=1分米3(dm3),1毫升(ml)=1厘米3(cm3)2.气体的温度(t,T)表示物体的冷热程度(宏观定义),物体内分子运动的剧烈程度(微观定义)温标摄氏温标的单位是摄氏度,符号℃。
在国际单位制中,以热力学温标表示温度,又称绝对温标。
它是国际单位制中七个基本单位之一,单位是,符号。
热力学温度T与摄氏温度t的关系是:。
现在国际上公认的热力学温度的零度是,叫做,它是低温的极限,能够无限接近,但不可能达到。
就每一度的大小来说热力学温度和摄氏温度是相同的,即。
3.气体的压强(p)大量气体分子频繁撞击器壁,垂直作用在器壁单位面积上的平均压力,就是气体的压强。
在国际单位中,压强的单位是,简称,符号。
1标准大气压(atm)=厘米汞柱(cmHg)=Pa计算容器内气体压强时常以气体与外界的连接物为研究对象列力学方程求解。
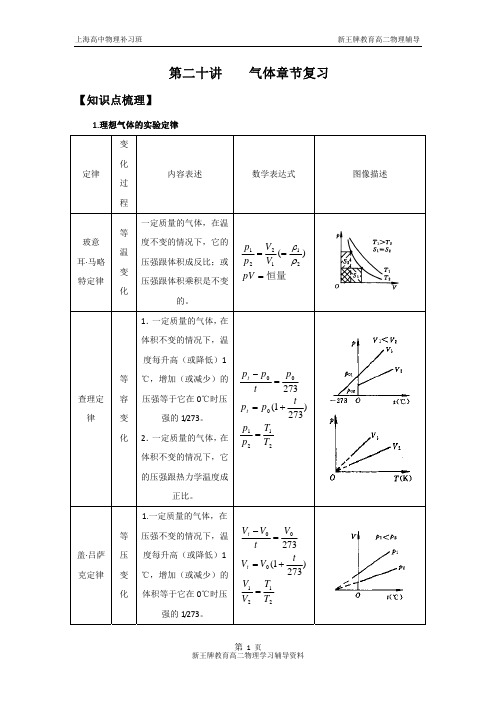
【典型例题】7.(2006上海)如图所示,竖直放置的弯曲管A端开口,B端封闭,密度为ρ的液体将两段空气封闭在管内,管内液面高度差分别为h1、h2和h3,则B端气体的压强为(已知大气压强为p 0)( )(A )p 0-ρg (h 1+h 2-h 3)(B )p 0-ρg (h 1+h 3)(C )p 0-ρg (h 1+h 3-h 2)(D )p 0-ρg (h 1+h 2)8.(2000广东)如图,一气缸竖直倒放,气缸内有一质量不可忽略的活塞,将一定量的理想气体封在气缸内,活塞与气缸壁无摩擦,气体处于平衡状态,现保持温度不变把气缸稍微倾斜一点,在达到平衡后,与原来相比,则( )(A )气体的压强变大(B )气体的压强变小(C )气体的体积变大(D )气体的体积变小三.气体实验定律4.玻意耳定律一定质量的气体,温度不变时压强与体积成反比。
p 1V 1=p 2V 2,pV =C (C 为常数,由温度与气体质量、种类决定,同种气体温度越高,质量越大,C 就越大)推论:p 1ρ1 =p 2ρ2【典型例题】9.(1999上海)某同学做“验证玻意耳定律”实验时,将注射器竖直放置,测得的数据如下表所示。
发现第5组数据中的pV 乘积值有较大偏差。
如果读数和计算无误,那么造成此偏差的原因可能是 或 。
实验次序1 2 3 4 5 p (105Pa )1.21 1.06 0.93 0.80 0.66 V (m l )33.2 37.8 43.8 50.4 69.2 pV (105Pa ·ml ) 40.240.1 40.7 40.3 45.710.有一内径均匀的一端开口的玻璃管长l =100cm ,其中有一段水银柱,把一部分空气封在管内。
当管开口向上竖直放置时,空气柱长l 1=60cm,水银柱长h=15cm,如图所示。
现将玻璃管缓慢倒转,到达开口向下的竖直位置,然后插入水银槽中,如图所示,当管底与管外水银面的高度差d=45cm时,空气柱的长度l2为多少厘米?设大气压p0=75cmHg,整个过程中温度保持不变。
11.如图所示,粗细均匀的U形玻璃管,臂长40 cm,宽为10 cm,有一5cm长的水银柱封闭着一段长为30cm的空气柱,若设法对开口端抽气,当开口端内空气压强从75cmHg降至45 cmHg高时,管中被封闭的空气柱长度是多少?12.(2004上海)如图所示,一端封闭、粗细均匀的薄壁玻璃管开口向下竖直插在装有水银的水银槽内,管内封闭有一定质量的空气,水银槽的截面积上下相同,是玻璃管截面积的5倍。
开始时管内空气长度为6cm,管内外水银面高度差为50cm。
将玻璃管沿竖直方向缓慢上移(管口末离开槽中水银),使管内外水银面高度差变成60cm。
(大气压相当于75cmHg),求:(1)此时管内空气柱的长度;(2)水银槽内水银面下降的高度。
13.气缸内封有压强为p,密度为ρ的理想气体,内中放有一质量为m,体积为V的空心小球。
活塞的横截面积为S,可无摩擦滑动。
现有一力F向右慢慢推活塞,如图所示。
问力F多大时,小球对气缸壁可无压力?(设大气压强为p0)5.查理定律一定质量的气体,体积不变时压强与热力学温度成正比。
p1T1=p2T2=ΔpΔT,pT=C(C为常数,由体积与气体质量、种类决定,同种气体体积越小,质量越大,C就越大)【典型例题】14.(1991上海)用如图所示的实验装置,研究体积不变时气体的压强与温度的关系,当时大气压为H厘米汞柱。
封有一定质量气体的烧瓶,浸在冰水混合物中,U形压强计可动管A和固定管B中的水银面刚好相平。
将烧瓶浸入温度为t℃的热水中时,B 管水银面将,这时应将A管,(以上二格填“上升”或“下降”),使B管中水银面。
记下此时A、B两管中水银面的高度差为h厘米,此状态下瓶中气体的压强为。
15.(1992上海)如图,某汞气压计的玻璃管顶端高出汞槽液面l m,因上部混入少量空气,使其读数不准。
当气温为27℃,标准气压计读数为76cmHg时,该气压计读数为70cmHg。
(1)在相同气温下,若用该气压计测量气压,测得读数68cmHg,则实际气压应为多少cmHg?(2)若在气温为-3℃时,用该气压计测得气压读数仍为70cmHg,则实际气压应为多少cmHg?16.(2003上海)某登山爱好者在攀登珠穆朗玛峰的过程中,发现他携带的手表表面玻璃发生了爆裂,这种手表是密封的,出厂时给出的参数为:27℃时表内气体压强为1×105Pa,在内外压强差超过6×104 Pa时,手表表面玻璃可能爆裂,已知当时手表处的气温为-13 C,则手表表面玻璃爆裂时表内气体压强的大小为Pa,已知外界大气压强随高度变化而变化,高度每上升12 m大气压强降低133 Pa,设海平面大气压为1×105 Pa,则登山运动员此时的海拔高度约为m。
17.(1997上海)有人设计了一种测温装置,其结构如图所示,玻璃泡A内封有一定量气体,与A相连的B管插在汞槽中,管内汞面的高度x即可反映泡内气体的温度,即环境温度,并可由B管上的刻度直接读出。
设B管的体积与A泡的体积相比可略去不计:(1)在1个标准大气压下对B管进行温度刻度(1个标准大气压相当于76cmHg的压强),已知当温度t=27℃时,管内汞面高度x1=16cm,此高度即为27℃的刻度线,问t=0℃时的刻度线x为多少厘米处?(2)若大气压已变为相当于75cmHg的压强,利用该测温装置测量温度时所得读数为27℃,问此时实际温度为多少?6.盖·吕萨克定律一定质量的气体,压强不变时体积与热力学温度成正比。
V1T1=V2T2=ΔVΔT,VT=C(C为常数,由压强与气体质量、种类决定,同种气体压强越小,质量越大,C就越大)推论:ρ1T1=ρ2T2【典型例题】18.(1985上海)如图所示,在球形烧瓶上连一根水平玻璃管,管中有一段汞柱把瓶中气体与外界大气隔开,将烧瓶从室温情况下浸入热水中,可以看到此时水平玻璃管中的汞柱将向移动,稳定后,气体的末状态温度,体积,压强,密度(填“变大”、“变小”或“不变”)19.一定质量的气体,在压强不变的情况下,温度从100℃升高到200℃,则其体积()(A)增大到原来的2倍(B)缩小到原来的1/2(C)增加原来的100/273 (D)增加原来的100/37320.食油的沸点超过200℃。
设有一滴0℃的水滴落到沸油中时,立即吸热而化为水蒸气。
试计算水滴汽化为100℃的水蒸气时,其体积要增大为原来的多少倍?21.(2002上海)如图所示,上端开口的圆柱形气缸竖直放置,横截面积为0.2m2的活塞将一定质量的气体和一形状不规则的固体A封闭在气缸内。
温度为300K时,活塞离气缸底部的高度为0.6m;将气体加热到330K时,活塞上升了0.05m,不计摩擦力及固体体积的变化,求物体A的体积。
22.跟大气连通的开口容器内的空气温度为27℃,它的质量为8kg,当温度升高到127℃时,容器内空气的质量为多少?7.气体图像p-V图像显示的等温线为双曲线的一支。