1.1.3 电子云与原子轨道
- 格式:ppt
- 大小:985.00 KB
- 文档页数:44

第3课时原子核外电子排布规则【目标导航】1.掌握基态原子、激发态原子、电子云、原子轨道的概念。
2.能运用核外电子排布的规律熟练掌握1~36号元素的原子的核外电子排布。
【基础落实】一、能量最低原理、泡利原理和洪特规则1.能量最低原理原子的电子排布遵循____________能使整个原子的能量处于________状态,简称能量最低原理。
2.泡利原理在一个原子轨道里最多只能容纳____个电子,而且它们的自旋状态________,这个原理称为泡利原理。
3.洪特规则当电子排布在________能级的________轨道时,基态原子中的电子总是优先____________________,而且自旋状态________,这个规则称为洪特规则。
跟踪训练1 一定呈+1价的金属元素是()A.M层比L层电子数少6个电子的元素B.质量数为24,中子数为12的元素C.4s轨道上有1个电子的元素D.电子排布式为1s22s22p63s23p64s1的原子二、电子排布式与电子排布图1.电子排布式用数字在能级符号右上角标明该能级上排布的电子数,这就是电子排布式。
写出下列基态原子的电子排布式:(1)16S:;(2)20Ca:;(3)26Fe:;(4)29Cu:。
2.电子排布图用方框代表一个原子轨道,用箭头表示一个电子,这样的式子称为电子排布图。
如Na:N:____________________________________O:____________________________________3.原子核外电子排布的表示方法(1)电子排布式和电子排布图反映的是基态原子即处于最低能量状态的原子的电子排布情况,它们相互关联,可以非常方便地相互转换。
(2)虽然电子排布是遵循构造原理的,但书写电子排布式时应按照能层的顺序书写。
如铁原子的电子排布式是1s22s22p63s23p63d64s2,而不写作1s22s22p63s23p64s23d6。





关于电子云和原子轨道(1)电子云的实质● 我们能不能把电子云中的小点当作电子?你问这个问题首先是把电子看作一个粒子。
电子能不能看作粒子?能,但它在核外空间出现的规律却只能用波动方程描述,不能用宏观物体的运动方程描述。
简单说,电子在原子核外空间的任一个点都有可能出现,不同的只是在各点出现的概率不同,而且,我们也不能预测电子从某个小点会移到哪一个点上去,因为电子在核外空间的运动不能用描述宏观运动的轨迹概念描述。
在教学中一定不能忘记强调,氢原子核外只有一个电子,而它的电子云图里却有许许多多点。
可见小点绝非电子本身!因此,电子云中的每个小点是该电子在小点所在的位置上出现的“记录”,或者说电子在这里出现留下的“踪迹”,或者说,你想象中“看到了”电子在这个点上出现过了,甚至说,你用了一架虚拟的照相机把电子在这个点出现“拍摄”下来了。
1s 2s 3s图1 氢原子的1s, 2s, 3s 电子云(注意三张图的尺寸不同)● 电子云图中的小点的总数可多可少吗?是的,可多可少。
这要看你“记录”电子在核外空间出现的次数。
通俗地讲,每个小点相当于一次记录。
如果电子云图里有500个小点,就相当于记录了500次。
如果有10000个点,就相当于记录了10000次。
记录的次数越多,小点就越多。
● 如何制作电子云图?用计算机程序可以制作电子云图。
在网上有一个生成电子云(黑点图)的程序。
可以从网上下载。
这个程序模拟了电子的波动方程得到的Ψ2的值,将它转化为小黑点在二维(纸面)上给出。
这个程序是用JA V A 程序编写的。
运行时间越长,随机产生的小黑点数目越大(图2)。
在本教学参考资料中有一个文件叫做“电子云黑点图计算机模拟动画程序”对这个程序作了详尽介绍。
图1就是用这一程序画的。
图2 用计算机程序制作电子云图,程序运行时间越长,小点越多如果在上课时能够直接上网,也可打开如下网站:/StuHome/cabell_f/Density.html ,在该网页的电子概率密度applet 程序上直接输入主量子数(n )、角量子数(l )和磁量子数(m ),可快速地得到不同状态的电子云的图像。

原子轨道与电子云的概念及表示在探索微观世界的奇妙旅程中,原子轨道和电子云是两个至关重要的概念。
它们为我们理解原子中电子的行为和分布提供了关键的理论基础。
首先,让我们来谈谈原子轨道。
简单来说,原子轨道是描述原子中电子可能存在的空间区域。
就好像一个特定的“房间”,电子在这个“房间”里有一定的出现概率。
原子轨道的概念基于量子力学的理论。
在经典物理学中,我们可能会想象电子像行星绕太阳一样围绕着原子核运动。
但在量子世界里,情况完全不同。
电子的运动并非遵循这样的确定性轨迹,而是具有一定的不确定性和波动性。
不同的原子轨道具有不同的形状和能量。
比如,常见的有 s 轨道、p 轨道、d 轨道和 f 轨道。
s 轨道是球形的,就像一个均匀的球体;p 轨道则呈现哑铃状,有三个相互垂直的取向。
每个原子轨道都对应着特定的能量。
能量越低的轨道,电子越容易占据。
当原子处于基态时,电子会优先填充能量较低的轨道。
那么,电子云又是什么呢?电子云其实是对电子在原子核外空间出现概率的一种形象描述。
想象一下,我们在一段时间内对电子的位置进行多次观测,并将这些位置点记录下来。
如果观测的次数足够多,这些点就会形成一种密集的分布,看起来就像一团“云”,这就是电子云。
电子云的密度表示了电子在某个区域出现的概率大小。
密度越大,电子在该区域出现的概率就越高;密度越小,电子出现的概率就越低。
与原子轨道不同,电子云更侧重于从概率的角度来描述电子的位置。
它并不是说电子真的像云一样弥漫在空间中,而是反映了电子在不同位置出现可能性的分布情况。
为了更直观地表示原子轨道和电子云,科学家们采用了多种方法。
对于原子轨道,通常会使用波函数来描述。
波函数是一个数学表达式,它可以给出电子在不同位置出现的概率幅。
通过对波函数进行平方,可以得到电子出现的概率密度,从而进一步了解原子轨道的特性。
而电子云的表示方法则更加直观。
常见的有电子云图和电子云轮廓图。
电子云图通过不同的颜色或灰度来表示电子云的密度,让我们能够一目了然地看到电子出现概率的分布情况。



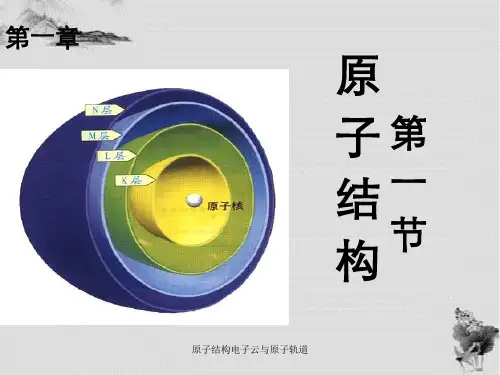
第一章原子结构与性质第一节原子结构第三课时电子云与原子轨道泡利原理、洪特规则、能量最低原理【学习目标】1.了解核外电子运动、电子云轮廓图和核外电子运动的状态。
2. 了解泡利原理和洪特规则,会书写和说明136号元素基态原子的核外电子排布式和轨道表示式【学习重点】泡利原理和洪特规则在轨道表示式书写中的应用【学习难点】电子的运动状态和电子云轮廓图【课前预习】旧知回顾:1、能级能量大小的判断方法:①先看能层,一般情况下,能层序数越大,能量越高;再看同一能层各能级的能量顺序为:E(ns)< E(np)< E(nd)< E(nf) ……②不同能层中同一能级,能层序数越大,能量越高。
③不同原子同一能层,同一能级的能量大小不同。
2、构造原理示意图中,从1s至5s电子的排布顺序:1s→2s→2p→3s→3p→4s→3d→4p→5s新知预习:1、电子云:由于核外电子的概率密度分布看起来像一片云雾,因而被形象地称作电子云2、原子轨道:量子力学把电子在原子核外的一个空间运动状态称为一个原子轨道3、泡利原理:在一个原子轨道里,最多只能容纳2个电子,它们的自旋相反,这个原理被称为泡利原理(也称为泡利不相容原理)4、洪特规则:基态原子中,填入简并轨道的电子总是先单独分占,且自旋平行,称为洪特规则5、能量最低原理:在构建基态原子时,电子将尽可能地占据能量最低的原子轨道,使整个原子的能量最低,这就是能量最低原理【课中探究】情景导入:通过刚才的视频,我们发现,电子的运动状态是很复杂的,那么电子到底是如何运动的,视频中提到的电子构成的概率云,自旋又指的是什么,通过今天的学习,我们就能解决这些问题。
一、电子云与原子轨道任务一、了解电子云的相关内容V P【学生活动】阅读教材P 12第14自然段,了解电子云,回答下列问题:1、概率密度的表达式及相关物理量的含义? 用P 表示电子在某处出现的概率,V 表示该处的体积,则 称为概率密度,用ρ表示。
第一节原子结构第3课时电子云与原子轨道、泡利原理、洪特规则、能量最底原理时间:40分钟一、单选题(共40分)1.下列有关电子云和原子轨道的说法正确的是()A.原子核外的电子像云雾一样笼罩在原子核周围,故称电子云B.s能级的原子轨道呈球形,处在该轨道上的电子只能在球壳内运动C.p能级的原子轨道呈哑铃形,随着能层序数的增加,p能级原子轨道数也在增多D.s、p能级原子轨道的平均半径均随电子层的增大而增大2.电子云是处于一定空间运动状态的电子在原子核外空间的概率密度分布的形象化描述。
下列有关电子云的说法正确的是A.概率密度的大小体现了电子数目的多少B.概率密度的大小体现了空间某处电子出现概率的大小C.基态C原子的1s电子的电子云和2s电子的电子云完全相同D.基态Li原子的1s电子的电子云和2s电子的电子云形状不同3.下列轨道表示式不符合泡利原理的是A.3p能级B.3d能级C.2p能级D.4d能级4.某原子的轨道表示式如下,从中得到的信息错误的是()A.有2个电子层B.有3种能量不同的电子C.最外层有3个电子D.有7种运动状态不同的电子5.已知锰的核电荷数为25,以下是一些同学绘制的基态锰原子外围电子的电子排布图,其中最能准确表示基态锰原子核外电子运动状态的是()A.B.C.D.6.下列叙述正确的是()A.可能存在核外电子排布式为1s22s22p63s23p64s24p1的原子B.当电子排布在同一能级的不同轨道时,总是优先单独占据一个轨道,而且自旋方向相反C.1个原子轨道里最多容纳2个电子,且自旋方向相同D.基态原子的电子获得一定能量变为激发态原子,而激发态原子变为基态原子,则要放出能量7.下列有关核外电子排布的表述正确的是A.基态碳原子最外层电子排布图为B.基态铜原子的价层电子的轨道表示式为C.基态Se原子的简化电子排布式为[Ar]3d104s24p4D.F 的结构示意图为8.在核电荷数为26的元素Fe的基态原子核外的3d、4s轨道内,下列电子排布图正确的是A.B.C.D.9.以下是一些原子的2P 能级和3d 能级中电子排布的情况;其中违反了洪特规则的是()A.①B.①①C.①①①D.①①①10.下列说法错误的是A.电子排布式2262631s2s2p3s3p4s违反了泡利不相容原理B.基态原子电子排布式2262651s2s2p3s3p3d违反了能量最低原理C.Li原子的核外电子排布式写成31s违反了能量最低原理Sc1s2s2p3s3p3d违反了能量最低原理D.电子排布式()22626321二、多选题(共30分)11.下列化学用语表达正确的是A.碳原子最外层电子排布式:1s22s22p2B.磷原子的M层电子轨道表示式:C.S2的核外电子排布式:1s22s22p63s23p6D.Cu2+的核外电子排布式:[Ar]3d104s112.下列对电子排布式或电子排布图书写的评价正确的是()O原子的电子排布图:N原子的电子排布图:A.A B.B C.C D.D 13.下列判断正确的是A.Li原子的核外电子排布式写成1s3违背了能量最低原理B.电子的吸收光谱和发射光谱总称原子光谱C.处于基态的氧原子电子排布图表示成,违背了泡利原理D.某种基态原子中可能存在运动状态完全相同的电子14.下列微粒的核外电子的表示方法中正确的是A.碳原子轨道表示式B.P原子价电子轨道表示式:C.Cr原子的价电子排布式:3d54s1D.Fe2+价电子排布式:3d44s215.下列原子构成的单质中既能与稀硫酸反应,又能与烧碱溶液反应,且都产生H2的是A.核内无中子的原子B.外围电子构型为3s23p4的原子C.核外电子排布图为的基态原子D.处于激发态时其原子的电子排布式可能为1s22s22p63s13p2三、填空题(共30分)16.下列原子或离子的电子排布式或排布图正确的是________(填序号,下同),违反能量最低原理的是____________,违反洪特规则的是________,违反泡利原理的是________。