几种常见的盐(简)
- 格式:ppt
- 大小:3.15 MB
- 文档页数:24
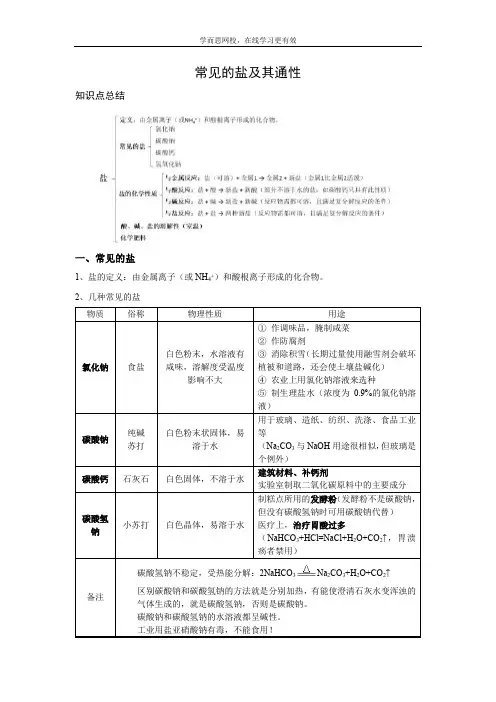
常见的盐及其通性知识点总结一、常见的盐1、盐的定义:由金属离子(或NH4+)和酸根离子形成的化合物。
2、几种常见的盐碳酸氢钠不稳定,受热能分解:2NaHCO3Na2CO3+H2O+CO2↑区别碳酸钠和碳酸氢钠的方法就是分别加热,有能使澄清石灰水变浑浊的气体生成的,就是碳酸氢钠,否则是碳酸钠。
碳酸钠和碳酸氢钠的水溶液都呈碱性。
工业用盐亚硝酸钠有毒,不能食用!●消毒用盐⏹游泳池一般用硫酸铜消毒。
⏹医疗上一般用高锰酸钾消毒。
⏹过去习惯用氯气给自来水消毒,现在用二氧化氯消毒。
●钠离子可以维持细胞内外的水分分布,促进细胞内外物质交换;氯离子可以促生盐酸、帮助消化,增进食欲。
●氯化钠等溶于水后,会使水的凝固点降低,以达到融雪的目的。
氯化钠作为融雪剂,对植物有害,会腐蚀桥梁等,所以现在逐渐被绿色融雪剂代替。
二、粗盐提纯1、粗盐的初步提纯只是除去不溶性杂质,得到的盐中还含有氯化镁、氯化钙等可溶性杂质。
氯化镁、氯化钙等易吸收空气中的水分而潮解,因此需要除去。
2、实验●蒸发时要经常用玻璃棒搅拌液体,防止由于局部温度过高造成液滴飞溅。
●当蒸发皿中出现较多固体时,停止加热,利用蒸发皿余热使滤液蒸干。
三、盐的化学性质1、与金属反应盐(可溶)+ 金属1 → 金属2 + 新盐(金属1比金属2活泼,金属不是钾、钙、钠)2、与酸反应盐+ 酸→ 新盐+ 新酸(部分不溶于水的盐,如碳酸钙只具有此性质)氯化银、硫酸钡既不溶于水,也不溶于酸(不溶于酸就是不与酸反应)。
3、与碱反应盐+ 碱→ 新盐+ 新碱(反应物需都可溶,且满足复分解反应的条件)4、与盐反应盐 + 盐 → 两种新盐(反应物需都可溶,且满足复分解反应的条件)四、酸、碱、盐的溶解性(室温)1、酸:大多数都可溶。
2、碱:只有氢氧化钠、氢氧化钾、氢氧化钡和氢氧化钙可溶于水,其余均为沉淀。
3、盐:钾盐、钠盐、铵盐、硝酸盐都可溶。
● 氯化物除氯化银、氯化亚汞不溶于水外,其余多数均易溶于水。

盐的复习一、几种常见的盐1、氯化钠:化学式——NaCl俗称食盐无色晶体易溶于水,有咸味。
重要的化工原料——广泛用于制取氯气、盐酸、火碱、纯碱等工业方面;并在塑料、橡胶、合成纤维、医药、农药等工业方面有广泛的应用,也是日常生活重要的调味品。
2、碳酸钠:化学式——Na2CO3,俗称:纯碱白色粉末,易溶于水成无色溶液。
实验事实:无色碳酸钠溶液能使无色酚酞试液变红。
说明:碳酸钠的水溶液呈碱性。
一般情况下:碳酸盐如碳酸钠,碳酸钾(K2CO3)等均能与盐酸发生剧烈反应,有无色气体产生——该气体能使澄清的石灰水变浑浊,即生成CO2。
Na2CO3+2HCl→2NaCl+H2O+CO2↑K2CO3+2HCl→2KCl+H2O+CO2↑主要用途:重要的化工原料——玻璃、造纸、纺织、制药、精炼石油等方面用途显著。
3、硫酸铜:化学式——CuSO4无水硫酸铜为白色粉末,易溶于水,其水溶液为蓝色。
硫酸铜晶体含五个结晶水,为蓝色、因此俗称蓝矾或胆矾,化学式为——CuSO4·5H2O。
主要用途:是制农药波尔多液的重要原料,也广泛应用于印染,电镀等工业方面。
二、盐溶液的导电性——盐的定义1、盐溶液的导电性:实验事实证明:可溶性盐的水溶液,均具有导电性。
说明: 盐溶液中存在着自由移动的阴、阳离子,在电场作用下,自由移动的离子定向移动而形成电流,——导电。
可溶性盐在溶液里的电离: 以食盐、碳酸钾、硫酸铵等为例,其水溶液中的电离方程式为:2、盐的定义:由金属(或铵根)离子与酸根离子相结合而组成的化合物,叫盐。
三、盐的分类:1、从盐的组成上分(1)正盐: 只由金属(或铵根)离子及酸根离子组成,例:NaCl 、Na 2SO 4、NH 4NO 3、MgCl 2、K 2CO 3等。
(2)酸式盐:组成当中,除金属(或铵根)离子与酸根离子外,还有氢离子。
以碳酸氢铵,碳酸氢钠为例看酸式盐在其水溶液中的电离:NH 4HCO 3→NH 4++H ++CO 32-NaHCO 3→Na ++H ++CO 32- 电离出来的阳离子除H +外,还有其它阳离子——NH 4+、Na +,因此上述二者是盐而不是酸。
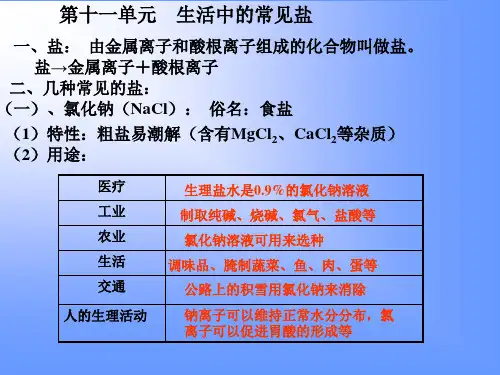

常见的盐一、几种常见的盐1、氯化钠—NaCl—食言(1)物理性质:白色固体,易溶于水,pH=7;区别:工业盐≠食言NaNO2,有毒性,显碱性;(2)用途:调味品,生理盐水0.9%,重要的工业原料(可制备NaOH、Cl2、HCl、Na2CO3等)2、碳酸钠—Na2CO3—苏打、纯碱(1)物理性质:白色粉末,易溶于水,水溶液呈碱性,pH>7;区别:Na2CO3≠Na2CO3·10H2O(室温下干燥失去结晶水)碳酸钠晶体、十水碳酸钠Na2CO3·10H2O=Na2CO3+10H2O(化学反应)(2)用途:重要的工业原料,洗涤、纺织,制玻璃,食品工业。
3、碳酸钙—CaCO3—大理石、石灰石(1)物理性质:白色固体、难溶于水;(2)用途:重要的建筑材料,制备CO2,补钙剂;4、碳酸氢钠—NaHCO3—小苏打(1)物理性质:白色粉末,易溶于水,pH>7;(2)用途:发酵粉,用于中和胃酸。
5、硫酸铜—CuSO4(无水硫酸铜,白色粉末)硫酸铜晶体—CuSO4·5H2O—蓝矾、胆矾,蓝色晶体。
(蓝色晶体,五水硫酸铜)鉴别物质中是否含有水。
用途:炼铜、镀铜,配制波尔多液。
二、盐的通性1、盐和金属的反应盐+金属=新盐+新金属(溶液)(溶液)CuSO4+Fe=Cu+FeSO43CuSO4+2Al=3Cu+Al2(SO4)32、盐+酸=新盐+新酸(CO32-和可溶性盐)(生成沉淀、气体、水)CaCO3+2HCl=CaCl2+H2O+CO2HCl+AgNO3=AgCl+HNO33、盐+碱=新盐+新碱(可溶性盐和碱)(生成沉淀、气体、水)Ca(OH)2+Na2CO3=CaCO3+2NaOHNH4Cl+NaOH=NaCl+NH3+H2O(铵盐不能和碱共存)4、盐1+盐2=盐3+盐4(溶液)(其中一个必须是难溶性的)AgNO3+NaCl=AgCl+NaNO3BaCl2+Na2SO4=BaSO4+2NaClBa(NO3)2+CaCO3=??KNO3+NaCl=??。


盐与化肥知识点一、什么是盐1、定义:电离时生成金属离子〔或铵根离子〕和酸根离子的化合物2、理解:○1盐的定义不像酸或碱的定义那样强调“全部〞二字,事实上,一种物质中只要含有金属离子〔或铵根离子〕和酸根离子,该物质就是盐。
○2食盐属于“盐〞类,然而化学上所说的盐具有更广泛的涵义,是指一类化合物。
○3“盐〞不一定都有咸味,许多盐有其它味道,例如,醋酸铅是甜的〔有毒!不能食用〕,氯化镁是苦的,碳酸钠是涩的,硫酸亚铁是酸的,而谷氨酸钠,就是大家所熟悉的味精,味道却十分鲜美!知识点二、几种常见的盐1、碳酸钠〔Na2CO3〕〔1〕俗称:纯碱、苏打。
〔2〕物理性质:白色粉末状固体,易溶于水。
〔3〕化学性质与酸反响:Na2CO3+ 2HCl = 2NaCl + H2O + CO2↑与可溶性碱反响:Na2CO3+Ca(OH)2 = CaCO3↓+ 2NaOH〔工业制氢氧化钠的反响原理〕〔4〕用途:工业上制取烧碱的原料之一,可用来制造玻璃、肥皂、去油污。
2、碳酸钙〔CaCO3〕〔1〕存在形式:XX石、石灰石、汉白玉、鸡蛋壳、水垢等物质的主要成分都是碳酸钙。
〔2〕物理性质:白色固体,难溶于水。
〔3〕化学性质与酸反响:CaCO3+2HCl =CaCl2 + H2O + CO2↑高温分解:CaCO3高温CaO+CO2↑〔工业制氢氧化钠的反响原理〕〔4〕用途:重要的建筑材料,可用来制水泥、炼钢、制生石灰等;也是一种补钙剂。
2、碳酸氢钠〔NaHCO3〕〔1〕俗称:小苏打。
〔2〕物理性质:白色粉末,易溶于水。
〔3〕化学性质与酸反响:NaHCO3 + HCl = NaCl + H2O + CO2↑〔4〕用途:发酵粉的主要成分;也可用于治疗胃酸过多(肝胃去痛片〕。
知识点三、盐的通性1、盐的分类〔1〕按照具有的一样离子分类:○1阳离子一样,如碳酸钠〔Na2CO3〕、硫酸钠(Na2SO4)、硝酸钠(NaNO3)和磷酸钠(NaPO4)等称为钠盐○2阴离子一样,如碳酸钠〔Na2CO3〕碳酸钾〔K2CO3〕碳酸钙〔CaCO3〕和碳酸钡〔BaCO3〕等称为碳酸盐〔2〕按照盐的溶解性分类○1可溶性盐:碳酸钠〔Na2CO3〕、硫酸钠(Na2SO4)、碳酸钾〔K2CO3〕○2难溶性盐:硫酸钡〔BaSO4〕、氯化银AgCl○3微溶于水:硫酸钙〔CaSO4〕2、物理性质:常温下大多数为固体。

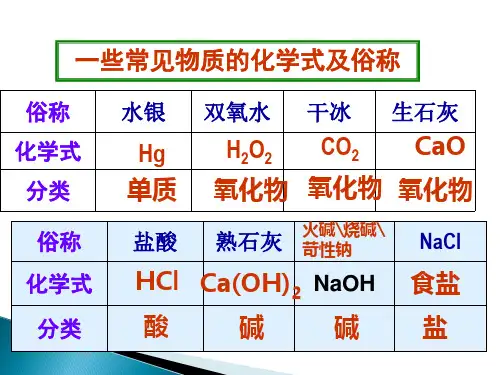
几种常见的盐(一)1.氯化钠(NaCl)粗盐因含有MgCl2、CaCl2等杂质,会吸收空气里的水分而潮解。
熔点801℃,沸点1413℃。
用途:重要的化工原料,可用于制取钠、氢气、氢氧化钠、盐酸、纯碱等化工产品。
2.碳酸钠(Na2CO3)在工业中称为纯碱,因为和水反应,呈碱性。
白色粉末状物质,以溶于水。
当它从溶液里结晶析出时,晶体里结合着一定数目的水分子,这样的水分子叫结晶水,含有结晶水的物质叫结晶水合物。
碳酸钠晶体化学式Na2CO3·10H2O※常温是在干燥的空气里,碳酸钠晶体能逐渐失去结晶水而成为粉末,这种现象叫做风化。
(化学变化) Na2CO3·10H2O==Na2CO3+10H2O盐湖——天然碱(口碱)用途:化学工业重要产品之一,广泛应用于玻璃、造纸、纺织、洗涤剂工业上。
3.硫酸铜(CuSO4)无水硫酸铜是一种白色固体,能溶于水,水溶液呈蓝色,俗称胆矾或蓝矾,含有结晶水(CuSO4·5H2O)受热又能失去结晶水成为白色的CuSO4。
CuSO4·5H2O==CuSO4+5H2O(分解反应)条件加热CuSO4+5H2O==CuSO4·5H2O用途:农业上作杀虫剂(波尔多液:CaO、CuSO4),工业上炼铜。
(二)盐的分类和命名1.正盐酸和碱完全中和的产物。
(NaCl、Na2CO3、CuSO4)命名:非金属元素和金属元素名称中间加一“化”字,叫“某化某”。
(无氧酸盐NaCl)酸名称后加金属的名称,叫“某酸某”。
(含氧酸盐Na2SO4)※如果一种金属元素具有多种化合价,对于含低价的金属元素命名,可在前面加个“亚”字。
(硫酸钾K2SO4 硫酸亚钾K2SO3)2.酸式盐酸中的氢部分被中和的产物。
(NaHCO3、KHSO4)命名:在酸的名称后加“氢”(某酸氢某)Eg. NaHCO3碳酸氢钠(酸式碳酸钠) HCO3碳酸氢根离子如果酸式盐中含有2个可以电离的氢原子,命名时,可标明数字。

初中常见的盐的化学式全文共四篇示例,供读者参考第一篇示例:初中生在学习化学的过程中,经常会接触到各种各样的化学物质,其中盐就是一种常见的化合物。
盐是由正离子和负离子组成的离子化合物,在化学式中通常以化合价最小的简单离子表示。
下面将介绍一些初中常见的盐的化学式。
1. 氯化钠(NaCl):氯化钠是一种最为常见的盐,也就是我们日常所说的食盐。
它由钠离子(Na+)和氯离子(Cl-)组成,化学式为NaCl。
氯化钠在我们的日常饮食中是必不可少的,它除了用于调味外,还具有保鲜等功能。
2. 硫酸钠(Na2SO4):硫酸钠是一种常见的无机盐,由两个钠离子和一个硫酸根离子组成。
其化学式为Na2SO4。
硫酸钠可用于制作洗涤剂和玻璃等化工产品,也可作为药品的原料。
4. 硫酸铜(CuSO4):硫酸铜是一种含铜的盐类化合物,由一个铜离子和一个硫酸根离子组成。
其化学式为CuSO4。
硫酸铜在农业领域被广泛应用,可以作为杀菌剂、杀虫剂和植物短缺元素的补充剂。
5. 氯化钾(KCl):氯化钾是一种含钾的盐类化合物,由钾离子和氯离子组成,其化学式为KCl。
氯化钾在医药和农业领域具有重要的应用价值,可以用作补充钾元素、化学试剂和医药原料等。
以上是一些初中常见的盐的化学式,通过学习这些盐的结构和性质,可以更好地了解化学物质的特性和用途。
盐作为化学反应中常见的产物,广泛应用于不同领域,对我们的生活和生产起着重要作用。
希望同学们在学习化学的过程中,能够掌握这些盐的化学式及其相关知识,为将来的学习和工作打下坚实基础。
第二篇示例:初中化学课程中,学生通常会学习一些常见的盐的化学式。
盐是一类化合物,由阳离子和阴离子组成。
在盐的化学式中,通常会有金属离子和非金属离子组成。
我们来谈谈氯化钠,也就是我们日常生活中所熟知的食用盐。
氯化钠的化学式为NaCl,其中Na代表钠阳离子,Cl代表氯阴离子。
氯化钠是一种白色晶体,常用于调味食物和保存食物。
硫酸铜也是初中常见的盐之一。


常见的盐一、知识点知识点1、生活中常见的盐1.生活中常见的盐:有氯化钠、碳酸钠、碳酸氢钠、碳酸钙等。
亚硝酸钠(NaNO2)是一种工业用盐,外观和食盐相似,有毒。
2.粗盐提纯的主要步骤:溶解、过滤、蒸发。
3.碳酸根离子的检验:含CO32-(HCO3-)的化合物,遇到酸会反应放出能使澄清的石灰水变浑浊的二氧化碳气体。
利用此反应可以检验盐的组成中是否含有CO32-离子(或HCO3-)。
【要点诠释】1.组成里含有碳酸根离子的盐统称为碳酸盐,如Na2CO3、K2CO3、BaCO3、CaCO3等,它们与盐酸反应都会生成使澄清石灰水变浑浊的二氧化碳气体。
2.含有碳酸根离子的盐和某些物质反应生成不溶于水的固体,这一类反应有时也可以用来鉴别碳酸盐。
例如:Na2CO3 + Ca(OH)2=CaCO3↓+ 2NaOH知识点2、复分解反应发生的条件复分解反应发生的条件:当两种化合物互相交换成分,生成物中有沉淀或有气体或有水生成时,复分解反应才可以发生。
【要点诠释】1.复分解反应属于基本反应类型,其特点为AB+CD=AD+CB。
2.复分解反应发生的三个条件中,只要具备其中一个,反应就可以进行,不必三个条件都具备。
知识点3、盐的化学性质不同种类的盐其化学性质也有所不同。
对于其共性总结如下表所示:盐与酸反应、盐与碱反应、盐与盐反应都属于复分解反应,盐与金属反应属于置换反应。
二、精选练习题知识点1 生活中常见的盐【典例】1.用符合要求的物质的序号填空。
①氯化钠②小苏打③二氧化碳④熟石灰(1)可用于治疗胃酸过多的是。
(2)可用于改良酸性土壤的是。
2.在河边有A、B、C、D四家工厂向河中排放废水,每个工厂的废水中含有NaOH、HCl、MgCl2、Na2CO3四种物质中的一种.某中学环保小组对该河流的污染状况进行检测,发现:A处河水能使紫色石蕊试液变蓝色;F处河水出现白色浑浊;E处河水有大量气泡产生.试推断:(1)A工厂排放的废水中含有的污染物是;(2)C工厂排放的废水中含有的污染物是;(3)E处发生反应的化学方程式为:.【变式训练】1.服用可溶性的钡盐可使人中毒.医疗水用X射线检查胃肠疾病时,可作为“钡餐”让病人服用的是()A.BaCl2B.Ba(OH)2C.BaCO3D.BaSO42.酸、碱、盐在工农业生产和日常生活中应用广泛.下列做法错误的是()A.用石灰乳与硫酸铜溶液配制农药波尔多液B.用稀盐酸除去铁制品表面的铁锈C.用食盐水除去水壶中的水垢D.用NaOH溶液洗涤石油产品中残留的硫酸3.下列物质俗称小苏打的是()A.碳酸钠B.碳酸氢钠C.氢氧化钠D.硫酸钠4.食盐、食醋、纯碱均是家庭厨房中常用的物质,利用这些物质,我能够完成的实验是()①检验自来水中是否含有氯离子;②除去热水瓶中的水垢;③区分食盐和纯碱;④检验鸡蛋壳中是否含有碳酸盐。
化学生活中常见的盐教案——盐的种类及分类。
一、盐的基本概念盐,是一种由酸和碱反应而成的化合物。
一般指的是金属离子和非金属离子以离子键相互结合的化合物,具有晶体结构和离子性。
盐一般具有以下性质:电解质、易溶于水、化学稳定性好、不挥发和不易燃等。
二、盐的种类及分类1.氯化物氯化物,是化学生活中最常见的盐类之一。
它可以通过氧化或还原反应、酸碱反应等制备而成。
常见的氯化物有氯化钠、氯化钾、氯化铁等。
正如它的名字所示,氯化物中含有氯离子(Cl-)。
2.碳酸盐碳酸盐,是一种由碳酸根离子和金属离子组成的盐类。
常见的碳酸盐包括碳酸钙、碳酸镁、碳酸铁等。
在生活中,我们也常见到含有碳酸盐的物质,比如纯净水中的二氧化碳溶解就形成了碳酸氢离子(HCO3-)和碳酸盐离子(CO32-)。
3.硝酸盐硝酸盐,是一种由硝酸根离子(NO3-)和金属离子组成的盐类。
硝酸盐可以通过硝酸的酸化反应制备而成。
常见的硝酸盐有硝酸钙、硝酸钾、硝酸铁等。
4.磷酸盐磷酸盐,是一种由磷酸根离子(PO43-)和金属离子组成的盐类。
常见的磷酸盐有磷酸钙、磷酸铁、磷酸钾等。
磷酸盐在生物体内也有很重要的作用,如骨骼中就含有大量的磷酸钙。
5.硫酸盐硫酸盐,是一种由硫酸根离子(SO42-)和金属离子组成的盐类。
常见的硫酸盐有硫酸钙、硫酸铝、硫酸铁等。
硫酸盐可以通过硫酸的酸化反应制备而成。
根据阴离子的不同,盐还可以进一步分为单质盐、复盐和配位盐等不同的类型。
1.单质盐单质盐是一种仅含有一种类型离子的盐类,比如氯化钠、碳酸钙等。
单质盐的结构相对简单。
2.复盐复盐是指由两种不同类型的离子组成的盐,例如硫酸铜和硝酸银复盐AgNO3·CuSO4。
复盐的结构较为复杂。
3.配位盐配位盐是一种离子化学中的重要形式,以配位原子团为主要特征。
例如,六配位的[Cu(NH3)4(H2O)2]SO4·H2O就是配位盐的一种。
总结:通过以上的介绍,我们可以看出,盐是化学生活中最为常用的化工物料之一,它种类繁多,分类也有详细的方法。