高等有机化学第十一章 卡宾
- 格式:pdf
- 大小:1.14 MB
- 文档页数:14

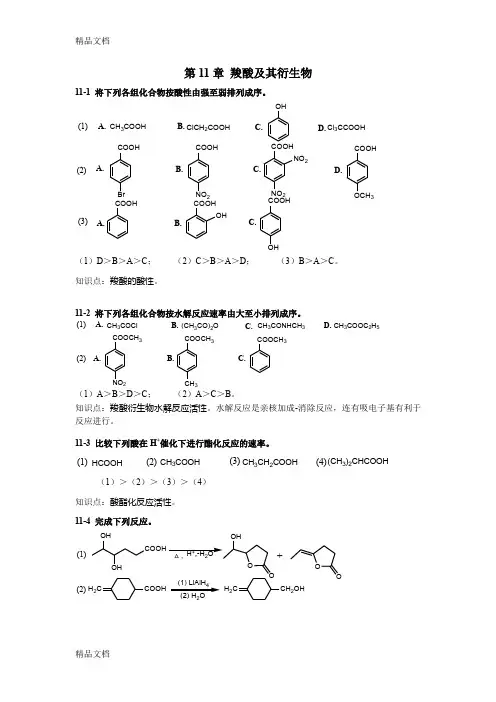
第11章 羧酸及其衍生物11-1 将下列各组化合物按酸性由强至弱排列成序。
CH 3COOHClCH 2COOHCl 3CCOOHOHA. B. C.D.A.B.C.D.COOHBr COOHNO 2COOHOCH 3COOHNO 2NO 2COOHOHCOOHCOOHOHA. B.C.(1)(2)(3)(1)D >B >A >C ; (2)C >B >A >D ; (3)B >A >C 。
知识点:羧酸的酸性。
11-2 将下列各组化合物按水解反应速率由大至小排列成序。
CH 3COCl(CH 3CO)2OCH 3CONHCH 3A. B. C. D.COOCH 3NO 2COOCH 3CH 3COOCH 3A.B.C.(1)(2)CH 3COOC 2H 5(1)A >B >D >C ; (2)A >C >B 。
知识点:羧酸衍生物水解反应活性。
水解反应是亲核加成-消除反应,连有吸电子基有利于反应进行。
11-3 比较下列酸在H +催化下进行酯化反应的速率。
HCOOH CH 3COOH CH 3CH 2COOH(1)(2)(3)(CH 3)2CHCOOH (4)(1)>(2)>(3)>(4) 知识点:酸酯化反应活性。
11-4 完成下列反应。
(1)COOHOHOHOOO+(1) LiAlH 4(2)H 2CCOOH2H 2CCH 2OHSOCl 2(3)H 3C CH 2CH 23C CH 2CH 2COClH 3COAlCl 3(分子内酰基化)(1) Zn, CH 3CH(Cl)COOEt(Reformasky 反应)(4)(2) H 2OOOHCHCOOC 2H 5CH 3(5)Br 2/红磷CH 2COOHCHCOOHBr(酰胺还原)(6)N HO(Hofmann 降解)(7)22C 6H 5H 32C 6H 5H 3(8)△H 3O(Claisen 酯缩合反应, Wittig 反应, Mannich 反应)32(9)△O(10)3(酯与格氏试剂反应,羟醛缩合反应)HCOOC 2H 5NaOC 2H5(11)+C H OHCHO(12)O O333CH 3COOC 2H 5AlPO 4(13)CH 3COOH2CH 3CH 2OHH 2CC O知识点:羧酸及其衍生物的化学性质。


分子结构 struture(constitution) 分子中原子的连接次序和方式以及在空间的排布。
分子结构至少应包括分子的构造、构型和构象,结构是一个广义的概念,有时还与“构造”一词混同泛用。
构造 constitution 分子中原子的连接次序和方式,即指具有一定分子式的物质,其分子中各原子成键的顺序和键性。
构型 configuration 具有一定构造的分子中各原子在空间的排列状况。
构象conformation 在一定的条件下,由于单键的旋转而产生的分子中各原子(或原子团)在空间的不同排布形象。
构型和构象虽然都是表述分子的立体模样或空间形象的概念,但两者不能并列,构象比构型更为精细。
在室温下,分子的一种构象可以通过单键的“自由”旋转,变成另一种构象。
一般地讲,分子的构型是不能通过单键的旋转而改变的,必须通过化学键的断裂和形成才能改变分子的构型。
手性 Chirality 也称手征性,物质的分子和它的镜象不能重合的性质。
手性是物质具有旋光性和产生对映异构现象的充分必要条件。
手性分子 Chiral molecule 具有手性的分子称为手性分子。
手性分子一定具有旋光性,并存在一对对映体。
对映体 Enantiomer对映异构体的简称,两个互为镜象的立体异构体。
在非手性条件下,对映体具有相同的物理和化学性质。
非对映体Diaseromer 非对映异构体的简称,两个不呈镜象关系的立体异构体。
非对映体的物理性质不同。
由于具有相同的官能团,同属一类化合物,因而化学性质相似,即可发生相同类型的化学反应,但活性不同。
次序规则sequence rule 各种原子或取代基按其原子序数的大小排列成序的规则,顺、反异构体的Z、E标记法和手性中心的构型R、S标记法,都是按次序规则来进行标记的。
立体选择反应Stereoselective reaction 一个反应不管反应物的立体化学如何,如果生成的产物只有或主要是某一种立体异构体(或一对映体),这样的反应叫做立体选择性反应立体专一反应 Stereospecific reaction从立体化学上有差别的反应物分别给出立体化学上有差别的产物的反应对映体过量百分数(%e,.e.) enantiomeric excess percent 评价手性合成优劣的一种指标。


邢大本的错误纠正作者:exoto上册P278~P279E1Cb邢大本描述,“这表明邻二卤代烷的消除肯定是反式消除,因而也是立体选择的”。
虽然说得是I-采取的反应,但是这句话本身是肯定不对的。
现有研究已经指出,该反应机理往往比较复杂,并与试剂和反应条件有关,以邢大本提出的Zn为例,发现有时候反应是反是立体专一的,有时候则不是。
何况,正常来说,顺势消除也并非不能发生(只是非常非常的慢,但如果是唯一途径,比如两个离去集团的二面角在过渡态时无法达到180度,顺势消除也是会发生的),这和底物结构也是有关的。
P337卡宾,单线态和三线态的卡宾杂化状态并非sp2和sp,或者不是纯粹的,这点键角角度能看出来。
P379习题9-11(i)以及炔烃的硼氢化氧化这个问题显著的与高等有机的介绍存在冲突,邢大本认为,烯基硼烷可以通过简单的B2H6与末端炔反应产生醛基,而事实上,这是错误的。
这个反应真实的情况是会产生双次的硼氢化,而很难停在一员取代上,如果希望得到最终产物醛,则需要大位组的硼烷比如邻苯二酚基硼烷或者与BHBr2-SMe2反应。
P494环戊二烯负离子,这页中间的大图里,环戊二烯负离子和EtBr发生SN2,产物却是苯基环戊二烯,这显然是印刷错误。
P325烯烃过氧化机理邢大本认为这个机理是过酸与烯烃产生了5元环的中间体,然后再通过消去羧酸得到的环氧化物。
这个机理是错误的,现有的量化计算已经详细得分析了过酸氧化烯烃的机理,以及过渡态的构型,给出LUMO的是过酸的O原子,而不是那个1,3偶极体。
这个过渡态的构型更像是五元环的过酸与烯烃交与O原子上,P554,wacker氧化反应这个反应的机理也是不准确的,正确的机理如wiki所说【其他网友】这个图总体上来说没有大问题,但是有几个地方不加以文字解释的话会产生很大的误解。
维基啥的,谨慎。
首先一个小小的不准确,在乙烯可逆的取代了一个氯离子后,水也很快的取代了乙烯对位的那个氯离子(当然这个反应也是可逆的),所有对Wacker反应机理的动力学研究都是从cis-[(C2H4)(H2O)PdCl2]起始的。


练习题一、名词解释1、三线态卡宾(Triplet carbene)卡宾是H2C: 及其取代衍生物的通称,也叫碳烯,含有一个电中性的二价碳原子,该碳原子上有两个未成键的电子,属于中性活泼中间体,通常由含有容易离去基团的分子消去一个中性分子而形成。
三线态卡宾的碳原子为sp杂化,生成的两个杂化轨道分别与其他原子形成σ键,而未参与杂化的两个p轨道中各有一个未成键电子,自旋平行。
2、前线分子轨道(Frontier Molecular Orbital)原子轨道线性组合形成分子轨道,在填充有电子的分子轨道中,能量最高的轨道叫最高占有分子轨道(HOMO);在未填充电子的分子轨道中,能量最低的分子轨道叫最低未占分子轨道(LUMO)。
HOMO与LUMO能量接近,HOMO上的电子被束缚得最松弛,最容易激发到能量最低的LUMO中去,组成新轨道,HOMO和LUMO是决定一个体系发生化学反应的关键,被称为前线分子轨道。
3、协同反应(Concerted reaction)是指反应过程中旧键的断裂和新键的形成同步进行,反应的过程中不产生离子或自由基等活性中间体,只有过渡态的动力学基元反应。
如周环反应、协同亲核取代反应(S N2)、协同消除反应(E2)等。
4、逆合成分析(Retrosynthesis)有机合成路线设计的基本方法,其实质是将目标化合物(Target Molecule)合理地分割成简单的合成子(Synthon),反推出合成所需的基本化学原料。
基本要求是反应步骤少,反应产率高,起始原料简便易得,有合适且合理的反应方法和反应机理作保证。
5、合成砌块(Synthetic block)带有较复杂官能团的合成原料称合成砌块。
6、不对称合成(Asymmetric synthesis)不对称合成即手性合成,将一种含前手性中心、前手性轴或前手性面的非手性化合物,与光学纯的化合物(手性试剂)反应形成新的光活性化合物,是对映选择合成的一种有效方法,文献上常叫“不对称合成”,属于立体选择反应。


《高等有机化学》教学大纲课程名称:高等有机化学学时/学分:54/4先修课程:无机化学、有机化学适用专业:化学开课教研室:有机化学一、课程的性质和任务1.课程性质:本课程是化学专业师范方向本科生的专业选修课程。
2.课程任务:本课程基本任务是在学习四大基础化学的基础上,对《有机化学》课程的进一步深化,为有关后继课程《精细化学品化学》和《有机合成化学》的学习以及毕业论文打下良好的理论基础。
通过本门课程的学习,要求学生掌握有机反应历程的分类和测试方法。
熟悉各类基本有机反应的历程、立体化学关系、影响因素和在有机合成上的应用。
理解一些基本的有机反应理论,并能够用所学的知识解决一些有机化学问题和指导专业有机实验。
二、课程教学基本要求本课程的教学环节包括课堂讲授,学生自学,习题讨论课,习题,答疑,质疑,期中测验和期末考试。
通过上述基本教学步骤,要求同学们能用现代化学的理论知识,认识有机化学中化学键的本质,深刻认识有机化学分子结构与物理、化学性质的内在联系和变化规律。
掌握高等有机化学的基本原理、动态学原理及其有机化学的五大反应原理。
掌握研究反应机理和设计合成方法。
从微观电子结构层次上认识有机化学动态反应过程。
通过有机化合物的结构可推测其物理性质和化学反应性质。
学会并领悟分析问题、解决问题的方法和技能,为继续学习相关课程奠定理论基础,为从事相应专业的工作提供必要的理论知识。
本课程课堂讲授(包括自学、讨论)54学时,以便于每学期根据实际情况调整教学,考试方式为闭卷考试,总评成绩:平时成绩占40%,期末考试占60%。
三、课程教学内容第一章化学键.(一)主要内容1.偶极矩、氢键、氢键在有机化学中的应用2.共振论与分子轨道,共振论在有机化学中的应用,分子轨道理论简介(二)基本要求掌握偶极矩、氢键、氢键在有机化学中的应用。
共振论与分子轨道,共振论在有机化学中的应用,分子轨道理论简介。
解决难点:共振论与分子轨道,共振论在有机化学中的应用,分子轨道理论简介。

第十一章 醛、酮和醌(一) 写出丙醛与下列各试剂反应时生成产物的构造式。
(1) NaBH 4,NaOH 水溶液 (2) C 2H 5MgBr ,然后加H 2O (3) LiAlH 4 , 然后加H 2O (4) NaHSO 3 (5) NaHSO 3 , 然后加NaCN (6) OH - , H 2O(7) OH - , H 2O , 然后加热 (8) HOCH 2CH 2OH , H + (9) Ag(NH 3)2OH(10) NH 2OH解:(1)、CH 3CH 2CH 2OH (2)、CH 3CH 2C 2H 5OH(3)、CH 3CH 2CH 2OH(4)、CH 3CH 2CHSO 3NaOH(5)、CH 3CH 2CHCN OH(6)、CH 3CH 2CHCHCHO 3OH(7)、CH 3CH 2CH=CCHOCH 3(8)、OCH 3CH 2C OH(9)、CH 3CH 2COO - + Ag(10)、CH 3CH 2CH=NOH(二) 写出苯甲醛与上题各试剂反应时生成产物的构造式,若不反应请注明。
(1)、C 6H 5CH 2OH (2)、C 6H 5C 2H 5OH(3)、C 6H 5CH 2OH(4)、C 6H 53Na OH (5)、C 6H 5OH(6)、不反应 (7)、不反应(8)、OC OC 6H 5H(9)、C 6H 5COO - (10)、C 6H 5C=NOH(三) 将下列各组化合物按其羰基的活性排列成序。
(1)CH 3CH O,CH 3CCHO O, CH 3CCH 2CH 3O,(CH 3)3CCC(CH 3)3O(2)CH 33OC 2H 53O ,解:(1)CH 3CHOCH 3O CH 32CH 3O(CH 3)33)3O(2)CH33O C 2H 53O(四) 怎样区别下列各组化合物?(1)环己烯,环己酮,环己烯 (2) 2-己醇,3-己醇,环己酮(3)CHO3CH 2CHO COCH 3OH3CH 2OH,,,,解:(1)OOH析出白色结晶褪色不褪色xx(2)CH 32)3CH 3OHCH 3CH 22)2CH 3OHO2,4-二硝基苯腙(黄色结晶)xxxCHI 3 (黄色结晶)(3) p-CH 3C 6H 4CHO C 6H 5CH 2CHOC 6H 5COCH3C 6H 5CH 2OHp-CH 3C 6H 4OH323Ag 镜Ag 镜x xxCu 2O (砖红)xx 显色xCHI 3(黄)(五) 化合物(A)的分子式C 5H 120,有旋光性,当它有碱性KMnO 4剧烈氧化时变成没有旋光性的C 5H 10O(B)。
目录历史背景简述卡宾反应的定义和机理卡宾反应的催化条件卡宾反应中的试剂卡宾反应的特点非传统卡宾反应卡宾反应在药物及天然产物合成中的应用卡宾反应实例参考文献(大于30篇)1.历史背景在20世纪中期,开始有化学工作者对卡宾进行研究工作[1],对卡宾研究的初期实验室工作大部分是由Skell完成的[2].1964年,Fischer等成功把卡宾引入到合成有机化合物中[3],此后金属卡宾在有机合成和大分子化学中得到了广泛的应用。
1968年,Ofele[4]和Wanzlick等[5]合成了N一杂环卡宾(N-Heterocyclic carbine,NHC)的金属络合物,但他们并未成功分离出游离的NHC,只限于研究金属络合物。
1991年,Arduengo等首次成功分离得到了第一个稳定的N一杂环卡宾——咪唑-2-碳烯[6],立即引起了化学界极大的关注。
2.卡宾反应的定义和机理2.1卡宾反应的定义卡宾又称碳烯是一类包含只有六个价电子的两价碳原子化合物的总称。
卡宾是非常活泼的物质, 卡宾生存期全在一秒以下, 用低温(77K或更低)矩阵捕获法已经分离出卡宾[7]。
最简单的卡宾是亚甲基 , 卡宾实际是亚甲基及其衍生的总称.亚甲基及其衍生物作为中间体参与的反应成为卡宾反应。
2.1.1卡宾的分类CH2CHR CRR'(R为烷基、芳基、烯基或者炔基)CHX CRX CRX (X 为F 、Cl 、Br 、I ) CHY CRY CYY ' (Y 为CN 等吸电子集基团)CR 2C C C CR 22.1.2卡宾的命名卡宾命名通常采用卡宾命名系统和碳烯命名系统2.1.3卡宾的结构碳原子有4个价电子,卡宾只用了2个价电子来成键,还剩两个非键轨道,共容纳2个电子,这2个非键电子有两种填充方式在光谱上叫单线态卡宾和三线态卡宾:a )2个电子占据1个轨道,自旋相反;b )2个电子各自占据1个轨道,其自旋方向可以相同。
H H(a ) (b)单线态、三线态是光谱学上的术语。
第十一章酚和醌一、用系统命名法命名下列化合物:1.NO2 OHCH3OH2.3.OHCH3CH34.O2NOHNO5.OHOCH36.C2H5CH3OHSO3HHO7.8.OH9.HOOHOH10.CH3OHCH(CH3)2 11.NO2OH12.CCClO5-硝基-1-萘酚2-氯-9,10-蒽醌二、写出下列化合物的结构式:1.对硝基苯酚2,对氨基苯酚3,2,4-二氯苯氧乙酸ClClNO 2OH NH 2OHOCH 2COOH4.2,4,6-三溴苯酚 5。
邻羟基苯乙酮 6,邻羟基乙酰苯OH OHBrBrBrCOCH 3OHCOCH 37, 4-甲基-2,4- 8,1,4-萘醌- 9,2,6-蒽醌二磺酸二叔丁基苯酚 -2-磺酸钠OHCH 3(CH 3)3CC(CH 3)3OOOSO 3NaOSO 3HHSO 310.醌氢醌 11,2,2-(4,4‘-二羟基 12,对苯醌单肟苯基)丙烷OOOHHOHC CH 3CH 3HOONOH三、写出邻甲基苯酚与下列试剂作用的反应式:OHCH 3FeCl 3+OCH 3Fe63-(1)OHCH 3Br 2/H 2O+OHCH 3(2)BrBrOHCH 3NaOH+ONaCH 3(3)OHCH 3CH 3COCl+OCOCH 3CH 3(4)OHCH 3(CH 3CO)2O+OCOCH 3CH 3(5)OHCH 3稀HNO ++OHCH 3(6)2OHCH 3O 2NOHCH 3Cl 2(过量)+(7)OHCH 3ClClOHCH 3浓H 2SO 4+(8)OHCH 33SSO 3HOHCH 3NaOH/(CH 3)2SO +(9)OCH 3CH 3OHCH 3++OHCH 3(10)CH 2OHOHCH 2OHH 3C HCHOH + or OH -四、用化学方法区别下列化合物:O C H 3CH 3OHCH 2OH五、分离下列各组化合物: 1,苯和苯酚解:加入氢氧化钠水溶液,分出苯,水相用盐酸酸化,分出苯酚2,环己醇中含有少量苯酚。
卤代烃消除反应的探究与思考摘要:从反应机理的角度探讨了“无β氢的卤代烃”能发生消除反应并给出反应实证,提出了教学与资料编写要注重科学性,要关心和预见学生现在学习和未来学习有机衔接的思考。
关键词无βH的卤代烃β消除碳正离子重排α消除消除反应1 问题的提出长期以来,一些文献认为“无βH的卤代烃不能发生消除反应生成烯烃”。
有代表性的表述如:(1)卤代甲烷不能发生消除反应,碳原子数必须≥2且与卤素原子直接相连的碳原子的邻位碳上必须有氢原子才能发生消除反应;(2)卤代烃一般可以发生消除反应,但只有一个碳原子的或具有下列结构的卤代烃不能发生消除反应,如CR2R3R1CH2X等;(3)2,2二甲基1氯丙烷是不能发生消除反应的,因为与氯原子相连的碳原子的相邻碳上没有氢[1~3]。
笔者对以上观点有不同的看法。
本文运用文献研究成果,从卤代烃消除反应的机理探讨无βH的卤代烃的消除反应,并结合中学教学实际谈处理该知识点的策略,以期对无βH的卤代烃的教学有一个较为理性的认识。
2 卤代烃消除反应的机理2.1 卤代烃消除反应的3种情况卤代烃失去卤化氢或卤素,生成烯烃或炔烃的反应称为卤代烃的消除反应。
可以根据消去2原子或基团的相对位置分为3类[4~6]。
若消去的2个原子连在同一个碳原子上,称为1,1消除或α消除;2个消去的原子连在相邻的2个碳原子上,则称为1,2消除或β消除;2个消去的原子连在1,3位碳原子上,则称为1,3消除或γ消除。
中学教学主要涉及的是在溶液中进行的离子型反应,生成烯键或炔键,一般属β消除反应。
2.2 卤代烃消除反应的3种机理根据消除反应所涉及的机理可将其分为单分子消除反应(E1)、双分子消除反应(E2)和单分子共轭碱消除反应(E1cb)[4~8]。
2.2.1 单分子消除单分子消除为2步过程,第一步是离去基团带着一对电子离去,底物成为碳正离子;第二步是碳正离子从β位脱去一个质子,给予碱或溶剂,生成烯键,第一步速率较慢,是决定反应速率的步骤。
第十一章卡宾
11.1 卡宾的定义
C:表示,卡宾(carbene),又称碳烯,一般以R
2
指碳原子上只有两个价键连有基团,还剩两个未成键电子的高活性中间体。
卡宾的寿命远低于1秒,只能在低温下(77K以下)捕集,在晶格中加以分离和观察。
它的存在已被大量实验所证明。
卡宾的两个未成键电子既能自旋方向相反,处于单线态,也可自旋方向平行,处于三线态。
取哪种状
C:的两种态应视取代基和制备方法而异。
下式为H
2
状态:
单线态和三线态卡宾
11.2 卡宾的轨道
1CH2H f=110.856KCAL/MOL3CH2H f=80.809KCAL/MOL
11.3 卡宾的立体结构
烷基卡宾
三线态卡宾的结构,最简单是用中心碳原子sp杂化来描述。
两个sp杂化轨道和两个氢原子成键,两个没有杂化的p轨道,每一个容纳一个电子。
这是形成两个σ键和最大程度降低所有六个电子的电子与电子之间相互排拒的最有效的形式。
三线态卡宾的分子构型是线性的。
由于每一个p轨道只容纳了一个电子,因而可以把三线态卡宾看作是一个双游离基。
事实上,它们在许多方面的表现也确是如此。
单线态卡宾最简单是用中心碳原子sp2杂化来描述。
在这三个sp2杂化轨道中,有两个和氢原子成键,第三个容纳孤电子对。
没有杂化的p轨道保持是空的。
这是对三个电子对的最大程度减少电子与电子之间排拒作用的最有效的形式。
单线态的几何构型是弯的,由于孤电子对对C-H 键的排拒作用,键角小于120°。
单线态卡宾同时显示了碳负离子的独电子对和碳正离子的空p轨道。
实际上,这样考虑的单线态和三线态的结构是过于简单化的。
最近的计算和测定的结果:单线态卡宾的键角约为103°,三线态键角约为136°。
单线态和三线态之间的能量差别也曾经见诸报导,三线态比单线态稳定,能量差约为8∼9千卡/摩尔。
芳基卡宾
电子自旋共振谱表明芳基卡宾的基态是三线态。
反应物光解首先形成单线态卡宾,然后自旋反转,形成三线态卡宾。
三线态的esr信号的寿命比较长,在77K长达几小时。
芳基卡宾的esr谱表明芳基卡宾有一个未成对电子和芳香π体系共轭,一个未成对电子和它垂直。
基态三线态芳基卡宾是弯的,这里,一个p轨道和芳香体系重叠,从而在77K阻碍了旋转。
11.4 卡宾的生成
(1)活泼的乙烯酮或重氮化合物分解
(2) α-消去反应
二卤卡宾的稳定性和卤素的电负性是密切关联的。
卤素的电负性越大,二卤卡宾的稳定性越高。
(3) 三卤乙酸的碱脱羧反应
(4)碳正离子中间体的α-消去反应
(5)光消去反应
(6)三卤甲基汞衍生物分解反应
(7) 强碱与烷基锂的作用
11.5 卡宾的反应卡宾是典型的缺电子的化合物,它们以亲电子反应为特征。
1.和负离子反应二氯卡宾很容易和卤离子结合,形成CX 3 -,然后接受质子,形成卤仿。
与中性分子(如水)作用,形成溶剂化产品,也是常见的。
2. 对多重键反应(合成环状结构)
b.卡宾和C=N ,C=P ,N=N 等双键也能发生加成反应。
例如,二氯卡宾加成到重氮化合物(A)形成烯烃
(B)。
a.烯烃
对N=N双键加成,并不形成二氮杂环丙烷;用偶氮二甲酸酯捕集卡宾,形成重排产品。
c.苯
卡宾和叁键也能发生加成反应。
3. 对单键反应
4. 重排反应
饶有兴趣的是:使用光学活性环丙烷作用物,给予光学活性丙二烯,反应具有高度的立体选择性。
这种重排,考虑是顺旋开环。
但是,这里可能有两种顺旋开环,导致两种不同的对映体。
可以预计开环按非键张力最小的途径进行。
芳基卡宾在溶液中虽然不倾向于重排,但是在气相加热则发生重排。
5. 二聚反应
在溶液中进行反应,卡宾几乎不发生二聚;这里,卡宾的浓度很小,两个分子相遇以前,已然和作用物发生反应,或者分子内部发生反应,形成了新的产品。
但是,在闪光分解、或者温热的惰性模床的条件下,则二聚产品是常见的。
11.6 单线态和三线态卡宾反应的特点
1. 对单键反应
单线态卡宾(协同机理)
反应产物具有立体选择性
三线态卡宾(自由基机理)
反应产物无立体选择性
2. 对π键反应
单线态卡宾(协同机理)
反应产物具有立体选择性
三线态卡宾(自由基机理)
反应产物无立体选择性
单线态卡宾选择性比较小。
在C-H插入反应中只有很小的选择性。
和异戊烷反应,选择性依次3°>2°>1°,比例为1.5:1.2:1。
在烯烃环加成中,由于取代基的不同,在速度上只有很小的改变。
这些选择性数据表明单线态卡宾反应对自由基稳定性不敏感。
三线态卡宾与不同类的C-H键反应的选择性比较大,选择性依次3°>2°>1°,比例约为7:2:1。
对烯烃的活泼性表现的范围也比较大,例如,在气相,三线态卡宾与丁二烯-1,3的反应比与乙烯的快19倍。
这些情况很容易在形成最稳定的双自由基或自由基对的基础上来解释。