高三化学复习优质课件8:离子共存 离子的检验和推断
- 格式:pptx
- 大小:4.25 MB
- 文档页数:2










离子共存离子的检验和推断1.离子共存的本质几种离子在同一溶液中能大量共存,就是指离子之间不发生任何反应;若离子之间能发生反应,则不能大量共存。
2.判断离子能否大量共存的“四个要点”判断多种离子能否大量共存于同一溶液中,归纳起来就是:一色、二性、三特殊、四反应。
(1)一色——溶液颜色几种常见离子的颜色:离子Cu2+Fe3+Fe2+MnO-4溶液颜色蓝色棕黄色浅绿色紫红色(2)二性——溶液的酸碱性①在强酸性溶液中,OH-及弱酸根阴离子(如CO2-3、SO2-3、S2-、CH3COO-等)不能大量存在。
②在强碱性溶液中,H+及弱碱阳离子(如NH+4、Al3+、Fe3+等)不能大量存在(3)三特殊——三种特殊情况:①AlO-2与HCO-3不能大量共存:AlO-2+HCO-3+H2O===Al(OH)3↓+CO2-3。
②“NO-3+H+”组合具有强氧化性,能与S2-、Fe2+、I-、SO2-3等还原性的离子发生氧化还原反应而不能大量共存。
③NH+4与CH3COO-、CO2-3,Mg2+与HCO-3等组合中,虽然两种离子都能水解且水解相互促进,但总的水解程度仍很小,它们在溶液中仍能大量共存。
(4)四反应——四种反应类型四反应是指离子间通常能发生的四种类型的反应,能相互反应的离子显然不能大量共存。
①复分解反应:如Ba2+与SO2-4,NH+4与OH-,H+与CH3COO-等。
②氧化还原反应:如Fe3+与I-、S2-,NO-3(H+)与Fe2+等。
③相互促进的水解反应:如Al3+与CO2-3、HCO-3或AlO-2等。
④络合反应:如Fe3+与SCN-等。
问题思考指出下列离子组不能大量共存的原因。
(1)Na+、OH-、SO2-4、Fe3+_____________________________________________________。
(2)K+、Mg2+、I-、ClO-_______________________________________________________。
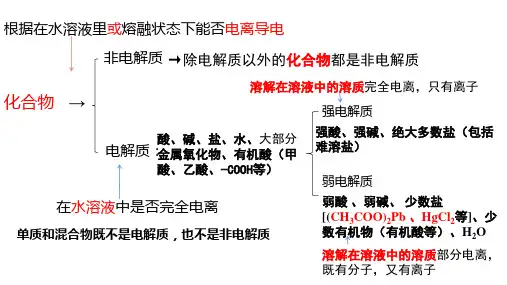
课时6离子共存、离子检验和推断考点一离子共存的判断【考必备·清单】1.离子共存的含义所谓几种离子在同一溶液中能大量共存,就是指离子之间不发生任何反应;若离子之间能发生反应,则不能大量共存。
2.熟记常考离子的性质[名师点拨]①无色溶液中,有色离子不能存在;透明溶液中可能含有有色离子。
②既能与酸反应又能与碱反应的离子,一般为多元弱酸的酸式酸根离子。
3.熟记相互促进的水解反应4.离子共存判断中常见的限制条件加水稀释,c H+c OH-减小某溶液的lgc H+c OH-=12【提素能·好题】1.判断正误(正确的打“√”,错误的打“×”)。
(1)透明的溶液即无色溶液,不含有任何有颜色的离子()(2)Fe3+和Al3+在中性溶液中能大量存在()(3)加入铝粉能够发生反应产生氢气的溶液,一定是酸性溶液()(4)水电离出c(H+)=1×10-13 mol·L-1的溶液呈碱性()(5)次氯酸能电离产生H+,故在溶液中H+和ClO-能够大量共存()答案:(1)×(2) ×(3)×(4)×(5)×2.下列各组离子在溶液中因发生复分解反应而不能大量共存的是。
①K+、H+、CH3COO-、Br-②Ba2+、Na+、CO2-3、NO-3③Na+、HCO-3、H+、Cl-④Al3+、Fe3+、NO-3、SO2-4⑤Na+、K+、AlO-2、NO-3⑥Na+、H+、Cl-、OH-答案:①②③⑥3.下列各组离子在溶液中因发生氧化还原反应而不能大量共存的是。
①H3O+、NO-3、Fe2+、Na+②Na+、Fe3+、I-、Cl-③H+、S2-、SO2-3、SO2-4④SO2-4、NO-3、Na+、H+⑤I-、ClO-、K+、H+⑥Na+、K+、MnO-4、Cl-答案:①②③⑤⑥4.下列各组离子在溶液中因水解相互促进而不能大量共存的是。
离子共存、离子的检验和推断【知识梳理】一、离子共存1.实质:几种离子在同一溶液中能大量共存,就是指离子之间不发生任何反应;若离子之间能发生反应,则不能大量共存。
2.离子间通常进行的四类反应(1)复分解反应:生成沉淀、气体、弱电解质等思考:试总结因发生复分解反应不能共存的离子(2)氧化还原反应:常见氧化性离子:常见还原性离子:(3)双水解反应:常见的因发生相互促进的水解反应而不能大量共存的离子如下:①Al3+与、、、、AlO2-、SiO32-;②Fe3+与、、AlO2-、SiO32-;③NH4+与AlO2-、SiO32-。
(4)形成配合物:Fe3+与形成、Ag+与NH3·H2O形成而不能大量共存注意:还应注意题干中的限制性条件(详见“知识探究”)A.在溶液中加KSCN,溶液显红色,证明原溶液中有Fe3+,无Fe2+B.气体通过无水CuSO4,粉末变蓝,证明原气体中含有水蒸气C.灼烧白色粉末,火焰呈黄色,证明原粉末中有Na+,无K+D.将气体通入澄清石灰水,溶液变浑浊,证明原气体是CO2【知识探究】一、离子共存问题中的常见“陷阱”例1 下列各溶液中一定能大量共存的离子组是()A.加入铝粉有氢气生成的溶液中:Mg2+、Cu2+、SO42-、K+B.使pH试纸呈红色的溶液中:Fe2+、I-、NO3-、Cl-C.常温下,c(H+)=10-13mol·L-1的溶液中:Na+、AlO2-、S2-、SO32-+--28的溶液中:K+、Na+、HCO-、Ca2+有色离子不能大量存在,例如:Cu2+( )、Fe3+( )、Fe2+( )、MnO4-( )、[Fe SCN2]+( )“因发生氧化还原反应而不能大量共存”只能是氧化性离子和还原性离子不能大量共存,不包括其他类型反应的离子常见的易错点“透明”“透明”也可“有色”“与Al反应放出H2”溶液既可能显酸性也可能显碱性“由水电离出的c(H+)=1×10-12 mol·L-1”溶液既可能显酸性也可能显碱性“通入足量的NH3”与NH3·H2O反应的离子不能大量存在常见题干要求(1)“一定大量共存”(2)“可能大量共存”(3)“不能大量共存”审清关键字二、离子推断例2某钠盐溶液可能含有阴离子NO3-、CO32-、SO32-、SO42-、Cl-、Br-、I-。