2015年山东省高考化学试卷答案与解析
- 格式:doc
- 大小:242.00 KB
- 文档页数:14


2015年普通高等学校招生全国统一考试(山东卷)化学一、选择题(共7小题,每小题5分,满分35分)1.(5分)进行化学实验时应强化安全意识。
下列做法正确的是( )A.金属钠着火时使用泡沫灭火器灭火B.用试管加热碳酸氢钠固体时使试管口竖直向上C.浓硫酸溅到皮肤上时立即用稀氢氧化钠溶液冲洗D.制备乙烯时向乙醇和浓硫酸的混合液中加入碎瓷片解析:A、金属钠着火生成过氧化钠,与泡沫灭火器喷出的二氧化碳反应,反应生成的氧气助燃,不能灭火,应利用沙土铺盖,故A错误;B、碳酸氢钠分解生成水,则用试管加热碳酸氢钠固体时使试管口略向下倾斜,故B错误;C、酸碱中和放出大量的热,且强酸、强碱具有强腐蚀性,则浓硫酸溅到皮肤上时立即用抹布擦拭,再水冲洗,最后涂上适量的碳酸氢钠溶液,故C错误;D、制备乙烯时向乙醇和浓硫酸的混合液加入碎瓷片,防止暴沸,从实验安全的角度考虑,故D正确。
答案:D2.(5分)短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示。
已知Y、W的原子序数之和是Z的3倍,下列说法正确的是( )Y ZX WA.原子半径:X<Y<ZB.气态氢化物的稳定性:X>ZC.Z、W均可与Mg形成离子化合物D.最高价氧化物对应水化物的酸性:Y>W解析:Y、W的原子序数之和是Z的3倍,设Y的原子序数为x,则Z的原子序数为x+1,W的原子序数为x+10,则x+x+10=3×(x+1),解得x=7,即Y为N,结合位置关系可知,Z为O,X为Si,W为Cl,A、电子层越多,原子半径越大,则原子半径为X>Y>Z,故A错误;B、非金属性越强,气态氢化物越稳定,则气态氢化物的稳定性为X<Z,故B错误;C、Z、W均可与Mg形成离子化合物,分别为Mg3N2、MgCl2,故C正确;D、Cl的最高价氧化物对应水化物的酸性为含氧酸中酸性最强的酸,则最高价氧化物对应水化物的酸性:Y<W,故D错误。
答案:C3.(5分)分枝酸可用于生化研究。

2015年山东省高考化学试卷一、选择题(共7小题,每小题5分,满分35分)1.(5分)进行化学实验时应强化安全意识.下列做法正确的是()A.金属钠着火时使用泡沫灭火器灭火B.用试管加热碳酸氢钠固体时使试管口竖直向上C.浓硫酸溅到皮肤上时立即用稀氢氧化钠溶液冲洗D.制备乙烯时向乙醇和浓硫酸的混合液中加入碎瓷片2.(5分)短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示。
已知Y、W的原子序数之和是Z的3倍,下列说法正确的是()Y ZX WA.原子半径:X<Y<ZB.气态氢化物的稳定性:X>ZC.Z、W均可与Mg形成离子化合物D.最高价氧化物对应水化物的酸性:Y>W3.(5分)分枝酸可用于生化研究.其结构简式如图.下列关于分枝酸的叙述正确的是()A.分子中含有2种官能团B.可与乙醇、乙酸反应,且反应类型相同C.1mol分枝酸最多可与3molNaOH发生中和反应D.可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同4.(5分)某化合物由两种单质直接反应生成,将其加入Ba(HCO3)2溶液中同时有气体和沉淀产生.下列化合物中符合上述条件的是()A.AlCl3B.Na2O C.FeCl2D.SiO25.(5分)下列由实验现象得出的结论正确的是()操作及现象结论A向AgCl悬浊液中加入NaI溶液时出现黄色沉淀K sp(AgCl)<K sp(AgI)B向某溶液中滴加氯水后再加入KSCN溶液,溶液呈红溶液中一定含有Fe2+色C向NaBr溶液中滴入少量氯水和苯,振荡、静置,溶Br﹣还原性强于Cl﹣液上层呈橙红色D加热盛有NH4Cl固体的试管,试管底部固体消失,试NH4Cl固体可以升华管口有晶体凝结A.A B.B C.C D.D6.(5分)下列表示对应化学反应的离子方程式正确的是()A.向稀HNO3中滴加Na2SO3溶液:SO32﹣+2H+═SO2↑+H2OB.向Na2SiO3溶液中通入过量SO2:SiO32﹣+SO2+H2O═H2SiO3↓+SO32﹣C.向Al2(SO4)3溶液中加入过量的NH3•H2O:Al3++4NH3•H2O═AlO2﹣+4NH4++2H2O D.向CuSO4溶液中加入Na2O2:2Na2O2+2Cu2++2H2O═4Na++2Cu(OH)2↓+O2↑7.(5分)室温下向10mL 0.1 mol•L﹣1NaOH溶液中加入0.1mol•L﹣1的一元酸HA 溶液pH的变化曲线如图所示.下列说法正确的是()A.a点所示溶液中c(Na+)>c(A﹣)>c(H+)>c(HA)B.a、b两点所示溶液中水的电离程度相同C.pH=7时,c(Na+)=c(A﹣)+c(HA)D.b点所示溶液中c(A﹣)>c(HA)二、解答题8.(15分)利用LiOH和钴氧化物可制备锂离子电池正极材料.LiOH可由电解法制备,钴氧化物可通过处理钴渣获得.(1)利用如图装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液.B 极区电解液为溶液(填化学式),阳极电极反应式为,电解过程中Li+向电极迁移(填“A”或“B”).(2)利用钴渣[含Co(OH)3、Fe(OH)3等]制备钴氧化物的工艺流程如下:Co(OH)3溶解还原反应的离子方程式为,铁渣中铁元素的化合价为,在空气中煅烧CoC2O4生成钴氧化物和CO2,测得充分煅烧后固体质量为2.41g,CO2的体积为1.344L(标准状况),则钴氧化物的化学式为.9.(19分)合金贮氢材料具有优异的吸放氢性能,在配合氢能的开发中起到重要作用.(1)一定温度下,某贮氢合金(M)的贮氢过程如图所示,纵轴为平衡时氢气的压强(p),横轴表示固相中氢原子与金属原子的个数比(H/M).在OA段,氢溶解于M中形成固溶体MH x,随着氢气压强的增大,H/M逐惭增大;在AB段,MH x与氢气发生氢化反应生成氢化物MH y,氢化反应方程式为:zMH x(s)+H2(g)⇌zMH y(s)△H(Ⅰ);在B点,氢化反应结束,进一步增大氢气压强,H/M几乎不变.反应(Ⅰ)中z=(用含x和y的代数式表示).温度为T1时,2g某合金4min内吸收氢气240mL,吸氢速率v=mL•g﹣1•min ﹣1.反应(Ⅰ)的焓变△HⅠ0(填“>”“<”或“=”).(2)η表示单位质量贮氢合金在氢化反应阶段的最大吸氢量占其总吸氢量的比例,则温度为T1、T2时,η(T1)η(T2)(填“>”“<”或“=”).当反应(Ⅰ)处于图中a点时,保持温度不变,向恒容体系中通入少量氢气,达到平衡后反应(Ⅰ)可能处于图中的点(填“b”“c”或“d”),该贮氢合金可通过或的方式释放氢气.(3)贮氢合金ThNi5可催化由CO、H2合成CH4的反应,温度为T时,该反应的热化学方程式为.已知温度为T时:CH4(g)+2H2O═CO2(g)+4H2(g)△H=+165kJ•mol﹣1CO(g)+H2O(g)═CO2(g)+H2(g)△H=﹣41kJ•mol﹣1.10.(19分)毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2•2H2O的流程如下:(1)毒重石用盐酸浸取前需充分研磨,目的是。

2015年山东省高考化学试卷一、选择题(共7小题,每小题5分,满分35分)1.(5分)进行化学实验时应强化安全意识.下列做法正确的是()A.金属钠着火时使用泡沫灭火器灭火B.用试管加热碳酸氢钠固体时使试管口竖直向上C.浓硫酸溅到皮肤上时立即用稀氢氧化钠溶液冲洗D.制备乙烯时向乙醇和浓硫酸的混合液中加入碎瓷片2.(5分)短周期元素、Y、、W在元素周期表中的相对位置如图所示。
已知Y、W的原子序数之和是的3倍,下列说法正确的是()YWA.原子半径:<Y<B.气态氢化物的稳定性:>C.、W均可与Mg形成离子化合物D.最高价氧化物对应水化物的酸性:Y>W3.(5分)分枝酸可用于生化研究.其结构简式如图.下列关于分枝酸的叙述正确的是()A.分子中含有2种官能团B.可与乙醇、乙酸反应,且反应类型相同C.1mol分枝酸最多可与3molNaOH发生中和反应D.可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同4.(5分)某化合物由两种单质直接反应生成,将其加入Ba(HCO3)2溶液中同时有气体和沉淀产生.下列化合物中符合上述条件的是()A.AlCl3B.Na2O C.FeCl2D.SiO25.(5分)下列由实验现象得出的结论正确的是()操作及现象结论A向AgCl悬浊液中加入NaI溶液时出现黄色沉淀sp(AgCl)<sp(AgI)B向某溶液中滴加氯水后再加入SCN溶液,溶液呈红色溶液中一定含有Fe2+C向NaBr溶液中滴入少量氯水和苯,振荡、静置,溶液上层呈橙红色Br﹣还原性强于Cl﹣D加热盛有NH4Cl固体的试管,试管底部固体消失,试管口有晶体凝结NH4Cl固体可以升华A.A B.B C.C D.D6.(5分)下列表示对应化学反应的离子方程式正确的是()A.向稀HNO3中滴加Na2SO3溶液:SO32﹣+2H+═SO2↑+H2OB.向Na2SiO3溶液中通入过量SO2:SiO32﹣+SO2+H2O═H2SiO3↓+SO32﹣C.向Al2(SO4)3溶液中加入过量的NH3•H2O:Al3++4NH3•H2O═AlO2﹣+4NH4++2H2O D.向CuSO4溶液中加入Na2O2:2Na2O2+2Cu2++2H2O═4Na++2Cu(OH)2↓+O2↑7.(5分)室温下向10mL 0.1 mol•L﹣1NaOH溶液中加入0.1mol•L﹣1的一元酸HA 溶液pH的变化曲线如图所示.下列说法正确的是()A.a点所示溶液中c(Na+)>c(A﹣)>c(H+)>c(HA)B.a、b两点所示溶液中水的电离程度相同C.pH=7时,c(Na+)=c(A﹣)+c(HA)D.b点所示溶液中c(A﹣)>c(HA)二、解答题8.(15分)利用LiOH和钴氧化物可制备锂离子电池正极材料.LiOH可由电解法制备,钴氧化物可通过处理钴渣获得.(1)利用如图装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液.B 极区电解液为溶液(填化学式),阳极电极反应式为,电解过程中Li+向电极迁移(填“A”或“B”).(2)利用钴渣[含Co(OH)3、Fe(OH)3等]制备钴氧化物的工艺流程如下:Co(OH)3溶解还原反应的离子方程式为,铁渣中铁元素的化合价为,在空气中煅烧CoC2O4生成钴氧化物和CO2,测得充分煅烧后固体质量为2.41g,CO2的体积为1.344L(标准状况),则钴氧化物的化学式为.9.(19分)合金贮氢材料具有优异的吸放氢性能,在配合氢能的开发中起到重要作用.(1)一定温度下,某贮氢合金(M)的贮氢过程如图所示,纵轴为平衡时氢气的压强(p),横轴表示固相中氢原子与金属原子的个数比(H/M).在OA段,氢溶解于M中形成固溶体MH,随着氢气压强的增大,H/M逐惭增大;在AB段,MH与氢气发生氢化反应生成氢化物MH y,氢化反应方程式为:MH (s)+H2(g)⇌MH y(s)△H(Ⅰ);在B点,氢化反应结束,进一步增大氢气压强,H/M几乎不变.反应(Ⅰ)中=(用含和y的代数式表示).温度为T1时,2g某合金4min内吸收氢气240mL,吸氢速率v=mL•g﹣1•min﹣1.反应(Ⅰ)的焓变△HⅠ0(填“>”“<”或“=”).(2)η表示单位质量贮氢合金在氢化反应阶段的最大吸氢量占其总吸氢量的比例,则温度为T1、T2时,η(T1)η(T2)(填“>”“<”或“=”).当反应(Ⅰ)处于图中a点时,保持温度不变,向恒容体系中通入少量氢气,达到平衡后反应(Ⅰ)可能处于图中的点(填“b”“c”或“d”),该贮氢合金可通过或的方式释放氢气.(3)贮氢合金ThNi5可催化由CO、H2合成CH4的反应,温度为T时,该反应的热化学方程式为.已知温度为T时:CH4(g)+2H2O═CO2(g)+4H2(g)△H=+165J•mol﹣1CO(g)+H2O(g)═CO2(g)+H2(g)△H=﹣41J•mol﹣1.10.(19分)毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2•2H2O的流程如下:(1)毒重石用盐酸浸取前需充分研磨,目的是。

2015年山东省高考化学试卷一、选择题(共7小题,每小题5分,满分35分)1.(5分)进行化学实验时应强化安全意识.下列做法正确的是()A.金属钠着火时使用泡沫灭火器灭火B.用试管加热碳酸氢钠固体时使试管口竖直向上C.浓硫酸溅到皮肤上时立即用稀氢氧化钠溶液冲洗D.制备乙烯时向乙醇和浓硫酸的混合液中加入碎瓷片2.(5分)短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示。
已知Y、W的原子序数之和是Z的3倍,下列说法正确的是()Y ZX WA.原子半径:X<Y<ZB.气态氢化物的稳定性:X>ZC.Z、W均可与Mg形成离子化合物D.最高价氧化物对应水化物的酸性:Y>W3.(5分)分枝酸可用于生化研究.其结构简式如图.下列关于分枝酸的叙述正确的是()A.分子中含有2种官能团B.可与乙醇、乙酸反应,且反应类型相同C.1mol分枝酸最多可与3molNaOH发生中和反应D.可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同4.(5分)某化合物由两种单质直接反应生成,将其加入Ba(HCO3)2溶液中同时有气体和沉淀产生.下列化合物中符合上述条件的是()A.AlCl3B.Na2O C.FeCl2D.SiO25.(5分)下列由实验现象得出的结论正确的是()操作及现象结论A向AgCl悬浊液中加入NaI溶液时出现黄色沉淀K sp(AgCl)<K sp(AgI)B向某溶液中滴加氯水后再加入KSCN溶液,溶液呈红溶液中一定含有Fe2+色C向NaBr溶液中滴入少量氯水和苯,振荡、静置,溶Br﹣还原性强于Cl﹣液上层呈橙红色D加热盛有NH4Cl固体的试管,试管底部固体消失,试NH4Cl固体可以升华管口有晶体凝结A.A B.B C.C D.D6.(5分)下列表示对应化学反应的离子方程式正确的是()A.向稀HNO3中滴加Na2SO3溶液:SO32﹣+2H+═SO2↑+H2OB.向Na2SiO3溶液中通入过量SO2:SiO32﹣+SO2+H2O═H2SiO3↓+SO32﹣C.向Al2(SO4)3溶液中加入过量的NH3•H2O:Al3++4NH3•H2O═AlO2﹣+4NH4++2H2O D.向CuSO4溶液中加入Na2O2:2Na2O2+2Cu2++2H2O═4Na++2Cu(OH)2↓+O2↑7.(5分)室温下向10mL 0.1 mol•L﹣1NaOH溶液中加入0.1mol•L﹣1的一元酸HA 溶液pH的变化曲线如图所示.下列说法正确的是()A.a点所示溶液中c(Na+)>c(A﹣)>c(H+)>c(HA)B.a、b两点所示溶液中水的电离程度相同C.pH=7时,c(Na+)=c(A﹣)+c(HA)D.b点所示溶液中c(A﹣)>c(HA)二、解答题8.(15分)利用LiOH和钴氧化物可制备锂离子电池正极材料.LiOH可由电解法制备,钴氧化物可通过处理钴渣获得.(1)利用如图装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液.B 极区电解液为溶液(填化学式),阳极电极反应式为,电解过程中Li+向电极迁移(填“A”或“B”).(2)利用钴渣[含Co(OH)3、Fe(OH)3等]制备钴氧化物的工艺流程如下:Co(OH)3溶解还原反应的离子方程式为,铁渣中铁元素的化合价为,在空气中煅烧CoC2O4生成钴氧化物和CO2,测得充分煅烧后固体质量为2.41g,CO2的体积为1.344L(标准状况),则钴氧化物的化学式为.9.(19分)合金贮氢材料具有优异的吸放氢性能,在配合氢能的开发中起到重要作用.(1)一定温度下,某贮氢合金(M)的贮氢过程如图所示,纵轴为平衡时氢气的压强(p),横轴表示固相中氢原子与金属原子的个数比(H/M).在OA段,氢溶解于M中形成固溶体MH x,随着氢气压强的增大,H/M逐惭增大;在AB段,MH x与氢气发生氢化反应生成氢化物MH y,氢化反应方程式为:zMH x(s)+H2(g)⇌zMH y(s)△H(Ⅰ);在B点,氢化反应结束,进一步增大氢气压强,H/M几乎不变.反应(Ⅰ)中z=(用含x和y的代数式表示).温度为T1时,2g某合金4min内吸收氢气240mL,吸氢速率v=mL•g﹣1•min ﹣1.反应(Ⅰ)的焓变△HⅠ0(填“>”“<”或“=”).(2)η表示单位质量贮氢合金在氢化反应阶段的最大吸氢量占其总吸氢量的比例,则温度为T1、T2时,η(T1)η(T2)(填“>”“<”或“=”).当反应(Ⅰ)处于图中a点时,保持温度不变,向恒容体系中通入少量氢气,达到平衡后反应(Ⅰ)可能处于图中的点(填“b”“c”或“d”),该贮氢合金可通过或的方式释放氢气.(3)贮氢合金ThNi5可催化由CO、H2合成CH4的反应,温度为T时,该反应的热化学方程式为.已知温度为T时:CH4(g)+2H2O═CO2(g)+4H2(g)△H=+165kJ•mol﹣1CO(g)+H2O(g)═CO2(g)+H2(g)△H=﹣41kJ•mol﹣1.10.(19分)毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2•2H2O的流程如下:(1)毒重石用盐酸浸取前需充分研磨,目的是。

专题13 化学实验基础1.【2015山东理综化学】进行化学实验时应强化安全意识。
下列做法正确的是()A.金属钠着火时使用泡沫灭火器灭火B.用试管加热碳酸氢钠固体时使试管口竖直向上C.浓硫酸溅到皮肤上时立即用稀氢氧化钠溶液冲洗D.制备乙烯时向乙醇和浓硫酸的混合液中加入碎瓷片【答案】D【解析】A、泡沫灭火器喷出的泡沫中含有大量水,钠可与水反应生成氢气,氢气可燃烧甚至可能爆炸,错误;B、加热碳酸氢钠固体有水生成,如果试管口竖直向上,水倒流使试管炸裂,错误;C、浓硫酸溅到皮肤上应立即用干布擦掉,不能用稀氢氧化钠溶液冲洗,错误;D、制备乙烯时加入碎瓷片,可防止爆沸,正确。
【考点定位】本题以化学实验的安全常识为切入点,考查了学生的实验基本常识在实际操作中的应用,考查了高中化学重要实验的基本仪器的使用和实验基本操作。
【名师点睛】实验安全为化学实验的主要内容,本题涉及了重要物质和实验的安全问题,包含了金属钠着火时的灭火、固体反应的加热装置、浓硫酸的使用安全和加热液体时需加入沸石,体现了实验在化学中的重要作用,考生应熟练掌握重要化学实验的基本仪器的使用以及注意事项,记住实验基本操作及其原因。
2.【2015新课标Ⅰ卷理综化学】下列实验中,对应的现象以及结论都正确且两者具有因果关系的是()【答案】D【考点定位】中学常见实验、常见反应的定性考查;难度为一般等级【名师点晴】这种题主要考查考生读题获取的信息是否完整、是否抓住了关键词(A项中的“过量铁粉”、B项“有黑色固体出现”、C项“液态铝滴落”、D项“不再有沉淀产生”等)。
学生的决断力也有考查,如看到B项“有黑色固体出现”,考生要坚信自己所学的Cu和Fe3+的反应而判断B项错误。
【注】本题同时分类于专题5、133.【2015新课标Ⅱ卷理综化学】海水开发利用的部分过程如图所示。
下列说法错误..的是()A.向苦卤中通入Cl2是为了提取溴B.粗盐可采用除杂和重结晶等过程提纯C.工业生产中常选用NaOH作为沉淀剂D.富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收【答案】C【解析】A.氯气具有强氧化性,能把溴离子氧化为单质溴,因此向苦卤中通入Cl2是为了提取溴,A正确;B.粗盐中的钙离子、镁离子等可采用沉淀法除去,所得氯化钠溶液可采用重结晶等过程提纯,B正确;C.工业生产常选用来源更广泛、价格更便宜的石灰乳作为沉淀剂,用氢氧化钠不经济,C错误;D.富集溴一般先用空气和水蒸气吹出单质溴,SO2具有还原性,能被溴氧化,因此再用SO2将其还原吸收,D正确,答案选C。
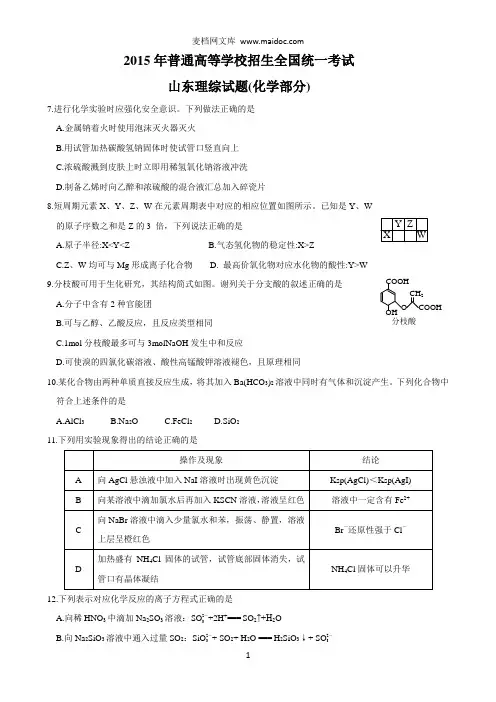
2015年普通高等学校招生全国统一考试山东理综试题(化学部分)7.进行化学实验时应强化安全意识。
下列做法正确的是 A.金属钠着火时使用泡沫灭火器灭火B.用试管加热碳酸氢钠固体时使试管口竖直向上C.浓硫酸溅到皮肤上时立即用稀氢氧化钠溶液冲洗D.制备乙烯时向乙醉和浓硫酸的混合液汇总加入碎瓷片8.短周期元素X 、Y 、Z 、W 在元素周期表中对应的相应位置如图所示。
已知是Y 、W 的原子序数之和是Z 的3 倍,下列说法正确的是A.原子半径:X<Y<ZB.气态氢化物的稳定性:X>ZC.Z 、W 均可与Mg 形成离子化合物D. 最高价氧化物对应水化物的酸性:Y>W 9.分枝酸可用于生化研究,其结构简式如图。
谢列关于分支酸的叙述正确的是 A.分子中含有2种官能团B.可与乙醇、乙酸反应,且反应类型相同C.1mol 分枝酸最多可与3molNaOH 发生中和反应D.可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同10.某化合物由两种单质直接反应生成,将其加入Ba(HCO 3)2溶液中同时有气体和沉淀产生。
下列化合物中符合上述条件的是A.AlCl 3B.Na 2OC.FeCl 2D.SiO 2 11.下列用实验现象得出的结论正确的是12.下列表示对应化学反应的离子方程式正确的是A.向稀HNO 3中滴加Na 2SO 3溶液:SO 2-3+2H +=== SO 2↑+H 2OB.向Na 2SiO 3溶液中通入过量SO 2:SiO 2-3+ SO 2+ H 2O === H 2SiO 3↓+ SO 2-3COOHOHO CH 2分枝酸C .向Al 2(SO 4)3溶液中加入过量NH 3•H 2O :Al 3++4NH 3•H 2O === [Al(OH)4]-+ 4NH + 4D.向CuSO 4溶液中加入Na 2O 2:2Na 2O 2+2Cu 2++2H 2O === 4Na ++2Cu(OH)2↓+O 2↑ 13.室温下向10mL 0.1 mol •L-1NaOH 溶液中加入0.1mol·L ‾1 的一元酸HA 溶液pH 的变化曲线如图所示。

2015年山东省高考化学试卷一、选择题(共7小题,每小题5分,满分35分)1.(5分)进行化学实验时应强化安全意识.下列做法正确的是()A.金属钠着火时使用泡沫灭火器灭火B.用试管加热碳酸氢钠固体时使试管口竖直向上C.浓硫酸溅到皮肤上时立即用稀氢氧化钠溶液冲洗D.制备乙烯时向乙醇和浓硫酸的混合液中加入碎瓷片2.(5分)短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示。
已知Y、W 的原子序数之和是Z的3倍,下列说法正确的是()A.原子半径:X<Y<ZB.气态氢化物的稳定性:X>ZC.Z、W均可与Mg形成离子化合物D.最高价氧化物对应水化物的酸性:Y>W3.(5分)分枝酸可用于生化研究.其结构简式如图.下列关于分枝酸的叙述正确的是()A.分子中含有2种官能团B.可与乙醇、乙酸反应,且反应类型相同C.1mol分枝酸最多可与3molNaOH发生中和反应D.可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同4.(5分)某化合物由两种单质直接反应生成,将其加入Ba(HCO3)2溶液中同时有气体和沉淀产生.下列化合物中符合上述条件的是()A.AlCl3B.Na2O C.FeCl2D.SiO25.(5分)下列由实验现象得出的结论正确的是()A .AB .BC .CD .D6.(5分)下列表示对应化学反应的离子方程式正确的是( )A .向稀HNO 3中滴加Na 2SO 3溶液:SO 32﹣+2H +═SO 2↑+H 2OB .向Na 2SiO3溶液中通入过量SO 2:SiO 32﹣+SO 2+H 2O ═H 2SiO 3↓+SO 32﹣C .向Al 2(SO 4)3溶液中加入过量的NH 3•H 2O :Al 3++4NH 3•H 2O ═AlO 2﹣+4NH 4++2H 2O D .向CuSO 4溶液中加入Na 2O 2:2Na 2O 2+2Cu 2++2H 2O ═4Na ++2Cu (OH )2↓+O 2↑7.(5分)室温下向10mL 0.1 mol•L ﹣1NaOH 溶液中加入0.1mol•L ﹣1的一元酸HA 溶液pH 的变化曲线如图所示.下列说法正确的是( )A .a 点所示溶液中c (Na +)>c (A ﹣)>c (H +)>c (HA )B .a 、b 两点所示溶液中水的电离程度相同C .pH=7时,c (Na +)=c (A ﹣)+c (HA )D .b 点所示溶液中c (A ﹣)>c (HA )二、解答题8.(15分)利用LiOH 和钴氧化物可制备锂离子电池正极材料.LiOH 可由电解法制备,钴氧化物可通过处理钴渣获得.(1)利用如图装置电解制备LiOH ,两电极区电解液分别为LiOH 和LiCl 溶液.B 极区电解液为溶液(填化学式),阳极电极反应式为,电解过程中Li+向电极迁移(填“A”或“B”).(2)利用钴渣[含Co(OH)3、Fe(OH)3等]制备钴氧化物的工艺流程如下:Co(OH)3溶解还原反应的离子方程式为,铁渣中铁元素的化合价为,在空气中煅烧CoC2O4生成钴氧化物和CO2,测得充分煅烧后固体质量为2.41g,CO2的体积为1.344L(标准状况),则钴氧化物的化学式为.9.(19分)合金贮氢材料具有优异的吸放氢性能,在配合氢能的开发中起到重要作用.(1)一定温度下,某贮氢合金(M)的贮氢过程如图所示,纵轴为平衡时氢气的压强(p),横轴表示固相中氢原子与金属原子的个数比(H/M).在OA段,氢溶解于M中形成固溶体MH x,随着氢气压强的增大,H/M逐惭增大;在AB段,MH x与氢气发生氢化反应生成氢化物MH y,氢化反应方程式为:zMH x(s)+H2(g)⇌zMH y(s)△H(Ⅰ);在B点,氢化反应结束,进一步增大氢气压强,H/M几乎不变.反应(Ⅰ)中z=(用含x和y的代数式表示).温度为T1时,2g某合金4min内吸收氢气240mL,吸氢速率v=mL•g﹣1•min﹣1.反应(Ⅰ)的焓变△HⅠ0(填“>”“<”或“=”).(2)η表示单位质量贮氢合金在氢化反应阶段的最大吸氢量占其总吸氢量的比例,则温度为T1、T2时,η(T1)η(T2)(填“>”“<”或“=”).当反应(Ⅰ)处于图中a点时,保持温度不变,向恒容体系中通入少量氢气,达到平衡后反应(Ⅰ)可能处于图中的点(填“b”“c”或“d”),该贮氢合金可通过或的方式释放氢气.(3)贮氢合金ThNi5可催化由CO、H2合成CH4的反应,温度为T时,该反应的热化学方程式为.已知温度为T时:CH4(g)+2H2O═CO2(g)+4H2(g)△H=+165kJ•mol﹣1CO(g)+H2O(g)═CO2(g)+H2(g)△H=﹣41kJ•mol﹣1.10.(19分)毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2•2H2O的流程如下:(1)毒重石用盐酸浸取前需充分研磨,目的是。

2015年山东省高考化学试题(带解析)2015年山东省高考化学试题(带解析)7.进行化学实验时应强化安全意识。
下列做法正确的是:A.金属钠着火时使用泡沫灭火器灭火B.用试管加热碳酸氢钠固体时使试管口竖直向上C.浓硫酸溅到皮肤上时立即用稀氢氧化钠溶液冲洗D.制备乙烯时向乙醇和浓硫酸的混合液中加入碎瓷片【答案】D8.短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示。
已知YW的原子充数之和是Z的3倍,下列说法正确的是YZXWA.原子半径:XYZB.气态氢化物的稳定性:XZC.Z、W均可与Mg形成离子化合物D.最高价氧化物对应水化物的酸性:YW【答案】C【解析】试题分析:设元素Y的原子序数为y,则y+y+10=3×(y+1),解得y=7,则Y为N元素、X为Si元素、Z为O 元素、W为Cl元素。
A、原子半径:ZYX,错误;B、气态氢化物的稳定性:XZ,错误;C、O元素、Cl元素都能与Mg形成离子化合物,正确;D、最高价氧化物对应水化物的酸性:YW,错误。
考点:物质结构、元素周期律9.分枝酸可用于生化研究。
其结构简式如图。
下列关于分枝酸的叙述正确的是A.分子中含有2种官能团B.可与乙醇、乙酸反应,且反应类型相同C.1mol分枝酸最多可与3molNaOH发生中和反应D.可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同【答案】B考点:有机物的结构及性质10.某化合物由两种单质直接反应生成,将其加入BaHCO3溶液中同时有气体和沉淀产生。
下列化合物中符合上述条件的是:A.AlCl3B.Na2OC.FeCl2D.SiO2【答案】A【解析】试题分析:A、AlCl3可由Al与Cl2反应制得,AlCl3与Ba(HCO3)2反应生成CO2和Al(OH)3沉淀,正确;B、Na2O与Ba(HCO3)2反应没有气体生成,错误;C、FeCl2不能由两种单质直接反应生成,错误;D、SiO2不与Ba(HCO3)2反应,错误。

2015年山东省高考化学试卷答案与解析一、选择题(共7小题,每小题5分,满分35分)7.(5分)(2015•山东)进行化学实验时应强化安全意识.下列做法正确的是() A.金属钠着火时使用泡沫灭火器灭火B.用试管加热碳酸氢钠固体时使试管口竖直向上C.浓硫酸溅到皮肤上时立即用稀氢氧化钠溶液冲洗D.制备乙烯时向乙醇和浓硫酸的混合液中加入碎瓷片【答案】D【解析】A.金属钠着火生成过氧化钠,与泡沫灭火器喷出的二氧化碳反应,反应生成的氧气助燃,不能灭火,应利用沙土铺盖,故A错误;B.碳酸氢钠分解生成水,则用试管加热碳酸氢钠固体时使试管口略向下倾斜,故B错误;C.酸碱中和放出大量的热,且强酸、强碱具有强腐蚀性,则浓硫酸溅到皮肤上时立即用抹布擦拭,再水冲洗,最后涂上适量的碳酸氢钠溶液,故C错误;D.制备乙烯时向乙醇和浓硫酸的混合液加入碎瓷片,防止暴沸,从实验安全的角度考虑,故D正确;8.(5分)(2015•山东)短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示.已知Y、W的原子序数之和是Z的3倍,下列说法正确的是()Y ZX WA.原子半径:X<Y<ZB.气态氢化物的稳定性:X>ZC.Z、W均可与Mg形成离子化合物D.最高价氧化物对应水化物的酸性:Y>W【答案】C【解析】Y、W的原子序数之和是Z的3倍,设Y的原子序数为x,则Z的原子序数为x+1,W的原子序数为x+10,则x+x+10=3×(x+1),解得x=7,即Y为N,结合位置关系可知,Z为O,X为Si,W为Cl,A.电子层越多,原子半径越大,则原子半径为X>Y>Z,故A错误;B.非金属性越强,气态氢化物越稳定,则气态氢化物的稳定性为X<Z,故B错误;C.Z、W均可与Mg形成离子化合物,分别为MgO、MgCl2,故C正确;D.Cl的最高价氧化物对应水化物的酸性为含氧酸中酸性最强的酸,则最高价氧化物对应水化物的酸性:Y<W,故D错误;9.(5分)(2015•山东)分枝酸可用于生化研究.其结构简式如图.下列关于分枝酸的叙述正确的是()A.分子中含有2种官能团B.可与乙醇、乙酸反应,且反应类型相同C.1mol分枝酸最多可与3molNaOH发生中和反应D.可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同【答案】B【解析】A.分子中含﹣COOH、﹣OH、碳碳双键、醚键,共4种官能团,故A错误; B.含﹣COOH与乙醇发生酯化反应,含﹣OH与乙酸发生酯化反应,故B正确;C.不是苯环,只有﹣COOH与NaOH反应,则1mol分枝酸最多可与2molNaOH发生中和反应,故C错误;D.碳碳双键与溴的四氯化碳溶液发生加成反应,双键与﹣OH均能被酸性高锰酸钾溶液氧化,原理不同,故D错误;10.(5分)(2015•山东)某化合物由两种单质直接反应生成,将其加入Ba(HCO3)2溶液中同时有气体和沉淀产生.下列化合物中符合上述条件的是()A.A lCl3B.N a2O C.F eCl2D.S iO2【答案】A【解析】A.Al与氯气化合生成AlCl3,AlCl3与Ba(HCO3)2溶液反应生成氢氧化铝沉淀和二氧化碳气体,故A正确;B.钠与氧气反应生成氧化钠,但Na2O与Ba(HCO3)2溶液反应不生成气体,只生成碳酸钡沉淀,故B错误;C.Fe与氯气化合生成FeCl3,故C错误;D.Si与氧气化合生成SiO2,但SiO2与Ba(HCO3)2不反应,故D错误;11.(5分)(2015•山东)下列由实验现象得出的结论正确的是()操作及现象结论A 向AgCl悬浊液中加入NaI溶液时出现黄色沉淀K sp(AgCl)<K sp(AgI)B 向某溶液中滴加氯水后再加入KSCN溶液,溶液呈红色溶液中一定含有Fe2+C 向NaBr溶液中滴入少量氯水和苯,振荡、静置,溶液上层Br﹣还原性强于Cl﹣呈橙红色D 加热盛有NH4Cl固体的试管,试管底部固体消失,试管口NH4Cl固体可以升华有晶体凝结A.A B.B C.C D.D【答案】C【解析】A.同类型的沉淀转化时,难溶电解质之间可实现由溶度积常数较大的物质转化为溶度积常数较小的物质,AgCl悬浊液中加入KI溶液,白色沉淀变成黄色,证明此条件下K sp (AgCl)>K sp(AgI),故A错误;B.原溶液中若含有Fe3+,加入KSCN溶液,溶液也会呈红色,不能说明原溶液中是否含有Fe2+,故B错误;C.向NaBr溶液中滴入少量氯水和苯,振荡、静置,溶液上层呈橙红色,说明有Br2生成,发生反应:2Br﹣+Cl2=2Cl﹣+Br2,说明Br﹣还原性强于Cl﹣,故C正确;D.NH4Cl受热分解为NH3与HCl,在试管口处冷却,NH3与HCl反应又得到NH4Cl固体,不能说明NH4Cl固体可以升华,故D错误,12.(5分)(2015•山东)下列表示对应化学反应的离子方程式正确的是()A.向稀HNO3中滴加Na2SO3溶液:SO32﹣+2H+═SO2↑+H2OB.向Na2SiO3溶液中通入过量SO2:SiO32﹣+SO2+H2O═H2SiO3↓+SO32﹣C.向Al2(SO4)3溶液中加入过量的NH3•H2O:Al3++4NH3•H2O═[Al(OH)4]﹣+4NH4+ D.向CuSO4溶液中加入Na2O2:2Na2O2+2Cu2++2H2O═4Na++2Cu(OH)2↓+O2↑【答案】C【解析】A.硝酸具有强氧化性,将SO32﹣氧化为SO42﹣,不能生成二氧化硫,反应离子方程式为:3SO32﹣+2H++2NO3﹣=3SO42﹣+2NO↑+H2O,故A错误;B.二氧化硫过量,应生成HSO3﹣,反应离子方程式为SiO32﹣+2SO2+2H2O═H2SiO3↓+2HSO3﹣,故B错误;C.氢氧化铝不能溶于氨水,得到氢氧化铝沉淀,反应离子方程式为:Al3++3NH3•H2O═Al (OH)3↓+3NH4+,故C错误;D.过氧化钠与水反应生成氢氧化钠与氧气,氢氧化钠在与硫酸铜反应生成氢氧化铜沉淀与硫酸钠,反应总离子方程式为:2Na2O2+2Cu2++2H2O═4Na++2Cu(OH)2↓+O2↑,故D正确,13.(5分)(2015•山东)室温下向10mL 0.1 mol•L﹣1NaOH溶液中加入0。

2015年山东省高考化学试卷一、选择题(共7小题,每小题5分,满分35分)1.(5分)进行化学实验时应强化安全意识.下列做法正确的是()A.金属钠着火时使用泡沫灭火器灭火B.用试管加热碳酸氢钠固体时使试管口竖直向上C.浓硫酸溅到皮肤上时立即用稀氢氧化钠溶液冲洗D.制备乙烯时向乙醇和浓硫酸的混合液中加入碎瓷片2.(5分)短周期元素、Y、、W在元素周期表中的相对位置如图所示。
已知Y、W的原子序数之和是的3倍,下列说法正确的是()YWA.原子半径:<Y<B.气态氢化物的稳定性:>C.、W均可与Mg形成离子化合物D.最高价氧化物对应水化物的酸性:Y>W3.(5分)分枝酸可用于生化研究.其结构简式如图.下列关于分枝酸的叙述正确的是()A.分子中含有2种官能团B.可与乙醇、乙酸反应,且反应类型相同C.1mol分枝酸最多可与3molNaOH发生中和反应D.可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同4.(5分)某化合物由两种单质直接反应生成,将其加入Ba(HCO3)2溶液中同时有气体和沉淀产生.下列化合物中符合上述条件的是()A.AlCl3B.Na2O C.FeCl2D.SiO25.(5分)下列由实验现象得出的结论正确的是()操作及现象结论A向AgCl悬浊液中加入NaI溶液时出现黄色沉淀sp(AgCl)<sp(AgI)B向某溶液中滴加氯水后再加入SCN溶液,溶液呈红色溶液中一定含有Fe2+C向NaBr溶液中滴入少量氯水和苯,振荡、静置,溶液上层呈橙红色Br﹣还原性强于Cl﹣D加热盛有NH4Cl固体的试管,试管底部固体消失,试管口有晶体凝结NH4Cl固体可以升华A.A B.B C.C D.D6.(5分)下列表示对应化学反应的离子方程式正确的是()A.向稀HNO3中滴加Na2SO3溶液:SO32﹣+2H+═SO2↑+H2OB.向Na2SiO3溶液中通入过量SO2:SiO32﹣+SO2+H2O═H2SiO3↓+SO32﹣C.向Al2(SO4)3溶液中加入过量的NH3•H2O:Al3++4NH3•H2O═AlO2﹣+4NH4++2H2O D.向CuSO4溶液中加入Na2O2:2Na2O2+2Cu2++2H2O═4Na++2Cu(OH)2↓+O2↑7.(5分)室温下向10mL 0.1 mol•L﹣1NaOH溶液中加入0.1mol•L﹣1的一元酸HA 溶液pH的变化曲线如图所示.下列说法正确的是()A.a点所示溶液中c(Na+)>c(A﹣)>c(H+)>c(HA)B.a、b两点所示溶液中水的电离程度相同C.pH=7时,c(Na+)=c(A﹣)+c(HA)D.b点所示溶液中c(A﹣)>c(HA)二、解答题8.(15分)利用LiOH和钴氧化物可制备锂离子电池正极材料.LiOH可由电解法制备,钴氧化物可通过处理钴渣获得.(1)利用如图装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液.B 极区电解液为溶液(填化学式),阳极电极反应式为,电解过程中Li+向电极迁移(填“A”或“B”).(2)利用钴渣[含Co(OH)3、Fe(OH)3等]制备钴氧化物的工艺流程如下:Co(OH)3溶解还原反应的离子方程式为,铁渣中铁元素的化合价为,在空气中煅烧CoC2O4生成钴氧化物和CO2,测得充分煅烧后固体质量为2.41g,CO2的体积为1.344L(标准状况),则钴氧化物的化学式为.9.(19分)合金贮氢材料具有优异的吸放氢性能,在配合氢能的开发中起到重要作用.(1)一定温度下,某贮氢合金(M)的贮氢过程如图所示,纵轴为平衡时氢气的压强(p),横轴表示固相中氢原子与金属原子的个数比(H/M).在OA段,氢溶解于M中形成固溶体MH,随着氢气压强的增大,H/M逐惭增大;在AB段,MH与氢气发生氢化反应生成氢化物MH y,氢化反应方程式为:MH(s)+H2(g)⇌MH y(s)△H(Ⅰ);在B点,氢化反应结束,进一步增大氢气压强,H/M几乎不变.反应(Ⅰ)中=(用含和y的代数式表示).温度为T1时,2g某合金4min内吸收氢气240mL,吸氢速率v=mL•g﹣1•min﹣1.反应(Ⅰ)的焓变△HⅠ0(填“>”“<”或“=”).(2)η表示单位质量贮氢合金在氢化反应阶段的最大吸氢量占其总吸氢量的比例,则温度为T1、T2时,η(T1)η(T2)(填“>”“<”或“=”).当反应(Ⅰ)处于图中a点时,保持温度不变,向恒容体系中通入少量氢气,达到平衡后反应(Ⅰ)可能处于图中的点(填“b”“c”或“d”),该贮氢合金可通过或的方式释放氢气.(3)贮氢合金ThNi5可催化由CO、H2合成CH4的反应,温度为T时,该反应的热化学方程式为.已知温度为T时:CH4(g)+2H2O═CO2(g)+4H2(g)△H=+165J•mol﹣1CO(g)+H2O(g)═CO2(g)+H2(g)△H=﹣41J•mol﹣1.10.(19分)毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2•2H2O的流程如下:(1)毒重石用盐酸浸取前需充分研磨,目的是。
2015年山东省高考化学试卷一、选择题(共7小题,每小题5分,满分35分)1.(5分)进行化学实验时应强化安全意识.下列做法正确的是()A.金属钠着火时使用泡沫灭火器灭火B.用试管加热碳酸氢钠固体时使试管口竖直向上C.浓硫酸溅到皮肤上时立即用稀氢氧化钠溶液冲洗D.制备乙烯时向乙醇和浓硫酸的混合液中加入碎瓷片2.(5分)短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示。
已知Y、W的原子序数之和是Z的3倍,下列说法正确的是()Y ZX WA.原子半径:X<Y<ZB.气态氢化物的稳定性:X>ZC.Z、W均可与Mg形成离子化合物D.最高价氧化物对应水化物的酸性:Y>W3.(5分)分枝酸可用于生化研究.其结构简式如图.下列关于分枝酸的叙述正确的是()A.分子中含有2种官能团B.可与乙醇、乙酸反应,且反应类型相同C.1mol分枝酸最多可与3molNaOH发生中和反应D.可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同4.(5分)某化合物由两种单质直接反应生成,将其加入Ba(HCO3)2溶液中同时有气体和沉淀产生.下列化合物中符合上述条件的是()A.AlCl3B.Na2O C.FeCl2D.SiO25.(5分)下列由实验现象得出的结论正确的是()操作及现象结论A向AgCl悬浊液中加入NaI溶液时出现黄色沉淀K sp(AgCl)<K sp(AgI)B向某溶液中滴加氯水后再加入KSCN溶液,溶液呈红溶液中一定含有Fe2+色C向NaBr溶液中滴入少量氯水和苯,振荡、静置,溶Br﹣还原性强于Cl﹣液上层呈橙红色D加热盛有NH4Cl固体的试管,试管底部固体消失,试NH4Cl固体可以升华管口有晶体凝结A.A B.B C.C D.D6.(5分)下列表示对应化学反应的离子方程式正确的是()A.向稀HNO3中滴加Na2SO3溶液:SO32﹣+2H+═SO2↑+H2OB.向Na2SiO3溶液中通入过量SO2:SiO32﹣+SO2+H2O═H2SiO3↓+SO32﹣C.向Al2(SO4)3溶液中加入过量的NH3•H2O:Al3++4NH3•H2O═AlO2﹣+4NH4++2H2O D.向CuSO4溶液中加入Na2O2:2Na2O2+2Cu2++2H2O═4Na++2Cu(OH)2↓+O2↑7.(5分)室温下向10mL 0.1 mol•L﹣1NaOH溶液中加入0.1mol•L﹣1的一元酸HA 溶液pH的变化曲线如图所示.下列说法正确的是()A.a点所示溶液中c(Na+)>c(A﹣)>c(H+)>c(HA)B.a、b两点所示溶液中水的电离程度相同C.pH=7时,c(Na+)=c(A﹣)+c(HA)D.b点所示溶液中c(A﹣)>c(HA)二、解答题8.(15分)利用LiOH和钴氧化物可制备锂离子电池正极材料.LiOH可由电解法制备,钴氧化物可通过处理钴渣获得.(1)利用如图装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液.B 极区电解液为溶液(填化学式),阳极电极反应式为,电解过程中Li+向电极迁移(填“A”或“B”).(2)利用钴渣[含Co(OH)3、Fe(OH)3等]制备钴氧化物的工艺流程如下:Co(OH)3溶解还原反应的离子方程式为,铁渣中铁元素的化合价为,在空气中煅烧CoC2O4生成钴氧化物和CO2,测得充分煅烧后固体质量为2.41g,CO2的体积为1.344L(标准状况),则钴氧化物的化学式为.9.(19分)合金贮氢材料具有优异的吸放氢性能,在配合氢能的开发中起到重要作用.(1)一定温度下,某贮氢合金(M)的贮氢过程如图所示,纵轴为平衡时氢气的压强(p),横轴表示固相中氢原子与金属原子的个数比(H/M).在OA段,氢溶解于M中形成固溶体MH x,随着氢气压强的增大,H/M逐惭增大;在AB段,MH x与氢气发生氢化反应生成氢化物MH y,氢化反应方程式为:zMH x(s)+H2(g)⇌zMH y(s)△H(Ⅰ);在B点,氢化反应结束,进一步增大氢气压强,H/M几乎不变.反应(Ⅰ)中z=(用含x和y的代数式表示).温度为T1时,2g某合金4min内吸收氢气240mL,吸氢速率v=mL•g﹣1•min ﹣1.反应(Ⅰ)的焓变△HⅠ0(填“>”“<”或“=”).(2)η表示单位质量贮氢合金在氢化反应阶段的最大吸氢量占其总吸氢量的比例,则温度为T1、T2时,η(T1)η(T2)(填“>”“<”或“=”).当反应(Ⅰ)处于图中a点时,保持温度不变,向恒容体系中通入少量氢气,达到平衡后反应(Ⅰ)可能处于图中的点(填“b”“c”或“d”),该贮氢合金可通过或的方式释放氢气.(3)贮氢合金ThNi5可催化由CO、H2合成CH4的反应,温度为T时,该反应的热化学方程式为.已知温度为T时:CH4(g)+2H2O═CO2(g)+4H2(g)△H=+165kJ•mol﹣1CO(g)+H2O(g)═CO2(g)+H2(g)△H=﹣41kJ•mol﹣1.10.(19分)毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2•2H2O的流程如下:(1)毒重石用盐酸浸取前需充分研磨,目的是。
(1)毒重石用盐酸浸取前需充分研磨,目的是。
实验室用37%的盐酸配置15%的盐酸,除量筒外还需使用下列仪器中的。
33.(12分)[化学---物质结构与性质]氟在自然界中常以CaF2的形式存在。
(1)下列关于CaF2的表述正确的是_______。
a.Ca2+与F-间仅存在静电吸引作用b.F-的离子半径小于Cl-,则CaF2的熔点高于CaCl2c.阴阳离子比为2:1的物质,均与CaF2晶体构型相同d.CaF2中的化学键为离子键,因此CaF2在熔融状态下能导电(2)CaF2难溶于水,但可溶于含Al3+的溶液中,原因是________(用离子方程式表示)。
已知AlF63-在溶液中可稳定存在。
(3)F2通入稀NaOH溶液中可生成OF2,OF2分子构型为______________,其中氧原子的杂化方式为_________。
(4)F2与其他卤素单质反应可以形成卤素互化物,例如ClF3、BrF3等。
已知反应Cl2(g)+3F2(g) =2ClF3(g) △H=-313kJ·mol-1,F-F键的键能为159kJ·mol-1,Cl-Cl键的键能为242kJ·mol-1,则ClF3中Cl-F键的平均键能为______kJ·mol-1。
ClF3的熔、沸点比BrF3的________(填“高”或“低”)。
34.(12分)[化学---有机化学基础]菠萝酯F是一种具有菠萝香味的赋香剂,其合成路线如下:(1)A的结构简式为_________________,A中所含官能团的名称是_________。
(2)由A生成B的反应类型是______________,E的某同分异构体只有一种相同化学环境的氢,该同分异构体的结构简式为_________________。
(3)写出D和E反应生成F的化学方程式________________________。
(4)结合题给信息,以溴乙烷和环氧乙烷为原料制备1-丁醇,设计合成路线(其他试剂任选)。
费县二中专用2015 年高考山东化学试题及答案分析7.进行化学实验时应加强安全意识。
以下做法正确的选项是:A.金属钠着火时使用泡沫灭火器灭火B.用试管加热碳酸氢钠固体时使试管口竖直向上C.浓硫酸溅到皮肤上时立刻用稀氢氧化钠溶液冲刷D.制备乙烯时向乙醇和浓硫酸的混淆液中加入碎瓷片D分析:观察化学与生活知识。
Na 能够与二氧化碳反响,金属钠着火时不可以使用泡沫灭火器灭火;用试管加热碳酸氢钠固体时使试管口稍微向下倾斜;NaOH 对皮肤有腐化作用,浓硫酸溅到皮肤上时不可以用稀氢氧化钠溶液冲刷;制备乙烯时向乙醇和浓硫酸的混淆液中加入碎瓷片,以防备暴沸。
选择 D 。
8.短周期元素X 、 Y 、 Z、 W 在元素周期表中的相对地点以下图。
已知Y 、 W 的原子序数之和是Z 的3 倍,以下说法正确的选项是A .原子半径:X<Y<Z Y ZB.气态氢化物的稳固性:X>Z X WC.Z 、 W 均可与 Mg 形成离子化合物D.最高价氧化物对应水化物的酸性:Y>WC分析:观察元素周期表和元素周期律。
Y 、 W 的原子序数之和是Z 的 3 倍,设 Y 的原子序数为 a,a+a+2+8=3(a+1) , a=7, Y 是 N, Z 是 O,X 是 Si ,W 是 Cl 。
依据元素周期律,原子半径: Si>N>O ,气态氢化物的稳固性:SiH 4<H 2O,MgO 、MgCl 2是离子化合物,最高价氧化物对应水化物的酸性: HClO 4>HNO 3。
选择 C。
9.分枝酸可用于生化研究。
其构造简式如图。
以下对于分枝酸的表达COOH 正确的选项是CH2A .分子中含有 2 种官能团O COOHOH B.可与乙醇、乙酸反响,且反响种类同样分支酸C.1mol 分枝酸最多可与 3molNaOH 发生中和反响D.可使溴的四氯化碳溶液、酸性高锰酸钾溶液退色,且原理同样B分析:观察有机构造与性质的关系。
2015年山东省高考化学试卷
参考答案与试题解析
一、选择题(共7小题,每小题5分,满分35分)
7.(5分)(2015•山东)进行化学实验时应强化安全意识.下列做法正确的是()A.金属钠着火时使用泡沫灭火器灭火
B.用试管加热碳酸氢钠固体时使试管口竖直向上
C.浓硫酸溅到皮肤上时立即用稀氢氧化钠溶液冲洗
D.制备乙烯时向乙醇和浓硫酸的混合液中加入碎瓷片
考点:真题集萃;化学实验安全及事故处理.
分析:A.金属钠着火生成过氧化钠,与泡沫灭火器喷出的二氧化碳反应;
B.碳酸氢钠分解生成水;
C.酸碱中和放出大量的热,且强酸、强碱具有强腐蚀性;
D.加入碎瓷片,防止暴沸.
解答:解:A.金属钠着火生成过氧化钠,与泡沫灭火器喷出的二氧化碳反应,反应生成的氧气助燃,不能灭火,应利用沙土铺盖,故A错误;
B.碳酸氢钠分解生成水,则用试管加热碳酸氢钠固体时使试管口略向下倾斜,故B 错误;
C.酸碱中和放出大量的热,且强酸、强碱具有强腐蚀性,则浓硫酸溅到皮肤上时立即用抹布擦拭,再水冲洗,最后涂上适量的碳酸氢钠溶液,故C错误;
D.制备乙烯时向乙醇和浓硫酸的混合液加入碎瓷片,防止暴沸,从实验安全的角度考虑,故D正确;
故选D.
点评:本题为2015年山东高考题,侧重化学与生活、实验安全的考查,把握物质的性质、实验基本技能、实验安全常识等为解答的关键,题目难度不大.
8.(5分)(2015•山东)短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示.已知Y、W的原子序数之和是Z的3倍,下列说法正确的是()
Y Z
X W
A.原子半径:X<Y<Z
B.气态氢化物的稳定性:X>Z
C.Z、W均可与Mg形成离子化合物
D.最高价氧化物对应水化物的酸性:Y>W
考点:真题集萃;位置结构性质的相互关系应用.
分析:Y、W的原子序数之和是Z的3倍,设Y的原子序数为x,则Z的原子序数为x+1,W的原子序数为x+10,则x+x+10=3×(x+1),解得x=7,即Y为N,结合位置关系可知,Z为O,X为Si,W为Cl,然后结合元素化合物知识来解答.
解答:解:Y、W的原子序数之和是Z的3倍,设Y的原子序数为x,则Z的原子序数为x+1,W的原子序数为x+10,则x+x+10=3×(x+1),解得x=7,即Y为N,结合位置
关系可知,Z为O,X为Si,W为Cl,
A.电子层越多,原子半径越大,则原子半径为X>Y>Z,故A错误;
B.非金属性越强,气态氢化物越稳定,则气态氢化物的稳定性为X<Z,故B错误;
C.Z、W均可与Mg形成离子化合物,分别为MgO、MgCl2,故C正确;
D.Cl的最高价氧化物对应水化物的酸性为含氧酸中酸性最强的酸,则最高价氧化物对应水化物的酸性:Y<W,故D错误;
故选C.
点评:本题为2015年山东高考题,侧重位置、结构与性质的考查,把握原子序数的关系推断元素为解答的关键,注意元素性质的比较方法,选项D为解答的易错点,题目难度不大.
9.(5分)(2015•山东)分枝酸可用于生化研究.其结构简式如图.下列关于分枝酸的叙述正确的是()
A.分子中含有2种官能团
B.可与乙醇、乙酸反应,且反应类型相同
C.1mol分枝酸最多可与3molNaOH发生中和反应
D.可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
考点:真题集萃;有机物的结构和性质.
专题:有机物的化学性质及推断.
分析:由结构简式可知,分子中含﹣COOH、﹣OH、碳碳双键、醚键等,结合羧酸、醇、烯烃的性质来解答.
解答:解:A.分子中含﹣COOH、﹣OH、碳碳双键、醚键,共4种官能团,故A错误;
B.含﹣COOH与乙醇发生酯化反应,含﹣OH与乙酸发生酯化反应,故B正确;
C.不是苯环,只有﹣COOH与NaOH反应,则1mol分枝酸最多可与2molNaOH发生中和反应,故C错误;
D.碳碳双键与溴的四氯化碳溶液发生加成反应,双键与﹣OH均能被酸性高锰酸钾溶液氧化,原理不同,故D错误;
故选B.
点评:本题为2015年山东高考题,侧重有机物结构与性质的考查,把握官能团与性质的关系为解答的关键,注意官能团的判断,题目难度不大.
10.(5分)(2015•山东)某化合物由两种单质直接反应生成,将其加入Ba(HCO3)2溶液中同时有气体和沉淀产生.下列化合物中符合上述条件的是()
A.A lCl3B.N a2O C.F eCl2D.S iO2
考点:真题集萃;盐类水解的应用;钠的重要化合物;镁、铝的重要化合物;铁的氧化物和氢氧化物.。