滴定管的校准实验报告
- 格式:doc
- 大小:84.50 KB
- 文档页数:2

滴定分析操作实验报告
实验报告:滴定分析操作
实验目的:
本实验旨在通过滴定分析操作,掌握滴定法的基本原理和操作方法,以及学习
如何使用滴定管和指示剂进行准确的滴定分析。
实验原理:
滴定分析是一种定量分析方法,通过向待测溶液中滴加已知浓度的滴定液,直
至滴加到等当点,从而确定待测溶液中的物质含量。
滴定液与待测溶液反应终
点的判断通常通过指示剂的颜色变化来确定。
实验步骤:
1. 准备滴定管和滴定瓶,用去离子水冲洗干净并用所需滴定液预冲。
2. 用容量瓶准确量取待测溶液,并加入适量的指示剂。
3. 将待测溶液置于白色背景下,用滴定管滴加滴定液,同时轻轻摇晃容器。
4. 当出现指示剂颜色变化时,停止滴定,并记录所需滴定液的体积。
5. 重复实验,直至滴定结果一致。
实验数据:
通过实验操作,记录下了不同试验条件下的滴定结果,包括滴定液的体积、滴
定终点的颜色变化等数据。
实验结果:
根据实验数据,计算得出待测溶液中物质的含量,得到了滴定分析的准确结果。
实验结论:
通过本次实验,我们掌握了滴定分析的基本原理和操作方法,了解了滴定法在
定量分析中的应用。
同时也学会了如何使用滴定管和指示剂进行准确的滴定分析,为今后的实验操作打下了坚实的基础。
总结:
滴定分析操作是一种常用的定量分析方法,通过本次实验,我们对滴定法有了更深入的了解,相信在今后的实验中能够更加熟练地进行滴定分析操作。


滴定管的使用与校正实验报告
滴定管的使用与校正实验报告
滴定管是精密实验手段,具有快速、精准等优势,在实验中有着十分重要的用处。
本次实验主要内容包括滴定管的使用和校正,实验结果如下。
实验过程:
(1)首先将滴定管整洁地放置在垫底底板上,方便操作和排查问题。
(2)按照操作说明部分,按住定标箍松度调节开关,将滴定管安装在定标架上,使其垂直于水面,调整好准直环固定滴定锥的位置,并将滴定管螺丝固定到定标箍上,以保证滴定管良好的定标。
(3)将滴定液逐滴倒入滴定管中,关注定标指示针,记录下它所指示的分子量和定标液分子量的差值,并填写实验表,以作实验记录。
(4)检查定标液定量,将定标液再拥到定标分子量为止,完成一轮定标,将定标值表格中的定标值分子量记录后重复定标第二次。
(5)比较第二次定标和第一次定标的定标量,将它们的变动值相减,便得到滴定管的滴定误差,即校正值。
结论:
本次实验,成功完成了滴定管的使用和校正实验,校正值为XX,可见滴定管的定量实验精度较高,该实验采用的技术可用于实验室中其他类似实验中。

移液管和滴定管滴定管_移液管_容量瓶的校准实验0 仪器的校准(移液管、滴定管、容量瓶)一、实验目的1、掌握滴定管、移液管、容量瓶的使用方法2、练习滴定管、移液管、容量瓶的校准方法,并了解容量器皿校准的意义二、实验原理滴定管,移液管和容量瓶是滴定分析法所用的主要量器。
容量器皿的容积与其所标出的体积并非完全相符合。
因此,在准确度要求较高的分析工作中,必须对容量器皿进行校准。
由于玻璃具有热胀冷缩的特性,在不同的温度下容量器皿的体积也有所不同。
因此,校准玻璃容量器皿时,必须规定一个共同的温度值,这一规定温度值为标准温度。
国际上规定玻璃容量器皿的标准温度为20?。
既在校准时都将玻璃容量器皿的容积校准到20?时的实际容积。
容量器皿常采用两种校准方法。
11、相对校准要求两种容器体积之间有一定的比例关系时,常采用相对校准的方法。
例如,25mL移液管量取液体的体积应等于250mL容量瓶量取体积的10%。
2、绝对校准绝对校准是测定容量器皿的实际容积。
常用的校准方法为衡量法,又叫称量法。
即用天平称得容量器皿容纳或放出纯水的质量,然后根据水的密度,计算出该容量器皿在标准温度20?时的实际体积。
由质量换算成容积时,需考虑三方面的影响:(1)水的密度随温度的变化(2)温度对玻璃器皿容积胀缩的影响(3)在空气中称量时空气浮力的影响。
为了方便计算,将上述三种因素综合考虑,得到一个总校准值。
经总校准后的纯水密度列于表(空气密度为0.0012g?cm-3,钙钠玻璃体膨胀系数为2.6×10-5?-1)实际应用时,只要称出被校准的容量器皿容纳和放出纯水的质量,再除以该温度时纯水的密度值,便是该容量器皿在20?时的实际容积。
实验步骤:1( 移液管(单标线吸量管)的校准取一个50ml洗净晾干的具塞锥形瓶,在分析天平上称量至mg位。
用铬酸洗液洗净20ml移液管,吸取纯水(盛在烧杯中)至标线以上几mm,用滤纸片擦干管下端的外壁,将流液口接触烧杯壁,移液管垂直、烧杯倾斜约30? 。

滴定分析操作实验报告【实验报告】滴定分析操作实验一、实验目的1.了解滴定操作的基本原理和方法;2.掌握滴定管、管口接触液滴准确的判断方法;3.建立起准确加标的原理和操作方法;4.了解酸碱滴定反应的特征和滴定曲线的解析。
二、实验原理滴定法是一种常用的定量分析方法,根据滴定液与被测溶液反应进行测定。
滴定反应要求反应快速、定量适中、滴定曲线明确等特点,可用于酸碱中和、氧化还原、络合滴定等反应的定量分析。
滴定分析主要分为以下几个步骤:1.准备试样:取适量溶液,加入滴定瓶;2.酸碱滴定:用标准酸或碱滴定至指示剂变色;3.记录滴定体积:记录滴定前后溶液滴定的体积差值;4.滴定反应方程:根据滴定反应方程确定等值点;5.结果处理:计算所测试液浓度。
三、实验仪器与试剂1.仪器:滴定管、天平、容量瓶、酸碱滴定仪等;2.试剂:氢氧化钠溶液、硫酸溶液、酚酞指示剂等。
四、实验操作1.准备工作(1)清洗滴定管:用洗涤剂及去离子水反复清洗,然后用酒精漂洗,最后用烘箱烘干。
(2)清除试剂残留:用并底法过滤或去除杂质粒子。
2.准确判断滴定管的滴答点(1)用试剂带试剂滴在滴定管内壁3-4滴,观察液滴形状:若液滴呈半球形,未和壁接触,则为滴答点。
(2)对酸滴定,加入酚酞指示剂,当液滴颜色变为浅粉红色时,为滴答点。
3.滴定操作(1)量取被测溶液:用容量瓶准确量取一定体积被测溶液。
(2)加入指示剂:根据所滴定的酸碱性质,选择适当的指示剂加入。
(3)开始滴定:将滴定管浸入试管中,慢慢滴定,直至指示剂颜色转变。
(4)记录滴定体积:记录滴定前后滴定液的体积差值。
(5)重复操作:重复3次滴定操作,求平均值。
4.结果计算(1)滴定的计算:根据滴定反应方程,计算滴定液的浓度。
(2)结果处理:计算样品的浓度。
五、实验结果与分析以氢氧化钠溶液为待测试剂,硫酸溶液为标准溶液,进行滴定分析实验。
根据实验数据计算出滴定液浓度为0.1mol/L。
六、实验总结通过本次实验,我深入了解了滴定分析操作的基本原理和方法。

实验报告:滴定管的使用和校准
一、实验目的
本次实验的主要目的是了解滴定管组件及其校准方法,掌握滴定管的操作方式,利用标准溶液的物理性质,选择合适的pH范围,准确控制体系的稳定性,最终完成对滴定管的校准和检查。
二、实验仪器
1、校准量筒,分子量在400~800范围内;
2、滴定管;
3、分析天平,精度为0.1毫克;
4、电子PH仪;
五、实验步骤
实验前准备:
1、用校准量筒,将标准溶液用水按一定剂量做成组合溶液;
2、用分析天平量取组合溶液,于必要时用无定形的水进行稀释,直至原实验容量的百分率精度+/-5%;
3、将组合溶液充入滴定管中,使滴定管和容器里的溶液混合折叠;
4、用电子PH仪,测量组合溶液的pH值并记录;
1、将滴定管调节至0.0处,观看浊黑液体的系列变化,调节浊黑液体所在位置;
2、利用溶液本身实验容量的内窥视,在滴定管0.0处,当准确地显示出该实验容量时,记录滴定管读数;
3、调节滴定管,使其达到一定的位置,测量并记录溶液的PH值;
4、随着实验容量改变,不断重复第2,3步操作,最终形成校准曲线;
五、试验结果分析
本次实验,我们通过滴定管来测量组合溶液的PH值,并完成滴定管的校准,最终得到校准曲线。
从上述结果来看,经过滴定管校准后,系统具有良好的稳定性,滴定管可以准确地读取溶液的PH值,在pH范围内,有效地控制系统的稳定性,本次实验取得了良好的效果。
六、总结
本实验介绍了滴定管的使用和校准方法,包括实验前准备、校准溶液的制备、滴定管校准步骤和系统稳定性,完成了滴定管的校准和测量组合溶液的PH值,并且取得了良好的效果。
此外,本实验也提高了我的研究和实践能力,为以后做实验打下良好的基础。

一、实训目的通过本次实训,使学生掌握滴定管的使用方法和操作技巧,了解滴定实验的基本原理和操作流程,提高实验操作技能,为后续化学实验课程打下基础。
二、实训器材1. 滴定管:酸式滴定管、碱式滴定管2. 标准溶液:0.1000mol/L HCl溶液、0.1000mol/L NaOH溶液3. 待测溶液:未知浓度的NaOH溶液4. 酸式滴定管夹、碱式滴定管夹5. 烧杯、量筒、滴定台、滴定瓶、滴定管架6. 滴定指示剂:甲基橙、酚酞三、实训原理滴定实验是化学分析中常用的一种定量分析方法。
它是通过将已知浓度的标准溶液滴加到待测溶液中,根据化学反应达到滴定终点时消耗的标准溶液体积,计算出待测溶液的浓度。
本次实训采用酸碱滴定法,以0.1000mol/L HCl溶液滴定未知浓度的NaOH溶液。
四、实训步骤1. 准备工作(1)将滴定管洗净,用待测溶液润洗3-5次,排除滴定管内的气泡。
(2)将酸式滴定管夹固定在滴定台上,将滴定管垂直放置。
(3)用移液管将0.1000mol/L HCl溶液转移至滴定瓶中,加入2-3滴甲基橙指示剂。
2. 滴定操作(1)将烧杯放在滴定台上,用玻璃棒搅拌待测溶液,使其均匀。
(2)用滴定管向烧杯中滴加HCl溶液,边滴加边搅拌,观察溶液颜色的变化。
(3)当溶液颜色由黄色变为橙色时,停止滴加,此时溶液为终点。
(4)记录消耗的HCl溶液体积。
3. 计算结果(1)根据滴定反应的化学方程式,计算出NaOH溶液的浓度。
(2)重复实验3-5次,求出平均值。
五、实训结果与分析1. 滴定实验结果(1)第一次实验:消耗HCl溶液体积为V1(2)第二次实验:消耗HCl溶液体积为V2(3)第三次实验:消耗HCl溶液体积为V3(4)第四次实验:消耗HCl溶液体积为V4(5)第五次实验:消耗HCl溶液体积为V52. 结果分析(1)计算NaOH溶液的平均浓度C(NaOH)。
(2)计算实验误差。
(3)分析实验过程中可能出现的问题,并提出改进措施。

滴定管实验报告滴定管实验报告引言:滴定管是化学实验室中常见的一种实验工具,用于测量和分配液体。
它的主要原理是通过控制滴液速度和滴液量来实现精确的液体操作。
本实验旨在探究滴定管的使用方法和其在滴定实验中的应用。
一、滴定管的结构和使用方法滴定管一般由玻璃制成,分为管身和橡胶头两部分。
管身通常为长而细的圆柱形,一端封闭,另一端与橡胶头相连。
橡胶头具有一定的柔软性,可以通过挤压来控制滴液速度。
使用滴定管时,首先将待测液体吸入管身中,然后轻轻挤压橡胶头,使液体从封闭端滴出。
通过调整挤压力度和频率,可以控制滴液速度。
滴定管的刻度线通常用于测量滴液量,可以根据需要选择合适的刻度进行操作。
二、滴定管在滴定实验中的应用滴定实验是一种常见的定量分析方法,用于确定溶液中某种物质的浓度。
滴定管在滴定实验中起到了至关重要的作用。
以酸碱滴定为例,滴定管用于滴加滴定液和指示剂,以达到中和终点的目的。
在酸碱滴定实验中,首先将待测溶液与酸碱滴定液反应,然后通过滴定管滴加指示剂。
指示剂在溶液中会发生颜色变化,用于指示滴定终点的到来。
滴定管的精确滴液能力使得实验者能够准确地控制滴加速度,从而在接近终点时慢慢加入滴定液,避免过量滴加导致误差。
三、滴定管的注意事项在使用滴定管进行实验时,有一些注意事项需要遵守,以保证实验结果的准确性。
首先,滴定管应该保持清洁干燥。
在使用前,应用蒸馏水冲洗滴定管,并用纸巾擦干。
这样可以避免滴定液的污染和滴液速度的不准确。
其次,要注意滴定管的垂直使用。
在滴加滴定液时,滴定管应该垂直于反应容器,以确保滴液的准确性。
倾斜使用可能导致滴液速度不稳定,影响实验结果。
最后,滴定管的刻度线应该准确读取。
实验者在读取滴定管刻度时应该保持目光水平,并将刻度线对准眼睛以获得准确的读数。
误差的产生可能会导致实验结果的偏差。
结论:滴定管作为一种常见的实验工具,在化学实验中发挥着重要的作用。
通过控制滴液速度和滴液量,滴定管能够实现精确的液体操作,特别适用于滴定实验。

滴定管的校正摘要:滴定管是滴定时用来准确测量流出的操作溶液体积的量器。
有酸式滴定管和碱式滴定管两种。
最常用的是容积为50mL的滴定管,其读数可达小数点后两位。
由于玻璃具有热胀冷缩的特性,在不同的温度下容量器皿的的容积也有所不同。
关键词:碱式滴定管、酸式滴定管、分析天平、绝对校正、仪器和试剂:酸式滴定管、碱式滴定管、分析天平、带塞的50mL锥形瓶、锥形瓶、凡士林、烧杯、水前言:滴定管是滴定时用来准确测量流出的操作溶液体积的量器。
常量分析最常用的是容积为50mL的滴定管,其最小刻度是0.1mL,最小刻度间可估计到0.01mL,一般读数误差为±0.02mL。
滴定管一般分为两种:一种是具塞滴定管,称为酸式滴定管;另一种是无塞滴定管,常称碱式滴定管。
酸式滴定管用来装酸性及氧化性溶液,不能装碱性溶液;碱式滴定管用来装碱性溶液及无氧化性溶液。
由于玻璃具有热胀冷缩的特性,滴定管在使用时会因为环境的温度变化而体积也有所不同。
在校正时常用的标准方法为衡量法。
即用天平称得滴定管放出谁的质量,然后根据水的质量和密度,计算出水的实际容积。
实验步骤:在实验前,应将实验所用仪器清洗干净擦干,滴定管要检漏。
再在滴定管中,装满纯水,调节刻度在刻度,并记下读数,按正确的操作的方法,放出10mL水于已称量的锥形瓶中塞紧盖子称出瓶和水的总质量,两次质量之差即为水的质量,用同样的方法测出滴定管各部分的实际容积。
将所得数据绘图连线即得滴定管的校正曲线。
数据处理:由实验记录数据可得以下校正值及校正图:酸式滴定管的校正V读V表瓶+水水重V计V校V总校正0.03 0 57.66 0 0 0 010.1 10.07 67.603 9.943 9.963924 -0.10608 -0.1060815.02 4.92 72.604 5.001 5.011524 0.091524 -0.0145520.01 4.99 77.618 5.014 5.024552 0.034552 0.0225.04 5.03 82.6 4.982 4.992484 -0.03752 -0.0175230 4.96 87.504 4.904 4.91432 -0.04568 -0.063234.99 4.99 92.42 4.916 4.926345 -0.06365 -0.12685 40.09 5.1 97.465 5.045 5.055617 -0.04438 -0.17123 45.08 4.99 102.388 4.923 4.93336 -0.05664 -0.22787 49.091 4.011 107.166 4.778 4.788055 0.777055 0.5491810 0 57.556 0 0 0 09.92 9.92 67.457 9.901 9.921836 0.001836 0.001836 15.08 5.16 72.566 5.109 5.119751 -0.04025 -0.03841 20.07 4.99 77.562 4.996 5.006514 0.016514 -0.0219 24.98 4.91 82.44 4.878 4.888265 -0.02173 -0.04363 29.96 4.98 87.407 4.967 4.977453 -0.00255 -0.04618 35.05 5.09 92.488 5.081 5.091693 0.001693 -0.04449 39.98 4.93 97.346 4.858 4.868223 -0.06178 -0.10627 45.01 5.03 102.373 5.027 5.037579 0.007579 -0.09869 49.98 4.97 107.239 4.866 4.87624 -0.09376 -0.192450.05 0 57.564 0 0 0 0 10.01 9.96 67.506 9.942 9.962922 0.002922 0.002922 15.25 5.24 72.768 5.262 5.273073 0.033073 0.035996 20.02 4.77 77.534 4.766 4.77603 0.00603 0.042025 24.99 4.97 82.474 4.94 4.950396 -0.0196 0.02242130 5.01 87.461 4.987 4.997495 -0.01251 0.009916 35.09 5.09 92.488 5.027 5.037579 -0.05242 -0.04251 40.04 4.95 97.319 4.831 4.841166 -0.10883 -0.15134 44.94 4.9 102.13 4.811 4.821124 -0.07888 -0.23021 49.98 5.04 107.072 4.942 4.9524 -0.0876 -0.31781碱式滴定管的校正V读V表瓶+水水重V计V校V总校正0 0 57.776 0 0 0 0 9.98 9.98 67.723 9.947 9.967933 -0.01207 -0.01207 15.04 5.06 72.82 5.097 5.107726 0.047726 0.035659 20.02 4.98 77.803 4.983 4.993486 0.013486 0.049145 24.97 4.95 82.718 4.915 4.925343 -0.02466 0.024488 30.01 5.04 87.764 5.046 5.056619 0.016619 0.041107 35.08 5.07 92.824 5.06 5.070648 0.000648 0.041756 40.06 4.98 97.801 4.977 4.987474 0.007474 0.049229 45.99 5.93 102.726 4.925 4.935364 -0.99464 -0.94541 49.91 3.92 107.325 4.599 4.608678 0.688678 -0.25673 0.02 0 57.668 0 0 09.99 9.97 67.678 10.01 10.03107 0.061065 0.061065 15.07 5.08 72.74 5.062 5.072653 -0.00735 0.053718 20.02 4.95 77.7 4.96 4.970438 0.020438 0.074156 24.94 4.92 82.612 4.912 4.922337 0.002337 0.076493 30.04 5.1 87.705 5.093 5.103718 0.003718 0.08021 34.99 4.95 92.64 4.935 4.945385 -0.00461 0.075596 40.03 5.04 96.672 4.032 4.040485 -0.99951 -0.9239245.11 5.08 102.721 6.049 6.06173 0.98173 0.05781 49.93 4.82 107.512 4.791 4.801082 -0.01892 0.038893 0.02 0 57.57 0 0 0 010 9.98 67.583 10.013 10.03407 0.054072 0.054072 14.99 4.99 72.574 4.991 5.001503 0.011503 0.065575 20.07 5.08 77.609 5.035 5.045596 -0.0344 0.03117 24.98 4.91 82.495 4.886 4.896282 -0.01372 0.017453 29.95 4.97 87.511 5.016 5.026556 0.056556 0.074008 35.08 5.13 92.518 5.007 5.017537 -0.11246 -0.0384540 4.92 97.492 4.974 4.984467 0.064467 0.02601345 5 102.49 4.998 5.008518 0.008518 0.034531 49.95 4.95 107.124 4.634 4.643752 -0.30625 -0.27172结果讨论:由实验数据和图可知,酸式滴定管在20mL—30mL范围内的误差不大。

滴定管实验报告滴定管实验报告引言:滴定管是化学实验中常用的一种量取液体的仪器,它具有精确度高、操作简便等优点,在酸碱滴定、氧化还原滴定等实验中得到广泛应用。
本实验旨在通过滴定管进行酸碱滴定实验,探究滴定管的使用方法以及其在实验中的应用。
一、实验目的:1. 掌握滴定管的使用方法;2. 熟悉酸碱滴定实验的操作流程;3. 了解滴定管在实验中的应用。
二、实验材料和仪器:1. 滴定管;2. 酸碱溶液(如盐酸、氢氧化钠);3. 进口试剂;4. 量筒;5. 磁力搅拌器。
三、实验步骤:1. 准备工作:清洗滴定管,并用蒸馏水冲洗干净。
2. 用量筒将一定体积的酸碱溶液分别放入两个容器中。
3. 将试剂瓶中的试剂倒入滴定管中,使液面略高于刻度线。
4. 将滴定管的一端插入容器中的溶液中,另一端放入试剂瓶中。
5. 慢慢旋转试剂瓶,使试剂缓慢滴入溶液中,同时用磁力搅拌器搅拌溶液。
6. 当溶液颜色发生变化时,停止滴定,记录滴定管中试剂的体积。
7. 重复实验3-6步骤,直到滴定结果相近为止。
四、实验结果与分析:通过实验,我们得到了滴定管中试剂滴入溶液的体积数据。
根据滴定管的刻度,我们可以计算出溶液的浓度。
同时,根据溶液颜色的变化,我们可以判断滴定反应的终点。
在实验过程中,我们需要注意滴定管的使用方法。
首先,要确保滴定管干净,避免试剂之间的相互污染。
其次,滴定管的滴液速度要适中,过快或过慢都会对实验结果产生影响。
最后,要注意溶液的搅拌,以确保反应充分进行。
五、实验总结:滴定管作为一种常用的实验仪器,在化学实验中发挥着重要的作用。
通过本次实验,我们掌握了滴定管的使用方法,并了解了酸碱滴定实验的操作流程。
同时,我们也学会了如何根据滴定管的使用结果进行数据分析和实验总结。
在今后的实验中,我们将进一步熟练掌握滴定管的使用技巧,并将其应用于更复杂的实验中。
通过不断的实践和探索,我们相信滴定管在化学实验中的应用将会更加广泛,为我们的研究工作提供更多的帮助和支持。
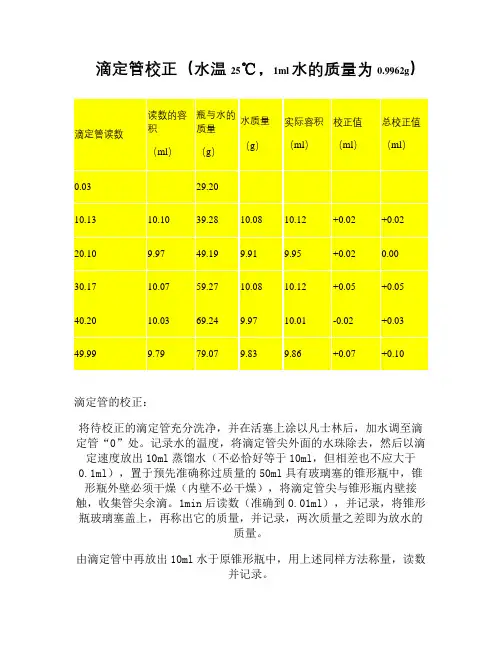
滴定管校正(水温25℃,1ml水的质量为0.9962g)滴定管的校正:将待校正的滴定管充分洗净,并在活塞上涂以凡士林后,加水调至滴定管“0”处。
记录水的温度,将滴定管尖外面的水珠除去,然后以滴定速度放出10ml蒸馏水(不必恰好等于10ml,但相差也不应大于0.1ml),置于预先准确称过质量的50ml具有玻璃塞的锥形瓶中,锥形瓶外壁必须干燥(内壁不必干燥),将滴定管尖与锥形瓶内壁接触,收集管尖余滴。
1min后读数(准确到0.01ml),并记录,将锥形瓶玻璃塞盖上,再称出它的质量,并记录,两次质量之差即为放水的质量。
由滴定管中再放出10ml水于原锥形瓶中,用上述同样方法称量,读数并记录。
同样,每次再放出10ml水,即从20ml到30ml(30ml~40ml),直到50ml为止。
用实验温度时1ml水的质量(查下表)来除每次得到的水的质量。
即可得相当于滴定管各部分容积的实际毫升数(即20℃时的真实容积)。
酸碱滴定管校正的方法相同。
不同温度下用水充满20℃时容积为1L的玻璃容器于空气中以黄铜砝码称取的水的质量/g 温度/℃质量/g温度/℃质量/g温度/℃质量/g0 998.241 998.32 11 998.32 21 997.00 31 994.642 998.39 12 998.23 22 996.80 32 994.343 998.44 13 998.14 23 996.60 33 994.064 998.48 14 998.04 24 996.38 34 993.755 998.50 15 997.93 25 996.17 35 993.456 998.51 16 997.80 26 995.93 36 993.127 998.50 17 997.65 27 995.69 37 992.808 998.48 18 997.51 28 995.44 38 992.469 998.44 19 997.34 29 995.18 39 992.1210 998.39 20 997.18 30 994.91 40 991.77不同温度下每1000ml水(或稀溶液)换算到20℃时的校正值5 +1.5 +1.710 +1.3 +1.4515 +0.8 +0.920 0.0 0.025 -1.0 -1.130 -2.3 -2.5滴定管的容量允差0.10。
滴定管的使用与校正实验报告四川农业大学理学院郑蓉周静*摘要:滴定管是滴定时用来准确测量流出的操作溶液体积的量器。
一般分为两种:一种是具塞滴定管,常称酸式滴定管;另一种是无塞滴定管,常称碱式滴定管。
酸式滴定管用来装酸性及氧化性溶液,不用于盛装碱性溶液。
对于滴定管一类具有较高精密度的玻璃仪器,由于玻璃本身具有热胀冷缩的性质和其他一些因素,实际容积与标出数并非完全相符。
因此,校准是一项对于提高准确度的必要操作。
关键词:酸式滴定管碱式滴定管使用校正The use of burettes and calibrationZheng Rong; Zhou Jing*Abstract: Burettes are used to measure the outflows truly at the time of titration, generally divided into two kinds. One is with plug often called acid burette, the other is without plug often called base buret. Acid is used for acidic and oxidizing solution but not for alkaline solution. For glassware with high precision as a buret, the actual volume is not completely consistent with the standard volume due to the glass has the nature of expansion and contraction. Therefore, calibration is a necessary operation to improve the accuracy.Key words: acid burette base buret use calibretion仪器与试剂:50ml酸式滴定管50ml碱式滴定管滴定管架烧杯50ml磨口锥形瓶分析天平温度计蒸馏水滴定管的使用:1.检漏。
滴定分析操作实验报告滴定分析操作实验报告引言:滴定分析是一种常见的定量分析方法,广泛应用于化学实验室中。
本次实验旨在通过滴定分析方法确定未知溶液中含有的酸或碱的浓度。
滴定分析操作需要严谨的实验技巧和精确的数据处理,以获得准确的结果。
本报告将详细介绍实验的步骤、原理以及结果分析。
实验步骤:1. 准备工作:清洗滴定管、瓶口滴管和烧杯,确保无杂质残留。
使用洗净的玻璃棒蘸取少量试剂,滴在白纸上,观察是否有颜色变化,以检查试剂是否纯净。
2. 标定滴定管:用已知浓度的酸或碱溶液标定滴定管。
取一定体积的标定溶液倒入烧杯中,加几滴指示剂,记录初始体积。
然后,逐滴加入待测溶液,直到指示剂颜色发生明显变化。
记录滴定管的最终体积。
3. 滴定操作:取一定体积的未知溶液倒入烧杯中,加几滴指示剂,将标定过的滴定管插入烧杯中,缓慢滴加标定溶液,直到指示剂颜色发生明显变化。
记录滴定管的最终体积。
4. 数据处理:根据标定滴定管时记录的初始和最终体积,计算出滴定液的体积。
根据滴定液的浓度和滴定液与待测溶液反应的化学方程式,计算出待测溶液中酸或碱的浓度。
实验原理:滴定分析是一种基于化学反应的定量分析方法。
在滴定过程中,通过滴加已知浓度的酸或碱溶液,使其与待测溶液中的酸或碱发生反应,达到化学反应的当量点。
滴定过程中使用指示剂来指示反应的终点,通常是指示剂颜色发生明显变化的时刻。
滴定反应的化学方程式如下所示:酸滴定:酸 + 碱→ 盐 + 水碱滴定:酸 + 碱→ 盐 + 水根据滴定反应的化学方程式,可以计算出待测溶液中酸或碱的浓度。
滴定过程中,滴定液的体积和浓度是已知的,通过滴定液的体积和化学方程式的配比关系,可以反推出待测溶液中酸或碱的浓度。
结果分析:在本次实验中,我们使用了硫酸和氢氧化钠两种溶液进行滴定分析。
通过标定滴定管,我们确定了滴定液的浓度。
在滴定过程中,我们观察到指示剂颜色的变化,从而确定了滴定反应的终点。
通过计算滴定液的体积和化学方程式的配比关系,我们得出了待测溶液中酸或碱的浓度。
滴定管的实验报告滴定管的实验报告引言:滴定管是化学实验中常用的一种玻璃仪器,用于定量测量和转移液体。
它具有精确度高、操作简便等优点,在酸碱滴定、溶液稀释等实验中发挥着重要作用。
本文将结合实验结果,对滴定管的使用方法、实验步骤以及注意事项进行探讨。
一、滴定管的使用方法滴定管是由玻璃制成的,具有一端较粗的漏斗形状,另一端较细的尖管。
使用滴定管前,首先要确保其清洁干燥,避免对实验结果的影响。
在使用滴定管时,一般需要进行预洗,以去除可能残留的杂质。
预洗滴定管的方法是,将滴定管的尖端浸入去离子水中,用手指捏住滴定管的上部,反复吸取和释放去离子水,直至水滴在尖端形成连续的流动。
这样可以确保滴定管内部没有空气,并且水分子可以完全覆盖滴定管的内壁。
二、滴定管的实验步骤滴定管在实验中常用于酸碱滴定实验。
下面以酸碱滴定为例,介绍滴定管的实验步骤。
1. 准备工作:a. 将待滴定的溶液与滴定管放在同一水平面上,以便更准确地观察滴定过程。
b. 准备好滴定管架,将滴定管放入架上,以保持滴定管的稳定。
2. 滴定过程:a. 使用背景板或白纸将试管或容器放在背景上,以便更清楚地观察滴定过程中液体的颜色变化。
b. 用滴定管吸取一定量的滴定液,注意不要碰到容器的壁面,以免影响实验结果。
c. 将滴定管尖端放入待滴定溶液中,缓慢滴加滴定液,同时轻轻旋转滴定管,直至滴定液的颜色发生明显变化。
d. 当颜色变化明显时,停止滴定,记录滴定液使用的体积。
3. 结果处理:a. 计算滴定液的浓度,可以根据滴定液的浓度和使用的体积来计算待滴定溶液的浓度。
b. 计算滴定液的平均滴定体积,可以进行多次滴定实验,取平均值,以提高实验结果的准确性。
三、滴定管的注意事项在使用滴定管进行实验时,需要注意以下几点:1. 操作要轻柔:滴定管是玻璃制品,使用时要轻柔,避免碰撞或摔落,以免破损。
2. 避免交叉污染:在滴定不同溶液时,要彻底清洗滴定管,以避免溶液之间的交叉污染,影响实验结果。
滴定管和移液管的使用及校正滴定管和移液管的使用及校正一、摘要:本次实验主要分为两个部分,第一个部分为移液管的使用及误差分析,利用移液管的定量体积,通过衡量法和作图探究偶然误差的存在和其数学规律;第二个部分是对滴定管进行校准,由于玻璃具有热胀冷缩的特性,通过对仪器进行绝对校准,来体会玻璃容器在分析化学中所产生的误差。
除此之外,该实验还对移液管、滴定管的使用方法和注意事项等有所探讨。
关键词:偶然误差、衡量法、热胀冷缩、绝对校准二、材料:2.1、仪器:移液管(25mL);碱式滴定管(50mL);酸式滴定管(50mL);洗耳球;具塞锥形瓶(50mL);烧杯;滴定管架;分析天平(万分之一)。
2.2、试剂:超纯水;凡士林;铬酸洗液。
三、前言:由于玻璃具有热胀冷缩的特性,在不同温度下容量器皿的体积也有所不同。
因此在准确度要求较高的分析工作中,必须对容量器皿进行校准。
容量器的常用校准方法有相对校准和绝对校准。
本次实验通过绝对校准的方法,体验实验过程中所产生的偶然误差并对误差结果进行探究。
此次绝对校准采用衡量法(称量法)来测定容量器皿的实际容积,进而求得校正及总校正,通过作图的方式探讨滴定管的误差;对移液管进行74次检定,利用所得数据作图可以发现偶然误差大致接近正态曲线的分布;对滴定管进行4次校准,每次的放出单位为1mL,从数据中可以发现,尽管实验条件都相同但是不同时间、不同的人所得到的数据都是不一样的,从数据整体的趋势可以看到,由于温度低于正常使用温度,滴定管的实际容积小于读出的容积。
四、实验方法:4.1、移液管的校准:①清洗:用自来水将待测移液管洗净,若有明显油污,则先用洗液清洗(清洗完后的洗液需倒回试剂瓶直至全部洗液变成绿色)后,再用自来水冲洗,最后用蒸馏水润洗3次,擦干移液管表面残留的水,清洗后的移液管应清澈、透明;②练习:用洗耳球吸取蒸馏水至移液管标线之上2-3cm处,将移液管提离液面轻靠于容器壁,缓慢释放至液面底部与标线相切,多次练习,熟练、精准掌握移液管的操作方法;③检定:称取50mL具塞锥形瓶的质量,用准备好的移液管吸取蒸馏水,调整凹液面与刻度线平齐后除去尖端外面的水,锥形瓶倾斜30度,将移液管尖嘴紧贴其内壁,使水充分流入锥形瓶中。
滴定管校正方法
滴定管的校正方法
将欲校准的滴定管充分洗净,装入蒸馏水至刻度零处,记录水的温度。
然后由滴定管放出10ml 水(放出速度:10ml/min)至预先称过质量的具塞瓶中,该盖上瓶塞,再称出它的质量(精确到0.01g).两次质量之差即为放出水的质量。
用同样的方法称出滴定管从0到20ml,0到30ml,0到40ml ,0到50ml刻度间水的质量,用实验温度时水的质量来除相对应水的体积换算校正值(非密度值),即可得到相当于滴定管各部分容积的实际毫升数。
例如在15℃由滴定管中放出10.03ml水,其质量为10.04g,又此算出水的实际体积为:10.04/0.99792=10.06(ml),因此,滴定管这段容积的误差为10.06-10.03=+0.03ml。
使用时应将视容量为10.03 ml,加上校正值+0.03ml,才等于真实容量(10.03+0.03=10.06ml)。
举例:阶段放出体积校正法
25ml滴定管校正举例(总体积校正法)
滴定管校正曲线的绘制
溶液温度补正值
注:
1 本表数值是以20℃为标准温度以实测法测出。
2 表中带有+”、“-”号的数值是以20℃为分界。
室温低于20℃的补正值均为“+”,高于20℃的补正值均为“-”。
3 本表的用法:如1L硫酸溶液〔c(1/2H2SO4)=1mol/L〕由25℃换算为20℃时,其体积修正值为-1.5mL,故40.00mL换算为20℃时的体积为V20=40.00-1.5/1000×40.00=39.94mL。
滴定管的校准实验报告
摘要:本文介绍了滴定管的常用校正方法,说明了玻璃仪器在使用过程中产生误差的原因。
并对50mL的酸式和碱式滴定管进行校正,得出了两只滴定管的校正曲线。
关键词:校正,酸式滴定管,碱式滴定管,误差。
综述:容量器皿的容积与其所标出的体积并非完全相符。
因此,在准确要求较高的分析的工作中,必须对容量器皿进行校准。
由于玻璃仪器具有热胀冷缩的特性,在不同温度下容量器皿的容积也有所不同,所以在校准容量器皿时必须在一个共同的温度下进行。
容量器皿常用两种校准方法:相对校准和绝对校准。
相对校准时要求对两种容器之间的容积有一定的比例关系时常采用的方法;绝对校准是测定容量器皿的实际容积,常用称量法。
实验部分: 1.仪器和试剂: 50mL滴定管,酸式、碱式各一支;锥形瓶(50mL,具有玻璃磨口)一只;温度计一支;蒸馏水;电子天平,凡士林。
2.试验方法:酸式滴定管的校正:首先把滴定管洗净,检查是否漏液,如果漏液则把滴定管的活塞取出,用吸水纸把活塞和插活塞的孔的水吸干,再在活塞上均匀的涂抹上少量凡士林,切记活塞上有孔的几个面不能涂抹,否则会将孔堵住。
当活塞旋转灵活无噪音即可。
不再漏液后装入蒸馏水,再排气,并使液面位于零刻度线处。
记录实验温度,把锥形瓶洗干净,并把瓶外壁的水分擦干,用分析天平称量后记下空瓶的质量(保留3位小数)。
依次将滴定管内的水放进锥形瓶,用分析天平称量其质量,精确到小数点后三位并记录。
分别将几次的数据记录并分析。
将上述实验重复做2次,并取平均值。
碱式滴定管的校正:先洗净滴定管,检查是否漏液,如果漏液,更换乳胶管和其中的玻璃球。
其余操作与酸式滴定管相同。
结果与讨论:酸式滴定管的校正,将二次的数据归纳统计记入下表,用滴定管的读数减去上一次的滴定管的读数,算出读出总体积。
用分析天平的读数减去上一次的读数,得到总水的体积。
实验温度为18°C,查表得此温度下水的密度为0.9975g.cm-1。
利用V=m/ρ算出水的实际体积。
再用实际容量值减去读出总容积,得到总校准值。
表格见数据记录本。
酸式滴定管校正曲线
碱式滴定管的校正:酸式滴定管的计算,将碱式滴定管的校准数据归纳得出:
碱式滴定管校正曲线。