碳酸钠与碳酸氢钠性质的比较
- 格式:ppt
- 大小:1.04 MB
- 文档页数:41




碳酸钠与碳酸氢钠的性质与差异
碳酸钠与碳酸氢钠有3点不同:
一、两者的性质不同:
1、碳酸钠的性质:碳酸钠常温下为白色无气味的粉末或颗粒。
有吸水性,露置空气中逐渐吸收1mol/L水分。
碳酸钠易溶于水和甘油。
20℃时每一百克水能溶解20克碳酸钠,35.4℃时溶解度最大,100克水中可溶解49.7克碳酸钠,微溶于无水乙醇,难溶于丙醇。
溶液显碱性,能使酚酞变红。
2、碳酸氢钠的性质:碳酸氢钠为白色晶体,或不透明单斜晶系细微结晶。
比重2.15。
无臭、无毒、味咸,可溶于水,微溶于乙醇。
25℃时溶于10份水,约18℃时溶于12份水。
其水溶液因水解而呈微碱性,常温中性质稳定,受热易分解,在50℃以上逐渐分解,在270℃时完全失去二氧化碳,在干燥空气中无变化,在潮湿空气中缓慢潮解。
二、两者的分子量不同:
1、碳酸钠的分子量:为105.99。
2、碳酸氢钠的分子量:为84.06。
三、两者的密度不同:
1、碳酸钠的密度:2.532g/cm³。
2、碳酸氢钠的密度:2.159g/cm³。

碳酸钠和碳酸氢钠的溶解度差异的原因碳酸钠和碳酸氢钠是两种常见的碳酸盐化合物,它们在溶液中的溶解度有一定的差异。
本文将分析碳酸钠和碳酸氢钠溶解度差异的原因,并探讨其在实际应用中的意义。
1. 溶解度定义及影响因素在讨论碳酸钠和碳酸氢钠的溶解度差异之前,我们先介绍一下溶解度的概念。
溶解度是指在一定温度下,单位溶剂中溶质能够溶解的最大量。
影响溶解度的因素包括温度、压力、溶质和溶剂的性质等。
2. 碳酸钠和碳酸氢钠的结构和性质碳酸钠的化学式为Na2CO3,它是一种无机化合物,存在着结晶水合物的形式。
碳酸氢钠的化学式为NaHCO3,也是一种无机化合物,在固态中并不含结晶水合物。
两者的分子结构略有不同,这也是导致它们溶解度差异的一个关键因素。
3. 水溶液中的离解行为在水溶液中,碳酸钠和碳酸氢钠会发生离解反应,形成溶解度平衡。
碳酸钠的离解方程式为:Na2CO3 ⇌ 2Na+ + CO3^2-碳酸氢钠的离解方程式为:NaHCO3 ⇌ Na+ + HCO3^-从离解方程式可以看出,碳酸钠中的两个钠离子与碳酸根离子的比例是1:1,而碳酸氢钠中只有一个钠离子与碳酸根离子的比例是1:1。
这也是导致碳酸钠和碳酸氢钠溶解度差异的原因之一。
4. pH值对溶解度的影响另一个导致碳酸钠和碳酸氢钠溶解度差异的因素是溶液的pH值。
碳酸钠溶解时会释放出碱性的氢氧根离子(OH-),从而提高溶液的碱性。
而碳酸氢钠溶解时会产生碳酸根离子(HCO3-),从而使溶液呈现酸性或中性。
由于碱性条件下,钠离子(Na+)更易溶解于水中,所以碳酸钠的溶解度相对较高。
而酸性或中性条件下,碳酸根离子(HCO3-)更易溶解于水中,导致碳酸氢钠的溶解度较高。
5. 应用意义与实际应用碳酸钠和碳酸氢钠在实际应用中有着广泛的用途。
碳酸钠常用于玻璃制造、制碱工业、纺织业等领域;碳酸氢钠则常用于食品加工、制药、调节水质等方面。
对于不同领域的应用,我们需要根据具体情况选择合适的碳酸盐化合物。

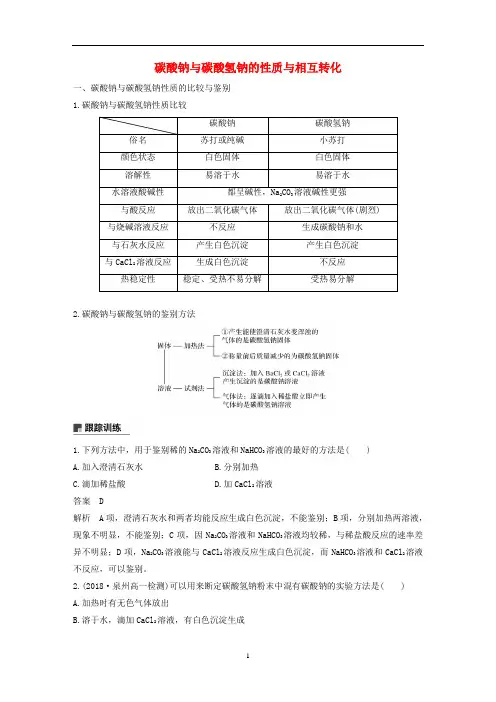
碳酸钠与碳酸氢钠的性质与相互转化一、碳酸钠与碳酸氢钠性质的比较与鉴别1.碳酸钠与碳酸氢钠性质比较碳酸钠碳酸氢钠俗名苏打或纯碱小苏打颜色状态白色固体白色固体溶解性易溶于水易溶于水水溶液酸碱性都呈碱性,Na2CO3溶液碱性更强与酸反应放出二氧化碳气体放出二氧化碳气体(剧烈) 与烧碱溶液反应不反应生成碳酸钠和水与石灰水反应产生白色沉淀产生白色沉淀与CaCl2溶液反应生成白色沉淀不反应热稳定性稳定、受热不易分解受热易分解2.碳酸钠与碳酸氢钠的鉴别方法1.下列方法中,用于鉴别稀的Na2CO3溶液和NaHCO3溶液的最好的方法是( )A.加入澄清石灰水B.分别加热C.滴加稀盐酸D.加CaCl2溶液答案 D解析A项,澄清石灰水和两者均能反应生成白色沉淀,不能鉴别;B项,分别加热两溶液,现象不明显,不能鉴别;C项,因Na2CO3溶液和NaHCO3溶液均较稀,与稀盐酸反应的速率差异不明显;D项,Na2CO3溶液能与CaCl2溶液反应生成白色沉淀,而NaHCO3溶液和CaCl2溶液不反应,可以鉴别。
2.(2018·泉州高一检测)可以用来断定碳酸氢钠粉末中混有碳酸钠的实验方法是( )A.加热时有无色气体放出B.溶于水,滴加CaCl2溶液,有白色沉淀生成C.滴加盐酸有气泡产生D.溶于水,滴加澄清石灰水,有白色沉淀生成答案 B解析NaHCO3受热易分解,Na2CO3不分解,加热时有气体放出无法判定有Na2CO3,A项错误;CaCl2+Na2CO3===CaCO3↓+2NaCl,NaHCO3与CaCl2不反应,滴加CaCl2溶液有白色沉淀生成,说明该粉末中有Na2CO3,B项正确;NaHCO3、Na2CO3均能与盐酸反应产生气泡,故无法判定Na2CO3的存在,C项错误;Na2CO3与Ca(OH)2反应:Na2CO3+Ca(OH)2===CaCO3↓+2NaOH,产生白色沉淀,NaHCO3与Ca(OH)2反应:Ca(OH)2+2NaHCO3===2H2O+Na2CO3+CaCO3↓,也产生白色沉淀,故无法判定Na2CO3的存在,D项错误。

碱和小苏打的区别
我们通常说的碱一般是食用碱,苏打一般指碳酸氢钠,又称小苏打。
苏打和碱在性质、作用等方面均有区别。
1.性质:①食用碱,是纯碱(碳酸钠)与小苏打(碳酸氢钠)的混合物,其外观为固体状,外表色呈现纯白色,且易溶于水中。
②小苏打为白色粉末状或细微结晶,易溶于水,微溶于乙醇,水溶液呈微碱性。
小苏打的外观颜色也呈白色,但是其本体却为细小晶体状,类似盐的感觉。
2.作用与用途:①小苏打可以除油污,用其洗衣可以提高去污的效果;小苏打可中和胃酸,碱化尿液;可用于防治代谢性酸中毒;还常作为食品的膨松剂。
②食用碱并不是一种常用调味品,它只是一种食品疏松剂和肉类嫩化剂,能使干货原料迅速涨发,软化纤维,去除发面团的酸味,适当使用可为食品带来极佳的色、香、味、形,以增进人们的食欲。
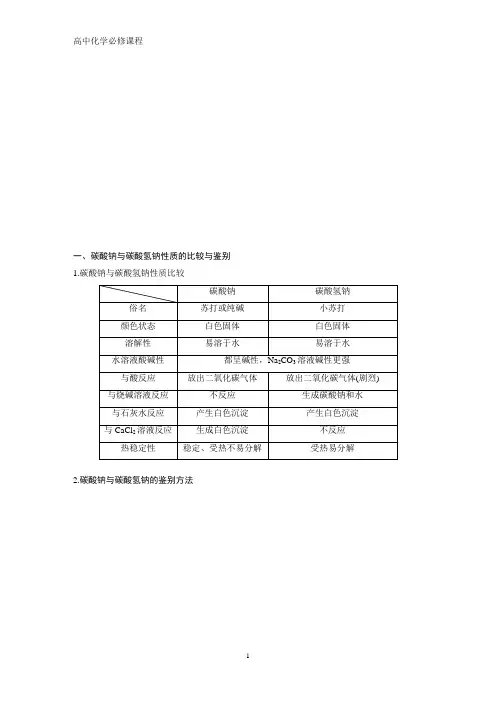
一、碳酸钠与碳酸氢钠性质的比较与鉴别1.碳酸钠与碳酸氢钠性质比较2.碳酸钠与碳酸氢钠的鉴别方法1.下列方法中,用于鉴别稀的Na2CO3溶液和NaHCO3溶液的最好的方法是()A.加入澄清石灰水B.分别加热C.滴加稀盐酸D.加CaCl2溶液[答案] D[解析]A项,澄清石灰水和两者均能反应生成白色沉淀,不能鉴别;B项,分别加热两溶液,现象不明显,不能鉴别;C项,因Na2CO3溶液和NaHCO3溶液均较稀,与稀盐酸反应的速率差异不明显;D项,Na2CO3溶液能与CaCl2溶液反应生成白色沉淀,而NaHCO3溶液和CaCl2溶液不反应,可以鉴别。
2.(2018·泉州高一检测)可以用来断定碳酸氢钠粉末中混有碳酸钠的实验方法是()A.加热时有无色气体放出B.溶于水,滴加CaCl2溶液,有白色沉淀生成C.滴加盐酸有气泡产生D.溶于水,滴加澄清石灰水,有白色沉淀生成[答案] B[解析]NaHCO3受热易分解,Na2CO3不分解,加热时有气体放出无法判定有Na2CO3,A项错误;CaCl2+Na2CO3===CaCO3↓+2NaCl,NaHCO3与CaCl2不反应,滴加CaCl2溶液有白色沉淀生成,说明该粉末中有Na2CO3,B项正确;NaHCO3、Na2CO3均能与盐酸反应产生气泡,故无法判定Na2CO3的存在,C项错误;Na2CO3与Ca(OH)2反应:Na2CO3+Ca(OH)2===CaCO3↓+2NaOH,产生白色沉淀,NaHCO3与Ca(OH)2反应:Ca(OH)2+2NaHCO3===2H2O+Na2CO3+CaCO3↓,也产生白色沉淀,故无法判定Na2CO3的存在,D 项错误。
3.下列有关NaHCO3和Na2CO3性质的叙述中正确的是()A.碳酸钠可用于治疗胃溃疡病人的胃酸过多症B.发酵粉中主要含有碳酸钠,能使焙制出的糕点疏松多孔C.在Na2CO3和NaHCO3溶液中滴加石灰水均产生白色沉淀D.Na2CO3和NaHCO3均能与盐酸和NaOH溶液反应[答案] C[解析]可用于治疗胃酸过多症的是NaHCO3,A项错误;发酵粉的主要成分为碳酸氢钠,B 项错误;在Na2CO3和NaHCO3溶液中滴加石灰水均产生碳酸钙沉淀,C项正确;Na2CO3溶液不能与NaOH溶液反应,D项错误。

高中化学碳酸钠和碳酸氢钠的对比一、碳酸钠和碳酸氢钠的共性1、都能与盐酸(或硫酸与硝酸)反应生成能使澄清石灰水变浑浊的气体;2、跟石灰水或氢氧化钡溶液都生成白色沉淀;3、水溶液均呈碱性;4、焰色反应呈黄色;5、都能与铝盐或铁盐溶液发生双水解反应;二、碳酸钠和碳酸氢钠的差异1、热稳定性:碳酸钠加热不分解,碳酸氢钠加热易分解成碳酸钠,水和二氧化碳;2、水溶解性:碳酸钠的溶解度大于碳酸氢钠;3、与二氧化碳的反应:碳酸钠能跟二氧化碳(与水)化合生成碳酸氢钠,而碳酸氢钠不反应;4、与氢氧化钠的反应:碳酸氢钠能跟氢氧化钠反应生成碳酸钠和水,而碳酸氢钠不反应;5、与氯化钙的反应:碳酸钠跟氯化钙(或氯化钡)溶液易生成碳酸盐沉淀,而碳酸氢钠跟盐类稀溶液不易生成沉淀6、与苯酚的反应:碳酸钠能与苯酚反应生成苯酚钠和碳酸氢钠,而碳酸氢钠不与苯酚反应;三、碳酸钠和碳酸氢钠的区分方法一、固体状态法1:据热稳定性不同。
分别加热少量样品,并将生成的气体通入到澄清石灰水。
能使澄清石灰水变浑浊的样品为碳酸氢钠。
该方法使用的仪器装置比较复杂,需要用到加热装置法2:据与酸反应的速率不同。
分别取相同质量的固体,加入等浓度等体积的盐酸中,反应较快的是碳酸氢钠。
这种方法观察起来有一定难度。
二、溶液状态法3:据与酸反应的过程不同。
取同浓度同体积的溶液,分别滴加盐酸,开始无气体一段时间后有气体的是碳酸钠;开始即有气体的是碳酸氢钠。
当溶液浓度比较低的时候,出现气泡不明显;法4:据沉淀反应不同。
分别取稀溶液,滴加BaCl2(或CaCl2)溶液,产生沉淀的原试剂为碳酸钠。
法5:据溶液的碱性不同。
测其等浓度稀溶液的pH,pH值较大较大的原试剂为碳酸钠。
需要配置物质的量浓度相等的溶液;法6:根据碳酸氢钠的两性。
分别取溶液,并滴加偏铝酸钠溶液,生成白色沉淀的为碳酸氢钠。
三、错误方法法1:利用澄清石灰水。
因为碳酸氢钠溶液和碳酸钠溶液均能与澄清石灰水反应生成白色沉淀,因此澄清石灰水无法鉴别两种溶液。

高中化学中碳酸钠和碳酸氢钠对比一、碳酸钠和碳酸氢钠的共性1、都能与盐酸(或硫酸与硝酸)反应生成能使澄清石灰水变浑浊的气体;2、跟石灰水或氢氧化钡溶液都生成白色沉淀;3、水溶液均呈碱性;4、焰色反应呈黄色;5、都能与铝盐或铁盐溶液发生双水解反应;二、碳酸钠和碳酸氢钠的差异1、热稳定性:碳酸钠加热不分解,碳酸氢钠加热易分解成碳酸钠,水和二氧化碳;2、水溶解性:碳酸钠的溶解度大于碳酸氢钠;3、与二氧化碳的反应:碳酸钠能跟二氧化碳(与水)化合生成碳酸氢钠,而碳酸氢钠不反应;4、与氢氧化钠的反应:碳酸氢钠能跟氢氧化钠反应生成碳酸钠和水,而碳酸氢钠不反应;5、与氯化钙的反应:碳酸钠跟氯化钙(或氯化钡)溶液易生成碳酸盐沉淀,而碳酸氢钠跟盐类稀溶液不易生成沉淀6、与苯酚的反应:碳酸钠能与苯酚反应生成苯酚钠和碳酸氢钠,而碳酸氢钠不与苯酚反应;三、碳酸钠和碳酸氢钠的区分方法一、固体状态法1:据热稳定性不同。
分别加热少量样品,并将生成的气体通入到澄清石灰水。
能使澄清石灰水变浑浊的样品为碳酸氢钠。
该方法使用的仪器装置比较复杂,需要用到加热装置法2:据与酸反应的速率不同。
分别取相同质量的固体,加入等浓度等体积的盐酸中,反应较快的是碳酸氢钠。
这种方法观察起来有一定难度。
二、溶液状态法3:据与酸反应的过程不同。
取同浓度同体积的溶液,分别滴加盐酸,开始无气体一段时间后有气体的是碳酸钠;开始即有气体的是碳酸氢钠。
当溶液浓度比较低的时候,出现气泡不明显;法4:据沉淀反应不同。
分别取稀溶液,滴加BaCl2(或CaCl2)溶液,产生沉淀的原试剂为碳酸钠。
法5:据溶液的碱性不同。
测其等浓度稀溶液的pH,pH值较大较大的原试剂为碳酸钠。
需要配置物质的量浓度相等的溶液;法6:根据碳酸氢钠的两性。
分别取溶液,并滴加偏铝酸钠溶液,生成白色沉淀的为碳酸氢钠。
三、错误方法法1:利用澄清石灰水。
因为碳酸氢钠溶液和碳酸钠溶液均能与澄清石灰水反应生成白色沉淀,因此澄清石灰水无法鉴别两种溶液。
碳酸钠和碳酸氢钠的溶解度不同的原因碳酸钠(Na2CO3)和碳酸氢钠(NaHCO3)是两种常见的碱性物质,它们具有不同的化学性质和溶解度。
本文将深入探讨碳酸钠和碳酸氢钠的溶解度不同的原因,并给出一些对此的观点和理解。
1. 解释碳酸钠和碳酸氢钠的结构及其对溶解度的影响- 碳酸钠的结构:碳酸钠是由一个碳酸根离子(CO3^2-)和两个钠离子(Na+)组成。
在水中溶解时,水分子会与钠离子和碳酸根离子发生离解反应。
- 碳酸氢钠的结构:碳酸氢钠是由一个碳酸根离子和一个氢离子(H+)以及一个钠离子组成。
与碳酸钠相比,碳酸氢钠在水中的溶解度要高一些,因为它在水中会释放出更多的氢离子。
2. pH值的影响- 碳酸钠和碳酸氢钠的溶解度与水的pH值密切相关。
碳酸钠在水中的溶解度较低,部分原因是由于碱性物质的溶解度与溶液的酸碱性有关。
- 当碳酸钠溶解时,它会释放出氢氧根离子(OH-),它们与水中的氢离子结合形成水分子。
这种中和反应会减少溶解度,从而降低了碳酸钠在水中的溶解度。
3. 温度的影响- 温度也对碳酸钠和碳酸氢钠的溶解度产生影响。
通常情况下,温度升高会增加溶质溶解于溶剂中的速率。
- 对于碳酸钠,温度升高会增加其溶解度,因为碳酸钠的溶解是一个吸热过程。
随着温度的升高,碳酸钠溶解时需要的能量也增加,因此其溶解度会增加。
- 相比之下,碳酸氢钠在温度升高时,溶解度增加的速率相对较慢,因为其溶解是一个放热过程。
碳酸氢钠在水中溶解时会释放出氢离子,并产生一定的热量。
当温度升高时,放热过程会减缓其溶解度的增加。
4. 结论和观点- 碳酸钠和碳酸氢钠的溶解度不同是由于它们的化学结构和物理性质的差异所致。
- 碳酸钠在水中的溶解度较低,部分原因是由于其在溶液中形成氢氧根离子,从而降低了其溶解度。
- 温度也对碳酸钠和碳酸氢钠的溶解度产生影响,温度升高会增加碳酸钠的溶解度,但对碳酸氢钠的影响较小。
- 进一步研究碳酸钠和碳酸氢钠的溶解度可帮助深入理解它们的化学行为,并在工业和实验室应用中提供重要的参考价值。
碳酸钠和碳酸氢钠的溶解度曲线全文共四篇示例,供读者参考第一篇示例:碳酸钠和碳酸氢钠是常见的碱性盐类化合物,在实验室和工业生产中有着广泛的应用。
它们的溶解度与温度之间存在一定的关系,通过实验可以获得溶解度曲线,了解它们在不同温度下的溶解度变化规律。
本文将介绍碳酸钠和碳酸氢钠的基本性质、溶解度曲线的制作方法以及实验结果分析。
一、碳酸钠和碳酸氢钠的基本性质碳酸钠(Na2CO3)是一种无机化合物,常见的形式为无水和十水合物。
它在空气中易吸收水分产生碱性溶液,是一种重要的化工原料,广泛用于玻璃、纺织、造纸等行业。
碳酸氢钠(NaHCO3)又称小苏打,是一种含有碳酸根离子和氢碱根离子的化合物,常用作食品添加剂、中和剂等。
碳酸钠和碳酸氢钠在水中溶解时,会发生离子的溶解反应,生成碳酸根离子和氢碱根离子。
其溶解度受温度的影响较大,随着温度的升高,溶解度通常会增大。
为了研究它们在不同温度下的溶解度变化规律,我们可以进行实验制作溶解度曲线。
二、溶解度曲线的制作方法制作碳酸钠和碳酸氢钠的溶解度曲线需要以下实验仪器和药品:碳酸钠、碳酸氢钠、蒸馏水、热水浴、恒温槽、PH计等。
具体步骤如下:1. 分别称取适量的碳酸钠和碳酸氢钠样品,将其分别置于烧杯中。
2. 向每个烧杯中加入一定量的蒸馏水,搅拌均匀使固体完全溶解。
3. 将制备好的溶液置于恒温槽中,并分别设定不同的温度,如20℃、30℃、40℃、50℃等。
4. 使用PH计测量每个温度下溶液的PH值,记录下实验数据。
5. 根据PH值的变化,计算出每个温度下碳酸钠和碳酸氢钠的溶解度。
6. 绘制溶解度曲线图,表示碳酸钠和碳酸氢钠在不同温度下的溶解度变化规律。
三、实验结果分析碳酸钠和碳酸氢钠的溶解度曲线是一个重要的研究课题,通过实验证明了温度对其溶解度的影响规律。
通过继续深入研究,可以更好地理解碳酸盐的溶解行为,为相关领域的科研工作提供有益的参考和指导。
希望本文对您对碳酸钠和碳酸氢钠的溶解度曲线有所帮助。