对比碳酸钠与碳酸氢钠 (3)
- 格式:doc
- 大小:34.50 KB
- 文档页数:1

碳酸钠与碳酸氢钠的鉴别方法碳酸钠(Na2CO3)和碳酸氢钠(NaHCO3)是两种常见的碱性盐类化合物。
尽管它们在化学性质上有一些相似之处,但它们有一些不同之处,可以通过一系列的实验方法进行鉴别。
1.水溶液鉴别法首先,将待鉴别物溶解在一些水中。
如果溶解物产生气泡,且导电性增加,那么该物质为碳酸氢钠(NaHCO3)。
而如果没有气泡产生且导电性不变,那么则可能是碳酸钠(Na2CO3)或其他非碱性物质。
2.酸反应鉴别法将现有溶液逐滴加入盛有酸性指示剂(如酚酞)的试管中。
若溶液呈现橙红色(酚酞原有颜色),则该物质为碳酸氢钠(NaHCO3)。
如果溶液呈现黄色,或不产生颜色变化,那么则可能是碳酸钠(Na2CO3)或其他非碱性物质。
3.酸酐法将待鉴别物与醋酸酐(乙酸酐)反应。
加入几滴醋酸酐,并加热试管底部。
如果产生气泡,可以通过向试管中悬挂带有苏花纸(湿酸性纸)来检验气体。
苏花纸将变红,表示碳酸钠(Na2CO3)存在。
4.热分解法将待鉴别物加热至高温。
碳酸氢钠(NaHCO3)在加热时会分解为二氧化碳气体、水和碳酸钠(Na2CO3)。
当没有气泡产生,但产生白色固体残留物时,可以加入几滴水检验。
如果固体残留物溶于水,表明物质为碳酸钠(Na2CO3)。
而如果固体残留物不溶于水,则为碳酸氢钠(NaHCO3)。
5.晶体形态鉴别法视观待鉴别物的晶体形态也可以提供一些线索。
碳酸氢钠(NaHCO3)的晶体形态呈现细小的鳞片状或结晶簇,而碳酸钠(Na2CO3)的晶体形态呈现立方体或四面体状。
总结:通过水溶液鉴别法、酸反应鉴别法、酸酐法、热分解法和晶体形态鉴别法,我们可以通过一系列实验证据来鉴别碳酸钠(Na2CO3)和碳酸氢钠(NaHCO3)。
这些方法结合使用将确保准确的鉴别结果。


微专题(四) ——碳酸钠与碳酸氢钠的鉴别与图像分析学校:___________姓名:___________班级:___________考号:___________一、单选题1.有四位同学为鉴别23Na CO 和3NaHCO 两种白色固体,分别设计了下列四种不同的方法,其中可行的是A .分别加入相同浓度的盐酸中,看有无气泡产生B .分别取样在试管中加热,将可能产生的气体通入澄清石灰水中,观察澄清石灰水是否变浑浊C .分别取样配成溶液,滴加()2Ca OH 溶液,观察有无白色沉淀产生D .分别取样配成溶液,用洁净的铂丝蘸取溶液在酒精灯火焰上灼烧,观察火焰的颜色2.实验室有两瓶失去标签的Na 2CO 3和NaHCO 3的无色饱和溶液,下列鉴别方法不合理的是A .用干燥的pH 试纸检验,pH 大的是Na 2CO 3B .取等量的溶液于两支试管中,各滴入酚酞溶液,红色较深的是Na 2CO 3C .取等量的溶液于两支试管中,加热,有气泡产生的是NaHCO 3D .取等量的溶液于两支试管中,逐滴加入稀盐酸,开始就有气体放出的是NaHCO 3(1)在A 情况下,溶质是(填化学式)。
(2)在B 情况下,溶质是 (填化学式)。
三、单选题4.向100 mL NaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入一定浓度的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示。
下列判断正确的是A.所得溶液的溶质成分为NaOH、Na2CO3B.所得溶液的溶质成分为Na2CO3 C.所得溶液的溶质成分为NaHCO3、Na2CO3D.所得溶液的溶质成分为NaHCO3 5.现有两瓶无标签的无色溶液,分别装有Na2CO3和NaHCO3,用下列试剂或方法能将两者区分的是①Ca(OH)2 ②盐酸 ③BaCl2 ④NaOH ⑤加热A.②③B.①③C.③④D.②⑤6.为确定NaHCO3固体中是否含Na2CO3,下列实验操作及判断正确的是A.加热,观察能否放出气体B.溶于水中,加入澄清石灰水,观察是否有白色沉淀生成C.加盐酸观察能否放出气体D.溶于水中,滴加少量BaCl2溶液,观察是否有白色沉淀生成7.纯碱和小苏打是厨房中两种常见的用品,它们都是白色固体。

碳酸钠(Na2CO3)和碳酸氢钠(NaHCO3)碳酸钠(Na2CO3)俗名纯碱,又叫苏打.碳酸氢钠(NaHCO3)俗名小苏打.碳酸钠和碳酸氢钠都属于盐类,但都被用做食用碱.碳酸钠(Na2CO3)和碳酸氢钠(NaHCO3)的区别碳酸钠(Na2CO3) 碳酸氢钠(NaHCO3) 外观白色粉末细小的白色晶体溶解性较大比Na2CO3热稳定性稳定,受热不分解不稳定,受热容易分解溶于水后的酸碱性显较强碱性碱性比Na2CO3碳酸钠(Na2CO3)和碳酸氢钠(NaHCO3)的各种化学反应.与盐酸反应:Na2CO3+2HCl=2NaCl+CO2↑+H2ONaHCO3+2HCl=NaCl+CO2↑+H2O与NaOH溶液反应:Na2CO3不与NaOH反应.NaHCO3+NaOH=Na2CO3+H2O与Ca(OH)2或Ba(OH)2反应:Na2CO3+Ca(OH)2=CaCO3↓+2NaOHNaHCO3+Ca(OH)2=CaCO3↓+H2O+NaOHNa2CO3+Ba(OH)2=BaCO3↓+2NaOHNaHCO3+Ba(OH)2=BaCO3↓+H2O+NaOH与CaCl2或BaCl2反应:Na2CO3+CaCl2=CaCO3↓+2NaClNa2CO3+BaCl2=BaCO3↓+2NaClNaHCO3不与BaCl2和CaCl2反应Na2CO3和的NaHCO3相互转换向饱和的Na2CO3溶液通入CO2:Na2CO3+CO2+H2O=2NaHCO3加热NaHCO3:2NaHCO3==Na2CO3+H2O+CO2↑鉴别Na2CO3和NaHCO3的方法:①加热固体,产生能使澄清石灰水变浑浊的气体的是NaHCO3②溶解,向水溶液中加入BaCl2或CaCl2,产生沉淀的是Na2CO3CO2气体中混有HCl气体,如何去除杂质?把混合气体通入Na2CO3或NaHCO3溶液中,Na2CO3或NaHCO3与HCl反应生成CO2。
反应方程式:NaHCO3+2HCl=NaCl+CO2↑+H2ONa2CO3+2HCl=2NaCl+CO2↑+H2O。

细说碳酸氢钠与碳酸钠的鉴别《实验教学与仪器》(长沙)2007年6期34页上,有“用CaCl2溶液区分NaHCO3和Na2CO3溶液”为题的一篇文章。
我的基本观点认为,用CaCl2溶液作为NaHCO3和Na2CO3的区分试剂的方法欠妥。
1.Na2CO3和NaHCO3的一般鉴别方法(1)如果两种试样都是固体——用加热法量多(如有数克或更多)能受热分解,放出的气体能使澄清石灰水变混浊的是NaHCO3,不能受热分解的是Na2CO3.量少,甚至是微量(如米粒、绿豆、芝麻量大小)按图l所示装置,微微加热样品4s~5s,稍稍用力挤压乳胶头,让滴管尖端悬上一滴饱和石灰水,几秒钟之后,又让石灰水滴回吸到滴管内,可形成一段白色浑浊的液柱的是NaHCO3,没有这种现象发生的是Na2CO3.(2)如果两种试样都是溶液试样浓度较大:两个试管各取1mL~2m1.样液,分别加入l~2滴酚酞试液,溶液显粉红色的是NaHCO3,色泽呈深红色的是Na2CO3。
试样浓度较小:两个试管各取1mL~2mL样液,各加入1~2滴酚酞试液,溶液都呈不易分辨的浅红色。
当把两种溶液都加热煮沸,色泽由浅(红)变深(红)的是NaHCO3,没有色泽变化的是Na2CO3. 2NaHCO3=Na2CO3 + H2O+CO2↑2.细说NaHCO3与Na2CO3的鉴别大家知道,比较NaHCO3和Na2CO3的性质,有两个最显著的差别:一是NaHCO3有对热的不稳定性,受热极易分解(在空气中会缓慢分解,65℃以上迅速分解),而Na2CO3则有极高的热稳定性;二是NaHCO3水解仅显极弱的碱性(0.1mol/L NaHCO3溶液的pH=8.31),刚好在酚酞的变色范围(酚酞的变色范围是pH=8.1~10.0),仅显极浅的粉红色,而Na2CO3水解则显较强的碱性(0.1mol/LNa2CO3,溶液的pH=11.63),遇酚酞显鲜艳的红色。
显然,NaHCO3与Na2CO3这种性质上的差别,就成为这两种物质鉴别(区分)的最为可靠的理论支持和方法依据。

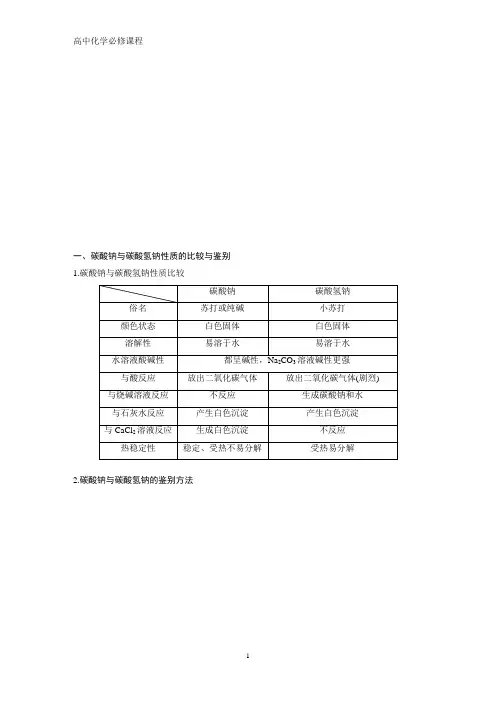
一、碳酸钠与碳酸氢钠性质的比较与鉴别1.碳酸钠与碳酸氢钠性质比较2.碳酸钠与碳酸氢钠的鉴别方法1.下列方法中,用于鉴别稀的Na2CO3溶液和NaHCO3溶液的最好的方法是()A.加入澄清石灰水B.分别加热C.滴加稀盐酸D.加CaCl2溶液[答案] D[解析]A项,澄清石灰水和两者均能反应生成白色沉淀,不能鉴别;B项,分别加热两溶液,现象不明显,不能鉴别;C项,因Na2CO3溶液和NaHCO3溶液均较稀,与稀盐酸反应的速率差异不明显;D项,Na2CO3溶液能与CaCl2溶液反应生成白色沉淀,而NaHCO3溶液和CaCl2溶液不反应,可以鉴别。
2.(2018·泉州高一检测)可以用来断定碳酸氢钠粉末中混有碳酸钠的实验方法是()A.加热时有无色气体放出B.溶于水,滴加CaCl2溶液,有白色沉淀生成C.滴加盐酸有气泡产生D.溶于水,滴加澄清石灰水,有白色沉淀生成[答案] B[解析]NaHCO3受热易分解,Na2CO3不分解,加热时有气体放出无法判定有Na2CO3,A项错误;CaCl2+Na2CO3===CaCO3↓+2NaCl,NaHCO3与CaCl2不反应,滴加CaCl2溶液有白色沉淀生成,说明该粉末中有Na2CO3,B项正确;NaHCO3、Na2CO3均能与盐酸反应产生气泡,故无法判定Na2CO3的存在,C项错误;Na2CO3与Ca(OH)2反应:Na2CO3+Ca(OH)2===CaCO3↓+2NaOH,产生白色沉淀,NaHCO3与Ca(OH)2反应:Ca(OH)2+2NaHCO3===2H2O+Na2CO3+CaCO3↓,也产生白色沉淀,故无法判定Na2CO3的存在,D 项错误。
3.下列有关NaHCO3和Na2CO3性质的叙述中正确的是()A.碳酸钠可用于治疗胃溃疡病人的胃酸过多症B.发酵粉中主要含有碳酸钠,能使焙制出的糕点疏松多孔C.在Na2CO3和NaHCO3溶液中滴加石灰水均产生白色沉淀D.Na2CO3和NaHCO3均能与盐酸和NaOH溶液反应[答案] C[解析]可用于治疗胃酸过多症的是NaHCO3,A项错误;发酵粉的主要成分为碳酸氢钠,B 项错误;在Na2CO3和NaHCO3溶液中滴加石灰水均产生碳酸钙沉淀,C项正确;Na2CO3溶液不能与NaOH溶液反应,D项错误。

高中化学中碳酸钠和碳酸氢钠对比一、碳酸钠和碳酸氢钠的共性1、都能与盐酸(或硫酸与硝酸)反应生成能使澄清石灰水变浑浊的气体;2、跟石灰水或氢氧化钡溶液都生成白色沉淀;3、水溶液均呈碱性;4、焰色反应呈黄色;5、都能与铝盐或铁盐溶液发生双水解反应;二、碳酸钠和碳酸氢钠的差异1、热稳定性:碳酸钠加热不分解,碳酸氢钠加热易分解成碳酸钠,水和二氧化碳;2、水溶解性:碳酸钠的溶解度大于碳酸氢钠;3、与二氧化碳的反应:碳酸钠能跟二氧化碳(与水)化合生成碳酸氢钠,而碳酸氢钠不反应;4、与氢氧化钠的反应:碳酸氢钠能跟氢氧化钠反应生成碳酸钠和水,而碳酸氢钠不反应;5、与氯化钙的反应:碳酸钠跟氯化钙(或氯化钡)溶液易生成碳酸盐沉淀,而碳酸氢钠跟盐类稀溶液不易生成沉淀6、与苯酚的反应:碳酸钠能与苯酚反应生成苯酚钠和碳酸氢钠,而碳酸氢钠不与苯酚反应;三、碳酸钠和碳酸氢钠的区分方法一、固体状态法1:据热稳定性不同。
分别加热少量样品,并将生成的气体通入到澄清石灰水。
能使澄清石灰水变浑浊的样品为碳酸氢钠。
该方法使用的仪器装置比较复杂,需要用到加热装置法2:据与酸反应的速率不同。
分别取相同质量的固体,加入等浓度等体积的盐酸中,反应较快的是碳酸氢钠。
这种方法观察起来有一定难度。
二、溶液状态法3:据与酸反应的过程不同。
取同浓度同体积的溶液,分别滴加盐酸,开始无气体一段时间后有气体的是碳酸钠;开始即有气体的是碳酸氢钠。
当溶液浓度比较低的时候,出现气泡不明显;法4:据沉淀反应不同。
分别取稀溶液,滴加BaCl2(或CaCl2)溶液,产生沉淀的原试剂为碳酸钠。
法5:据溶液的碱性不同。
测其等浓度稀溶液的pH,pH值较大较大的原试剂为碳酸钠。
需要配置物质的量浓度相等的溶液;法6:根据碳酸氢钠的两性。
分别取溶液,并滴加偏铝酸钠溶液,生成白色沉淀的为碳酸氢钠。
三、错误方法法1:利用澄清石灰水。
因为碳酸氢钠溶液和碳酸钠溶液均能与澄清石灰水反应生成白色沉淀,因此澄清石灰水无法鉴别两种溶液。


碳酸钠和碳酸氢钠的溶解度不同的原因碳酸钠(Na2CO3)和碳酸氢钠(NaHCO3)是两种常见的碱性物质,它们具有不同的化学性质和溶解度。
本文将深入探讨碳酸钠和碳酸氢钠的溶解度不同的原因,并给出一些对此的观点和理解。
1. 解释碳酸钠和碳酸氢钠的结构及其对溶解度的影响- 碳酸钠的结构:碳酸钠是由一个碳酸根离子(CO3^2-)和两个钠离子(Na+)组成。
在水中溶解时,水分子会与钠离子和碳酸根离子发生离解反应。
- 碳酸氢钠的结构:碳酸氢钠是由一个碳酸根离子和一个氢离子(H+)以及一个钠离子组成。
与碳酸钠相比,碳酸氢钠在水中的溶解度要高一些,因为它在水中会释放出更多的氢离子。
2. pH值的影响- 碳酸钠和碳酸氢钠的溶解度与水的pH值密切相关。
碳酸钠在水中的溶解度较低,部分原因是由于碱性物质的溶解度与溶液的酸碱性有关。
- 当碳酸钠溶解时,它会释放出氢氧根离子(OH-),它们与水中的氢离子结合形成水分子。
这种中和反应会减少溶解度,从而降低了碳酸钠在水中的溶解度。
3. 温度的影响- 温度也对碳酸钠和碳酸氢钠的溶解度产生影响。
通常情况下,温度升高会增加溶质溶解于溶剂中的速率。
- 对于碳酸钠,温度升高会增加其溶解度,因为碳酸钠的溶解是一个吸热过程。
随着温度的升高,碳酸钠溶解时需要的能量也增加,因此其溶解度会增加。
- 相比之下,碳酸氢钠在温度升高时,溶解度增加的速率相对较慢,因为其溶解是一个放热过程。
碳酸氢钠在水中溶解时会释放出氢离子,并产生一定的热量。
当温度升高时,放热过程会减缓其溶解度的增加。
4. 结论和观点- 碳酸钠和碳酸氢钠的溶解度不同是由于它们的化学结构和物理性质的差异所致。
- 碳酸钠在水中的溶解度较低,部分原因是由于其在溶液中形成氢氧根离子,从而降低了其溶解度。
- 温度也对碳酸钠和碳酸氢钠的溶解度产生影响,温度升高会增加碳酸钠的溶解度,但对碳酸氢钠的影响较小。
- 进一步研究碳酸钠和碳酸氢钠的溶解度可帮助深入理解它们的化学行为,并在工业和实验室应用中提供重要的参考价值。

碳酸氢钠与碳酸钠用途比较碳酸氢钠(NaHCO3)和碳酸钠(Na2CO3)是两种常见的无机化合物,它们在不同的领域有着各自特定的应用和用途。
下面我将详细比较这两种化合物的用途。
碳酸氢钠(NaHCO3)又称小苏打,是一种白色结晶固体,可溶于水。
它在许多方面都有着广泛的应用。
1. 烹饪:碳酸氢钠是一种常用的烹饪原料。
在烘焙中,它可以作为发酵剂,产生二氧化碳,使面团膨胀。
这是因为碳酸氢钠在加热时分解为二氧化碳、水和碳酸钠。
这种膨胀作用可以使面包、蛋糕等食品变得松软蓬松。
2. 药品:碳酸氢钠也被用于制备一些药品。
它可以用作胃药,中和胃酸,缓解胃痛和消化不良。
此外,它还可以用于制备含氢氧化铝的抗酸药物。
3. 清洁剂:碳酸氢钠在清洁领域也有一定的用途。
它可以作为一种天然洗涤剂,用于清洁烤箱、锅碗瓢盆等厨房器具。
此外,它还可以作为去污剂,清除一些顽固污渍。
4. 环保:碳酸氢钠可以用于处理工业废水和废气。
由于其中和酸碱的性质,可以用于调节废水和废气的PH值,减少对环境的污染。
5. 消防:碳酸氢钠可以用作灭火剂,在灭火器中常常使用。
它具有灭火迅速、不导电、不导热等特点,适用于电器火灾,油类火灾等。
与碳酸氢钠相比,碳酸钠(Na2CO3)有着不同的性质和应用。
1. 玻璃制造:碳酸钠是玻璃制造过程中的重要原料。
它可以作为玻璃成分的稳定剂,提高玻璃的抗化学侵蚀性能。
此外,碳酸钠还可以调节玻璃的折射率和抗拉强度,使玻璃更坚硬。
2. 化学工业:碳酸钠也是化学工业中常用的原料之一。
它可以用作氧化剂,在一些化学反应中起到催化剂的作用,如某些化学合成反应和焦炉煤气净化等。
3. 洗涤剂:碳酸钠是一种强碱性物质,因此它常被用于洗涤剂中。
它可以与油脂结合形成皂基,使污垢溶解并去除。
此外,碳酸钠还可以调节洗涤剂的酸碱性,提高洗涤效果。
4. 沉淀剂:碳酸钠在水处理中有着重要的应用。
它可以与水中的硬度离子结合,形成不溶于水的沉淀物,从而减少水中的硬度,防止管道和设备的结垢。
高中化学常识:碳酸钠和碳酸氢钠的鉴别高中化学常识碳酸钠和碳酸氢钠的鉴别方法如下(1)定性检验法:①.挑少量液态兴于液态制氧装置中,冷却,将导管伸进装有回应石灰水的试管中,石灰水变小混浊,表明液态就是碳酸氢钠,否则就是碳酸钠。
②.取少量固体溶解,加入氯化钙溶液,产生沉淀是碳酸钠溶液,否则是碳酸氢钠溶液。
(2)定量检验法:①.分别向等量的白色粉末中加等体积、等浓度的稀盐酸,生成气体快的是碳酸氢钠,慢的是碳酸钠。
②.分别向等量的白色粉末中加等体积适度的水,液态熔化量的多的碳酸钠,太少的就是碳酸氢钠。
7.了解fe3+的氧化性,认识fe3+和fe2+之间的相互转化(1)物理性质:亚铁盐溶液呈圆形浅绿色,铁盐溶液呈圆形黄色。
(2)化学性质:①亚铁盐的水解反应(彰显还原性)ⅰ、氯化亚铁溶液与氯气反应生成氯化铁:2fecl2+cl2=2fecl3;2fe2++cl2=2fe+3++2cl-表明:氯化铁溶液中氯化亚铁杂质的除去方法,溶液由浅绿色变为黄色,杂质转变的同时不导入崭新杂质。
ⅱ、氯化亚铁溶液在盐酸酸化的条件下通入氧气转化为氯化铁溶液4fecl2+4hcl+o2=4fecl3+2h2o;4fe2++4h++o2=4fe3++2h2o说明:氯化铁溶液中氯化亚铁杂质的除去方法,溶液由浅绿色变成黄色,杂质转化的同时不引入新杂质。
ⅲ、氯化亚铁溶液在盐酸酸化的条件下重新加入双氧水转变为氯化铁溶液2fecl2+2hcl+h2o2=2fecl3+2h2o;2fe2++2h++h2o2=2fe3++2h2o说明:氯化铁溶液中氯化亚铁杂质的除去方法,溶液由浅绿色变成黄色,杂质转化的同时不引入新杂质。
ⅳ、硝酸亚铁溶液在叶唇柱硝酸的水解下沦为硝酸铁溶液3fe(no3)2+4hno3(稀)=3fe(no3)3+no↑+2h2o;3fe2++4h++no=3fe3++no↑+2h2o表明:溶液由浅绿色变为黄色,fe2+和no在大量h+存有时无法大量并存。
鉴别碳酸钠和碳酸氢钠的实验探究在《碳酸钠和碳酸氢钠的应用》的教学中发现,可以设计以下实验方案鉴别Na2CO3和NaHCO3:方案①: 取等质量的两种固体,加水, 明显放热的是Na2CO3;方案②: 取等质量的两种固体,加水, 溶解度大的是Na2CO3;方案③:配成等物质的量浓度的两种溶液,测试其溶液的pH,pH 大的是Na2CO3;方案④:配成等物质的量浓度的两种溶液,滴加酚酞,红色明显深的是Na2CO3;方案⑤: 取固体放入试管中加热,有气体产生的是NaHCO3;方案⑥: 取固体分别加入盐酸,反应剧烈的是NaHCO3;方案⑦:取固体分别配成饱和溶液,滴加盐酸,刚开始无明显现象、继续滴加后产生气泡的是Na2CO3;方案⑧: 取固体分别配成溶液,滴加氯化钙溶液,有白色沉淀生成的是Na2CO3;方案⑨: 取固体分别配成溶液,滴加氯化钡溶液,有白色沉淀生成的是Na2CO3;方案⑩: 取固体分别配成饱和溶液,通入CO2,有白色固体析出的是Na2CO3;依据学生现有的知识,这些方案看上去均可以区别。
但笔者课后根据学生设计的实验,准确进行了一些实验,现将结果汇报如下:(室温:20℃ :水温20.5℃)【实验一】取1.0gNa2CO3固体,加5mL 水,立即振荡,Na2CO3全部溶解,水温升至27℃;取2.0g Na2CO3固体,加5mL 水,Na2CO3全部溶解,水温升至3 3 ℃;取1.0g NaHCO3固体,加5mL 水,立即振荡,静置,剩余固体覆盖试管底部,水温降至18℃;取2.0gNaHCO3固体,加5mL 水,立即振荡,静置,剩余大量固体,水温降至1 8 ℃;建议实验:分别取2.0gNa2CO3固体,加5mL 水,立即振荡,静置,固体全部溶解的是Na2CO3;剩余大量固体的是NaHCO3;固体溶解时能感到明显升温的是Na2CO3,无明显现象的是NaHCO3;【实验二】取Na2CO3、NaHCO3固体配成饱和溶液,分别测试两者溶液的pH,碳酸钠饱和溶液的pH 约为12,碳酸氢钠饱和溶液的pH 约为8。
高中化学《碳酸钠和碳酸氢钠》知识点碳酸钠和碳酸氢钠是常见的碳酸盐化合物,也是化学课程中的重要知识点。
在高中化学中,学生需要学习这两种化合物的性质、制备方法、实验室合成、反应性质等方面的知识。
下面将详细介绍碳酸钠和碳酸氢钠这两种化合物的相关知识点。
1.碳酸钠(Na2CO3),又称苏打灰或重晶石,是一种无机化合物。
它在常温常压下为无色晶体或白色颗粒。
碳酸钠的溶解度较高,易溶于水。
2.制备方法:-通过反应氢氧化钠与二氧化碳:氢氧化钠与二氧化碳反应,生成碳酸钠和水,化学方程式为:2NaOH+CO2→Na2CO3+H2O。
-通过反应二氧化碳与碳酸钙:二氧化碳和碳酸钙反应,生成碳酸钠和水,化学方程式为:CaCO3+CO2+H2O→Na2CO33.碳酸钠的性质:-在空气中,碳酸钠逐渐失去结晶水并变为碱式碳酸钠(Na2CO3·NaHCO3·xH2O),称为天然碱。
-碳酸钠可以吸湿,经过长时间的暴露,会逐渐形成碱式碳酸钠。
-碳酸钠具有碱性,可与酸反应生成相应的盐和水。
-碳酸钠可与金属离子反应,生成相应的金属碳酸盐。
-碳酸钠具有还原性,可还原氧化剂如硝酸、高锰酸钾等。
4.碳酸氢钠(NaHCO3),又称小苏打,常温下为白色结晶或粉末。
碳酸氢钠的溶解度较碳酸钠低,稍微溶于水。
5.实验室合成碳酸氢钠:-反应盐酸与碳酸钠:盐酸与碳酸钠反应,生成碳酸氢钠、氯化钠和水,化学方程式为:Na2CO3+2HCl→2NaHCO3+H2O+CO26.碳酸氢钠的性质:-碳酸氢钠具有酸性,可与碱反应生成盐和水。
-碳酸氢钠可以作为酸中和剂,用来中和酸性物质。
-碳酸氢钠可以分解产生二氧化碳和水,例如加热后分解为二氧化碳、水和碳酸钠,化学方程式为:2NaHCO3→Na2CO3+CO2+H2O。
-碳酸氢钠可以通过酸碱滴定法确定酸的浓度。
总结:高中化学中,碳酸钠和碳酸氢钠是重要的化学知识点。
学生需要学习这两种化合物的性质、制备方法、实验室合成、反应性质等方面的知识。
碳酸钠和碳酸氢钠碱性
同浓度的碳酸钠的碱性强于碳酸氢钠。
因为碳酸氢根的水解远大于电离,而碳酸氢根
的水解可以看做是碳酸根的第二步水解,因为第二步水解远小于第一步水解,所以碳酸根
第一步水解产生的oh-远多于第二步产生的,所以同浓度的碳酸钠的碱性强于碳酸氢钠。
碳酸钠碱性强
1、碳酸钠的水溶液时具碱性(ph=11.6)且存有一定的腐蚀性,碳酸氢钠就是强碱与
弱酸中和后分解成的酸式盐,溶水时呈现出弱碱性。
2、相同条件下碳酸根离子的水解能力大于碳酸氢根离子,原因是碳酸根离子水解生
成碳酸氢根离子,而碳酸氢根离子水解生成碳酸,碳酸的酸性大于碳酸氢根离子。
碳酸钠的水溶液时具碱性(ph=11.6)且存有一定的腐蚀性,能够与酸出现为丛藓科
扭口藓水解反应,也能够与一些钙盐、钡盐出现为丛藓科扭口藓水解反应。
所含结晶水的
碳酸钠存有3种:na2co3·h2o、na2co3·7h2o 和na2co3·10h2o。
碳酸氢钠是强碱与弱酸中和后生成的酸式盐,溶于水时呈现弱碱性。
此特性可使其作
为食品制作过程中的膨松剂。
碳酸氢钠在作用后会残留碳酸钠,使用过多会使成品有碱味。
其冷水做成的没搅乱的溶液,对酚酞试纸仅呈圆形微碱性反应,置放或增高温度,
其碱性减少。
25℃新鲜酿制的0.1mol/l水溶液ph值8.3。
杀虫剂,半数致死量(大鼠,
经口)mg/kg。
学习方法报社全新课标理念,优质课程资源
对比碳酸钠与碳酸氢钠
生活中有许多盐类物质正在为我们服务,我们主要了解碳酸钙、碳酸钠和碳酸氢钠的组成及其在生活中的主要用途。
例题胃酸过多可以服用下列哪种盐进行缓解()。
A.硝酸钾B.碳酸钠C.碳酸氢钠D.硫酸钠
解析胃酸主要成分是盐酸,如果过多,就需要用药物治疗。
碳酸钠易溶于水,溶于水后溶液显碱性,但碱性较强,会伤害人体。
通过实验证明碳酸氢钠水溶液也是碱性,治胃酸效果好。
硝酸钾、硫酸钠水溶液是中性,所以不能用来治疗胃酸过多。
答案选C。
变式题某兴趣小组设计实验探究碳酸钠、碳酸氢钠与盐酸反应过程中的放热、吸
热情况。
操作步骤为:①向试剂1中加入试剂2,搅拌、测温;②静置、测温;③再加入试剂3,搅拌、测温、记录。
得到了如下数据:
20.0
则下列说法中,错误的是()。
A.Na2CO3在溶于水的过程中放出热量
B.NaHCO3在溶于水的过程中吸收热量
C.其他条件相同时,碳酸氢钠溶液与盐酸混合过程中放出的热量更多
D.实验中,若同一列试剂的温度及所取的量不同,则实验结论的可信度降低
解析该题比较上面的原题难度要增大,主要是对比研究碳酸钠和碳酸氢钠与盐酸反应过程中热量的变化情况。
通过反应前后对比,Na2CO3在溶于水的过程中放出热量,而NaHCO3在溶于水的过程中吸收热量,Na2CO3与盐酸混合过程中放出的热量更多。
在进行实验的过程中,要注意控制变量。
答案选C。
拓展题制作松花蛋所用的配料主要有纯碱、生石灰、食盐、水等物质,制作时需要将它们混合并充分搅拌。
回答下列问题:
(1)写出制作过程中能发生反应的两个化学方程式。
(2)制作松花蛋的工人有的说“纯碱溶液显碱性”;有的说“纯碱溶液显中性”。
请你利用pH试纸测定纯碱溶液的pH,简述测定方法。
解析此题是碳酸钠在实际生活中的应用,以及如何测试碳酸钠水溶液的酸碱性。
生石灰与水反应生成氢氧化钙,氢氧化钙与碳酸钠反应产生碳酸钙与氢氧化钠,我们可以用PH 试纸来检验碳酸钠水溶液是碱性还是中性。
答案(1)CaO + H2O ==Ca(OH)2;Na2CO3 +Ca(OH)2==CaCO3↓+ 2NaOH。
(2)在白瓷板(或玻璃片)上放一小片pH试纸,(用玻璃棒或胶头滴管)将纯碱溶液滴到试纸上,把试纸显示的颜色与标准比色卡比较,即可得出纯碱溶液的pH。