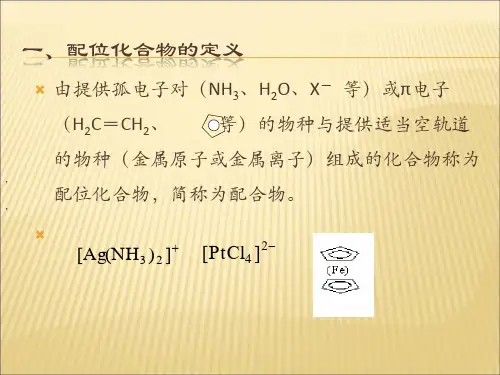
配位化合物
- 格式:doc
- 大小:133.01 KB
- 文档页数:8



什么是配位化合物?配位化合物是指由一个或多个配位体(ligand)与一个中心金属离子(或原子)通过配位键(coordination bond)结合形成的化合物。
在配位化合物中,配位体通过共用电子对与中心金属离子形成配位键,将其固定在配位体的周围形成配位球形结构。
1. 配位体:配位体是能够提供一个或多个电子对给中心金属离子的分子或离子。
配位体通常是具有孤对电子的原子或分子,包括有机分子如胺、醇和酸以及无机分子如氨、水和卤素离子等。
配位体通过配位键与中心金属离子结合,形成稳定的配位化合物。
2. 配位键:配位键是指配位体与中心金属离子之间的共用电子对。
配位键通常是通过配位体中的孤对电子与中心金属离子中的空轨道形成。
这种共用电子对的形成使得配位体与中心金属离子之间形成了较强的化学键。
配位键可以是单个配位体提供一个电子对形成的单配位键,也可以是多个配位体提供多个电子对形成的多配位键。
根据配位键的数量,配位体可以分为单齿配位体、多齿配位体和桥配位体等。
3. 配位球形结构:配位化合物中的配位体通过配位键与中心金属离子结合,形成了一个稳定的配位球形结构。
在这个结构中,中心金属离子被配位体包围,形成一个多面体的结构。
配位球形结构的形状和几何构型取决于配位体的种类和数量,以及中心金属离子的电子构型。
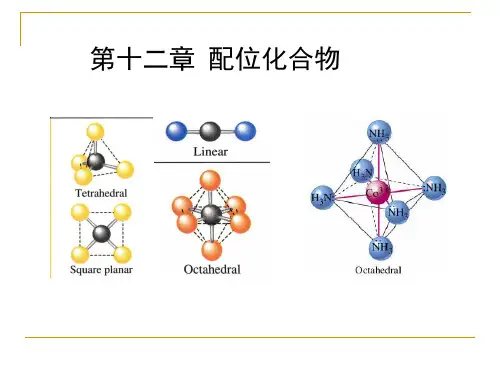
常见的配位球形结构包括八面体、四方体、正方形平面、三角双锥等。
这些不同的结构对于化合物的性质和反应有重要影响。
配位化合物具有许多特点和性质。
首先,配位化合物通常具有良好的溶解性和热稳定性,因为配位键是较强的化学键。
其次,配位化合物的颜色通常取决于中心金属离子的电子结构和配位体的取代情况。
这使得配位化合物在催化、荧光和生物活性等领域具有重要应用。
此外,配位化合物还可以通过改变配位体的种类和数量来调节其性质和功能,如选择性吸附、储能和分子识别等。
配位化合物是化学中的重要概念,对于理解过渡金属化学、配位化学和配位聚合物等领域具有重要意义。



化学中的配位化合物化合物是由不同原子通过共价或离子键相互结合形成的物质,而配位化合物则是在这个基础上引入了一个中心离子,使得周围的分子(配体)以孪晶体的方式围绕中心离子达到稳定的结构。
配位化合物的结构一般有两种,一种是具有点群对称的配位化合物,形成简单、对称的分子结构,大部分金属的情况都可以用点群的理论来解释。
另一种是非点群对称的配位化合物,由于存在不对称的原子、分子轨道、配体偏离等因素,使得其结构更为复杂。
不同种类的配位化合物均有着精细的内部结构和相关的理论研究。
以下将简单介绍一些常见的配位化合物及其特性。
1. 氨基酸配合物氨基酸是生物体中基础的分子构成单元,能通过阳离子交换、水解、还原等方式形成两性离子、金属离子配合物等,而在生命的进化过程中扮演了重要的角色。
例如,在乳酸菌中形成的结晶化氢桥纤维素(HBNC)中,氧原子上存在的羧基(O-H)和羧酸根基相连形成具有羟基和羧基的链状结构,进而与其它羟基和尿酸等形成氢键和金属离子配合物。
这些配合物有着天然的抗氧化、生物酸等很好的保健作用。
2. 金属络合物金属络合物即为金属离子与配体发生协同作用形成的化合物。
一般来说,金属离子具有可导电性、电子电离能低、主量子数较低、容易失去电子等特性,而其与配体之间的协同作用则存在着多种络合键,如项链式、夹心戒指式、四面体结构等。
这些络合物往往具有一定的生物活性、化学稳定性和物理性能特征,同时也在催化、光催化等领域为人们所利用。
例如,著名的血红蛋白就是由铁离子与血红蛋白配体组成,具有保护红细胞、传递氧气等作用。
而且通过控制金属离子的丰度、配合物的带电性等可以实现多种功能,例如合成光致消除材料、催化剂及光电转换器件等等。
3. 铁与铜络合物铁与铜被广泛应用在催化剂、生物学等领域,其化学性质与络合物的结构密切相关。
铁与铜的化合物因其含有容易发生氧化还原反应的过渡金属离子而具有很大的生物活性;而其复杂的化学结构和理论分析则常常是人们探寻其性质的难点。

化学中的配位化合物知识点配位化合物是指由一个或多个配体与一个中心金属离子或原子形成的化合物。
配位化合物在化学中具有重要的地位,广泛应用于催化剂、药物、化妆品、材料等领域。
本文将介绍配位化合物的定义、配体、配位数、结构和性质等方面的知识点。
一、定义配位化合物是由一个或多个配体与一个中心金属离子或原子通过配位键相连而形成的化合物。
配位键是指配体上的一个或多个原子通过共用电子对与中心金属离子或原子形成的化学键。
二、配体配体是指能够通过配位键与中心金属离子或原子形成化学键的化合物或离子。
配体可以是简单的阴离子、分子或配合物,常见的配体有水分子(H2O)、氨分子(NH3)、氯化物离子(Cl-)等。
三、配位数配位数是指中心金属离子或原子周围配体的个数。
配位数决定了配合物的结构和性质。
一般情况下,配位数为2或4的配合物呈平面结构,配位数为6的配合物呈八面体结构。
四、结构配位化合物的结构多样,常见的几何构型有线性、正方形、八面体等。
配合物的结构与配位数、中心金属离子的价态、配体的性质等因素有关。
五、配合物的性质配合物具有许多特殊的性质,包括颜色、磁性、溶解度等。
其中,颜色是由于配合物的电子结构所引起的。
许多过渡金属离子在配位化合物中呈现出丰富多彩的颜色。
六、常见的配位化合物1. 水合物:即配位化合物中的水分子,常见于许多金属离子的溶液中,如CuSO4·5H2O(硫酸铜五水合物);2. 氨合物:即配位化合物中的氨分子,常见于许多过渡金属离子的配合物中,如[Co(NH3)6]Cl3(六氨合三氯钴);3. 配位聚合物:由多个配位单元组成的大分子化合物,如蓝色胆矾[Cu(NH3)4][Fe(CN)6](铜铁氰合物);4. 配位聚合物:由两个或多个中心金属离子和对应的配体组成的化合物,如[Fe2(CN)6]4-(四氰合二铁)。
综上所述,配位化合物是化学中的重要概念,对于理解化学反应、催化剂、材料科学等领域具有重要意义。

高考化学常见配位化合物化学是一门研究物质组成、性质和变化的科学,而配位化学则是化学中一个重要的分支。
配位化学是研究含有金属离子或金属原子与配位基(通常是带负电的原子团或分子)相互作用形成稳定化合物的学科。
在高考化学中,配位化合物也是一个重要的考点。
本文将介绍高考化学中常见的配位化合物。
1. [Fe(CN)6]4-:这是高考中常见的一个配位化合物。
它的结构为八面体形,铁离子(Fe2+)与六个氰根离子(CN-)配位形成。
该化合物稳定性很高,可以用作铁的标准溶液,也用于分析化学和生物化学实验中。
2. [Cu(NH3)4]2+:这是另一个高考中常见的配位化合物。
它的结构为正方形平面形,铜离子(Cu2+)与四个氨分子配位形成。
该化合物常用于铜盐的检测和分离,同时也可用来制备其他铜配合物。
3. [Ag(NH3)2]+:这个化合物是银阳离子与两个氨分子配位形成,它在高考化学实验中常用来检测和分析卤素离子(如氯离子、溴离子等)。
4. [Co(NH3)6]3+:这是一个典型的八面体配合物,其中钴离子(Co3+)与六个氨分子配位形成。
该化合物常用于有机合成中的氧化反应,同时也是高考中的重要考点。
5. [Ni(CO)4]:这是一个重要的四面体配合物,在其中镍离子(Ni2+)与四个一氧化碳配位形成。
该化合物是重要的工业催化剂,常用于有机合成反应中。
6. [PtCl2(NH3)2]:这是一个常见的方阵配合物,在其中铂离子(Pt2+)与两个氯离子(Cl-)和两个氨分子配位形成。
该化合物具有良好的溶解性,广泛用于医学和生物化学领域。
这些配位化合物是高考化学中常见的,理解它们的性质和应用对于高考化学的学习和应试非常重要。
除了上述提到的化合物,还有许多其他的配位化合物在高考中也有可能出现。
在学习高考化学时,要注重对配位化合物的分子结构、性质和配位基的影响等方面的理解。
此外,还需要掌握相关的实验操作和分析方法,以便在实际操作中可以正确使用配位化合物。

配位化合物一、配位化合物的定义往CuSO4的稀溶液滴加6mol/L的氨水不断振摇,开始时有天蓝色Cu(OH)2沉淀,继续再加氨水时,沉淀消失。
在溶液中检查不到Cu2+却只能检测到SO42-,推测生成了一种新物质,用酒精沉淀,再经结构分析:该物质为[Cu(NH3)4]SO4·H2O。
物质[Ag(NH2)]NO3,K2[HgI4]……,在水溶液中形成离子[Cu(NH3)4]2+,[Ag(NH2)]+,[HgI4]2-。
金属离子(或原子)与一定数目的中性分子或负离子结合成不易离解的复杂离子称为配离子。
含有配离子及配位分子的化合物统称为配合物。
配合物与复盐如明矾[KAl(SO4)2]12H2O不一样,不能相混。
二、配合物的组成以[Cu(NH3)4] SO4为例其组成可表示配位离子1.中心原子:一般为金属阳离子(原子),特别是过渡金属离子,Fe、Co、Ni、Cu、Ag、Au等。
2.配体:中心原子周围的分子或离子(可以是阴离子,也可以是中性分子)。
3.配位原子:配体中能向中心原子提供孤对电子的原子如NH3中的N原子,H2O中的O原子,CN-中的C原子,以N、P、O、S、C等原子居多。
配体又分:4.配位数:直接与中心原子相结合的配位原子总数。
以2、4、6较为多见。
在[Pt(en)2]Cl其配位数为4。
5.配离子电荷:中心原子和配位体电荷的代数和。
如[Cu(NH3)4]2+、[Fe(CN)6]4-。
三、配位化合物的类型1.简单配位化合物单齿配位体与单个中心离子(或原子)所形成的配合物K2[PtCl6][Fe(H2O)6]Cl5[Cr(H2O)6]Cl3Na[AlF6]2.螯合物由中心离子和多齿配体结合而成的环状配合物。
思考题:在制剂中作为金属离子络合剂使用的是A.NaHCO3B.NaClC.焦亚硫酸钠D.NaOHE.依地酸二钠【正确答案】E四、配位平衡Ks(K稳)称为配离子的稳定常数,Ks越大,说明生成配离子的倾向越大,配合物越稳定。
配位化合物的性质与金属离子的配位方式配位化合物是指由一个或多个配体与一个中心金属离子通过配位键形成的化合物。
在配位化合物中,金属离子作为中心原子与配体形成配位键,其性质与配位方式对于化学反应和性质具有重要影响。
一、配位化合物的性质1. 物理性质配位化合物的物理性质受到中心金属离子的电子结构和配体的性质的影响。
例如,大部分配位化合物呈现高度的溶解度,且通常呈现比配体或金属离子更高的熔点和沸点。
此外,配位化合物还表现出一些特殊的磁性和光学性质,如双光性和荧光。
2. 化学性质配位化合物的化学性质不仅由中心金属离子的电子结构和配体的性质决定,还与配位键的稳定性有关。
配位键的稳定性受到配体的配位能力和配位键的性质影响,例如配体中的氧,氮等原子对金属离子形成的配位键通常较为稳定。
配位化合物的化学性质包括溶解度、酸碱性、氧化还原性等。
二、金属离子的配位方式金属离子在配位化合物中的配位方式可以分为几种常见的类型。
1. 八面体配位八面体配位是指金属离子被六个配体环绕形成的配位方式。
在八面体配位中,金属离子位于八个配位位点的正中心,配体平面呈八面体形状。
八面体配位常见于d8、d9和高自旋d6离子。
2. 四方配位四方配位是指金属离子被四个配体包围形成的配位方式。
四方配位中,金属离子位于四个配位位点的正中心,配体平面呈正方形。
四方配位常见于d8、d9离子。
3. 正方配位正方配位是指金属离子被四个配体分别位于配位位点的四个角上形成的配位方式。
正方配位中,金属离子位于四个配位位点的正中心,配体呈正方形排列。
正方配位常见于d9和低自旋d7离子。
4. 正六配位正六配位是指金属离子被六个配体包围形成的配位方式。
正六配位中,金属离子位于六个配位位点的正中心,配体平面呈六边形。
正六配位常见于d10和低自旋d8离子。
5. 六位配位六位配位是指金属离子被四个配体分别位于配位位点的四个角上以及两个配体分别位于正方形上下两个面中心形成的配位方式。
配位化合物配位化合物(coordination compound)定义简称配合物,为一类具有特征化学结构的化合物,由中心原子或离子(统称中心原子)和围绕它的称为配位体(简称配体)的分子或离子,完全或部分由配位键结合形成。
组成配合物由中心原子、配位体和外界组成,例如硫酸四氨合铜(Ⅱ)分子式为〔C u(NH3)4〕SO4,其中Cu2+是中心原子,NH3是配位体,SO4 2-是外界。
中心原子可以是带电的离子,如〔Cu(NH3)4〕SO4中的Cu2+,也可以是中性的原子,如四羰基镍〔Ni(CO)4〕中的Ni。
周期表中所有的金属元素都可作为中心原子,但以过渡金属最易形成配合物。
配位体可以是中性分子,如〔Cu(NH3)4〕SO4中的NH3,也可以是带电的离子,如亚铁氰化钾K4〔Fe(CN)6〕中的CN-。
与中心原子相结合的配位体的总个数称为配位数,例如K4〔Fe(CN)6〕中Fe2+的配位数是6 。
中心原子和配位体共同组成配位本体(又称内界),在配合物的分子式中,配位本体被括在方括弧内,如〔Cu(NH3)4〕SO4中,〔Cu(NH3)4〕2+就是配位本体。
它可以是中性分子,如〔Ni(CO)4〕;可以是阳离子,如[Cu(NH3)4〕2+ ;也可以是阴离子,如〔Fe(CN)6〕4-。
带电荷的配位本体称为配离子。
命名方法①命名配离子时,配位体的名称放在前,中心原子名称放在后。
②配位体和中心原子的名称之间用“合”字相连。
③中心原子为离子者,在金属离子的名称之后附加带圆括号的罗马数字,以表示离子的价态。
④配位数用中文数字在配位体名称之前。
⑤如果配合物中有多种配位体,则它们的排列次序为:阴离子配位体在前,中性分子配位体在后;无机配位体在前,有机配位体在后。
不同配位体的名称之间还要用中圆点分开。
根据以上规则,〔Cu(NH3)4〕SO4称硫酸四氨合铜(Ⅱ),〔Pt(NH3)2Cl2〕称二氯·二氨合铂(Ⅱ),K〔PtCl3(C2H4)〕称三氯·(乙烯)合铂(Ⅱ)酸钾。
配位化合物名词解释
配位化合物是一种金属与分子或原子间的稳定化合物,它们之间形成
复杂的化学键。
它们经常用作催化剂、抗生素、药物,以及工业催化
剂和电子装置。
1. 钴卟啉配位化合物:钴卟啉配位化合物是一种以钴为核心,同时有
四个卟啉分子构成的配位化合物。
它有着类似碳酸钴的结构,但它的
化学结构更加复杂。
它可以用作催化剂,可以加速苯酚的氧化。
它也
可以作为杀菌剂,可以对对霉菌和细菌有效抑制作用。
2. 氨基酸配位化合物:氨基酸配位化合物是金属和氨基酸结合的复杂
化合物,它通常把金属离子和氨基酸结合起来。
它们结构相似于金属键,并作为金属离子复合物的组成部分。
它们有助于金属离子在生物
体内被正确转移或保存,并参与金属离子催化酶(MEC)活性化。
3. 螺环配位化合物:螺环配位化合物是一种利用配位作用将金属和硫
衍生物配位成复杂结构的化合物。
它有以下特点:它具有超依赖性。
它高度稳定,不容易分解。
配位化合物具有独特的电磁性现象,这对材
料的性质有着重要作用。
螺环配位化合物常用于组装和检测生物物质,也可以用作药物作用的基础,能有效降低药物作用效率。
4. 氯酞配位化合物:氯酞配位化合物是氯酞分子和金属离子结合形成
的复合物。
它们结构类似磷酸盐,金属离子与氯酞分子的结合被称为配位作用。
氯酞配位化合物的性质类似于碳酸盐,它可以起到自组装作用,形成多孔和结构优美的复合材料,这些材料可以用于储存、催化剂和量子传输设备。
此外,它还可以用于光学传感器、磁性材料和绝缘材料等。
第十章配位化合物1.无水CrCl3和氨作用能形成两种配合物,组成相当于CrCl3•6NH3及CrCl3•5NH3。
加入AgNO3溶液能从第一种配合物水溶液中几乎所有的氯沉淀为AgCl,而从第二种配合物水溶液中仅能沉淀出相当于组成中含氯量2/3的AgCl,加入NaOH并加热时两种溶液都无NH3味。
试从配合物的形式推算出它们的内界和外界,并指出配离子的电荷数、中心离子的氧化数和配合物的名称。
答:第一种:[Cr(NH3)6]Cl3离子的电荷数3+:即[Cr(NH3)6]3+,Cr(Ⅲ),三氯化六氨合铬(Ⅲ)。
第二种:[CrCl(NH3)5]2+ , Cr(Ⅲ) , 二氯化一氯•五氨合铬(Ⅲ)。
2.命名下列配合物,并指出中心离子及氧化数,配位体及配位数。
(1)[Co(NH3)6]Cl2 (2)K2[PtCl6] (3)Na2[SiF6](4)[CoCl(NH3)5]Cl2(5)[Co(en)3]Cl3(6)[CoCl(NO2)(NH3)4]+答:命名中心离子氧化数配位体配位数(1)二氯化六氨合钴(Ⅱ) +2 NH3 6(2)六氯合铂(Ⅳ)酸钾+4 Cl- 6(3)六氟合硅(Ⅳ)酸钠+4 F- 6(4)二氯化一氯•五氨合钴(Ⅲ) +3 Cl- , NH3 6(5)三氯化三(乙二胺)合钴(Ⅲ) +3 En 6+3 Cl- , NO2- , NH3 6 (6)一氯•一硝基•四氨合钴(Ⅲ)配离子3.写出下列配合物的化学式(1)二硫代硫酸合银(Ⅰ)酸钠(2)三硝基三氨合钴(Ⅲ)(3)氯化二氯三氨一水合钴(Ⅲ)(4)二氯二羟基二氨合铂(Ⅳ)(5)硫酸一氯一氨二(乙二胺)合铬(Ⅲ)(6)二氯一草酸根一(乙二胺)合铁(Ⅲ)离子答:(1) Na3[Ag(S2O3)2] (2) [Co (NO2)3(NH3)3] (3) [CoCl2 (NH3)3(HO2)]Cl(4) [PtCl2(NH3)2(OH)2] (5) [CrCl(NH3)(en)2]SO4(6) [FeCl2(C2O4)(en)]-4.根据价键理论指出下列配离子的成键情况和空间构型(1) [Fe(CN)6]3-(2) [FeF6]3-(3) [CrCl(H2O)5]2+(4) [Ni(CN)4]2-答:(1)d2sp3杂化轨道成键,八面体。
(2)sp3d2杂化轨道成键,八面体。
(3)sp3d2杂化轨道成键,八面体。
(4)dsp2杂化轨道成键,平面正方形。
5.根据实验测得的有效磁矩,试确定下列配合物是内轨型或外轨型,说明理由,并以它们的电子层结构表示之(1)[Mn(SCN)6]4-μ=6.1 B.M. (2)[Mn(CN)6]4-μ=1.8 B.M.(3)[Co (NO2)6]3-μ=0 B.M. (4)[Co (SCN)4]2-μ=4.3 B.M.(5)K3[FeF6] μ=5.9 B.M. (6)K3[Fe(CN)6] μ=2.3 B.M.答:(1)有五个成单电子,外轨型配合物。
[Mn(SCN)6]4-3d54s 4p 4d↑↑↑↑↑sp3d2杂化成键(2)有一个成单电子,内轨型配合物[Mn(CN)6]4-3d 4s 4p↿⇂↿⇂↑d2sp3杂化成键(3)无成单电子,内轨型配合物。
[Co (NO2)6]3-3d 4s 4p↿⇂↿⇂↿⇂d2sp3杂化成键(4)有三个成单电子,外轨型配合物。
[Co (SCN)4]2-3d 4s 4p 4d↿⇂↿⇂↑↑↑sp3d2杂化成键(5)有五个成单电子,外轨型配合物。
K3[FeF6] 3d54s 4p 4d↑↑↑↑↑sp3d2杂化成键(6)有一个成单电子,内轨型配合物。
K3[Fe(CN)6] 3d 4s 4p↿⇂↿⇂↑d2sp3杂化成键6.已知一些铂金属配合物,如cis―PtCl4(NH3)2、cis―PtCl2(NH3)2和cis―PtCl2(en)可以作为活性抗癌剂(所有反式异构体均无抗癌活性),实验测得它们都是逆磁性物质。
试用价键理论画出这些配合物的杂化轨道图,它们是内轨型还是外轨型配合物?各采用哪种类型的杂化轨道成键?答:铂Pt 5d96s1Pt4+5d6cis―PtCl4(NH3)25d 6s 6p↿⇂↿⇂d2sp3杂化成键无成单电子,逆磁性,内轨型配合物。
cis―PtCl2(NH3)2和cis―PtCl2(en)Pt2+5d86s 6p↿⇂↿⇂↿⇂↿⇂dsp2杂化成键,无成单电子,逆磁性,内轨型配合物。
7.已知[PtCl4]2-为平面正方形结构,[HgI4]2-为四面体结构,画出它们的电子分布情况并指出它们采用哪种杂化轨道成键?答:[PtCl4]2-dsp2杂化成键5d86s 6p↿⇂↿⇂↿⇂↿⇂内轨型配合物[HgI4]2-sp3杂化成键5d106s 6p↿⇂↿⇂↿⇂↿⇂↿⇂外轨型配合物8.晶体场理论的基本要点是什么?它比价键理论有何优点?答:晶体场理论的基本要点:(1)晶体场理论认为,在配合物中,中心离子一般是带正电荷的金属离子,配位体往往是阴离子或极性分子,它们之间的相互作用可以被看作离子晶体中正、负离子间的相互作用,中心离子和配位体之间由于静电吸引而放出能量,使体系能量降低。
(2)过渡金属中心离子5个简并d轨道受到周围非球形对称的配体负电场的作用时,配体负电荷与d轨道上的电子的相互排斥,不仅使得各轨道电子能量普遍升高,而且不同d轨道的电子因受到影响不同,各轨道能量升高值不同,从而导致d轨道能级分裂。
(3)由于d轨道能级分裂,使d电子重新排布。
d电子从未分裂前的d轨道进入到分裂后的d轨道,引起体系总能量降低,它给配合物带来了额外的稳定性。
晶体场理论克服了价键理论的缺点,它不仅考虑到中心离子与配位体之间的静电效应,而且还考虑到它们之间的共价性质,它较好的解释了配合物的磁性,也较好地解释了可见光谱和紫外光谱,在一定程度上也能定量解释配合物的稳定性。
9.用晶体场理论说明为什么八面体配离子[CoF6]3-是高自旋的?而[Co(NH3)6]3+是低自旋的?并判断它们的稳定性大小?答:正八面体晶体场理论:[CoF6]3-(高自旋)↑↑ d r↿⇂↑↑↑↑(F-弱场,高自旋)↿⇂↑↑ dεCFSE = (-4) x 4 +(+6) x 2 = -4Dq正八面体晶体场理论:[Co(NH3)6]3+(低自旋)d r↿⇂↑↑↑↑(NH3强场,低自旋)↿⇂↿⇂↿⇂ dεCFSE = (-4) x 6 = -24Dq从CFSE的计算可知,[Co(NH3)6]3+比[CoF6]3-稳定。
10.实验测得[Co(NH3)6]3+配离子是逆磁性的,问:(1)它的空间构型是什么?根据价键理论Co 3+离子采用什么样的杂化轨道与配位体NH 3分子形成配位健?(2)根据晶体场理论绘出此配离子两种可能的d 电子构型,表明它们的高低自旋和磁性情况,对此配离子哪种情况是正确的?(3)当[Co(NH 3)6]3+被还原为[Co(NH 3)6]2+时,磁矩约为4~5玻尔磁子,绘出其可能的d 电子构型,说明它们的磁性情况。
答:(1) Co 3+ 3d 6 4s 4p[Co(NH 3)6]3+ ↿⇂ ↿⇂ d 2sp 3 杂化成键(2) Co 3+↑ ↑ d rd 6 ↿⇂ ↑ ↑ ↑ ↑ ( 弱场,高自旋)↿⇂ ↑ ↑ d εd r↿⇂ ↑ ↑ ↑ ↑ ( 强场,低自旋)↿⇂ ↿⇂ ↿⇂ d ε因为NH 3是强场配体,属低自旋配合物,μ=0 ,是逆磁性的。
(3) Co 2+ 3d 7 4s 4p 4d[Co(NH 3)6]2+ ↿⇂ ↿⇂ ↑ ↑ ↑sp 3d 2杂化成键带有三个未成对电子,具有顺磁性的八面体配离子。
11.已经测知水溶液中的Co(Ⅱ)形成一种带有三个未成对电子,具有顺磁性的八面体配离子。
下面哪一种说法与上述结论一致,并说明理由。
(1)[Co(H 2O)6]2+的晶体场分裂能(Δ)大于电子成对能(P )(2)d 轨道分裂后,电子填充情况是25γεd d (3)d轨道分裂后,电子填充情况是16γεd d 答:(2)与上述结论一致。
Co 2+ d 7 ↑ ↑ d r↿⇂ ↿⇂ ↑ ↑↿⇂ ↿⇂ ↑ d ε只有这样才能形成带有三个未成对电子,具有顺磁性八面体配离子。
12. Cr 3+ 、Cr 2+、Mn 2+、Fe 2+离子在八面体强场和八面体弱场中各有多少未成对电子,绘图说明εd 和γd 轨道的电子数目。
答: Cr 3+ d r d 3 ↑ ↑ ↑ Δ0 < P 弱场↑ ↑ ↑ d εd r↑ ↑ ↑ Δ0 > P 强场↑ ↑ ↑ d ε均为三个未成对电子,d 3只有一种排布。
Cr 2+ ↑ d rd 4 ↑ ↑ ↑ ↑ 弱场,四个成单电子↑ ↑ ↑ d εdr ↑ ↑ ↑ ↑ 强场,两个成单电子↿⇂ ↑ ↑ d εMn 2+ ↑ ↑ d rd 5 ↑ ↑ ↑ ↑ ↑ 五个成单电子↑ ↑ ↑ d εd r ↑ ↑ ↑ ↑↑ 一个成单电子↿⇂ ↿⇂ ↑ d εFe 2+ ↑ ↑ d rd 6 ↿⇂ ↑ ↑ ↑ ↑ 四个成单电子↿⇂ ↑ ↑ d εd r↿⇂ ↑ ↑ ↑ 无成单电子↿⇂ ↿⇂ ↿⇂ d ε13.已知[AlF 6]3-的逐级稳定常数的对数值分别为6.13、5.02、3.85、2.74、1.63和0.47,试求它的K 稳和K 不稳。
答:84.1947.063.174.285.302.513.6lg =+++++=稳K∴ 19][1092.636⨯=-AlF K 稳, 20191045.11092.611-⨯=⨯==稳不稳K K 14.预测下列各组所形成的两组配离子之间的稳定性大小,并简要说明理由:(1)Al 3+ 与F - 或Cl - 配合 (2)Pd 2+ 与RSH 或ROH 配合(3)Cu 2+ 与NH 2CH 2COOH 或CH 3COOH 配合答:(1)都是“硬亲硬”形成的配离子,且F -比Cl - 的半径更小,所以[AlF 6]3-稳定性大于[AlCl 6]3-。
(2)[Pd(RSH)4]2+稳定性大于[Pd(ROH)4]2+ ,因为电负性 硫< 氧之故,R 易送电子对。
(3)Cu 2+与NH 2CH 2COOH 形成的配合物比Cu 2+与CH 3COOH 形成的配合物稳定。
因前者形成的是螯合物。
15.指出在下列化合物中,哪些可能作为有效的螯合剂。
(1)H 2O (2)过氧化氢HO ―OH(3)H 2N ―CH 2―CH 2―CH 2―NH 2 (4)(CH 3)2N ―NH 2答:只有(3)才能作为有效的螯合剂,只有乙二胺才能形成环状螯合物,其它的不能形成五元环。
16.0.10mol •L -1 AgNO 3溶液50ml ,加入相对密度为0.932含NH 3 18.24%的氨水30ml 后,加水稀释至100ml ,求此溶液中[Ag +] 、[Ag(NH 3)2+] 和[NH 3] ?(已知 [Ag(NH 3)2] + K 稳= 1.7 x 107)答: Ag + + 2NH 3 ⇌ [Ag(NH 3)2] +开始(mol •L -1)100501.0⨯= 0.05 1001730%24.18932.01000⨯⨯⨯⨯= 3.0 平衡(mol •L -1) x 3.0- 0.05 x 2=2.9 0.05 – x ≈0.05722323107.1)9.2(05.0]][[])([⨯===++x NH Ag NH Ag K 稳 x = [Ag +] = 3.5 x 10-10 (mol •L -1) [Ag(NH 3)2+] = 0.05 (mol •L -1) [NH 3] = 2.9 (mol •L -1)17.计算含有0.10mol •L -1 CuSO 4和1.8mol •L -1氨水溶液中,Cu 2+离子浓度?([Cu(NH 3)4]2+ K 不稳= 5 x 10-16)答: [Cu(NH 3)4]2+ ⇌ Cu 2+ + 4NH 3开始(mol •L -1) 0.10 1.8 - 4 x 0.10 = 1.4平衡(mol •L -1) 0.1 – x ≈ 0.1 x 1.4 + 4x ≈1.416424343210510.0)4.1(])([]][[-++⨯===x NH Cu NH Cu K 不稳 x = [Cu 2+] = 1.30 x 10-17 (mol •L -1) 18.计算AgBr 在1.0 mol •L -1 Na 2S 2O 3溶液中的溶解度(mol •L -1),500ml 浓度为1.0 mol •L -1的Na 2S 2O 3 溶液可溶解AgBr 多少克?([Ag(S 2O 3)2]3- K 稳= 1.6 x 1013 AgBr K sp = 7.7 x 10-13)答: AgBr + 2S 2O 32- ⇌ [Ag(S 2O 3)2] 3- + Br -平衡 1.0 – 2 x x x32.12106.1107.7][][][]][)([131322323232=⨯⨯⨯=⋅=⋅=-++---稳K K Ag Ag O S Br O S Ag K sp 32.12)20.1(22=-x x x = 0.44 (mol •L -1) ∴ 溶解AgBr 为:0.44 x 188 x 0.5 = 41.36 (g)19.在0.06 mol •L -1 AgNO 3溶液中加入NH 3至生成[Ag(NH 3)2] +达到平衡,在此溶液中加入NaCl (忽略体积变化)使Cl -离子浓度为0.01 mol •L -1,欲阻止AgCl 沉淀生成,NH 3的最初浓度至少为多少?(已知[Ag(NH 3)2] + K 稳= 1.7 x 107, AgCl K sp = 1.56 x 10-10 )答: AgCl + 2NH 3 ⇌ [Ag(NH 3)2] + + Cl -371023231065.2107.11056.1][][][]][)([--++-+⨯=⨯⨯⨯=⋅=⋅=稳K K Ag Ag NH Cl NH Ag K sp 3231065.2][01.006.0-⨯=⨯NH [NH 3] 平衡 = 0.48 (mol •L -1) [NH 3] 最低 = 0.48 + 0.06 x 2 = 0.60 (mol •L -1)20.计算[Ag(NH 3)2] + + e ⇌ Ag + 2NH 3 体系的标准电极电势。