高中化学-可逆反应达到平衡状态的标志及判断(人教版精编讲义+习题)
- 格式:pdf
- 大小:227.35 KB
- 文档页数:9


高中化学可逆反应达到平衡状态的标志及判断在一定条件下的可逆反应里,当正反应速率与逆反应速率相等时,反应物和生成物的物质的量浓度不再发生改变的状态,叫化学平衡状态。
其特点有:(1)“逆”:化学平衡研究的对象是可逆反应。
(2)“等”:化学平衡的实质是正、逆反应速率相等,即:v(正)=v(逆)。
(3)“动”:v(正)=v(逆)≠0(4)“定”:平衡体系中,各组分的浓度、质量分数及体积分数保持一定(但不一定相等),不随时间的变化而变化。
(5)“变”:化学平衡是在一定条件下的平衡,若外界条件改变,化学平衡可能会分数移动。
(6)“同”:在外界条件不变的前提下,可逆反应不论采取何种途径,即不论由正反应开始还是由逆反应开始,最后所处的平衡状态是相同的,即同一平衡状态。
可逆反应达到平衡状态的标志及判断方法如下:以mA(g)+nB(g)pC(g)+qD(g)为例:一、直接标志:①速率关系:正反应速率与逆反应速率相等,即:A消耗速率与A的生成速率相等,A消耗速率与C的消耗速率之比等于m:p;②反应体系中各物质的百分含量保持不变。
二、间接标志:①混合气体的总压强、总体积、总物质的量不随时间的改变而改变(m+n≠p+q);②各物质的浓度、物质的量不随时间的改变而改变;③各气体的体积、各气体的分压不随时间的改变而改变。
对于密闭容器中的可逆反应:mA(g)+nB(g)pC(g)+qD(g)是否达到平衡还可以归纳如下表:【例题1】可逆反应:2NO2(g)2NO(g)+O2(g),在体积固定的密闭容器中,达到平衡状态的标志是①单位时间内生成nmolO2的同时生成2nmolNO2②单位时间内生成nmolO2的同时生成2nmolNO③用NO2、NO、O2表示的反应速率的比为2:2:1的状态④混合气体的颜色不再改变的状态⑤混合气体的密度不再改变的状态⑥混合气体的压强不再改变的状态⑦混合气体的平均相对分子质量不再改变的状态A.①④⑥⑦B.②③⑤⑦C.①③④⑤D.全部解析:①单位时间内生成nmolO2必消耗2nmolNO2,而生成2nmolNO2时,必消耗nmolO2,能说明反应达到平衡;②不能说明;③中无论达到平衡与否,化学反应速率都等于化学计量系数之比;④有颜色的气体颜色不变,则表示物质的浓度不再变化,说明反应已达到平衡;⑤体积固定,气体质量反应前后守恒,密度始终不变;⑥反应前后△V≠0,压强不变,意味着各物质的含量不再变化;⑦由于气体的质量不变,气体的平均相对分子质量不变时,说明气体中各物质的量不变,该反应△V≠0,能说明该反应达到平衡。

化学平衡状态标志的判断方法及习题化学平衡状态判断方法及其题最新考纲要求:化学平衡状态的判断及比较。
化学平衡状态1.研究对象:可逆反应中反应混合物中各组分的质量分数状态。
2.化学平衡的特征:动态平衡,正逆反应速率相等,各物质含量保持不变,条件改变平衡移动。
3.平衡状态的标志:1) 速率关系(本质特征):同一种物质:生成速率等于消耗速率。
不同的物质:速率之比等于方程式中各物质的计量数之比,但必须是不同方向的速率。
(等价反向)2) 各成分含量保持不变(宏观标志):各组成成分的质量、物质的量、分子数、体积(气体)、物质的量浓度均保持不变。
各组成成分的质量分数、物质的量分数、气体的体积分数均保持不变。
若反应前后的物质都是气体,且总体积不等,则气体的总物质的量、总压强(恒温、恒容)、平均摩尔质量、混合气体的密度(恒温、恒压)均保持不变。
反应物的转化率、产物的产率保持不变。
化学平衡状态的判断例如反应mA(g)+nB(g)↔pC(g)+qD(g),平衡是否建立?1.混合物体系:各物质的物质的量或各物质的物质的量分数一定是中各成分的,各物质的质量或各物质的质量分数一定是含量,各气体的体积或体积分数一定是。
2.正、逆反应:在单位时间内消耗了mmolA同时生成mmolA是速率的关系。
在单位时间内消耗了nmolB同时生成pmolC否。
在单位时间内生成了nmolB,同时消耗qmolD否。
3.压强:m+n≠p+q时,总压强一定(其他条件一定)。
m+n=p+q时,总压强一定(其他条件一定)。
4.混合气的Mr一定时,只有当m+n≠p+q时,是Mr;当Mr一定,但m+n=p+q时,否。
5.温度在其他条件不变的条件下,体系温度一定时是体系的密度密度一定否。
变”到“不变”是平衡过程中量“变”的过程,到达平衡后则“不变”,这是升华的过程。
巩固练】1.在恒温下的密闭中,有可逆反应2NO(g)+O2(g)↔2NO2(g);ΔH<0,不能说明已达到平衡状态的是:A。

可逆反应达到平衡状态的标志及判断在一定条件下的可逆反应里,当正反应速率与逆反应速率相等时,反应物和生成物的物质的量浓度不再发生改变的状态,叫化学平衡状态。
其特点有:(1)“逆”:化学平衡研究的对象是可逆反应。
(2)“等”:化学平衡的实质是正、逆反应速率相等,即:v(正) =v(逆)。
(3)“动”:v(正) =v(逆) ≠0(4)“定”:平衡体系中,各组分的浓度、质量分数及体积分数保持一定(但不一定相等),不随时间的变化而变化。
(5)“变”:化学平衡是在一定条件下的平衡,若外界条件改变,化学平衡可能会分数移动。
(6)“同”:在外界条件不变的前提下,可逆反应不论采取何种途径,即不论由正反应开始还是由逆反应开始,最后所处的平衡状态是相同的,即同一平衡状态。
可逆反应达到平衡状态的标志及判断方法如下:以m A(g) + n B(g) p C(g)+ q D(g)为例:一、直接标志:①速率关系:正反应速率与逆反应速率相等,即:A消耗速率与A的生成速率相等,A消耗速率与C的消耗速率之比等于m : p;②反应体系中各物质的百分含量保持不变。
二、间接标志:①混合气体的总压强、总体积、总物质的量不随时间的改变而改变(m+ n≠p + q);②各物质的浓度、物质的量不随时间的改变而改变;③各气体的体积、各气体的分压不随时间的改变而改变。
对于密闭容器中的可逆反应:m A(g) + n B(g) p C(g)+ q D(g)是否达到平衡还可以归纳如下表:化学反应m A(g) + n B(g) p C(g)+ q D(g) 是否平衡混合物体系①各物质的物质的量或物质的质量分数一定平衡中各成分的含量②各物质的质量或质量分数一定平衡③各气体的体积或体积分数一定平衡④总体积、总压强、总物质的量一定不一定平衡正、逆反应速率之间的关系①在单位时间内消耗了m mol A,同时也生成了m molA,即v(正) = v(逆)平衡②在单位时间内消耗了n mol B,同时也消耗了p molC,即v(正) =v(逆)平衡③v(A) : v(B) : v(C) : v(D) =m : n : p : q,v(正) 不一定等于v(逆)不一定平衡④在单位时间内生成了n mol B,同时也消耗了q molD,即叙述的都是v(逆)不一定平衡压强①其它条件一定、总压强一定,且m + n≠p + q平衡②其它条件一定、总压强一定,且m + n=p + q不一定平衡混合气体的平均相对分子质量①平均相对分子质量一定,且m + n≠p + q平衡②平均相对分子质量一定,且m + n=p + q不一定平衡温度任何化学反应都伴随着能量变化,当体系温度一定时平衡气体的密度密度一定不一定平衡颜色反应体系内有色物质的颜色稳定不变平衡三、例题分析:【例题1】可逆反应:2NO2(g) 2NO(g) + O2(g),在体积固定的密闭容器中,达到平衡状态的标志是①单位时间内生成n mol O2的同时生成2n mol NO2②单位时间内生成n mol O2的同时生成2n mol NO③用NO2、NO、O2表示的反应速率的比为2 : 2 : 1的状态④混合气体的颜色不再改变的状态⑤混合气体的密度不再改变的状态⑥混合气体的压强不再改变的状态⑦混合气体的平均相对分子质量不再改变的状态A. ①④⑥⑦B. ②③⑤⑦C. ①③④⑤D. 全部解析:①单位时间内生成n mol O2必消耗2n mol NO2,而生成2n mol NO2时,必消耗n mol O2,能说明反应达到平衡;②不能说明;③中无论达到平衡与否,化学反应速率都等于化学计量系数之比;④有颜色的气体颜色不变,则表示物质的浓度不再变化,说明反应已达到平衡;⑤体积固定,气体质量反应前后守恒,密度始终不变;⑥反应前后△V ≠ 0,压强不变,意味着各物质的含量不再变化;⑦由于气体的质量不变,气体的平均相对分子质量不变时,说明气体中各物质的量不变,该反应△V ≠ 0,能说明该反应达到平衡。


判断化学反应达到平衡状态的标志1、任何情况下均可作为标志的:(1)v正=v逆(同一种物质)(2)各组分含量(百分含量、物质的量、质量)不随时间变化(3)某反应物的消耗(生成)速率:某生成物的消耗(生成)速率=化学计量数之比2、在一定条件下可作为标志的:(1)对于有色物质参加或生成的可逆反应体系,颜色不再变化。
(2)对于有气态物质参加或生成的可逆反应体系,若反应前后气体的物质的量变化不为0,则混合气体平均相对分子质量M和反应总压P不变(恒温恒容)。
(3)对于恒容绝热体系,体系的温度不再变化。
3、不能作为判断标志的:(1)各物质的物质的量或浓度变化或反应速率之比=化学计量数之比(任何情况下均适用)(2)对于全气体的反应,若反应前后气体的体积无变化,则混合气体平均相对分子质量M和反应总压P不变(恒温恒容)。
[例题与解析]例1、下列方法中可以证明2HI(g)=H2(g)+I2(g)已达平衡状态的是()①单位时间内生成n mol H2的同时生成n mol HI②一个H—H键断裂的同时有两个H—I键断裂③百分组成HI%=I2%④反应速率v (H2)=v (I2)=0.5 v (HI)时⑤C (HI)=C (H2)=C (I2)=2∶1∶1⑥温度和体积一定时,某一生成物浓度不再变化⑦温度和体积一定时,容器内压强不再变化⑧条件一定,混合气体的平均相对分子质量不再变化⑨温度和体积一定时混合气体的颜色不再变化⑩温度和压强一定时混合气体密度不再变化分析:这是一个反应前后气体体积没有变化的反应①表示不同方向的反应,但生成H2与生成HI的物质的量之比应等相应化学计量数之比;②表示不同方向的反应且等于化学计量数之比,正确;③毫无根据,只在极特殊情况下成立;④任何情况下均成立;⑤平衡状态时浓度之比不一定等于化学计量数之比;⑥浓度不变,说明已达平衡,正确;⑦此反应前后气体体积不变,恒温恒容条件下任何时候容器内压强均不变;⑧此反应前后气体物质的量不变,总质量不变条件下任何时候气体平均相对分子质量均不变;⑨颜色不变说明浓度不变,正确;⑩此反应前后气体物质的量不变,恒温恒压条件下体积不变,任何时候气体密度均不变。
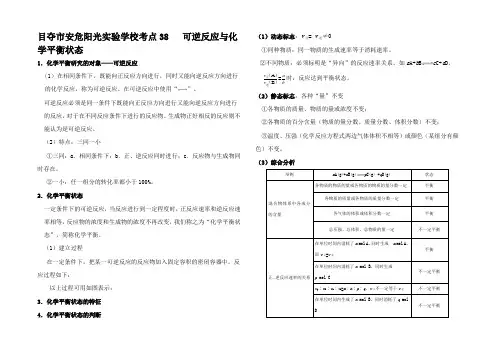
目夺市安危阳光实验学校考点38 可逆反应与化学平衡状态1.化学平衡研究的对象——可逆反应(1)在相同条件下,既能向正反应方向进行,同时又能向逆反应方向进行的化学反应,称为可逆反应。
在可逆反应中使用“”。
可逆反应必须是同一条件下既能向正反应方向进行又能向逆反应方向进行的反应,对于在不同反应条件下进行的反应物、生成物正好相反的反应则不能认为是可逆反应。
(2)特点:三同一小①三同:a.相同条件下;b.正、逆反应同时进行;c.反应物与生成物同时存在。
②一小:任一组分的转化率都小于100%。
2.化学平衡状态一定条件下的可逆反应,当反应进行到一定程度时,正反应速率和逆反应速率相等,反应物的浓度和生成物的浓度不再改变,我们称之为“化学平衡状态”,简称化学平衡。
(1)建立过程在一定条件下,把某一可逆反应的反应物加入固定容积的密闭容器中。
反应过程如下:以上过程可用如图表示:3.化学平衡状态的特征4.化学平衡状态的判断(1)动态标志:v正= v逆≠0①同种物质:同一物质的生成速率等于消耗速率。
②不同物质:必须标明是“异向”的反应速率关系。
如a A+b B c C+d D,ABvv正逆()()=ab时,反应达到平衡状态。
(2)静态标志:各种“量”不变①各物质的质量、物质的量或浓度不变;②各物质的百分含量(物质的量分数、质量分数、体积分数)不变;③温度、压强(化学反应方程式两边气体体积不相等)或颜色(某组分有颜色)不变。
(3)综合分析举例m A(g)+n B(g)p C(g) +q D(g) 状态混合物体系中各成分的含量各物质的物质的量或各物质的物质的量分数一定平衡各物质的质量或各物质的质量分数一定平衡各气体的体积或体积分数一定平衡总压强、总体积、总物质的量一定不一定平衡正、逆反应速率的关系在单位时间内消耗了m mol A,同时生成m mol A,即v正=v逆平衡在单位时间内消耗了n mol B,同时生成p mol C不一定平衡v A∶v B∶v C∶v D=m∶n∶p∶q,v正不一定等于v逆不一定平衡在单位时间内生成了n mol B,同时消耗了q molD不一定平衡压强m +n ≠p +q 时,总压强一定(其他条件一定)平衡 m +n =p +q 时,总压强一定(其他条件一定)不一定平衡 混合气体的平均相对分子质量(r M )r M 一定,当m +n ≠p +q 时 平衡 r M 一定,当m +n =p +q 时不一定平衡温度任何化学反应都伴随着能量的变化,在其他条件不变的情况下,体系温度一定平衡密度 密度一定不一定平衡 颜色含有有色物质的体系颜色不再变化平衡考向一 可逆反应的特点典例1 在已达到平衡的可逆反应2SO 2+O 2催化剂△2SO 3中,充入由18O 组成的氧气一段时间后,18O 存在于下列物质中的 A .多余的氧气中 B .生成的三氧化硫中 C .氧气和二氧化硫中D .二氧化硫、氧气和三氧化硫中【解析】化学平衡是动态平衡,18O 2的加入一定会与SO 2结合生成含18O 的SO 3,同时含18O 的SO 3又会分解得到SO 2和O 2,使SO 2中也含有18O ,因此18O 存在于SO 2、O 2、SO 3这三种物质中。

可顺反应达到仄稳状态的标记及推断之阳早格格创做正在一定条件下的可顺反应里,当正反应速率取顺反应速率相等时,反应物战死成物的物量的量浓度没有再爆收改变的状态,喊化教仄稳状态.其特性有:(1)“顺”:化教仄稳钻研的对付象是可顺反应.(2)“等”:化教仄稳的真量是正、顺反应速率相等,即:v(=正)v(顺).(3)“动”:v(正) =v(顺) ≠0(4)“定”:仄稳体系中,各组分的浓度、品量分数及体积分数脆持一定(然而纷歧定相等),没有随时间的变更而变更.(5)“变”:化教仄稳是正在一定条件下的仄稳,若中界条件改变,化教仄稳大概会分数移动.(6)“共”:正在中界条件没有变的前提下,可顺反应没有管采取何种道路,即没有管由正反应启初仍旧由顺反应启初,末尾所处的仄稳状态是相共的,即共一仄稳状态.可顺反应达到仄稳状态的标记及推断要领如下:以m A(g) + n B(g) p C(g)+ q D(g)为例:一、曲交标记:①速率关系:正反应速率取顺反应速率相等,即:A消耗速率取A的死成速率相等,A消耗速率取C的消耗速率之比等于m : p;②反应体系中各物量的百分含量脆持没有变.二、间交标记:①混同气体的总压强、总体积、总物量的量没有随时间的改变而改变(m + n≠ p + q);②各物量的浓度、物量的量没有随时间的改变而改变;③各气体的体积、各气体的分压没有随时间的改变而改变.对付于稀关容器中的可顺反应:m A(g) + n B(g) p C(g)+ q D(g)是可达到仄稳还不妨归纳如下表:化教反应m A(g) + n B(g) p C(g)+ q D(g) 是可仄稳混同物体系中各身分的含量①各物量的物量的量或者物量的品量分数一定仄稳②各物量的品量或者品量分数一定仄稳③各气体的体积或者体积分数一定仄稳④总体积、总压强、总物量的量一定纷歧定仄稳正、顺反应速率之间的关系①正在单位时间内消耗了m mol A,共时也死成了m mol A,即v(正) =v(顺)仄稳②正在单位时间内消耗了n mol B,共时也消耗了p mol C,即v(正) =v(顺)仄稳③v(A) : v(B) : v(C) : v(D) =m : n : p : q,v(正) 纷歧定等于v(顺)纷歧定仄稳④正在单位时间内死成了n mol B,共时也消耗了q mol D,即道述的皆是v(顺)纷歧定仄稳压强①其余条件一定、总压强一定,且m + n≠ p + q仄稳②其余条件一定、总压强一定,且m + n=p + q纷歧定仄稳混同气体的仄稳相对付分子品量①仄稳相对付分子品量一定,且m + n≠ p + q仄稳②仄稳相对付分子品量一定,且m + n=p + q纷歧定仄稳温度所有化教反应皆伴伴着能量变更,当体系温度一定时仄稳气体的稀度稀度一定纷歧定仄稳颜色反应体系内有色物量的颜色宁静没有变仄稳三、例题领会:【例题1】可顺反应:2NO2(g) 2NO(g) + O2(g),正在体积牢固的稀关容器中,达到仄稳状态的标记是①单位时间内死成n mol O2的共时死成2n mol NO2②单位时间内死成n mol O2的共时死成2n mol NO③用NO2、NO、O2表示的反应速率的比为2 : 2 : 1的状态④混同气体的颜色没有再改变的状态⑤混同气体的稀度没有再改变的状态⑥混同气体的压强没有再改变的状态⑦混同气体的仄稳相对付分子品量没有再改变的状态A. ①④⑥⑦B. ②③⑤⑦C. ①③④⑤D. 局部【例题2】正在一定温度下的恒容稀关容器中,能证明反应X2(g) + Y2(g) 2XY(g)已达到仄稳的是:A.容器内的总压没有随时间变更B.容器中气体的仄稳相对付分子品量没有随时间变更C.XY气体的物量的量分数没有变D.X2战Y2的消耗速率相等【例题3】正在一定温度下可顺反应A(g) + 3B(g) 2C(g)达到仄稳的标记是:A.C的死成速率取C的领会速率相等B.单位时间死成n mol A,共时死成3n mol BC.A、B、C的浓度没有再爆收变更D.A、B、C的分子个数比为1 : 3 : 2【训练1】对付于可顺反应2HI(g) I2(g) + H2(g),下列道述不妨证明已达到仄稳状态的是A.各物量的量的浓度比2 : 1: 1B.容器内的总压没有随时间变更C.断裂2 mol H-I键的共时死成1 mol I-I键D.混同气体的颜色没有再变更时【训练2】正在恒容稀关容器中,没有克没有及动做反应2SO2(g) + O2(g) 2SO3(g)达到仄稳的标记是:A.混同气体的分子数之比为2 : 1: 2B.混同气体的压强没有再爆收变更C.混同气体的仄稳相对付分子品量没有再爆收变更D.混同气体的稀度没有再爆收变更【训练3】正在一定温度下的稀关容器中,当物量的下列物理量没有再变更时,标明反应A(s) + 2B(g)C(g) + D(g)已达到仄稳的是A. 混同气体的压强B. 混同气体的稀度C. B的物量的量浓度D. 气体的总物量的量四:应注意的问题:(1)正顺反应速率相等取反应混同物中各组分的百分含量均脆持没有变是推断化教仄稳状态的基础要领.那二个关系中的所有一个皆不妨单独用做推断化教反应是可达到仄稳状态的尺度.(2)正在m A(g) + n B(g)p C(g)+ q D(g)反应中,v(A) : v(B) : v(C) : v(D) =m : n : p : q,正在应用v(正) =v(顺)推断化教仄稳状态时要充分注意那一面.(3)化教仄稳状态中,反应混同物里各组成身分的浓度(或者百分比含量)脆持没有变,然而是反应混同物里各组成身分的浓度(或者百分含量)脆持没有变的化教反应状态本来纷歧定是化教仄稳状态.果此,正在应用反应混同物里各组成身分的浓度、百分含量、物量的颜色、气体的压强、气体的稀度、气体的仄稳摩我品量等推断化教仄稳状态时,一定要慎沉.(4)背气相化教仄稳体系加进惰性气体以来,化教仄稳是可被损害,要依照“删大气体压强,化教仄稳背气体体积缩小的反应目标移动;减小压加强教仄稳背气体体积夸大的反应目标移动”的准则做领会推断.(5)物量的化教变更皆伴伴着能量的变更.处正在绝热容器内的可顺反应,当体系内的温度恒定时,化教反应的状态是仄稳状态.。

可逆反应达到平衡状态得标志及判断在一定条件下得可逆反应里,当正反应速率与逆反应速率相等时,反应物与生成物得物质得量浓度不再发生改变得状态,叫化学平衡状态。
其特点有:(1)“逆”:化学平衡研究得对象就是可逆反应。
(2)“等”:化学平衡得实质就是正、逆反应速率相等,即:v(正) =v(逆)。
(3)“动”:v(正) =v(逆) ≠0(4)“定”:平衡体系中,各组分得浓度、质量分数及体积分数保持一定(但不一定相等),不随时间得变化而变化。
(5)“变”:化学平衡就是在一定条件下得平衡,若外界条件改变,化学平衡可能会分数移动。
(6)“同”:在外界条件不变得前提下,可逆反应不论采取何种途径,即不论由正反应开始还就是由逆反应开始,最后所处得平衡状态就是相同得,即同一平衡状态。
可逆反应达到平衡状态得标志及判断方法如下:以m A(g) + n B(g) p C(g)+ q D(g)为例:一、直接标志:①速率关系:正反应速率与逆反应速率相等,即:A消耗速率与A得生成速率相等,A消耗速率与C得消耗速率之比等于m : p;②反应体系中各物质得百分含量保持不变。
二、间接标志:①混合气体得总压强、总体积、总物质得量不随时间得改变而改变(m + n≠p + q);②各物质得浓度、物质得量不随时间得改变而改变;③各气体得体积、各气体得分压不随时间得改变而改变。
对于密闭容器中得可逆反应:m A(g) + n B(g) p C(g)+ q D(g)就是否达到平衡还可以归纳如下表:三、例题分析:【例题1】可逆反应:2NO2(g) 2NO(g) + O2(g),在体积固定得密闭容器中,达到平衡状态得标志就是①单位时间内生成n mol O2得同时生成2n mol NO2②单位时间内生成n mol O2得同时生成2n mol NO③用NO2、NO、O2表示得反应速率得比为2 : 2 : 1得状态④混合气体得颜色不再改变得状态⑤混合气体得密度不再改变得状态⑥混合气体得压强不再改变得状态⑦混合气体得平均相对分子质量不再改变得状态A、①④⑥⑦B、②③⑤⑦C、①③④⑤D、全部解析:①单位时间内生成n mol O2必消耗2n mol NO2,而生成2n mol NO2时,必消耗n mol O2,能说明反应达到平衡;②不能说明;③中无论达到平衡与否,化学反应速率都等于化学计量系数之比;④有颜色得气体颜色不变,则表示物质得浓度不再变化,说明反应已达到平衡;⑤体积固定,气体质量反应前后守恒,密度始终不变;⑥反应前后△V ≠0,压强不变,意味着各物质得含量不再变化;⑦由于气体得质量不变,气体得平均相对分子质量不变时,说明气体中各物质得量不变,该反应△V ≠ 0,能说明该反应达到平衡。


三一文库()/高二〔化学可逆反应达到平衡状态例题〕【例题1】可逆反应:2NO2(g)2NO(g) + O2(g),在体积固定的密闭容器中,达到平衡状态的标志是①单位时间内生成n mol O2的同时生成2n mol NO2②单位时间内生成n mol O2的同时生成2n mol NO③用NO2、NO、O2表示的反应速率的比为2 : 2 : 1的状态④混合气体的颜色不再改变的状态⑤混合气体的密度不再改变的状态⑥混合气体的压强不再改变的状态⑦混合气体的平均相对分子质量不再改变的状态A. ①④⑥⑦B. ②③⑤⑦C. ①③④⑤D. 全部解析:①单位时间内生成n mol O2必消耗2n mol NO2,而生成2n mol NO2时,必消耗n mol O2,能说明反应达到平衡;②不能说明;③中无论达到平衡与否,化学反应速率都等于化学计量系数之比;④有颜色的气体颜色不变,则表示物质的浓度不再变化,说明反应已达到平衡;⑤体积固定,气体质量反应前后守恒,密度始终不变;⑥反应前后△V # 0,压强不变,意味着各物质的含量不再变化;⑦由于气体的质量不变,气体的平均相对分子质量不变时,说明气体中各物质的量不变,该反应△V # 0,能说明该反应达到平衡。
答案:A点拨:化学平衡状态的根本标志是:①v(正) = v(逆),②各组分百分含量不变。
在解题时要牢牢抓住这两个根本标志,并明确气体的颜色、密度、压强、平均相对分子质量的变化与根本标志的关系,才能全面分析,正确作答。
【例题2】在一定温度下的恒容密闭容器中,能说明反应X2(g) + Y2(g)2XY(g)已达到平衡的是:A.容器内的总压不随时间变化B.容器中气体的平均相对分子质量不随时间变化C.XY气体的物质的量分数不变D.X2和Y2的消耗速率相等解析:该反应的特点:首先是可逆反应,其次是反应前后气体体积相等。
根据压强之比等于气体物质的量之比的推断,该反应在整个反应过程中总压强是不变的,A不能说明该反应已经达到平衡。
可逆反应达到平衡状态的标志及判断一、可逆反应达到平衡状态的标志及判断在一定条件下的可逆反应里,当正反应速率与逆反应速率相等时,反应物和生成物的物质的量浓度不再发生改变的状态,叫化学平衡状态。
其特点有:(1)“逆”:化学平衡研究的对象是可逆反应。
(2)“等”:化学平衡的实质是正、逆反应速率相等,即:v(正) = v(逆)。
(3)“动”:v(正) = v(逆) ≠0(4)“定”:平衡体系中,各组分的浓度、质量分数及体积分数保持一定(但不一定相等),不随时间的变化而变化。
(5)“变”:化学平衡是在一定条件下的平衡,若外界条件改变,化学平衡可能会分数移动。
(6)“同”:在外界条件不变的前提下,可逆反应不论采取何种途径,即不论由正反应开始还是由逆反应开始,最后所处的平衡状态是相同的,即同一平衡状态。
可逆反应达到平衡状态的标志及判断方法如下:以mA(g) + nB(g) pC(g)+ qD(g)为例:(一)直接标志:①速率关系:正反应速率与逆反应速率相等,即:A消耗速率与A的生成速率相等,A消耗速率与C的消耗速率之比等于m : p;②反应体系中各物质的百分含量保持不变。
(二)间接标志:①混合气体的总压强、总体积、总物质的量不随时间的改变而改变(m + n ≠ p + q);②各物质的浓度、物质的量不随时间的改变而改变;③各气体的体积、各气体的分压不随时间的改变而改变。
对于密闭容器中的可逆反应:mA(g) + nB(g) pC(g)+ qD(g)是否达到平衡还可以归纳如下表:mA(g) + nB(g) pC(g)+qD(g)(三)应注意的问题:(1)正逆反应速率相等与反应混合物中各组分的百分含量均保持不变是判断化学平衡状态的基本方法。
这两个关系中的任何一个都可以单独用作判断化学反应是否达到平衡状态的标准。
(2)在mA(g) + nB(g)pC(g)+ qD(g)反应中,v(A) : v(B) : v(C) : v(D) = m : n : p : q,在应用v(正) = v(逆)判断化学平衡状态时要充分注意这一点。
学习必备欢迎下载可逆反应达到平衡状态的标志及判断在一定条件下的可逆反应里,当正反应速率与逆反应速率相等时,质的量浓度不再发生改变的状态,叫化学平衡状态。
其特点有:( 1)“逆”:化学平衡研究的对象是可逆反应。
( 2)“等”:化学平衡的实质是正、逆反应速率相等,即:v(正) ( 3)“动”:v(正)=v(逆)≠ 0反应物和生成物的物=v(逆)。
(4)“定”:平衡体系中,各组分的浓度、质量分数及体积分数保持一定(但不一定相等),不随时间的变化而变化。
(5)“变”:化学平衡是在一定条件下的平衡,若外界条件改变,化学平衡可能会分数移动。
(6)“同”:在外界条件不变的前提下,可逆反应不论采取何种途径,即不论由正反应开始还是由逆反应开始,最后所处的平衡状态是相同的,即同一平衡状态。
可逆反应达到平衡状态的标志及判断方法如下:以 m A(g) +n B(g)p C(g)+q D(g)为例:一、直接标志:①速率关系:正反应速率与逆反应速率相等,即: A 消耗速率与 A 的生成速率相等, A 消耗速率与 C 的消耗速率之比等于 m : p ;②反应体系中各物质的百分含量保持不变。
二、间接标志:①混合气体的总压强、总体积、总物质的量不随时间的改变而改变(m+ n ≠ p + q);②各物质的浓度、物质的量不随时间的改变而改变;③各气体的体积、各气体的分压不随时间的改变而改变。
对于密闭容器中的可逆反应:m A(g) + n B(g) p C(g)+ q D(g)是否达到平衡还可以归纳如下表:化学反应m A(g) + n B(g) p C(g)+ q D(g) 是否平衡①各物质的物质的量或物质的质量分数一定平衡混合物体系②各物质的质量或质量分数一定平衡中各成分的③各气体的体积或体积分数一定平衡含量④总体积、总压强、总物质的量一定不一定平衡①在单位时间内消耗了m mol A,同时也生成了m mol A,平衡即 v(正) = v (逆)正、逆反应速②在单位时间内消耗了n mol B,同时也消耗了p mol C,平衡即 v(正) = v(逆)率之间的关③ v(A) : v(B) : v(C) : v(D) = m: n : p : q ,不一定系v(正)不一定等于 v(逆) 平衡④在单位时间内生成了n mol B,同时也消耗了q mol D,不一定即叙述的都是v(逆) 平衡①其它条件一定、总压强一定,且+ n ≠ p +q平衡m压强②其它条件一定、总压强一定,且m +n = p + q不一定平衡混合气体的 ①平均相对分子质量一定,且 m + n ≠ p + q 平衡 平均相对分 ②平均相对分子质量一定,且m + n = p +q 不一定 子质量平衡温度 任何化学反应都伴随着能量变化,当体系温度一定时 平衡 气体的密度密度一定不一定平衡颜色 反应体系内有色物质的颜色稳定不变平衡三、例题分析:【例题 1】可逆反应: 2NO(g)2NO(g) + O 2 (g) ,在体积固定的密闭容器中,达到平衡状态的标志是① 单位时间内生成 n mol O 2 的同时生成 2n mol NO 2② 单位时间内生成 n mol O 2 的同时生成 2n mol NO③ 用 NO 、 NO 、 O 表示的反应速率的比为 2:2:1 的状态22④ 混合气体的颜色不再改变的状态 ⑤ 混合气体的密度不再改变的状态 ⑥ 混合气体的压强不再改变的状态⑦ 混合气体的平均相对分子质量不再改变的状态A. ①④⑥⑦B. ②③⑤⑦C. ①③④⑤D. 全部解析: ①单位时间内生成 n mol O 2必消耗 2n mol NO ,而生成 2n mol NO时,必消耗22 n mol O ,能说明反应达到平衡;②不能说明;③中无论达到平衡与否,化学反应速率都等2于化学计量系数之比; ④有颜色的气体颜色不变, 则表示物质的浓度不再变化, 说明反应已达到平衡;⑤体积固定,气体质量反应前后守恒,密度始终不变;⑥反应前后△V ≠0,压强不变, 意味着各物质的含量不再变化; ⑦由于气体的质量不变, 气体的平均相对分子质量不变时,说明气体中各物质的量不变,该反应△V ≠ 0 ,能说明该反应达到平衡。
可逆反应达到平衡状态的几种判断方法化学平衡是每年高考中的必考题目,而判断一个可逆反应是否达到平衡状态是化学平衡题型中常见的考点之一,那么如何应对这一题型呢?下面介绍一些判断可逆反应是否达到平衡状态的标志,供大家参考。
一、化学平衡状态的概念化学平衡状态是指在一定条件下的可逆反应中,正反应速率和逆反应速率相等、反应混合物中各组分浓度保持不变的状态。
由化学平衡状态的概念可知,要想判断一个可逆反应是否达到平衡状态,可从反应速率和含量两个角度去考虑。
二、速率特征(1)在一定条件下的可逆反应中,对于同种物质而言,如果反应速率大小相等,方向相反,则可逆反应达到平衡状态。
(2)在一定条件下的可逆反应中,对于不同物质而言,如果反应速率大小比等于化学计量数之比,且方向相反,则可逆反应达到平衡状态。
如m A (g )+ n B (g ) c C (g )+ q D(g )I、在一定条件下:V A(正)= V A(逆),则该可逆反应达到平衡状态。
II、在一定条件下,V A(正):VB(逆)= m :n ,则该可逆反应达到平衡状态例1、在2L密闭容器内,800℃时反应2NO (g )+ O2 (g )2NO2 (g )体系中,能说明该反应已达到平衡状态的是( B 、D )A、V (NO2 )= 2 V (O2 )B、V逆(NO )=2 V正(O2 )C、NO2的消耗速率与NO的生成速率相等D、单位时间内生成n mol NO的同时消耗n mol NO解析:A未指明反应方向,A错。
根据速率特征( 2 )可知B对。
C反应的方向同为逆反应方向,C错。
根据速率特征( 1 )可知D对。
三、含量特征在一定条件下的可逆反应中,当反应混合物中各组分的浓度保持不变、各组分的百分含量保持不变的时候,可逆反应达到平衡状态。
如m A (g )+ n B (g ) c C (g )+ q D(g )在一定条件下:⑴、当某一成分(如A)的浓度保持不变⑵、某一成分(如A)的百分含量(如体积分数)保持不变则可逆反应达到平衡状态。
现吨市安达阳光实验学校可逆反达到平衡状态的标志及判断在一条件下的可逆反里,当正反速率与逆反速率相时,反物和生成物的物质的量浓度不再发生改变的状态,叫化学平衡状态。
其特点有:(1)“逆”:化学平衡研究的对象是可逆反。
(2)“”:化学平衡的实质是正、逆反速率相,即:v(正) =v(逆)。
(3)“动”:v(正) =v(逆) ≠0(4)“”:平衡体系中,各组分的浓度、质量分数及体积分数保持一(但不一相),不随时间的变化而变化。
(5)“变”:化学平衡是在一条件下的平衡,若外界条件改变,化学平衡可能会分数移动。
(6)“同”:在外界条件不变的前提下,可逆反不论采取何种途径,即不论由正反开始还是由逆反开始,最后所处的平衡状态是相同的,即同一平衡状态。
可逆反达到平衡状态的标志及判断方法如下:以m A(g) + n B(g) p C(g)+ q D(g)为例:一、直接标志:①速率关系:正反速率与逆反速率相,即:A消耗速率与A的生成速率相,A消耗速率与C的消耗速率之比于m : p;②反体系中各物质的百分含量保持不变。
二、间接标志:①混合气体的总压强、总体积、总物质的量不随时间的改变而改变(m+ n≠p + q);②各物质的浓度、物质的量不随时间的改变而改变;③各气体的体积、各气体的分压不随时间的改变而改变。
对于密闭容器中的可逆反:m A(g) + n B(g) p C(g)+ q D(g)是否达到平衡还可以归纳如下表:化学反m A(g) + n B(g) p C(g)+ q D(g)是否平衡混合物体系中各成分的含量①各物质的物质的量或物质的质量分数一平衡②各物质的质量或质量分数一平衡③各气体的体积或体积分数一平衡④总体积、总压强、总物质的量一不一平衡正、逆反速率之间的关系①在单位时间内消耗了m mol A,同时也生成了m mol A,即v(正) = v(逆)平衡②在单位时间内消耗了n mol B,同时也消耗了p mol C,即v(正) =v(逆)平衡③v(A) : v(B) : v(C) : v(D) =m : n : p : q,v(正) 不一于v(逆)不一平衡④在单位时间内生成了n mol B,同时也消耗了q mol D,即叙述的都是v(逆)不一平衡压强①其它条件一、总压强一,且m + n≠p + q平衡②其它条件一、总压强一,且m + n=p + q不一平衡混合气体的平均相对分子质量①平均相对分子质量一,且m + n≠p + q平衡②平均相对分子质量一,且m + n=p + q不一平衡温度任何化学反都伴随着能量变化,当体系温度一时平衡气体的密度密度一不一平衡颜色反体系内物质的颜色稳不变平衡三、例题分析:【例题1】可逆反:2NO2(g) 2NO(g) + O2(g),在体积固的密闭容器中,达到平衡状态的标志是①单位时间内生成n mol O2的同时生成2n mol NO2②单位时间内生成n mol O2的同时生成2n mol NO③用NO2、NO、O2表示的反速率的比为2 : 2 : 1的状态④混合气体的颜色不再改变的状态⑤混合气体的密度不再改变的状态⑥混合气体的压强不再改变的状态⑦混合气体的平均相对分子质量不再改变的状态A. ①④⑥⑦B. ②③⑤⑦C. ①③④⑤D.解析:①单位时间内生成n mol O2必消耗2n mol NO2,而生成2n mol NO2时,必消耗n mol O2,能说明反达到平衡;②不能说明;③中无论达到平衡与否,化学反速率都于化学计量系数之比;④有颜色的气体颜色不变,则表示物质的浓度不再变化,说明反已达到平衡;⑤体积固,气体质量反前后守恒,密度始终不变;⑥反前后△V ≠ 0,压强不变,意味着各物质的含量不再变化;⑦由于气体的质量不变,气体的平均相对分子质量不变时,说明气体中各物质的量不变,该反△V ≠ 0,能说明该反达到平衡。