化学平衡状态的标志
- 格式:docx
- 大小:22.56 KB
- 文档页数:3


《化学平衡状态的判断》学案一、化学平衡状态的直接标志:1、等速标志:v正= v逆(本质特征)①同一种物质②不同的物质:例1.在一定条件下,可逆反应2A B+3C在下列4种状态中,处于平衡状态的是()(A) 正反应速度 v A=2mol/(L·min)逆反应速度v B=2 mol/(L·min)(B) 正反应速度 v A=2mol/(L·min)逆反应速度v C=2 mol/(L·min)(C) 正反应速度 v A=1mol/(L·min)逆反应速度v B=1.5 mol/(L·min)(D) 正反应速度 v A=1mol/(L·min)逆反应速度v C=1.5mol/(L·min)例2.在一定温度下反应A2(气)+B2(气)2AB(气)达到平衡的标志是()A、单位时间内生成nmolA2的同时,生成nmolB2B、单位时间内生成2nmolAB的同时,生成nmolB2C、单位时间内生成了nmolB2的同时,减少了nmolA2D、单位时间生成nmolA2,同时生成nmolABE、单位时间内消耗了nmolA2,同时消耗了2nmolAB例3、下列说法中,可以证明N2+3H22NH3已达到平衡状态的是()A.1个N≡N键断裂的同时,有3个H—H键形成B.1个N≡N键断裂的同时,有3个H—H键断裂C.1个N≡N键断裂的同时,有6个N—H键断裂D.1个N≡N键断裂的同时,有6个N—H键形成2、恒浓标志:反应混合物中各组成成分的浓度保持不变(外部表现)例4、在一定温度下,可逆反应A(g)+3B(g)2C(g)达到平衡的标志是()A.C生成的速率与C分解的速率相等B.A、B、C的浓度不再变化C.单位时间内生成n mol A,同时生成3n mol B D.A、B、C的分子数之比为1︰3︰2二、化学平衡状态的间接标志:1、各组成成分的质量、物质的量、分子数、体积(气体)、物质的量浓度均保持不变。

化学平衡知识归纳总结一、化学平衡化学平衡的涵义1、可逆反应:在同一条件下同时向正方向又向逆反应方向进行的反应。
注意:“同一条件”“同时进行”。
同一体系中不能进行到底。
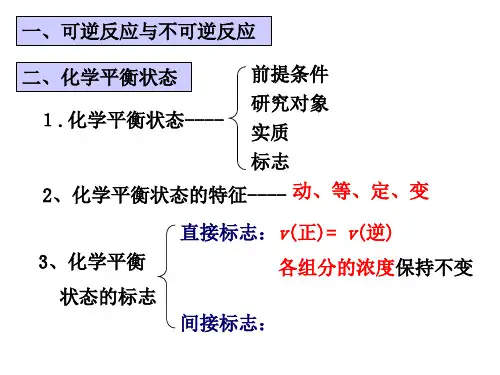
2、化学平衡状态在一定条件下的可逆反应里,正反应速率和逆反应速率相同时,反应混合物中各组分的浓度保持不变的状态叫化学平衡状态。
要注意理解以下几方面的问题:(1)研究对象:一定条件下的可逆反应(2)平衡实质:V正=V逆≠0 (动态平衡)(3)平衡标志:反应混合物各组分的含量保持不变,可用六个字概括——逆、等、定、动、变、同。
3、化学平衡状态的特征:(1)逆:化学平衡状态只对可逆反应而言。
(2)等:正反应速率和逆反应速率相等,即同一物质的消耗速率与生成速率相等。
(3)定:在平衡混合物中,各组分的浓度保持一定,不在随时间的变化而变化。
(4)动:化学平衡从表面上、宏观上看好像是反应停止了,但从本质上、微观上看反应并非停止,只不过正反应速率于逆反应速率相等罢了,即V正=V逆≠0,所以化学平衡是一种动态平衡。
(5)变:化学平衡实在一定条件下建立的平衡。
是相对的,当影响化学平衡的外界条件发生变化时,化学平衡就会发生移动。
(6)同:化学平衡状态可以从正逆两个方向达到,如果外界条件不变时,不论采取何种途径,即反应是由反应物开始或由生成物开始,是一次投料或多次投料,最后所处的化学平衡是相同的。
即化学平衡状态只与条件有关而与反应途径无关。
可逆反应达到平衡的标志1、同一种物质V正=V逆≠02、各组分的物质的量、浓度(包括物质的量的浓度、质量分数等)、含量保持不变。
等效平衡1、等效平衡原理:相同条件下,同一可逆反应体系,不管从正反应开始,还是从逆反应开始,只要按反应方程式中的化学计量数之比投入反应物或生成物,建立起的平衡状态都是相同,这就是等效平衡的原理。
由于化学平衡状态与条件有关,而与建立平衡的途径无关。
因而,同一可逆反应,从不同的状态开始,只要达到平衡时条件(温度、浓度、压强等)完全相同,则可形成等效平衡。

化学平衡的标志总结
嘿,朋友们!今天咱就来好好唠唠化学平衡的标志总结。
你瞧啊,就像一场拔河比赛!两边的力量得均衡吧,这就是化学平衡啦!比如说,在一个化学反应中,正反应速率和逆反应速率相等啦,这就好比拔河两边使的劲一样大,谁也赢不了谁,这不就是平衡的一个重要标志嘛!就像氢气和氮气合成氨的反应,当生成氨的速度和氨分解的速度一样时,那就是平衡状态呀!
还有呢,各组分的浓度保持不变也很关键哦!就像一群小伙伴在玩跷跷板,大家的位置固定了,平衡就达到了呀!比如二氧化碳和水反应生成碳酸,要是二氧化碳、水和碳酸的浓度一直不变了,那妥妥的就是平衡啦!
反应物的转化率也能说明问题呀!如果反应一直进行下去,反应物都没了,那还谈什么平衡呢,对吧?就好像跑步比赛,总不能一个人一直跑没完没了吧!比如说二氧化硫和氧气反应生成三氧化硫,要是二氧化硫的转化率不再变化了,那肯定平衡咯!
再者,体系的温度、压强等条件也很重要呢!这就好比天气会影响我们的心情一样。
温度呀压强呀稳定了,反应也容易达到平衡呀。
咱总结一下哈,化学平衡的标志就是正逆反应速率相等、各组分浓度不变、反应物转化率稳定,还有体系条件稳定。
这些标志就像是指引我们认识化学平衡这个神秘世界的灯塔呀!所以呀,大家以后再遇到化学平衡的问题,可别迷糊啦,就按照这些标志去判断准没错!怎么样,是不是很清楚啦?。

化学平衡状态的判断标志湖北省巴东县第二高级中学444324 谭贤凤化学平衡状态的判断是化学平衡教学中的难点,为了帮助同学们有效地掌握这方面的知识,笔者对化学平衡的概念深入剖析,总结规律,从不同侧面认识化学平衡,以化解难点,提高对知识的应用能力。
一.剖析概念,把握标志化学平衡状态是指在一定条件下的可逆反应里,正反应和逆反应速率相等,反应混合物中各组分的浓度保持不变的状态。
从其概念可知,判断一个可逆反应在一定条件下是否达到平衡状态主要根据两点:一是根据化学平衡状态的本质特征——正反应速率与逆反应速率相等;二是根据化学平衡状态的宏观表现——各组分的浓度保持不变。
二.深入理解,把握规律㈠化学平衡状态的一般标志化学平衡状态的标志可概括为“一等五不变”,现以mA(g)+nB(g)2pC(g)+qD(g)为例,化抽象为具体,提高学生对此标志的理解。
1.一等“一等”即正反应速率等于逆反应速率,其意义是针对反应体系中同一反应物(或生成物)而言的,而不是同一反应中的不同物质。
若用同一反应中不同物质来表示正反应速率和逆反应速率,必须要求两速率反向(切忌单向速率)且两速率之比等于其对应的化学计量数之比。
在试题中可有以下几种具体形式出现:⑴同一物质的正反应速率等于逆反应速率,如υA(消耗)=υA(生成)或υD(消耗)=υD(生成)。
⑵某反应物的正反应速率与另一反应物的逆反应速率之比等于化学计量数之比,如υA(消耗):υB(生成) =m:n,或υC(消耗):υD(生成) =p:q。
⑶某反应物的正反应速率与某生成物的逆反应速率之比等于化学计量数之比,如υA(消耗):υC(消耗) =m:p,或υB(生成):υD(生成) = n:q。
⑷对同一物质而言,断裂化学键的物质的量与形成化学键的物质的量相等。
2.五不变“五不变”即反应混合物中各组分的浓度保持不变,其意义是指各组分的物质的量不变;各组分的浓度不变;各组分的百分含量不变;反应物的转化率不变;对于全为气体的可逆反应,当m+n╪p+q 时,混合气体总物质的量不变。


如何判断化学反应是否达到平衡如何判断化学反应是否达到平衡化学反应平衡是高中化学的一个重要的内容,可以说是高中化学中最常用的,下面有途网小编分享给大家如何判断化学反应是否达到平衡。
本质性判断,化学平衡状态的本质性标志是:“正反应与逆反应的速率相等”。
这样就可以直接或间接地衍生出以下6种判断方式:(1)从速率的角度描述:同一物质的生成速率等于消耗速率;(2)从速率的角度描述:处于可逆方程式同一侧(即两者同为反应物或两者同为生成物)的不同种物质,必须一种物质生成同时另一种物质消耗,且两者的速率之比等于化学方程式中化学计量数之比;(3)从速率的角度描述:处于可逆方程式不同侧(即一为反应物,另一为生成物)的不同种物质,必须两种物质同时生成或同时消耗,且两者的速率之比等于化学方程式中化学计量数之比;(4)从时间和物质的生消量的角度描述:单位时间内消耗掉某物质的量与生成该物质的量相等;(5)从断键角度描述:如H2+I2 2HI的反应,单位时间内断裂一个H—H键的同时,形成一个H—H键,或形成一个I—I 键,或断裂2个H—I键;(6)从能量角度描述:绝热容器中,反应放出的热量与吸收的热量相等,即体系温度不变。
特征性判断。
化学平衡状态的特征性标志是:“反应混合物中各组分的浓度保持不变。
”这样,就又可以直接或间接地衍生出以下5种判断方式:(7)反应混合物中和物质的物质的量浓度保持不变;(8)反应混合物中各物质的物质的量分数、质量分数、体积分数(对气体物质而言)等保持不变;(9)反应混合物中各物质的物质的量、质量、分子数等保持不变;(10)反应混合物中某一种反应物的转化率、某一生成物的产率等保持不变;(11)反应混合物中某些特征,如某组分有颜色,体系的颜色不再改变时。
整体性判断,化学平衡状态可以从各组分来判断以外,对于有些可逆反应,还可以采取反应混合物的整体情况来判断。
如:对于mA(g)+nB(g) pC(g)+qD(g) (其中m+n=?p+q)或者mA(s)+nB(g) pC(g)+qD(g) (其中n=?p+q)等可逆反应而言,只要出现下列几种情况时,也达到了平衡状态:(12)定温、定容条件下,总压强保持不变;(13)定温、定压条件下,总体积保持不变;(14)定容条件下,气体密度保持不变(仅指除气体外还有固、液物质反应或生成的反应)(15)总物质的量保持不变;(16)总分子数保持不变。

化学平衡状态标志的判断【本讲教育信息】一. 教学内容:化学平衡状态与化学平衡状态的判断二. 教学目标:能描述化学平衡建立的过程;理解化学平衡的概念及化学平衡的特征;掌握判断化学平衡的方法和依据。
三. 教学重点、难点:化学平衡状态的特征,判断化学平衡的方法和依据四. 教学过程:(一)化学平衡状态:在一定条件下的可逆反应里,正反应速率和逆反应速率相等,反应混合物中各组成成分的含量保持不变的状态,称为化学平衡状态,简称化学平衡。
化学平衡状态的标志(本质)是:?ν正=ν逆;?反应混合物中各组成成分的含量不变。
化学平衡状态的特点可以用六个字表示:“逆”“动”“等”“定”“变”“同” 说明:1. 可逆反应是:在相同条件下,既能向正反应方向进行又能向逆反应方向进行的反应,对于在不同条件下向正、逆反应方向进行的反应则不认为是可逆反应。
2. 在一定的条件下,几乎所有的反应都具有不同程度的可逆性,但有些反应的逆反应程度太小而忽略,把几乎完全进行的反应称为不可逆反应。
而可逆反应不能进行到底,不能实现完全转化。
3. 逆,只有可逆反应,在一定条件下才建立平衡。
对于非可逆反应,由于反应终了时,某物质已经完全消耗,因此,不存在平衡状态;4. 动,是动态平衡,即v不等于零,v正=v逆?0。
反应开始时,正反应速率最大,逆反应速率最小,随着反应的进行,正反应速率逐渐减小,逆反应速率逐渐增大,至一定时间后,两者相等。
说明达到化学平衡状态的反应,反应并没有停止,还在继续,只是物质反应消耗的速率等于该物质生成的速率;5. 等,v正=v逆。
即在同一瞬间,某一成分的生成速率等于其消耗速率;6. 定,反应混合物或平衡混合物各成分含量不变。
是v正=v逆的结果。
反应混合物的含量不变,有多种可能:可以是浓度、物质的量、百分含量、压强、密度等; 7. 变,可逆反应达到平衡状态是在一定条件下达到的,条件改变,平衡就会被破坏。
外界条件通过影响可逆反应的反应速率,从而使正、逆反应的速率不等,使平衡发生移动。

化学平衡状态的标志一、化学平衡的标志一、化学平衡的标志化学平衡的标志是:①;②各组分的物质的量、质量、含量保持不变。
二、速度与平衡的关系二、速度与平衡的关系1、,平衡向正反应方向移动。
,平衡向正反应方向移动。
2、,平衡不移动。
,平衡不移动。
3、,平衡向逆反应方向移动。
,平衡向逆反应方向移动。
三、化学平衡状态的特征三、化学平衡状态的特征逆:研究对象是可逆反应。
逆:研究对象是可逆反应。
等:。
动:动态平衡。
动:动态平衡。
定:达平衡后,各组分的浓度保持不变。
变:条件改变,平衡发生移动。
变:条件改变,平衡发生移动。
同:在外界条件一定时,相当量的反应物和生成物间,不论从正反应开始,还是从逆反应开始,达到的平衡状态是相同的。
四、化学平衡状态的判断方法四、化学平衡状态的判断方法1、达到化学平衡状态的本质标志、达到化学平衡状态的本质标志化学平衡状态的本质标志是:正反应速率等于逆反应速率,但不等于零,是对同一反应物或同一生成物而言。
是对同一反应物或同一生成物而言。
对某一反应物来说,对某一反应物来说,正反应消耗掉反应物的速度等于逆反应生成该反应物的速度。
2、达到化学平衡状态的等价标志、达到化学平衡状态的等价标志所谓“等价标志”是指可以间接衡量某一可逆反应是否达到化学平衡状态的标志。
(1)与等价的标志等价的标志①同一物质:该物质的生成速率等于它的消耗速率,如:。
②不同的物质:速率之比等于化学方程式中的化学计量数之比,速率之比等于化学方程式中的化学计量数之比,但必须是不同方但必须是不同方向的速率,如:。
③可逆反应的正、逆反应速率不再随时间发生变化。
④化学键断裂情况=化学键生成情况。
④化学键断裂情况=化学键生成情况。
对同一物质而言,对同一物质而言,断裂化学键的物质的量与形成化学键的物质的量相等。
与形成化学键的物质的量相等。
对不同物质而言,对不同物质而言,与各物质的化学计量数和分子内的化学键多少有关。
如:对反应,当有3mol H —H 键断裂,同时有键断裂,则该反应达到了化学平衡。

针对学生的怕学、厌学现象,要充分发挥情感的功能,多鼓励支持学生,增强教育方法的情趣,引发学生积极的情感体验,使怕学、厌学转化为乐学、好学。
另外对于教学中的许多知识难点的分化,教师要运用恰当的方法,引导学生作好知识的分类和归纳,做到深入浅出(特别是与初中知识的衔接),让学生容易学、容易记,让学生在认知过程中不但不会感到困难,而且能尝到学习的乐趣。
(3)以理育情在化学教学中,教师要充分挖掘教材中的德育因素,对学生进行政治思想和科学素质教育,如在讲新能源材料时,可以联系我国的石化、宇航事业的发展,以及当今的“低碳经济”,培养学生爱国、爱科学的情感,同时也让化学同生活联系在一起,更有利让学生对化学产生浓厚兴趣。
4.通过开展课外活动,加强学生的学习兴趣课外活动一直都深受广大学生的喜爱,是培养和发展学生学习兴趣的重要途径,课外活动不仅能够加深对课堂所学知识的理解,而且能扩大学生的视野、开发智力、激发兴趣。
课外活动的形式很多,如:开展兴趣小组,让学生做一些简单有趣的实验,如豆奶粉中氮含量的测定,水果饮料中Vc 含量的检测,补铁制剂中铁含量测定等;组织学生参观化工厂,通过目睹生产第一线操作过程将书本上的知识结合起来,例如带学生去参观制皂厂,让学生进一步了解肥皂生产的过程和原理,思考一下:与书本介绍的有何相同或不同之处。
此外教师还可开展化学知识讲座、化学探究实验设计等活动来扩大学生的知识面,提高学生的学习兴趣。
同时,对学生的评价也应从“单一”走向“综合”,这样才能从根本上起到爱护学生的作用。
总之,只要教师在教学实践中不断钻研、不断总结,就会发现提高中职学生学习化学兴趣的手段是多种多样的,只要把它们灵活、巧妙地运用到具体的教学工作中去,就能有效地提高学生的学习兴趣,从而进一步激发学生的求知欲。
参考文献:[1]张龙主编.化学(通用类).北京:高等教育出版社,2009,6.(1).[2]付国华.化学教学中学生思维方式的构建研究.化学教育,2007,VOL12:27-32.[3]西南实话学院化学系编.中学化学实验教学[M ].北京:高等教育出版社,1996,4.[4]杨辉祥主编.中学化学教学参考[M ].西安:陕西师范大学,2005,4.[5]蒋蓉.化学课外活动的一点尝试[J ].化学教学,1996,6.化学平衡是中学化学最重要的基本理论之一,在高考中重现率高达100%,而平衡状态的判断是本部分重点考查的知识点之一。
化学平衡状态的标志
某可逆反应是否处于化学平衡状态,它们的标志可以通过化学平衡状态的本质特征来进行衡量
1.V正=V逆,它是判断化学平衡状态的主要标志。
正、逆反应速率相等是针对反应体系中的。
由于该物质的生成速率与消耗速率相等,才使这种物质的浓度保持不变,说明可逆反应己达到化学平衡状态。
2.反应混合物中各组分的浓度保持不变,是判断化学平衡状态的另一个主要标志。
如果反应混合物中某一种物质的量浓度,质量分数,体积分数(对气体而言)等保持一定,都说明可逆反应已达到平衡状态。
3.从其它角度也可以判断某可逆反应是否达到化学平衡状态,但要具体问题具体分析。
例如对于反应前后气体分子数不相等的可逆反应,可以通过以下几种情况来判断:
当体系中物质的总物质的量不随时间变化时,说明反应已达到平衡状态.
当恒温恒容时,体系的总压强有发生变化或当恒温恒压时,体系的总体积不发生变化都可以说明反应已达到平衡状态。
混合气体的平均含量不发生变化,也可以说明反应已达平衡状态.
对于反应前后气体分子数相等的反应,无论反应是否达到平衡,体系中物质的总物质的量,总压强,总体积或混合气体的平均含量都不发生变化,不能确定反应是否中达到平衡状态。
化学平衡标志、平衡移动及常见图形总结work Information Technology Company.2020YEAR可逆反应达到平衡状态的标志及判断在一定条件下的可逆反应里,当正反应速率与逆反应速率相等时,反应物和生成物的物质的量浓度不再发生改变的状态,叫化学平衡状态。
其特点有:(1)“逆”:化学平衡研究的对象是可逆反应。
(2)“等”:化学平衡的实质是正、逆反应速率相等,即:v(=v(逆)。
正)=v(逆) ≠0(3)“动”:v(正)(4)“定”:平衡体系中,各组分的浓度、质量分数及体积分数保持一定(但不一定相等),不随时间的变化而变化。
(5)“变”:化学平衡是在一定条件下的平衡,若外界条件改变,化学平衡可能会分数移动。
(6)“同”:在外界条件不变的前提下,可逆反应不论采取何种途径,即不论由正反应开始还是由逆反应开始,最后所处的平衡状态是相同的,即同一平衡状态。
可逆反应达到平衡状态的标志及判断方法如下:以m A(g) + n B(g) p C(g)+ q D(g)为例:一、直接标志:①速率关系:正反应速率与逆反应速率相等,即:A消耗速率与A的生成速率相等,A消耗速率与C的消耗速率之比等于m : p;②反应体系中各物质的百分含量保持不变。
二、间接标志:①混合气体的总压强、总体积、总物质的量不随时间的改变而改变(m + n≠p + q);②各物质的浓度、物质的量不随时间的改变而改变;③各气体的体积、各气体的分压不随时间的改变而改变。
对于密闭容器中的可逆反应:m A(g) + n B(g) p C(g)+ q D(g)是否达到平衡还可以归纳如下表:化学反应m A(g) + n B(g) p C(g)+ q D(g) 是否平衡混合物体系中各成分的含量①各物质的物质的量或物质的质量分数一定平衡②各物质的质量或质量分数一定平衡③各气体的体积或体积分数一定平衡④总体积、总压强、总物质的量一定不一定平衡正、逆反应速率之间的关系①在单位时间内消耗了m mol A,同时也生成了mmol A,即v(正) = v(逆)平衡②在单位时间内消耗了n mol B,同时也消耗了pmol C,即v(正) =v(逆)平衡③v(A) : v(B) : v(C) : v(D) =m : n : p :q,v(正) 不一定等于v(逆)不一定平衡④在单位时间内生成了n mol B,同时也消耗了qmol D,即叙述的都是v(逆)不一定平衡压强①其它条件一定、总压强一定,且m + n≠p + q平衡②其它条件一定、总压强一定,且m + n=p + q不一定平衡混合气体的平均相对分子质量①平均相对分子质量一定,且m + n≠p + q平衡②平均相对分子质量一定,且m + n=p + q不一定平衡温度任何化学反应都伴随着能量变化,当体系温度一定时平衡气体的密度密度一定不一定平衡颜色反应体系内有色物质的颜色稳定不变平衡三、例题分析:【例题1】可逆反应:2NO2(g) 2NO(g) + O2(g),在体积固定的密闭容器中,达到平衡状态的标志是①单位时间内生成n mol O2的同时生成2n mol NO2②单位时间内生成n mol O2的同时生成2n mol NO③用NO2、NO、O2表示的反应速率的比为2 : 2 : 1的状态④混合气体的颜色不再改变的状态⑤混合气体的密度不再改变的状态⑥混合气体的压强不再改变的状态⑦混合气体的平均相对分子质量不再改变的状态A. ①④⑥⑦B. ②③⑤⑦C. ①③④⑤D. 全部解析:①单位时间内生成n mol O2必消耗2n mol NO2,而生成2n mol NO2时,必消耗n mol O2,能说明反应达到平衡;②不能说明;③中无论达到平衡与否,化学反应速率都等于化学计量系数之比;④有颜色的气体颜色不变,则表示物质的浓度不再变化,说明反应已达到平衡;⑤体积固定,气体质量反应前后守恒,密度始终不变;⑥反应前后△V ≠ 0,压强不变,意味着各物质的含量不再变化;⑦由于气体的质量不变,气体的平均相对分子质量不变时,说明气体中各物质的量不变,该反应△V ≠ 0,能说明该反应达到平衡。
化学平衡的标志和判断1.判断可逆反应达到平衡状态方法:(1) 第一特征:V正=V逆:①同一物质生成速率等于消耗速率;②在方程式同一边的不同物质生成速率与消耗速率之比等于方程式系数之比或消耗速率与生成速率之比,前后比较项必须相反;③方程式不同一边的不同物质生成速率与生成速率之比等于方程式系数之比或消耗速率与消耗速率之比,前后比较项必须相同;④反应放出的热量与吸收的热量相等,体系温度不变。
(2) 第二特征:各组成成分百分含量保持不变①各组分的质量分数不变;②各气体组分的体积分数不变;③各组分的物质的量分数不变;④各组分的分子数之比不变;⑤各组分的物质的量浓度不变时一定平衡(变化时不一定);⑥各组分的转化率或产率不变;⑦若某组分有色,体系的颜色不再改变时一定平衡(变化时不一定)。
2.反应类型(1)对于反应:mA2(气)+nB2(气) pC(气)+Q,下述特征标志表示可逆反应达到平衡状态:①生成A2的速率与消耗A2的速率相等;生成B2的速率与消耗B2的速率相等;生成C的速率与分解C的速率相等;生成C的分子数与分解C的分子数相等;生成A2的速率:消耗B2的速率= m:n;消耗A2的速率:生成B2的速率=m:n消耗A2的速率:消耗C的速率=m:p;消耗B2的速率:消耗C的速率=n:p生成A2的速率:生成C的速率=m:p;生成B2的速率:生成C的速率=n:p单位时间内,每生成pmolC的同时生成了mmolA2和n molB2;每消耗pmolC的同时消耗了mmolA2和n molB2②A2、B2、C的 (质量、体积、物质的量)百分组成、分子数之比不变;③A2、B2、C的物质的量浓度不变;④A2、B2的转化率不变;⑤C的产率不变;⑥气体的颜色不变;⑦隔热条件下,体系温度不变;(2)当反应前后气体的体积相等时,即m+n = p时:①A2、B2、C物质的量浓度不变或物质的量浓度之比不变,也标志反应达到了平衡状态;但物质的量浓度大小、气体颜色深浅因外界压强改变而改变,平衡不移动,平衡状态不变。
化学反应限度知识点总结:
一、化学平衡状态的特征:
1、逆——可逆反应(研究对象)
2、等——v正=v逆≠0(本质)
3、动——平衡时正逆反应均未停止(动态平衡)
4、定——平衡时各组分含量不变(结果)
5、变——外界条件改变时,平衡可能发生移动(平衡移动)
二、可逆反应达到化学平衡状态的标志:
1、绝对标志:
(1)v正=v逆
①对于同一种物质而言,该物质的生成速率=它的消耗速率
②对不同物质而言,反应速率之比等于计量系数之比,但必须是不同方向的反应速率。
(同边异向,异边同向)
(2)反应混合物中各组分的含量保持不变
①各组分的浓度不随时间的改变而改变。
②各组分的质量分数、物质的量分数、体积分数不随时间的改变而改变。
③各组分的质量、物质的量、气体体积不随时间的改变而改变。
(3)反应物的转化率、产物的产率保持不变。
(4)绝热体系中温度保持不变。
(5)对于有色物质参与的反应,体系的颜色保持不变。
(6)若反应物或生成物中有非气态(固体或液体),则气体的平均相对分子质量、密度不变的状态为化学平衡状态。
3、不可能标志:
任何有关质量、物质的量、物质的量浓度、体积、反应速率等的比例关系都不能作为达到平衡的判断依据。
判断化学反应达到平衡状态的标志1、任何情况下均可作为标志的:(1)v正=v逆(同一种物质)(2)各组分含量(百分含量、物质的量、质量)不随时间变化(3)某反应物的消耗(生成)速率:某生成物的消耗(生成)速率=化学计量数之比2、在一定条件下可作为标志的:(1)对于有色物质参加或生成的可逆反应体系,颜色不再变化。
(2)对于有气态物质参加或生成的可逆反应体系,若反应前后气体的物质的量变化不为0,则混合气体平均相对分子质量M和反应总压P不变(恒温恒容)。
(3)对于恒容绝热体系,体系的温度不再变化。
3、不能作为判断标志的:(1)各物质的物质的量或浓度变化或反应速率之比=化学计量数之比(任何情况下均适用)(2)对于全气体的反应,若反应前后气体的体积无变化,则混合气体平均相对分子质量M和反应总压P不变(恒温恒容)。
[例题与解析]例1、下列方法中可以证明2HI(g)=H2(g)+I2(g)已达平衡状态的是()①单位时间内生成n mol H2的同时生成n mol HI②一个H—H键断裂的同时有两个H—I键断裂③百分组成HI%=I2%④反应速率v (H2)=v (I2)=0.5 v (HI)时⑤C (HI)=C (H2)=C (I2)=2∶1∶1⑥温度和体积一定时,某一生成物浓度不再变化⑦温度和体积一定时,容器内压强不再变化⑧条件一定,混合气体的平均相对分子质量不再变化⑨温度和体积一定时混合气体的颜色不再变化⑩温度和压强一定时混合气体密度不再变化分析:这是一个反应前后气体体积没有变化的反应①表示不同方向的反应,但生成H2与生成HI的物质的量之比应等相应化学计量数之比;②表示不同方向的反应且等于化学计量数之比,正确;③毫无根据,只在极特殊情况下成立;④任何情况下均成立;⑤平衡状态时浓度之比不一定等于化学计量数之比;⑥浓度不变,说明已达平衡,正确;⑦此反应前后气体体积不变,恒温恒容条件下任何时候容器内压强均不变;⑧此反应前后气体物质的量不变,总质量不变条件下任何时候气体平均相对分子质量均不变;⑨颜色不变说明浓度不变,正确;⑩此反应前后气体物质的量不变,恒温恒压条件下体积不变,任何时候气体密度均不变。
化学专题化学平衡状态
考纲要求:化学平衡状态的判断及比较。
化学平衡状态
1.研究的对象:
2.化学平衡状态:在一定条件下可逆反应
中相等,反应混合物中各组分的质量分数的状态。
3.化学平衡的特征:
动——动态平衡;
等——正逆反应速率相等;
定——各物质含量保持不变;
变——条件改变,平衡移动。
4.平衡状态的标志:
m A(g)+n B(g pC(g)+q D(g)
【升华】“变”到“不变”。
“变”就是到达平衡过程中量“变”,而到达平衡后“不变”,一定平衡。
【巩固练习】
2.在一定温度下,反应A 2(g)+B2(g)2AB(g)达到平衡的标志是()
A.单位时间生成的nmol的A2同时生成nmol的AB
B.容器内的总压强不随时间变化
C.单位时间生成2nmol的AB同时生成nmol的B2
D.单位时间生成nmol的A2同时生成nmol的B2
3.下列叙述表示可逆反应N 2 + 3H22NH3一定处于平衡状态的是()
A.N2、H2、NH3的百分含量相等
B.单位时间,消耗amolN2的同时消耗3amolH2
C.单位时间,消耗amolN2的同时生成3amolH2
D.反应若在定容的密器中进行,温度一定时,压强不随时间改变
6.可逆反应N 2+3H22NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示。
下列
各关系中能说明反应已达到平衡状态的是()
A.3v正(N2)=v正(H2)
B.v正(N2)=v逆(NH3)
C.2v正(H2)=3v逆(NH3)
D.v正(N2)=3v逆(H2)
7.在2NO 2(红棕色)N2O4(无色)的可逆反应中,下列状态说明达到平衡标志的是() A.c(N2O4)=c(NO2)的状态
B.N2O4处于不再分解的状态
C.NO2的分子数与N2O4分子数比为2∶1的状态
D.体系的颜色不再发生改变的状态
8、可逆反应H 2 (气)+I2 (气)2HI(气)达到平衡时的标志是()
A、混合气体的密度恒定不变 B.混合气体的颜色不再改变
C. H2、I2 、HI的浓度相等
D. I2在混合气体中体积分数不再改变
9、在一定的温度下,固定容器中发生可逆反应A(g)+ 3B(g) 2C(g)达到平衡的标志是()
A、C的生成速率与C的分解速率相等
B、单位时间生成nmolA,同时生成3nmolB
C、A、B、C的物质的量浓度保持不变
D、A、B、C的分子数之比为1 :3 :2
E、容器中气体的密度保持不变
F、混合气体的平均摩尔质量保持不变
G、容器中气体的总压强保持不变
10、可逆反应∶2NO 22NO+O2在密闭容器中反应,达到平衡状态的标志是()
①单位时间内生成nmolO2的同时生成2nmolNO2②单位时间内生成nmolO2的同时,生成2nmolNO ③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2: 2: 1的状态④混合气体的颜色不再改变的状态⑤混合气体的密度不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态()
A. ①④⑥
B.②③⑤
C.①③④
D.①②③④⑤⑥。