大学有机化学胺与酰胺
- 格式:ppt
- 大小:1.30 MB
- 文档页数:32

有机化学中的胺和酰胺的反应胺和酰胺是有机化学中常见的两类化合物,在许多化学反应中发挥着重要作用。
本文将探讨胺和酰胺的反应机理和一些重要的反应类型。
一、胺的反应1. 亲电取代反应胺可以作为亲电试剂参与取代反应。
在这类反应中,氨基(NH2)基团可以与带有亲电中心的化合物发生取代反应。
例如,胺可以与卤代烃反应,形成相应的胺类化合物。
这类反应可以通过氨基团中的孤对电子攻击带有亲电性的碳原子实现。
2. 缩合反应胺还可以参与缩合反应,形成脲、胸腺嘧啶等化合物。
在这类反应中,胺的氨基团与酮或醛的羰基进行缩合,形成C-N键。
缩合反应通常需要使用酸催化剂或碱催化剂来促进反应的进行。
3. 氧化反应胺是一种容易氧化的化合物,可以参与氧化反应。
在这类反应中,胺的氨基团会被氧化剂(如过氧化氢或过氧化苯甲酰)氧化为亚胺、亚胺氧化物等。
氧化反应通常需要在酸性或碱性条件下进行。
二、酰胺的反应1. 羟胺化反应酰胺可以与羟胺反应,形成羟基酰胺。
在这类反应中,酰胺的羰基与羟胺发生加成反应,形成新的羟基和酰胺的酰胺化合物。
这类反应在生物体内广泛存在,参与许多重要生物分子的合成过程。
2. 加氢反应酰胺可以参与加氢反应,将羰基还原为羟基。
这类反应通常需要使用氢化试剂(如氢气和催化剂)催化。
加氢反应对于合成醇和醛的羰基还原具有重要意义。
3. 脱酰反应酰胺可以发生脱酰反应,生成相应的胺和酰基化合物。
在这类反应中,酰胺的酰基与碱性条件下断裂,形成胺和酰基化合物。
这类反应在有机合成中常被用于制备新的胺类化合物。
总结起来,胺和酰胺在有机化学中具有广泛的应用。
胺可以参与亲电取代、缩合和氧化等反应,而酰胺主要参与羟胺化、加氢和脱酰等反应。
对这些反应的深入研究可以为新的有机合成方法的开发和有机化学的进一步应用提供重要的基础。


《胺和酰胺》讲义一、胺胺是一类含有氮原子的有机化合物,在有机化学中具有重要的地位。
胺可以看作是氨(NH₃)分子中的氢原子被烃基取代后的产物。
根据胺分子中氮原子所连接的烃基种类和数目不同,胺可以分为以下几类:1、伯胺(一级胺)伯胺中氮原子与一个烃基相连,通式为 RNH₂。
例如,甲胺(CH₃NH₂)就是一种常见的伯胺。
2、仲胺(二级胺)仲胺的氮原子连接着两个烃基,通式为 R₂NH。
二甲胺((CH₃)₂NH)是仲胺的一个典型例子。
3、叔胺(三级胺)叔胺的氮原子与三个烃基相连,通式为 R₃N。
三甲胺((CH₃)₃N)就是常见的叔胺。
胺的性质主要包括物理性质和化学性质。
在物理性质方面,胺一般为具有挥发性的液体或低熔点的固体,具有特殊的气味。
低级胺能溶于水,这是因为它们能与水分子形成氢键。
随着烃基的增大,胺在水中的溶解度逐渐降低。
从化学性质来看,胺具有碱性。
这是因为氮原子上有孤对电子,能接受质子。
胺的碱性强弱与氮原子上电子云密度有关,电子云密度越大,碱性越强。
一般来说,脂肪胺的碱性强于芳香胺。
胺还能发生酰化反应。
在酰化试剂(如酰氯、酸酐)的作用下,胺中的氨基与酰基结合,生成酰胺。
此外,胺还能与亚硝酸反应。
不同类型的胺与亚硝酸反应的产物不同,可用于胺的鉴别。
胺在生活和工业中有着广泛的应用。
例如,在医药领域,许多药物含有胺的结构;在化工生产中,胺是合成许多高分子材料的重要原料。
二、酰胺酰胺是羧酸中的羟基被氨基或胺基取代后形成的化合物。
它的通式为 RCONR'₂。
酰胺具有一些独特的物理性质。
一般来说,酰胺的熔点和沸点比相应的羧酸要高,这是因为酰胺分子间可以形成较强的氢键。
在化学性质方面,酰胺的水解是一个重要的反应。
在酸或碱的催化下,酰胺可以水解为羧酸和胺。
酰胺的脱水反应也是常见的。
在一定条件下,酰胺可以脱水生成腈。
酰胺在生物化学中具有重要意义。
蛋白质就是由氨基酸通过酰胺键(肽键)连接而成的大分子化合物。
三、胺和酰胺的相互转化胺和酰胺之间可以通过一系列化学反应相互转化。

有机化学中的酰胺与酰胺类化合物酰胺是一类重要的有机化合物,由酰基与氨基通过缩合反应而得。
在有机合成中,酰胺及其衍生物广泛应用于药物、农药、染料等领域。
本文将介绍酰胺的基本结构和性质、制备方法、应用以及一些相关化合物的特点。
一、酰胺的基本结构和性质酰胺的一般结构可表示为RCONH₂,其中R代表酰基。
酰胺的酰基可以是脂肪酸根、芳香酸根或其他有机官能团,根据酰基的不同,酰胺的性质也会有所不同。
酰胺分子中的酰基与氨基通过共价键连接,使得酰胺具有较强的分子内氢键作用力。
这种分子内氢键使得酰胺具有较高的沸点和溶解度,常见的酰胺如乙酰胺、丙酰胺等是无色结晶性固体。
二、酰胺的制备方法常用的酰胺制备方法有以下几种:1. 热胺法:将酰氯与氨水或胺类反应,生成酰胺。
反应条件可通过加热、催化或溶剂改变,得到不同的产物。
2. 缩合反应:酰胺也可通过酸催化的缩合反应制备。
将酰基与胺类在酸性或碱性条件下反应,生成酰胺。
3. 亲核取代反应:酰胺可由酮或酸酐与胺基发生亲核取代反应,生成酰胺。
以上是常见的酰胺制备方法,根据不同的实际需求和反应物条件,可以选择合适的方法来合成目标酰胺。
三、酰胺的应用酰胺及其衍生物在医药、农药和染料等领域具有广泛的应用。
1. 药物领域:许多药物分子中都含有酰胺结构,通过合成酰胺类化合物,可以获得具有特定生物活性的药物分子。
例如,头孢菌素类抗生素、抗癌药、镇痛药等。
2. 农药领域:酰胺类化合物也在农药的合成中发挥着重要作用。
常见的肉毒杆菌酰胺类农药、杀虫剂等都是酰胺类化合物。
3. 染料领域:酰胺类染料具有良好的染色性能和稳定性,广泛应用于纺织工业等领域。
四、酰胺类化合物的特点除了酰胺之外,还存在一些酰胺类化合物,它们在有机合成和应用中也具有重要的地位。
1. 酰亚胺:酰亚胺是酰胺中酰基与亚胺基缩合而成的化合物。
酰亚胺有较好的电子以及空间特性,广泛应用于金属催化反应和不对称合成中。
2. 酰胺酯:酰胺酯是酯与酰胺缩合而成的化合物。


大学有机化学反应方程式总结胺的酰化与酰胺的热解反应酰化反应是有机化学中重要的反应类型之一,常用于合成酯、酰胺等化合物。
胺的酰化反应指的是一种酰化剂与胺反应生成酰胺的化学反应。
酰胺的热解反应则是指酰胺在热条件下分解成酰化剂和相应的胺的反应。
本文将对这两类反应进行总结,并给出相应的反应方程式。
一、胺的酰化反应胺的酰化反应是通过与酰化剂反应生成酰胺的过程。
胺中的氮原子上的孤电子对可以和酰化剂中的亲电中心结合,形成新的化学键。
常用的酰化剂包括酰氯、酸酐和酰亚胺等。
以下是一些常见的胺的酰化反应方程式:1. 胺与酸酐的反应:R-NH2 + R'-C(O)-O-C(O)-R'' → R-NH-C(O)-O-C(O)-R'' + R'-CO2H2. 胺与酰氯的反应:R-NH2 + R'-C(O)-Cl → R-NH-C(O)-O-C(O)-R' + HCl3. 胺与酰亚胺的反应:R-NH2 + R'-C(O)NHR'' → R-NH-C(O)-NH-R'' + R'-C(O)NH2二、酰胺的热解反应酰胺的热解反应是指酰胺在高温下分解成酰化剂和相应的胺的反应。
酰胺的热解反应可以是一步反应,也可以包括多步反应。
以下是一些常见的酰胺的热解反应方程式:1. 链状酰胺的热解反应:R-NH-C(O)-NH-R' → R-NH2 + R'-C(O)NH22. 脂环酰胺的热解反应:R-N(C=O)-NH2 → R-NH2 + CO3. 共轭酰胺的热解反应:R-C(O)N=C(R')R'' → R-C(O)N=C(R')R'' + R''结论胺的酰化反应和酰胺的热解反应在有机化学中具有重要的应用价值。
通过对胺的酰化,可以合成出各种酰胺类化合物,这些化合物在医药、农药等领域具有广泛的应用。

大学有机化学反应方程式总结酰胺的酸碱水解与酰胺化反应在有机化学领域中,酰胺是重要的有机化合物之一。
酰胺可以通过酸碱水解和酰胺化反应与其他有机物发生反应,形成不同的化合物。
本文将总结酰胺的酸碱水解与酰胺化反应的反应方程式,并探讨其应用和重要性。
一、酰胺的酸碱水解反应方程式酸碱水解是一种常见的反应途径,通过加入酸或碱能够使酰胺分解为相应的酸或胺。
以下是酰胺的酸碱水解反应方程式的几个例子:1. 酰胺的酸水解反应方程式:RCONH2 + HCl → RCOOH + NH4Cl2. 酰胺的碱水解反应方程式:RCONH2 + NaOH → RCOONa + NH3这些反应方程式展示了酰胺与酸或碱反应后生成的产物。
酸水解会生成相应的酸和氨盐,碱水解会生成相应的盐和氨。
二、酰胺化反应方程式酰胺化反应是酰胺与羧酸或酸酐进行的一种反应。
该反应可以在酸性或碱性条件下进行,生成酰胺与羧酸的缩合产物。
以下是酰胺化反应方程的几个例子:1. 在酸性条件下的酰胺化反应方程式:RCOOH + R'NH2 → RCO-NHR' + H2O2. 在碱性条件下的酰胺化反应方程式:RCOCl + R'NH2 → RCONHR' + HCl这些反应方程式揭示了酰胺与羧酸或酸酐反应后生成的酰胺与水或盐的生成。
酰胺化反应在有机合成中具有重要的应用价值。
三、酰胺的应用与重要性酰胺是许多重要有机化合物的组成部分,广泛应用于药物、农药和高分子材料等领域。
酰胺的反应性使其成为有机合成中重要的中间体,通过调节酰胺的结构和反应条件,可以合成具有多种不同功能的化合物。
酰胺的酸碱水解和酰胺化反应是有机化学中常用的反应途径,同时也是酰胺的合成和降解的重要手段。
通过掌握酰胺的酸碱水解和酰胺化反应的反应方程式,可以更好地理解酰胺的化学性质和反应机制,为有机化学实验和研究提供有力的支持。
总结:本文总结了酰胺的酸碱水解和酰胺化反应的反应方程式,并探讨了它们的应用和重要性。

有机化学基础知识点整理酰胺的性质与应用有机化学基础知识点整理:酰胺的性质与应用酰胺是一类含有酰基的有机化合物,常用通式R-C(O)NR'R''来表示。
它是酰氨的一种衍生物,是有机化学中非常重要的一类功能团。
本文将整理酰胺的性质与应用。
一、酰胺的结构与性质1. 结构特点:酰胺的结构中,羰基碳与氮原子之间通过一个共价键连接。
羰基碳与氧原子之间是一个双键。
酰胺中的氮原子可以与H、烃基或其他官能团连接。
2. 物理性质:酰胺通常是无色结晶性固体,常温下稳定。
它们具有一定的溶解度,可溶于极性溶剂如水、乙醇和醚类溶剂。
在高温或酸性条件下,酰胺可能水解为酸和胺。
3. 化学性质:酰胺可以发生一系列的有机反应,如加成、氧化、还原、酰胺的水解等。
其中,酰胺的水解是一种重要的反应,可以通过酸性或碱性条件下进行。
二、酰胺的合成方法1. 度胺化反应:酰胺可以通过酰化剂与胺反应而合成。
主要的酰化剂有酸酐、酰氯和酰亚胺等。
例如,酸酐与胺反应可以形成相应的酰胺。
2. 缩合反应:酰胺也可通过缩合反应合成。
缩合反应是指酰胺的羰基碳与胺中的氮原子之间形成一个新的羰基键。
常见的缩合反应有兰氏缩合和加合缩合等。
例如,酮与胺反应可以形成酰胺。
三、酰胺的应用领域1. 药物化学领域:许多药物和生物活性化合物中都存在酰胺基团。
酰胺的特定结构使其在药物设计和开发中具有重要地位。
酰胺可改变药物的药代动力学性质,如增强药物的溶解度、稳定性和生物利用度等。
2. 聚合物领域:酰胺类聚合物是一类重要的高分子材料。
例如,聚酰胺是一种具有优异力学性能和耐高温性能的工程塑料,常用于制备高性能纤维、薄膜和涂层材料。
3. 有机涂料领域:酰胺在有机涂料中也有广泛的应用。
酰胺结构具有惰性和稳定性,使得其成为一种重要的涂料成分。
酰胺基团可以提供涂料的柔软性和耐热性能,同时还可以增加涂料的抗老化和粘附能力。
4. 生物化学领域:酰胺在生物化学研究中也具有重要地位。

有机化学胺类和酰胺的性质和反应有机化学中,氨基基团(-NH2)是常见的官能团之一。
氨基基团可以连接到碳骨架上的不同位置,形成胺类和酰胺。
本文将详细描述胺类和酰胺的性质和反应。
一、胺类的性质和反应1. 胺类的命名与分类胺类按照氨基基团的数量和位置可以分为一级胺、二级胺和三级胺。
一级胺指的是一个碳原子与一个氢原子通过一个键连接,二级胺指的是一个碳原子与两个氢原子通过一个或两个键连接,三级胺指的是一个碳原子与三个氢原子通过一个或两个键连接。
胺类的命名通常使用它们在有机分子中的名称,例如甲胺、乙胺等。
如果一个有机分子中含有多个氨基基团,将其位置和数量用前缀表示,如乙二胺表示乙醇胺。
2. 胺类的物理性质由于氨基基团的电子给予性质,胺类通常呈碱性。
一级胺和二级胺可形成氢键,使它们的沸点和溶解度较高。
与醇类相比,胺类的沸点和溶解度较低,主要是由于胺分子之间较弱的分子间作用力。
3. 胺类的化学性质和反应(1)胺的碱性反应由于氨基基团的弱碱性,胺类可以与酸反应,形成盐。
例如,乙胺与盐酸反应生成乙胺盐酸盐(C2H5NH3Cl)。
(2)胺的氧化反应一级胺在氧化剂的存在下可被氧化为亚硝胺。
例如,乙胺与亚硝酸反应生成亚硝基乙胺(C2H5NHOH)。
(3)胺的磷酸化反应胺类可与磷酰氯反应生成相应的磷酰胺。
例如,乙胺与磷酰氯反应生成乙基磷酰胺(C2H5NHP=OCl)。
(4)胺的取代反应胺类可发生取代反应,取代活泼氢原子的官能团可进一步反应。
例如,氯化乙酰与胺反应生成N-乙酰基乙胺(C2H5NHCOCH3)。
二、酰胺的性质和反应1. 酰胺的命名与分类酰胺是由酰基与胺基形成的化合物,通常按照胺基的数量和位置进行分类。
一级酰胺指的是一个碳原子与一个氨基基团通过一个键连接,二级酰胺指的是一个碳原子与两个氨基基团通过一个或两个键连接,三级酰胺指的是一个碳原子与三个氨基基团通过一个或两个键连接。
2. 酰胺的物理性质酰胺通常具有较高的沸点和溶解度,与醇类和胺类相比,酰胺分子之间的分子间作用力更强。

有机化学基础知识点酰胺的性质和反应酰胺是有机化合物中一类重要的官能团,广泛存在于生物体内和许多化学合成中。
其性质和反应是有机化学基础知识的重要组成部分。
本文将就酰胺的性质和反应进行探讨。
一、酰胺的结构特点酰胺是由羧酸与胺缩合而成,它的一般结构可以表示为R-CO-NH2。
其中R代表烃基或芳香基。
酰胺分为两类,一类是脂肪酰胺,即R为烷基;另一类是芳香酰胺,即R为芳香基。
二、酰胺的物理性质1. 熔点和沸点:酰胺的熔点和沸点较高,这是由于酰胺分子内部间存在较强的氢键和范德华力,使得酰胺分子之间的结合较紧密。
2. 溶解性:酰胺在水中可以溶解,而且与许多有机溶剂(如醇、醚等)也有良好的溶解性。
三、酰胺的重要性质和反应1. 氢键性质:酰胺中的氮原子可以与邻近的羰基氧形成氢键,这种氢键对于酰胺的稳定性和物理性质有很大影响。
2. 氨解反应:酰胺可以通过与强碱(如氨水)反应,发生氨解反应生成胺和酸的盐。
示例如下:R-CO-NH2 + NH3 → R-NH2 + NH4+ + COO-3. 水解反应:酰胺可以通过与水反应发生水解反应,生成相应的酸和胺。
示例如下:R-CO-NH2 + H2O → R-COOH + NH34. 酰胺的脱水缩合反应:酰胺中的羰基与胺的氮原子发生脱水缩合反应,生成酰胺之间的化合物。
示例如下:R-CO-NH2 + R'-CO-NH2 → R-CO-NH-R'-CO-NH2 + H2O5. 酰胺的磺化反应:酰胺可以与磺酰氯反应,发生磺化反应生成相应的磺酰胺。
示例如下:R-CO-NH2 + SCl2 → R-CO-NH-SO2Cl6. 酰胺的酰基取代反应:酰胺中的酰基可以被卤代烷取代,生成相应的酰胺衍生物。
示例如下:R-CO-NH2 + RX → R-CO-NHR + HX7. 酰胺的氧化反应:酰胺可以发生氧化反应,生成相应的酰胺衍生物或酮。
示例如下:R-CO-NH2 + [O] → R-CO-NH-R + H2O总结:酰胺作为一类重要的有机化合物,其性质和反应体现了有机化学的基础知识。
有机化学基础知识点酰胺的合成方法酰胺的合成方法酰胺是有机化合物中的一类重要化合物,具有广泛的应用领域。
它由酰氯和胺反应而成,具有许多重要的合成方法。
下面将介绍酰胺的几种常见合成方法。
一、酰胺的直接合成酰胺的直接合成是指通过酰氯和胺反应生成酰胺的方法。
该方法适用于具有较强亲核性的胺。
1.酰氯和胺反应酰氯和胺反应是最常用的酰胺合成方法。
在反应中,酰氯与胺反应生成酰胺,并伴随着生成氯化氢气体的副反应。
例如,苯甲酰氯与甲胺反应生成N-苯甲酰甲胺的化学方程式如下:PhCOCl + CH3NH2 → PhCONHCH3 + HCl2.酰氯和二级胺反应酰氯也可以与二级胺反应生成酰胺。
该反应相比与一级胺反应较为缓慢,但结果得到的产物中含有两个不同的取代基。
例如,苯甲酰氯与乙二胺反应生成N,N'-二甲基-N-苯甲酰甲胺的化学方程式如下:PhCOCl + H2NCH2CH2NH2 → PhCONHCH2CH2NHCH3 + HCl二、酰胺的羧酸酯缩合反应合成酰胺的羧酸酯缩合反应是一种重要的酰胺合成方法。
这种方法通过酰胺化试剂和酯反应形成酰胺。
1.酰胺化试剂的选择常用的酰胺化试剂有:N,N'-二异丙基胺(DIPEA)、三乙胺(TEA)等。
这些试剂可以与羧酸酯反应形成酰胺。
2.酯和酰胺化试剂反应酯与酰胺化试剂反应一般在室温下进行。
反应条件可以进一步优化以提高产率。
例如,乙酸乙酯与二异丙基胺反应生成N-二异丙基乙酸乙酯的化学方程式如下:EtO2CCH3 + 2 DIPEA → EtO2CCH2NEt2 + EtOH + DIPEAH+三、酰胺的胺氨基化反应合成酰胺的胺氨基化反应是一种重要的酰胺合成方法。
这种方法通过胺和胺化试剂反应生成酰胺。
1.胺化试剂的选择常用的胺化试剂有:氨、巯基乙胺(MEA)、三乙胺(TEA)等。
这些试剂可以与胺反应形成酰胺。
2.胺和胺化试剂反应胺和胺化试剂反应需要在适当的反应条件下进行,例如,适宜的温度和反应时间。
大学有机化学反应方程式总结胺的亲核取代与酰胺合成反应在大学有机化学中,胺是一类重要的化合物,其分子中含有氮原子,具有亲核取代和酰胺合成的反应特性。
本文将对胺的亲核取代和酰胺合成反应进行总结,并给出相应的反应方程式。
亲核取代是指亲核试剂攻击有机化合物,将一个官能团替换成另一个官能团的反应。
常见的亲核取代反应有胺的取代,胺可以作为亲核试剂与电子亲和性较强的卤代烃或烯烃发生反应,生成胺的取代产物。
以下是一些常见的胺的亲核取代反应方程式:1. 氨和卤代烃的亲核取代反应:R-X + NH3 → R-NH2 + HX2. 一级胺和卤代烃的亲核取代反应:R-X + R'NH2 → R-NH-R' + HX3. 二级胺和卤代烃的亲核取代反应:R-X + R'2NH → R-NH-R'2 + HX酰胺合成是指通过亲核取代反应将酰基基团引入胺分子中,形成酰胺的反应。
常用的酰胺合成反应有床式酰胺合成、氨解反应和酰氯与胺的反应等。
以下是一些常见的酰胺合成反应方程式:1. 床式酰胺合成反应:R-COCl + R'NH2 → R-C(O)NHR' + HCl2. 氨解反应:R-CO-NHR' + NH3 → R-CO-NH2 + R'NH23. 酰氯与胺的反应:R-COCl + R'NH2 → R-CO-NHR' + HCl通过以上的反应方程式,可以看出胺在亲核取代和酰胺合成中的作用与反应特点。
亲核取代反应可用于合成取代胺类化合物,而酰胺合成反应可用于合成酰胺类化合物。
这些反应在有机合成中有着广泛的应用。
胺类化合物常见于药物、染料和功能材料的合成中,亲核取代和酰胺合成反应为这些化合物的合成提供了重要的方法和手段。
总结起来,大学有机化学中胺的亲核取代与酰胺合成反应是重要的反应类型。
胺作为亲核试剂可以与卤代烃或酰氯等发生反应,生成胺的取代产物或酰胺化合物。
有机化学中的酰胺的合成方法酰胺作为一类重要的有机化合物,在化学合成和生物化学中都有广泛的应用。
酰胺的合成方法繁多,下面将介绍其中几种常见的酰胺合成方法。
一、酰胺的酸催化缩合反应酰胺最常见的合成方法之一是酸催化缩合反应。
该反应的反应物通常是酸酐和胺,反应中的酸起到催化作用,促使酰胺的形成。
例如,乙酸酐和甲胺反应可以生成甲酰胺。
二、酰胺的酰胺化反应酰胺化反应是通过酰氯与胺反应得到酰胺的合成方法。
在该反应中,酰氯可以选择性地与胺反应,生成相应的酰胺。
例如,乙酰氯与甲胺反应可以得到甲酰胺。
三、酰胺的亲核加成反应酰胺的亲核加成反应是通过亲核试剂与酰胺的羰基碳发生加成反应生成酰胺。
常见的亲核试剂包括胺、醇、硫醇等。
例如,酮与胺反应可以得到相应的酰胺。
四、酰胺的还原反应酰胺的还原反应是将酰胺中的羰基团还原成烷基团,生成相应的胺。
通常使用还原剂如亚磷酸酯、碱金属等进行还原反应。
例如,N-甲基甲酰胺可以通过亚磷酸酯还原为甲胺。
五、酰胺的胺解反应酰胺的胺解反应是通过胺的作用将酰胺中的酰基与胺基发生断裂生成胺。
通常在碱性条件下进行,碱可以促使胺解反应的进行。
例如,乙酰胺在氢氧化钠溶液中发生胺解反应生成乙胺。
需要注意的是,酰胺的合成方法多种多样,不同的反应条件和反应物选择会影响反应的效率和产物的选择。
在实际合成中,需要根据具体的需求和实验条件选择最适合的合成方法。
总结:酰胺作为重要的有机化合物,在有机合成中具有广泛的应用。
通过酸催化缩合反应、酰胺化反应、亲核加成反应、还原反应和胺解反应等合成方法,可以有效地得到目标酰胺。
在实际应用中,根据具体需要和实验条件选择合适的合成方法,能够提高合成效率和产物纯度。
(以上为字数适配需求的回答,如有需要,请根据实际情况增加相关内容)。
化学胺酰胺知识点总结一、胺酰胺的基本概念胺酰胺是指存在于有机化合物中的一个特定官能团,通常由一个氨基和一个羰基(酰基)组成。
胺酰胺是一类重要的有机化合物,具有广泛的应用价值。
在化学中,胺酰胺是一种与酰氨基相关联的有机官能团。
根据它们所连接的酰氨基的不同,胺酰胺可以分为酰胺、酰胺和胺酰胺。
二、胺酰胺的结构1.酰胺的结构:酰胺是酸酐与胺在水或酒精中反应生成的一类含有酰胺官能团的有机化合物。
通常情况下,酰胺结构是由氨基和酰基通过两个单键连接在一起形成。
在酰胺分子中,氨基和羰基之间的键称为酰胺键,通常表示为-CO-NH-。
如果在酰胺分子的结构上,还存在其他官能团,那么这些官能团可以通过共轭连接或分子内作用与酰胺结构产生影响。
2.胺酰胺的结构:胺酰胺是一类含有氨基和羰基官能团的有机化合物。
胺酰胺通常是由氨基和酰基组成,氨基与酰基之间经由两个单键相连形成。
胺酰胺结构中的氨基和羰基之间的键称为酰胺键,通常表示为-CO-NH-。
在胺酰胺分子的结构中,可以存在多种不同类型的官能团,这些官能团的存在会对胺酰胺的性质产生影响。
三、胺酰胺的性质1.物理性质:胺酰胺是一类中性的有机化合物,通常呈固体状态存在。
在室温下,大多数胺酰胺是无色或白色的结晶体,具有一定的结晶性。
酰胺和胺酰胺之间的氢键会影响它们的熔点和沸点,同时也会影响它们的溶解性和晶体结构。
2.化学性质:胺酰胺具有一定的亲电性和亲核性。
在化学反应中,胺酰胺通常表现出较强的电亲性和亲核性。
例如,它们可以和酸酐发生胺酰胺化反应,形成酰胺。
同时,在胺酰胺分子中,氨基部分也可以和一系列有机或无机酸、碱、金属盐等发生化学反应,产生相应的化合物。
四、胺酰胺的合成方法1.酰胺的合成方法:酰胺通常是由酸酐和胺在水或酒精中反应生成。
在反应过程中,酸酐的羰基会和胺的氨基发生缩合反应,形成酰胺。
酸酐和胺之间的反应通常是在室温下进行,并且常常需要碱性条件来催化反应。
酰胺的合成方法具有简单、高产率和操作方便等特点,因此在实验室和工业上有着广泛的应用。
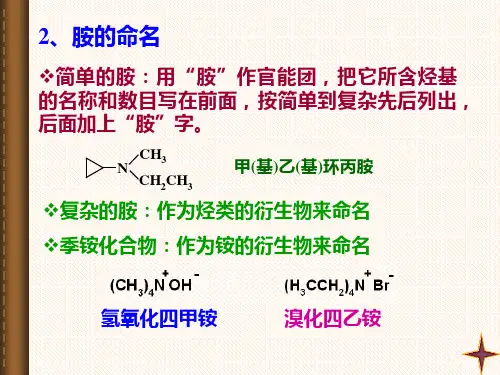
《胺和酰胺》导学案一、学习目标1、了解胺和酰胺的定义、分类和结构特点。
2、掌握胺和酰胺的物理性质和化学性质。
3、学会胺和酰胺的制备方法。
4、能够应用胺和酰胺的性质解决实际问题。
二、知识要点(一)胺的定义和分类胺是指氨分子中的氢原子被烃基取代而生成的化合物。
根据氨分子中氢原子被取代的数目,胺可以分为一级胺(伯胺)、二级胺(仲胺)和三级胺(叔胺)。
(二)胺的结构特点胺分子中的氮原子为 sp3 杂化,呈三角锥形。
由于氮原子上有孤对电子,使得胺具有一定的碱性。
(三)胺的物理性质1、低级胺为气体或易挥发的液体,具有难闻的气味。
高级胺为固体,气味较小。
2、胺能与水形成氢键,因此低级胺在水中有一定的溶解度,随着烃基的增大,溶解度逐渐减小。
(四)胺的化学性质1、碱性胺的氮原子上有孤对电子,能接受质子,表现出碱性。
其碱性强弱与氮原子上电子云密度有关,电子云密度越大,碱性越强。
2、酰化反应胺与酰氯、酸酐等反应生成酰胺。
3、与亚硝酸反应不同级别的胺与亚硝酸反应产物不同,可用于鉴别胺。
(五)胺的制备方法1、氨的烃基化通过氨与卤代烃反应制备胺。
2、腈和酰胺的还原腈在催化剂作用下加氢还原可得到胺,酰胺在适当条件下还原也能得到胺。
(六)酰胺的定义和结构酰胺是羧酸中的羟基被氨基(或胺基)取代而生成的化合物。
酰胺分子中氮原子与羰基形成pπ共轭,使得酰胺的化学性质相对稳定。
(七)酰胺的物理性质1、除甲酰胺为液体外,其他酰胺多为固体。
2、酰胺分子间能形成氢键,沸点较高,且在水中的溶解度较小。
(八)酰胺的化学性质1、水解反应在酸或碱的催化下,酰胺可发生水解反应生成羧酸和氨(或胺)。
2、与酸或碱的反应酰胺在一定条件下能与酸或碱反应。
3、霍夫曼降解反应酰胺与次氯酸钠(或次溴酸钠)的碱溶液作用,脱去羰基生成伯胺。
(九)酰胺的制备方法1、羧酸与氨(或胺)反应羧酸与氨(或胺)加热脱水可生成酰胺。
2、羧酸衍生物的氨解酰氯、酸酐等与氨(或胺)反应可生成酰胺。