第14章 镧系和锕系元素 习题参考答案
- 格式:doc
- 大小:61.00 KB
- 文档页数:1

![镧系元素和锕系元素[知识研究]](https://uimg.taocdn.com/9dfa421d852458fb770b5687.webp)

镧系元素和锕系元素1.从Ln 3+的电子构型,离子电荷和离子半径来说明三价离子在性质上的类似性。
2.试说明镧系元素的特征氧化态是+3,而铈、镨、铽却常呈现+4,钐、铕、镱又可呈现+2。
3.何谓“镧系收缩”,讨论出现这种现象的原因和它对第五、六周期中副族元素性质所产生的影响。
4.稀土元素有哪些主要性质和用途?5.试述镧系元素氢氧化物Ln(OH)3的溶解度和碱性变化的情况。
6.稀土元素的草酸盐沉淀有什么特性?7.Ln 3+离子形成配合物的能力如何?举例说明它们形成鳌合物的情况与实际应用。
8.锕系元素的氧化态与镧系元素比较有何不同?9.水合稀土氯化物为什么要在一定真空度下进行脱水?这一点和其他哪些常见的含水氯化物的脱水情况相似?10.写出Ce 4+、Sm 2+、Eu 2+、Yb 2+基态的电子构型。
11.试求出下列离子成单电子数:La 3+、Ce 4+、Lu 3+、Yb 2+、Gd 3+、Eu 2+、Tb 4+。
12.完成并配平下列反应方程式:(1)EuCl 2+FeCl 3 →(2)CeO 2+HCl → (3)UO 2(NO 3)2 → (4)UO 3 →(5)UO 3+HF →(6)UO 3+NaOH →(7)UO 3+SF 4 →(8)Ce(OH)3+NaOH +Cl 2 →(9)Ln 2O 3+HNO 3 →13.稀土金属常以+3氧化态存在,其中有些还有其他稳定氧化态。
如Ce 4+和Eu 2+。
Eu 2+的半径接近Ba 2+。
怎样将铕与其他稀土分离?14.f 组元素的性质为什么不同于d 组元素?举例说明。
△ △15.讨论下列性质(1)Ln(OH)3的碱强度随Ln原子序数的提高而降低?(2)镧系元素为什么形成配合物的能力很弱?镧元素配合物中配位键主要是离子性的?(3)Ln3+离子大部分是有色的,顺磁性的。
16.回答下列问题:(1)钇在矿物中与镧系元素共生的原因何在?(2)从混合稀土中提取单一稀土的主要方法有哪些?(3)根据镧系元素的标准电极电势,判断它们在通常条件下和水及酸的反应能力。



稀土元素化学习题答案1.简要回答下列问题:(1)什么叫稀土元素?什么叫镧系元素?答:稀土元素:镧系元素以及与镧系密切相关的钪(Sc)、钇(Y)共17种元素,称为稀土元素。
镧系元素:镧(La)、铈(Ce)、镨(Pr)、钕(Nd)、钷(Pm)、钐(Sm)、铕(Eu)、钆(Gd)、铽(Tb)、镝(Dy)、钬(Ho)、铒(Er)、铥(Tm)、镱(Yb)、镥(Lu)等15种元素。
(2) 何谓“镧系收缩”,说明其产生的原因。
答:镧系收缩是指从镧到镥随着原子序数的增加,它们的原子半径、离子半径均逐渐减小的现象。
原因:镧系元素中每增加一个质子,相应的一个电子进入4f轨道,而4f电子对原子核的屏蔽作用与内层电子相比较小,有效核电荷数增加较大,核对最外层电子的吸引力增加。
(3) 为什么镧系元素的电子结构在固态和气态不同?这对元素的特性会造成什么影响?答:金属由气态变为固态,原子间通过金属键的形式结合为金属晶体,该过程价层轨道重叠,由于镧系原子外层轨道的伸展程度是按4f-5d-6s的顺序增大的,即4f轨道的相互重叠比5d、6s轨道困难得多,当镧系元素的原子间形成金属键时,主要是通过6s及5d 轨道的重叠,而4f轨道并不参与。
由于,电子迁跃需要吸收能量(激发能),但迁跃的结果,增加了一个成键电子,可以释放出一份成键能。
对于大多数镧系元素的原子,成键能大于激发能,从而导致4f电子向5d的跃迁。
影响:使镧系金属键的成键电子数除Eu、Yb外其余都为3。
为什么镧系元素彼此间化学性质的差别比锕系元素彼此间的差别要小得多?答:锕系的收缩一般比镧系的收缩要小一些。
(5) 镧系离子的电子光谱同d区过渡金属离子相比有什么不同?为什么?答:镧系离子可以观察到的光谱线大约有30000 条,而具有未充满d电子壳层的过渡金属元素的谱线约有7000条。
镧系离子的电子光谱呈窄的线状,光谱的位移和劈裂受环境的影响较小,而d区过渡金属离子吸收光谱为带状光谱。

第十四章镧系和锕系元素
本章要求了解镧系和锕系元素的通性,我国稀土元素的概况以及核反应的类型。
f 区元素包括周期系中的镧系元素(原子序数57~71共15种元素)和锕系元素(原子序数89~103共15种元素)。
镧系元素中只有钷是人工合成的,具有放射性。
锕系元素均有放射性,铀后元素为人工合成元素,称超铀元素。
锕系元素中的钍(Th)和铀(U)在地壳内储量较多,而锕(Ac)、镤(Pa)、镎(Np)、钚(Pu)则极微。
周期系第ⅢB组中的钪、钇和镧以及其它镧系元素(共17种元素)性质都非常相似,并在矿物中共生在一起,总称为稀土元素,常用RE(Rare Earth)表示
f 区元素的价层电子构型为(n-2)f0~14(n-1)d0~2n s2, 其特征是随着核电荷的
增加,电子依次填入外数第三层(n-2)f 轨道,因而又统称内过渡元素。
14-1 镧系和锕系元素概述
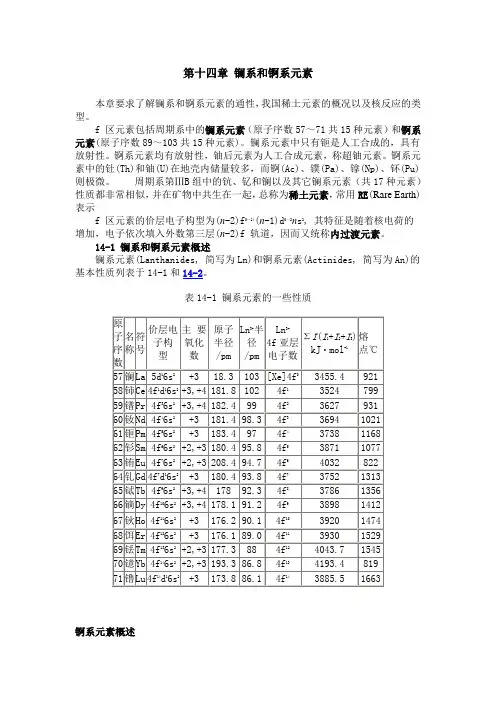
镧系元素(Lanthanides, 简写为Ln)和锕系元素(Actinides, 简写为An)的基本性质列表于14-1和14-2。
表14-1 镧系元素的一些性质
锕系元素概述
锕系元素(Actinides, 简写为An, 原子序数89~103, 共15种元素)。
锕系元素均有放射性,铀后元素为人工合成元素,称超铀元素。
锕系元素中的钍(Th)和铀(U)在地壳内储量较多,而锕(Ac)、镤(Pa)、镎(Np)、钚(Pu)则极微。
表14-2 锕系元素的基本性质。

第十四章 卤素元素习题参考答案1解:因单质氟活泼性高,会与水强烈反应,所以不能用KF 的水溶液。
液态HF 中因氟化氢以分子形式存在,不产生F -和H +,所以不导电。
而在氟化钾的无水氟化氢溶液中大量存在K +和HF 2-离子,导电能力强。
2解:氟的特殊性表现在:(1)电子亲合势:F 反常的小于Cl (2)解离能:F 2反常的低于Cl 2(3)F 2是单质中最强的氧化剂(4)氟化物的稳定性最高。
氟化氢和氢氟酸的特性:氟化氢的熔点、沸点和气化热等特别的高(因氢键的存在)。
其余的氢卤酸都为强酸,只有氢氟酸为弱酸(因H-F 键键能太大)。
在氢氟酸酸浓度低时,酸浓度越稀,HF 电离度越大。
而在酸浓度高时,酸浓度越大,HF 电离度反而增大,酸的强度也增加。
这是因为在高浓度的HF 存在下形成了H[HF 2]酸,使其变为强酸导致。
3解:(1)已知Ψ0(MnO 4/Mn 2+)=+1.491V, Ψ0(Cr 2O 72-/Cr 3+)=+1.23V, Ψ0(MnO 2/Mn 2+)=+1.228V, Ψ0(Cl 2/Cl - )=+1.36V. 则氧化剂的氧化性相对强弱为:MnO 4- >Cr 2O 72- >MnO 2 ,所以与Cl -反应的趋势应依次减弱(理论上).(2) 使用MnO 2,其反应式为: MnO 2+4HCl==MnCl 2+2H 2O+Cl 2设HCl 最低浓度为Xmol/L,[H +]=[Cl -]=X (mol/L)由奈斯特方程可得:4422][][]][[lg 0592.02-+-+Φ-=Cl H P Cl Mn n E E Cl 242//][][][lg 20592.02222-++ΦΦ--=-+Cl H P Mn Cl Cl Cl Mn MnO ϕϕ 令P Cl2 =1atm, [Mn 2+]=1.0 mol/L01lg 20592.036.1228.16>--=xE 则反应可以向右进行 即 61lg 20592.0132.0x >- 则 X > 5.54 (mol/L) 9解:取少量固体分别放入三只试管中,加入稀H 2SO 4,有气体(Cl 2)产生,并可使KI 淀粉试纸变兰色,则为KClO(或者溶液显碱性的为KClO).在剩下的两只试管中通入H 2S,有淡黄色沉淀析出的为KClO 3,无反应现象的为KClO 4.11解:(1)由这两个半反应组成一个原电池,则其电池的总反应为: I 2(aq)== I 2(s)E 0=0.621-0.535=0.086(V)又: 905.20592.0086.020592.0lg =⨯==ΦnE K ∴ K=804.3 而 3.804][12==)(平aq I K ∴ [I 2(aq)]=0.00124 (mol/L)(2)设平衡时生成I 3-为x mol/L,对于平衡I 2 + I - == I 3 -起始浓度: 0.1 0.1 0平衡浓度: 0.1-x 0.1-x x752.0)1.0(]][[][223=-==--x x I I I K C ∴ x=0.00665(mol/L )则达到平衡时I 2的浓度为0.1-0.00665=0.0934(mol/L )12解:A 为I 2的溶液,B 为含IO 3-的溶液,C 为含I -的溶液.(1)因Ψ0(ClO -/Cl -)=+0.81V>Ψ0(I 2/I -)=+0.535V , 则ClO -可以把I -氧化为单质I 2,而单质碘遇淀粉会变为兰色,反应为: 2KI+NaClO+H2O==I2+NaCl+2KOH(2)又因在碱性介质中: Ψ0(IO3-/I2)=+0.205V 则ClO-还可继续把单质I2氧化为无色的IO3-, 反应为: I2+5NaClO(过)+2OH-==2IO3-+5NaCl+H2O(3)而在酸性介质中: Ψ0(SO42-/SO32-)=+0.172V, Ψ0(IO3-/I2)=+0.1.195V, 则IO3-在酸性介质中又可以把SO32-氧化为SO42-,而自身还原为I2,遇淀粉就变蓝.反应为:2IO3-+5Na2SO3+2H+ == I2+5Na2SO4+H2O .(4)Na2SO3过量时,可把I2进一步还原为I- : I2 + Na2SO3 + H2O == Na2SO4 + 2HI(5)再加NaIO3时,则与I-反应生成I25I - + IO3- + 6H+ == 3I2 + 3H2O。

第14讲元素周期律和元素周期表1.IUPAC(国际纯粹与应用化学联合会)宣布,第112号化学元素正式名称为“Copernicium”,元素符号为“Cn”,以纪念著名天文学家哥白尼,该元素的一种核素含有的中子数为165。
下列关于Cn的说法正确的是()A.Cn位于第六周期,ⅡB族B.Cn是过渡元素C.Cn是非金属元素D.Cn元素的近似相对原子质量为277【答案】B【解析】根据稀有气体原子序数He为2、Ne为10、Ar为18、Kr为36、Xe为54、Rn 为86,118号位于第七周期0族,可知112号元素位于第七周期ⅡB族;属于过渡元素;属于金属元素;Cn元素的该核素的质量数=质子数+中子数=277,Cn元素的相对原子质量则是各同位素原子按原子个数百分比计算出的平均值,故B正确。
2.A、B、C均为短周期元素,它们在周期表中的位置如图所示。
已知B、C元素的原子序数之和是A元素原子序数的4倍,则A、B、C分别为()A.Be、Na、Al B.B、Mg、SiC.O、P、Cl D.C、Al、P【答案】C【解析】因A、B、C均为短周期元素,故A处于第二周期、B、C处于第三周期,同一主族二、三周期原子序数相差8,设A的原子序数是x,则B的原子序数是x+8-1=x +7,C的原子序数是x+8+1=x+9,根据题意得(x+7)+(x+9)=4x,解得x=8,即A为O,B为P,C为Cl。
3.我国神舟号飞船使用的砷化镓(GaAs)太阳能电池是我国自主研发、生产的产品。
在元素周期表中P与As同主族,Al与Ga同主族,Ga与As同周期,下列说法错误的是() A.酸性:H3AsO4<H3PO4B.还原性:AsH3>PH3C.原子半径:Ga>AsD.失电子能力:Ga<As【答案】D【解析】P与As同主族,非金属性As<P,则酸性H3AsO4<H3PO4,故A正确;非金属性As<P,故还原性:AsH3>PH3,故B正确;Ga、As同周期,且As的核电荷数更大,故原子半径:Ga>As,故C正确;Ga的金属性强于As,故失电子能力:Ga>As,故D错误。
镧系元素部分习题1. 写出下列元素原子的基态电子构型:24Cr : 3d54s159Pr : 4f36s22. 请写出Eu 、Yb的价层电子构型,为什么Eu、Yb的原子半径比左右相邻元素大,而它们的熔点比相邻元素低?Eu:4f76s2Yb: 4f146s2因为E u,Yb的价层电子构型可知其为稳定的结构,所以对核产生较大的屏蔽作用,而使Eu,Yu,的原子半径比左右相邻的都要大。
(影响半径大小的为d,等价电子层对原子核的屏蔽作用,屏蔽作用强,原子受到原子核的屏蔽作用增强,而对于镧系金属,随原子序数的增加,4f电子对核的屏蔽作用降低,进而使最外层电子受到强的核吸引力,所以半径由左至右依次降低,其次因为f层电子的电子分散相对较散,再填充4f轨道式,由于4f电子相互之间的屏蔽作用也不完全,所以使4f电子所收到的有效核电荷数也在逐渐增加,结果使得4f核层也逐渐缩小。
)4.与过渡金属的配合物相比较,镧系离子形成电子光谱的特点是什么?答:光谱特点 1.大多数Ln3+离子在可见光区内有吸收。
2.具有相同未成对f电子的稀土离子具有相近的颜色。
3.Ln3+离子是由f-f跃迁产生的。
f-f 跃迁属于禁阻跃迁,其吸收光谱的摩尔消光系数很小(约为0.51·mol-1·cm-3)。
4.其吸收光谱为类原子的线状光谱5.也可以发生Ln3+配体间的电荷迁移光谱,这时摩尔消光系数较大(约50~1000l·mol-1·cm-3)5. 什么是镧系收缩?镧系收缩造成的结果是什么?答:镧系收缩指:镧系元素的原子半径和离子半径随原子序数的增大总的趋势呈现逐渐见效的现象。
答:1是由于4f 电子对原子核的屏蔽作用比较弱,随着原子序数的递增,外层电子所经受的有效核电荷缓慢增加,外电子壳层依次有所缩小。
2. 由于f 轨道的形状太分散,4f 电子互相之间的屏蔽也非常不完全,在填充f 电子的同时,每个4f 电子所经受的有效核电荷也在逐渐增加,结果使得4f 壳层也逐渐缩小。