大学普通化学期末考试复习资料副本
- 格式:doc
- 大小:527.00 KB
- 文档页数:12

《大学化学》习题答案复习学习材料、试题与参考答案一、单选题1.江、河水中含的泥沙悬浮物在出海口附近都会沉淀下来,原因有多种,其中与胶体化学有关的是(B)A.盐析作用B.电解质聚沉作用C.溶胶互沉作用D.破乳作用2.下列各组量子数合理的是(C)A.B.C.D.3.下列各物质的分子间只存在色散力的是(A)A.B.C.D.4.下列物质中不属于毒品的是(B)A.吗啡B.黄曲霉素C.海洛因D.冰毒5.下列物质中,属于致癌物质的是:(B)A.谷酰胺B.苯并芘C.谷氨酸D.谷胱甘肽6.稀溶液依数性中心的核心性质是(D)A.溶液的沸点升高B.溶液的凝固点下降C.溶液是有渗透压D.溶液的蒸气压下降7.盖斯定律适用条件是(B)A.定温或定压B.定压或定容C.定温或定容D.不确定8.下列各种与爱滋病人接触途径中不会感染爱滋病的是(C)A.共用注射器B.性接触C.握手D.母婴传播9.导电性能最好的金属是(A)10.在定温定压条件下,某反应的,这表明该反应(B)A.正向自发进行B.逆向自发进行C.视具体情况而定D.不能确定11.下列哪种现象不属于稀溶液的依数性:(D)A.凝固点降低B.沸点升高C.渗透压D.蒸气压升高12.真实气体行为接近理想气体性质的外部条件是:(B)A.低温高压B.高温低压C.低温低压D.高温高压13下列分子中键角最大的是:(C)A.B.C.D.14.已知氢氧化合反应:,反应,要有利于取得的最大转化率,可采取的措施是(A)A.低温高压B.高温低压C.低温低压D.高温高压15.下列对于功和热叙述中正确的是(A)A.都是途径函数,无确定的变化途径就无确定的数值B.都是途径函数,对应于某一状态有一确定值C.都是状态函数,变化量与途径无关D.都是状态函数,始终态确定,其值也确定16.试指出下列物质中何者不含有氢键(B)A.B.HIC.D.17.在下列溶液中AgCl的溶解度最小的是(B)A.0.1mol/L的NaCl溶液B.0.1mol/L的溶液C.0.1mol/L的溶液D.0.5mol/L的溶液18.下列常用的能源中,属于新能源的是(C)A.石油B.天然气C.氢能D.水能19.下列各物质的化学键中,只存在键的是(C)A.B.C.D.无法确定20.将非挥发性溶质溶于溶剂中形成稀溶液时,将引起(A)A.沸点升高B.熔点升高C.蒸气压升高D.都不对21.以电对与组成原电池,已知,则反应物是(A)A.B.C.D.22.下面的叙述中违背平衡移动原理的是(C)A.升高温度平衡向吸热方向移动B.增加压力平衡向体积缩小的方向移动C.加入惰性气体平衡向总压力减少的方向移动D.降低压力平衡向增加分子数的方向移动23.电镀工艺是将欲镀零件作为电解池的(A)A.阴极B.阳极C.阴阳两极D.无法确定24.已知下列反应的平衡常数:(1)A=B;;(2)B+C=D;;则反应:A+C=D的平衡常数是下列中的(B)A.B.C.D.25.下列各物质中,含有氢键的是(A)A.HFB.NaClC.D.26.在定温定压条件下,某反应的ΔG>0,这表明该反应(A)A正向自发进行B逆向自发进行C视具体情况而定D不能确定27.试指出下列物质中何者不含有氢键(B)A.B(OH)3B.HIC.CH3OHD.H2NCH2CH2NH228.电镀工艺是将欲镀零件作为电解池的(A)A阴极B阳极C阴阳两极D无法确定29.在稀醋酸溶液中,加入等物质量的固态NaAc,在混合溶液中不变的量是A.PhB.电离度C.电离常数D.OH-离子的浓度31.下列各物质结构中,含有叁键的是 (C)A.乙烯B.H2OC.N2D.BF332.一支充满氢气的气球,飞到一定高度即会爆炸,这主要取决于一定高度上的(D)A.外压B.温度C.湿度D.外压和温度二、多选题33.下列各种与爱滋病人接触途径中会感染爱滋病的是 (ABD)A.共用注射器B.性接触C.握手D.母婴传播34.下列对于功和热叙述中错误的是 (BCD)A.都是途径函数,无确定的变化途径就无确定的数值B.都是途径函数,对应于某一状态有一确定值C.都是状态函数,变化量与途径无关D.都是状态函数,始终态确定,其值也确定35.下面的叙述中违背平衡移动原理的是 (ABD)A.升高温度平衡向吸热方向移动B.增加压力平衡向体积缩小的方向移动C.加入惰性气体平衡向总压力减少的方向移动D.降低压力平衡向增加分子数的方向移动三、判断题36.在晶态高聚物中,通常可同时存在晶态和非晶态两种结构。

《普通化学》综合复习资料.doc《普通化学》综合复习资料⼀、判断题1、体系和环境Z间的能量交换⽅式有热传递和做功,另外还有其他的⽅式。
(X )2、BF3和NH3都是⾮极性分⼦。
(x )3、可逆反应达平衡时,正反应速率与逆反应速率相等。
(勺)4、在0.1mol dm-3H2S 溶液中,c(H+): c(S2_)=2: 1。
( x )5、分⼦品体熔沸点的⾼低,决定于分⼦内部共价键的强弱。
(x )6、同⼀聚集状态的物质的标准摩尔嫡值在低温时⼤于⾼温时的燔值。
(x )7、内轨型配合物的⼬⼼离⼦采⽤内层轨道进⾏杂化,(n-l)d轨道的能量⽐nd轨道低,所以内轨型配合物[Fe(CN)6⼴⽐外轨型配合物[FeF6]3-稳定。
(7 )8、在任意条件下,标准电极电势⼤的电对中氧化态物质在反应过程中做氧化剂。
(x )9、由于Si原⼦和Cl原⼦的电负性不同,所以SiC14分⼦具有极性。
(x )10、sp杂化轨道成键能⼒⽐杂化前的s 轨道和p轨道成键能⼒都强。
(7 )11、通常所谓的原⼦半径,并不是指单独存在的⾃由原⼦本⾝的半径。
(x )12、在放热反应中,温度升⾼不会影响反应的平衡常数。
(x )13、标准吉布斯函数变⼩于零的反应可以⾃发进⾏。
(x )14、同⼀⾮⾦属元素⾼价态的氯化物⽐低价态的溶沸点⾼。
(7 )15、AS〉。
的反应⼀定是⾃发反应。
(x )16、温度升⾼,化学反应速度加快的主要原因是温度升⾼,反应物分⼦的热运动速度加快,分⼦的碰撞频率增⼤。
(x )17、催化剂能够改变化学反应速率的原因是因为催化剂参加了化学反应,改变了化学反应的途径,降低了化学反应的活化能。
(P )18、化学反应的级数等于反应物分⼦在化学反应⽅程式中的计量系数之和。
(x )19、氯原⼦轨道的能级只与主量⼦数(n)有关。
(x )20、配合物⼬,配位数是指配位体的数⽬。
(x )21、原电池反应中,某电对的电极电势与电极反应的写法⽆关。
(7 )22、弱酸浓度越稀,解离度越⼤,溶液的pH值越⼩。

《普通化学》课程综合复习资料一、判断题1、稳定单质在298K时的∆f H mӨ和S mӨ均为零。
答案:×2、凡中心原子采取sp3杂化的分子,其分子空间构型都是四面体。
答案:×3、在NH3分子中三个N-H键的键能是一样的,因此破坏每个N-H键所消耗的能量也相同。
答案:×4、共价单键一般是σ键,而共价双键一定有一个π键。
答案:√5、在标准状态下,反应的标准平衡常数KӨ=1。
答案:×6、NH3和H2O的分子构型虽然不同,但其中心离子采取的杂化方式都是sp3不等性杂化。
答案:√7、两原子间形成共价键时,首先形成的一定是σ键。
答案:√8、BF3和NH3都是极性分子。
答案:⨯9、内轨型配合物的中心离子采用内层轨道进行杂化,(n-1)d轨道的能量比nd轨道低,所以内轨型配合物[Fe(CN)6]3-比外轨型配合物[FeF6]3-稳定。
答案:√10、FeCl3的熔点比FeCl2的熔点高,是因为Fe3+离子的电荷数多、半径小,比Fe2+离子的极化力强。
答案:⨯11、0∆S的反应一定是自发反应。
>答案:×12、原电池反应达到平衡时,标准电池电动势等于零(EӨ=0)。
答案:×13、在电解反应中,用普通金属做电解电极时,阳极发生的反应一定是金属阳极溶解。
14、角量子数等于2 时为d轨道,共有五个轨道。
答案:√15、sp杂化轨道空间构型为平面三角形。
答案:×16、升高温度,会使反应速率和反应程度都得到提高。
答案:×17、一切非极性分子中的化学键都是非极性键。
答案:×18、反应前后,催化剂的物理性质和化学性质都不会发生变化。
答案:×19、非极性分子与极性分子间只存在诱导力。
答案:×20、配位化合物都是由内界和外界所组成的。
答案:×二、单选题1、在0.05 mol·L-1HCN溶液中,若HCN的解离度为0.01%,则其解离常数KӨa近似为()。


学好大学化学很简单 就是要学会 “穿线” 正文如下:大学化学第一章 热化学与反应重要概念1.系统:客观世界是有多种物质构成的,但我们可能只研究其中一种或若干物质。
人为地将一部分物质与其他物质分开,被划分的研究对象称为系统。
2.相:系统中具有相同物理性质和化学性质的均匀部分称为相。
3.状态:是指用来描述系统的诸如压力P 、体积V 、温度T 、质量m 和组成等各种宏观性质的综合表现。
4.状态函数:用来描述系统状态的物理量称为状态函数。
5.广度性质:具有加和性,如体积,热容,质量,熵,焓和热力学能等。
6.强度性质:不具有加和性,仅决定于系统本身的性质。
如温度与压力,密度等。
系统的某种广度性质除以物质的量或者质量之后就成为强度性质。
强度性质不必指定物质的量就可以确定。
7.热力学可逆过程:系统经过某种过程由状态1到状态2之后,当系统沿着该过程的逆过程回到原来状态时,若原来的过程对环境产生的一切影响同时被消除(即环境也同时复原),这种理想化的过程称为热力学的可逆过程。
8.实际过程都是不可逆的,可逆过程是一种理想过程。
9.化学计量数:0=∑BVB B表示反应中物质的化学式,VB是B 的化学计量数,量纲为一;对反应物取负值,生成物取正值。
10.化学计量数只表示当安计量反应式反应时各物质转化的比例数,并不是各反应物质在反应过程中世界所转化的量。
11.反应进度ξ:b b v /n ∆=∆ξ 对于化学反应来讲,一般选未反应时,0=ξ 引入反应进度这个量最大的优点是在反应进行到任意时刻时,可用任一反应物或产物来表示反反应进行的程度,所得的值总是相等的。
12.反应热的测定:T C T m c T T m c q s s s 12s s ∆⋅-=∆⋅⋅-=-⋅⋅-=)(所用到的仪器是弹式热量计又称氧弹 弹式热量计中环境所吸收的热可划分为两部分:主要部分是加入的吸热介质水所吸收的,另一部分是金属容器等钢弹组件所吸收的。
前一部分的热用)(O H q 2表示,后一部分热用b q 表示,钢弹组件的总热容b C 告诉了则直接求得b q 。

普通化学复习资料第一、二章(+)1、功和热是在系统和环境之间的两种能量传递方式,在系统内部不讨论功和热。
(× )12.系统由状态1变化到状态2,途径不同,Q 、w不同,所以Q+w 不同。
(√ )4.对化学反应而言,其等压热效应等于系统的焓变。
(√ )6.有气体参加的反应,改变总压,不一定使平衡移动,而改变任意气体的分压,则一定是破坏平衡。
(√ )8.在绝对零度时,一切纯物质的完美晶体的熵值都等于零。
(√ )9.一个热力学稳定系统必然在动力学上也是稳定的。
(× )2、一切放热反应都是自发反应。
(√ )4、有气体参加的反应,改变总压,不一定使平衡移动,而改变任意气体的分压,则一定是破坏平衡。
(√ )8、生成焓的负值越大,表明该物质键能越大,对热越稳定。
(× )10.标准平衡常数就是化学反应在标准条件下达到平衡时的反应商。
(× )11.化学方程式中各反应物浓度指数之和称为反应级数。
(√ )1、一次污染的危害性比二次污染危害性小。
(× )2、反应的级数取绝于反应方程式中反应物的化学计量数(绝对值)。
(× )7、酸雨又称为酸沉降,它是指pH 小于5.2的天然降水。
(√ )10、同一物质在相同的聚集状态时,其熵值随温度的升高而增大。
(× )11.对于放热的熵减小的反应,必定是高温自发而低温下非自发的反应。
(√ )12.复杂反应的速率主要由最慢的一步基元反应决定。
(× )13.K 不但温度的函数,也是浓度、压强催化剂的函数。
(× )1反应的ΔH 就是反应的热效应。
(× )2、Δr S 为正值的反应均是自发反应。
(× )3、催化剂能改变反应历程,降低反应的活化能,但不能改变反应的Δr G θm 。
(√ )5、有气体参加的反应,改变总压,不一定使平衡移动,而改变任意气体的分压,则一定是破坏平衡。
(√ )7、我国的酸雨主要是硫酸型酸雨。



《普通化学》课程综合复习资料一、判断题7、对于某电极,如果有H +或OH -参加反应,则溶液的pH 值改变将使其电极电势改变。
8、反应前后,催化剂的物理性质和化学性质都不会发生变化。
9、升高温度,使吸热反应的反应速率增大,而放热反应的反应速率减小,从而使平衡向吸热方向移动。
17、弱酸不断稀释时,解离度不断增大,H +浓度也不断增大。
18、对任何原子来说,3d 轨道的能量总是大于4s 轨道。
二、选择题3、下列物质热稳定性由大到小的顺序是( )A 、K 2CO 3> Mg (HCO 3)2> MgCO 3 >H 2CO 3B 、K 2CO 3> MgCO 3> Mg (HCO 3)2>H 2CO 3C 、MgCO 3> K 2CO 3 > H 2CO 3>Mg (HCO 3)2D 、Mg (HCO 3)2> MgCO 3> H 2CO 3 >K 2CO 39、下列离子中外层d 轨道达到半充满状态的是( )A 、Cr 3+B 、Fe 3+C 、Co 3+D 、Cu +10、下列元素电负性最小的为( )A 、OB 、SC 、FD 、N11、水分子之间除了普通的分子间力外,还存在( )A 、金属键B 、共价键C 、氢键D 、离子键12、利用下列反应组成原电池时,不需要加惰性电极的是( )A 、HCl 2Cl H 22=+B 、Cu Zn Cu Zn 22+=+++C 、22CuBr Br Cu =+D 、-+++=+Cl Fe Cl Fe322 13、反应速率随温度升高而增大的原因是( )A 、高温下分子碰撞更加频繁B 、反应物分子所产生的压力随温度升高而增大C 、活化能随温度升高而增大D 、活化分子的百分数随温度升高而增加14、已知某反应A 2(g) + B 2(g) = 2AB(g),∆H>0,∆S<0,则反应自发进行的条件是( )A 、高温B 、低温C 、任何温度都不能自发进行D 、任何温度都能自发进行15、决定多电子原子轨道能量高低的量子数是( )A 、nB 、n ,lC 、n ,l ,mD 、n ,l ,m ,m s16、在氨水溶液中加入几滴酚酞,再加入少许NH 4F 固体,则溶液的颜色将( )A 、由红色变为蓝色B 、由红色变为无色C 、由无色变为红色D 、红色变深三、填空题12、+6价Cr 的含氧酸根在酸性介质中以(35)形式存在,呈(36)色;在碱性介质中以(37)形式存在,呈(38)色。
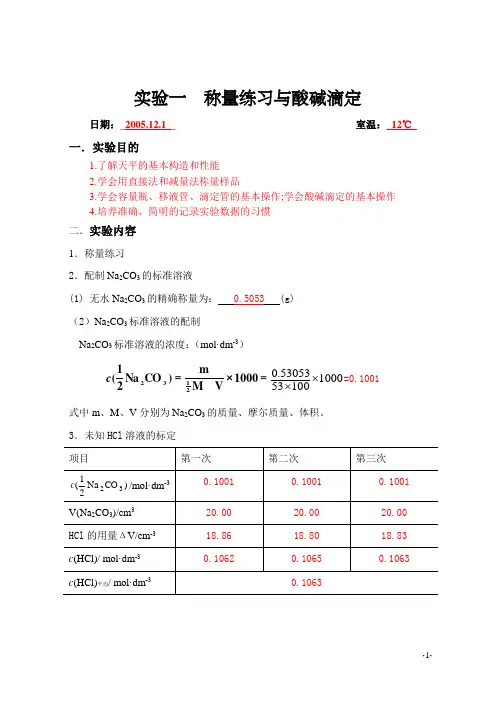
实验一 称量练习与酸碱滴定日期:_2005.12.1__ 室温:_12℃_一.实验目的1.了解天平的基本构造和性能2.学会用直接法和减量法称量样品3.学会容量瓶、移液管、滴定管的基本操作;学会酸碱滴定的基本操作4.培养准确、简明的记录实验数据的习惯 二.实验内容 1.称量练习2.配制Na 2CO 3的标准溶液(1) 无水Na 2CO 3的精确称量为: 0.5053 (g) (2)Na 2CO 3标准溶液的配制Na 2CO 3标准溶液的浓度:(mol·dm -3)=×=1000V Mm)CO Na 21(2132c 10001005353053.0⨯⨯=0.1001 式中m 、M 、V 分别为Na 2CO 3的质量、摩尔质量、体积。
3.未知HCl 溶液的标定实验二电解质溶液日期:2005.12.6室温:__12℃__ 压力:_________ 合作者:_______ 一.实验目的:1.了解弱酸、弱碱的解离平衡及平衡移动的基本原理。
2.了解水解平衡及平衡移动的基本原理。
3.了解难溶电解质的多相解离平衡及平衡移动的基本原理。
二.实验内容:2.缓冲溶液3.盐类的水解(1) 温度对水解的影响4.溶度积规则的应用实验三水的净化与软化处理实验日期:_2005.12.8__室温:__12℃___ 一.实验目的1.了解离子交换法净化水的原理与方法2.了解用配合滴定法测定水的硬度的基本原理和方法3.进一步练习滴定操作及离子交换树脂和电导率仪的使用方法二.实验内容结论:(你所在的城市自来水属于何种硬度的水?)中等硬水**2.硬水软化——离子交换法(1) 装柱(2)离子交换(3)Ca2+、Mg2+检验:3.各种水的定性检验质①自来水+ 铬黑T,现象:__________紫红___________________②离子交换软化水+ 铬黑T,现象:__________浅蓝___________________③市售纯净水+ 铬黑T,现象:__________蓝黑___________________④实验室制备高纯水+铬黑T,现象:__________浅紫红____________ _____⑤实验室制备蒸馏水+铬黑T,现象:__________淡蓝____________________⑥………….结论:(哪种水最不纯净?)自来水实验四铁矿石中铁含量的测定实验日期:2005.12.10室温:_10℃_一.实验目的1.了解测定铁矿石中铁含量的标准方法和基本原理2.学习矿样的分解,试液的预处理等操作方法3.初步了解测定矿物中某组分的含量的基本过程以及相应的实验数据处理方法二.实验主要化学反应方程Fe2O3(S)+6H+=2Fe3++3H2O2Fe3++Sn2+=Sn4++2Fe2+Fe3++Ti3++H2O =Fe2++TiO2++2H+Cr2O72-+6Fe2++14H+=6Fe3++2Cr3++7H2O(黄色)(绿色)。

※内能:体系中各种形式运动能量的总和,用U或E表示。
目前仍无法测量、计算一个体系内能的绝对值,但是内能变化的相对值(ΔU),可以通过两个状态之间能量的得失来求出,与过程无关。
※热力学第一定律: ΔU = Q + W W=-P外ΔV(只有体积功的时候)※通过不同途径从同样的初态膨胀或压缩到同样的终态环境对体系的功不同。
由此给出一个重要结论:压强-体积功是一个和途径有关的物理量。
※物理学上把一个体系能通过原途往返而环境无功损失的过程称为可逆过程;而把往返路径不一致因而环境有功损耗的过程叫做不可逆过程。
※对于理想气体体系的各种可逆过程(没有化学反应),功、热和体系内能变化之间的关系分别为: 1. 等容过程: V= 0,W = 0,QV = n・CV T体系的内能变化为: U = QV = nCV T (Cv等容热容,书P123~125)2. 等压过程: W = P V,QP = nCP T体系的内能变化为:U = P V + nCP T= n R T + n CP T= n (CP R) T = n CV T 3. 等温过程 : W = nRTln (V2/V1)U = 0体系从环境吸收的热量则为Q = W = nRTln (V2/V1)4. 绝热过程 : Q = 0, W = U, U n CV T, W = U = n CV T无论什么过程,没有化学反应的理想气体体系的内能变化都是: U n CV T (因为等温过程的 T = 0,所以 U = 0) ※热容比 =VPCC=VVCRC = 1 +VCR(可以得出CV = R / ( 1)所以绝热过程中环境对体系所作的功为:W = U = n CV T =nRT1)※对没有化学反应的理想气体体系: U=nCV T(W和Q不是状态函数,与具体过程有关) 所有过程(可逆、不可逆过程)都必须服从热力学第一定律※化学反应的热效应(只考虑体积功): 化学反应发生后,产物(终态)温度恢复到反应前反应物的温度(始态),过程中体系只对抗外压力做体积功,同时放出或吸收的热为此反应的反应热a)恒容反应热 : 等容过程W = -PΔV = 0 故ΔU = Qv,ΔU = Qv = nCvΔTb)恒压反应热 : 在等压过程中W =-PΔV,ΔU = Q + W = Qp-PΔV→Qp = ΔU-W =(U2+PV2)-(U1+PV1)说明等压反应热不仅与内能有关,也与体积变化有关Qp = nCpΔT ΔU = -PΔV + nCpΔT对理想气体:ΔU = -nRΔT + nCpΔT= n(Cp-R)ΔT = nCvΔT※状态函数焓(H) : H = U + PV ; Qp = H2-H1 =ΔH在等压过程中,体系吸收(或释放)的热量,全部用于增加(或减少)体系的焓。
学好大学化学很简单 就是要学会 “穿线” 正文如下:大学化学第一章 热化学与反应重要概念1.系统:客观世界是有多种物质构成的,但我们可能只研究其中一种或若干物质。
人为地将一部分物质与其他物质分开,被划分的研究对象称为系统。
2.相:系统中具有相同物理性质和化学性质的均匀部分称为相。
3.状态:是指用来描述系统的诸如压力P 、体积V 、温度T 、质量m 和组成等各种宏观性质的综合表现。
4.状态函数:用来描述系统状态的物理量称为状态函数。
5.广度性质:具有加和性,如体积,热容,质量,熵,焓和热力学能等。
6.强度性质:不具有加和性,仅决定于系统本身的性质。
如温度与压力,密度等。
系统的某种广度性质除以物质的量或者质量之后就成为强度性质。
强度性质不必指定物质的量就可以确定。
7.热力学可逆过程:系统经过某种过程由状态1到状态2之后,当系统沿着该过程的逆过程回到原来状态时,若原来的过程对环境产生的一切影响同时被消除(即环境也同时复原),这种理想化的过程称为热力学的可逆过程。
8.实际过程都是不可逆的,可逆过程是一种理想过程。
9.化学计量数:0=∑BVB B表示反应中物质的化学式,VB是B 的化学计量数,量纲为一;对反应物取负值,生成物取正值。
10.化学计量数只表示当安计量反应式反应时各物质转化的比例数,并不是各反应物质在反应过程中世界所转化的量。
11.反应进度ξ:b b v /n ∆=∆ξ 对于化学反应来讲,一般选未反应时,0=ξ 引入反应进度这个量最大的优点是在反应进行到任意时刻时,可用任一反应物或产物来表示反反应进行的程度,所得的值总是相等的。
12.反应热的测定:T C T m c T T m c q s s s 12s s ∆⋅-=∆⋅⋅-=-⋅⋅-=)(所用到的仪器是弹式热量计又称氧弹 弹式热量计中环境所吸收的热可划分为两部分:主要部分是加入的吸热介质水所吸收的,另一部分是金属容器等钢弹组件所吸收的。
前一部分的热用)(O H q 2表示,后一部分热用b q 表示,钢弹组件的总热容b C 告诉了则直接求得b q 。
13.习惯对不注明温度和压力的反应,皆指反应是在298.15K ,100kPa 下进行的。
14.一般没有特别的注明,实测的反应热(精确)均指定容反应热,而反应热均指定压反应热。
15.能量守恒定律:在任何过程中,能量不会自生自灭,只能从一种形式转化为另一种形式,在转化过程中能量的总值不变。
也叫做热力学第一定律。
16.热力学能具有状态函数的特点:状态一定,其值一定。
殊途同归,值变相等。
周而复始,值变为零。
17.系统与环境之间由于存在温差而交换的热量称为热。
若系统吸热值为正,若系统放热值为负。
18.系统与环境之间除了热以外其他形式传递的能量都称为功。
系统得功为正,系统做功为负。
在一定条件下由于系统体积的变化而与环境交换的功称为体积功,除体积功以外的一切功称为非体积功。
19.功和热都是过程中被传递的能量,它们都不是状态函数,其数值与途径有关。
而热力学第一定律中的热力学能的改变量只有过程的始态和终态决定,而与过程的具体途径无关。
20.化学反应热是指等温过程热,即当系统发生了变化后,使反应产物的温度回到反应前始态的温度,系统放出或吸收的热量。
21.定容反应热,在恒容,不做非体积功条件下。
这样热力学能改变量等于定容反应热。
其也只取决与始态和终态。
22.定压反应热,在恒压,只做体积功的条件下,∆H =-=+≡+-+=--=-=∆12p 1122p 12p 12H H q pV U H pV U pV U q V V p q U U U 则)令()()即( ∆H 是焓的增量,称为焓变。
如果∆H <0表示系统放热,∆H >0表示系统吸热,为吸热反应。
23.对于只有凝聚相的系统即液态和固态的系统,v p q q =,对于有气态物质参与的系统,考虑到体积的变化,可得RT Bg U H RT Bg q q Bm r m r B m v m p ⋅=∆-∆⋅=-∑∑)(即)(,,νν24.盖斯定律:在恒容或者恒压条件下,化学反应的反应热只与反应的始态和终态有关,而与变化途径无关。
25.在任一温度T、标准压力Θp 下表现出理想气体性质的纯气体状态为气体物质的标准状态。
液体固体物质或溶液的标准状态为任一温度T,标准压力Θp 下的纯液体,纯固体或标准浓度ΘC 时的状态。
26.单质和化合物的相对焓值,规定在标准状态时由指定单质生成单位物质的量的纯物质时反应的焓变叫做该物质的标准摩尔生成焓。
生成焓的负值越大,表明该物质键能越大,对热越稳定。
27.规定水和氢离子的标准摩尔生成焓值为零。
28.298.15K 温度下标准摩尔反应焓等于同温度下个参加反应物质的标准摩尔生成焓与其化学计量数的乘积的总和。
若系统的温度不是298.15K ,反应的焓变会有些改变,但一般变化不大,即反应的焓变基本不随温度而变。
第二章 化学反应的基本原理重要概念1.自发反应:在给定的条件下能自动进行的反应或过程叫做自发反应或自发过程。
自发过程都是热力学的不可逆过程。
2.系统倾向于取得最低的势能。
3.反应的焓变是判断一个反应能否自发进行的重要依据但是不是唯一的依据。
4.过程能自发地向着混乱程度增加的方向进行。
5.熵是系统内物质微观粒子的混乱度(或无序度)的量度。
Ω=kln S ,式中Ω为热力学概率或者称混乱度,k 为波尔兹曼常数。
6.熵的公式表明:熵是系统混乱度的量度,系统的微观状态数越多,热律学概率越大,系统越混流乱,熵就越大。
7.热力学第二定律:在隔离系统中发生的自发反应必伴随着熵的增加,或隔离系统的熵总是趋向于极大值,这就是自发过程热力学的准则,称为熵增加原理。
8.热力学第三定律:在绝对零度时,一切纯物质的完美晶体的熵值都等于零。
表达式为S (0K )=kln1=0;9.依此为基础,若知道某一物质从绝对零度到指定温度下的一些热力学数据如热容等,就可以求出此温度时的熵值,称为这一物质的规定熵。
10.单位物质的量的纯物质在标准状态下的规定熵叫做该物质的标准摩尔熵。
11.规定处于标准状态下水合氢离子的标准熵值为零。
12.(1)对于同一物质而言,气态时的熵大于液态时的,液态时的熵又大于固态时的熵。
(2)同一物质在相同的聚集态时,其熵值随温度的升高而增大;(3)在温度和聚集态相同时,分子或晶体结构较复杂的物质熵值大于分子或晶体结构较为简单的物质的熵值。
(4)混合物或溶液的熵值往往比相应的纯净物的熵值大。
13.对于物理或者化学变化而言,几乎没有例外,一个导致气体分子数增加的过程或反应总伴随着熵值的增大。
14.注意,虽然物质的标准熵随温度的升高而增大,但是只要是没有引起物质聚集状态的改变,其值通常相差不大,可以认为反应的熵变基本不随温度而变,这一点和焓变很类似。
15.自由能:把焓和熵并在一起的热力学函数。
16.吉布斯函数:m r m r m r S T H G TS H G ∆-∆=∆-=或者写成。
17.以∆G 作为判断化学反应自发性的标准,称为最小内能原理即:∆G<0 自发过程,过程能向正向进行;∆G=0 平衡状态;∆G>0 非自发过程,过程能向逆向进行。
18.熵判据和吉布斯函数判据的比较:斯函数判据应为:非自发状态平衡状态;自发过程;'G 'G 'G ωωω-<∆--=∆-->∆-,上式的意义是在等温等压下一个封闭系统所能做的最大非体积功等于吉布斯函数自由能的减少。
'max G ω-=∆-,'m ax ω表示最大电功。
20.热力学等温方程:Bv B B m r m r p /p RTln T G T G ∏ΘΘ+∆=∆)()()(其中R 为摩尔气体常数,B p 为参与反应的物质B的分压力,Θp 为标准压力(Θp =100kPa ),∏为连乘算符,习惯上将B vBB p /p ∏Θ)(称为反应商Q ,Θp /p B 称为相对分压,所以上式可以写成:RTlnQ T G T G m r m r +∆=∆Θ)()(,若所有气体的分压均处于标准状态,即Q=1,这时任一态变成了标准态。
21.道尔顿分压定律:第一,混合气体的总压力p 等于各组分气体分压力i p 之和。
即∑=i p p ;第二,混合气体中的某组分气体i 的分压力等于混合气体的总压力p 与该组分气体的摩尔分数i x 之乘积,即i i px p =式中,n n x i i /=,即某组分气体i 的摩尔分数等于该气体i 的物质的量i n 与混合气体总的物质的量n 之比。
22.标准摩尔生成吉布斯函数:在标准状态时,由指定单质生成单位物质的量的纯净物时反应的吉布斯函数变。
23.水合氢离子的标准摩尔生成吉布斯函数等于零。
24.反应的焓变和熵变基本不随温度改变,而反应的标准摩尔生成吉布斯函数变则是温度的线性函数。
25.任意状态时的反应的摩尔吉布斯函数变可根据实际条件用热力学等温方程进行计算。
26.宏观上的化学平衡是由于微观上仍持续进行着正逆反应的效果相互抵消所致,所以化学平衡是一种动态平衡。
27.0G T r =∆就是化学平衡的热力学标志或称反应限度的判据。
平衡系统的性质不随时间而改变。
28.标准平衡常数:当化学反应处于平衡状态时,以其化学反应的化学计量数(绝对值)为指数的各产物与反应物分压或浓度的乘机之比为一个常数。
ΘK 只是温度的函数,ΘK 值越大说明反应进行的越彻底,反应物的转化率越高。
29.转化率是指某反应物在反应中已转化的量相对于该反应物初始用量的比率。
30.标准平衡常数可从标准热力学方程函数求得。
当反应达到平衡时,)(T G m r ∆=0,则热力学等温方程式可以写成0p /p RTln T G T G B v B B m r m r =+∆=∆∏ΘΘ)()()(,将B vBeqB }p /p {K ∏ΘΘ=代入上式中得:ΘΘ-=∆RTlnK T G m r )(,RT T G lnK m r )(ΘΘ∆-= 31.(1)ΘK表达式可直接根据化学计量方程式写出;(2)ΘK的数值与化学计量方程式的写法有关;(3)ΘK不随压力和组成而变,但ΘK与)(T G m r ∆一样都是温度T 的函数。
32.多重平衡原则:如果某个反应可以表示成两个或者多个反应的总和,则总反应的平衡常数等于各反应平衡常数的乘积。
33.一切平衡都只是暂时的,相对的。
因条件的改变使化学反应从原来的平衡状态转变到了新的平衡状态的过程叫化学平衡的移动。
34.吕·查德里原理:假如改变平衡系统的条件之一,如浓度压力或者温度,平衡就会向能减弱这个改变的方向移动。
35.根据热力学等温方程式RTlnQ T G T G m r m r +∆=∆Θ)()(及ΘΘ-=∆RTlnK T G m r )(合并此两式可得Θ=∆KQ RTln G m r 根据此式只需比较静态的反应商Q 与平衡常数ΘK的相对大小,就可以判断反应进行的方向即平衡移动的方向,可分为下面三种情况:当Q<ΘK,则m r G ∆<0 反应正向自发进行;当Q=ΘK,则m r G ∆=0,平衡状态;当Q>ΘK,则m r G ∆>0,反应逆向自发进行。