热量衡算
- 格式:docx
- 大小:81.72 KB
- 文档页数:12
化工计算中的能量衡算是根据热力学第一定律,即能量守恒与转化定律,对化工过程进行能量计算。
化工生产中消耗的能量形式有机械能,电能和热能等等,其中以热能为主要形式,因此化工过程中的能量衡算重点是热量衡算。
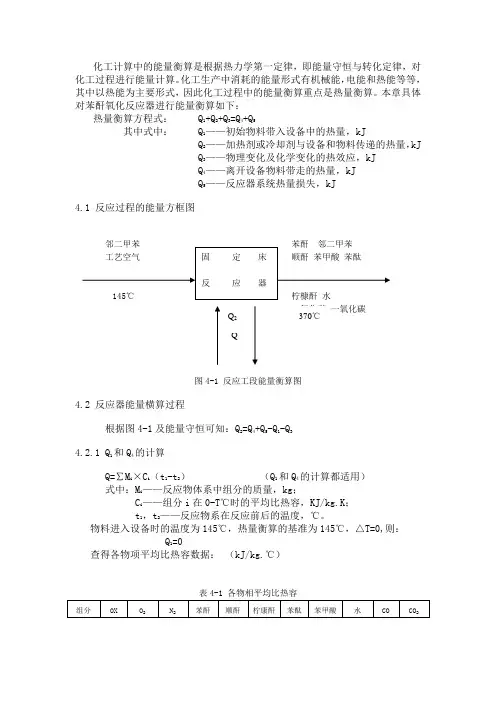
本章具体对苯酐氧化反应器进行能量衡算如下:热量衡算方程式: Q 1+Q 2+Q 3=Q 4+Q 5其中式中: Q 1——初始物料带入设备中的热量,kJQ 2——加热剂或冷却剂与设备和物料传递的热量,kJ Q 3——物理变化及化学变化的热效应,kJ Q 4——离开设备物料带走的热量,kJ Q 5——反应器系统热量损失,kJ 4.1 反应过程的能量方框图图4-1 反应工段能量衡算图4.2 反应器能量横算过程根据图4-1及能量守恒可知:Q 2=Q 4+Q 5-Q 1-Q 3 4.2.1 Q 1和Q 4的计算Q=∑M i ×C i (t 1-t 2) (Q 1和Q 4的计算都适用) 式中:M i ——反应物体系中组分的质量,kg ;C i ——组分i 在0-T℃时的平均比热容,KJ/kg.K ; t 1,t 2——反应物系在反应前后的温度,℃。
物料进入设备时的温度为145℃,热量衡算的基准为145℃,△T=0,则: Q 1=0查得各物项平均比热容数据: (kJ/kg.℃)所以: ()21i i 4t C M Q t -=∑=9.4000×6.96×(370-145)+8124.3234×1.15×225+70547.000×1.06×225+9990.0000×5.23×225+796.1912×4.52×225+162.0164×4.52×225+273.9496×4.91×225+574.4248×5.18×225+4972.6368×4.18×225+411.8582×1.11×225+2830.2066×1.45×225=38347694.4kJ 4.2.2 过程Q 3的计算过程热效率可以分为两类:一类是化学过程的热效率即化学反应速率;另一类是物理过程热效率。

热量衡算主要依据是能量平衡方程ΣQ in=ΣQ out +ΣQ其中ΣQ in输入设备流量ΣQ out +输出设备流量ΣQ为损失流量对于连续系统:Q+W=ΣH out +ΣH其中。
Q为设备热负荷W为输入系统的机械能ΣH out 离开设备的各物料焓之和ΣH进入设备的各物料焓之和在进入全厂能量横算时,是以单位设备为基本单位,考虑由机械能转换、化学反应释放和单纯的物理变化带来的能量变化,最终对全工艺段进行系统级的能量平衡计算,进而用于指导节能降耗设计工作。
热量衡算任务1、确定加热剂和冷却剂的用量2、计算有设备传递的热量,为设备设计提供依据3、提高热量应用水平4、最终确定总需求能量和能量费用各工段其热量衡算如下萃取精馏段:第一萃取精馏塔物流焓变一览表流股名反应前物流反应后物流温度(℃)60/6044/110压力(Kg/sqcm)7.767/6.118 5.099/6.099质量流量(Kg/hr)41600/2710017320/295280焓值(KW)-2575.31068.09热负荷一览表Q热负荷(Kw)—8296.9热量平衡一览表Q IN OUT Error -8296.9 -2575.3 1068.09 -1.241汽提塔物流焓变一览表流股名反应前物流反应后物流温度(℃)118.1/110.1/135.0108.4/134.4压力(Kg/sqcm)7.000/6.099/5.166 5.166/5.167质量流量(Kg/hr)37970.026/295280.000/7.04087E+623999.999/7.35012E+6焓值(KW)14050311412557热负荷一览表Q热负荷(Kw)—9789.0065热量平衡一览表Q IN OUT Error -9789.0065 1405031 1412557 -0.00533闪蒸塔物流焓变一览表流股名反应前物流反应后物流压力(Kg/sqcm) 5.167 5.166/5.166质量流量(Kg/hr)7.35012E+6202622.872/7.04087E+6焓值(KW)1407162.091435001.24热负荷一览表Q热负荷(Kw)46985.4228热量平衡一览表Q IN OUT Error 46985.4228 1407162.09 1435001.24 -0.0194第二萃取精馏塔物流焓变一览表流股名反应前物流反应后物流压力(Kg/sqcm) 5.000/5.160 3.071/3.059质量流量(Kg/hr)36000.000/23999.99937970.026/22030.029焓值(KW)3895.678174103.97348热负荷一览表Q热负荷(Kw)-4281.0457热量平衡一览表Q IN OUT Error -4281.0457 3895.67817 4103.97348 -0.0507545第一精馏塔物流焓变一览表流股名反应前物流反应后物流温度(℃)92.241.6/55.8压力(Kg/ sqcm) 3.059 5.099/5.099质量流量(Kg/hr)22030.029990.029/21040.000焓值(KW)12503.739251.09429热负荷一览表Q热负荷(Kw)-516.35568热量平衡一览表Q IN OUT Error -516.35568 12503.73 9251.09429 0.26013323第二精馏塔物流焓变一览表流股名反应前物流反应后物流(顶/釜)温度(℃)70.143.1/55.4压力(atm) 5.92 4.74/5.42质量流量(Kg/hr)19758.483419087.1667/671.3167焓值(KW)11111.0668 8876.86583热负荷一览表(KW)Q热负荷-9642.5248热量平衡一览表(KW)Q IN OUT Error -9642.524811111.06688876.86583-0.201079。


2.1设备的热量平衡方程式对于有传热要求的设备,其热量平衡方程式为:Q1+Q2+Q3=Q4+Q5+Q6式中 Q1—物料带入到设备的热量kJ;Q2—加热剂或冷却剂传给设备和所处理物料的热量kJ;Q3—过程热效应kJ;Q4—物料离开设备所带走的热量kJ;Q5—加热或冷却设备所消耗的热量kJ;Q6—设备向环境散失的热量kJ。
(1)Q1与Q4Q1与Q4均可用下式计算:Q1(Q4)=∑mtCp kJ 式中 m—输入(或输出)设备的物料量kg;Cp—物料的平均比热容kJ/kg·℃;t—物料的温度℃。
该式的计算基准是标准状态,即0℃及1.013×105Pa为计算基准。
因为物料的比热容是温度的函数,上式中物料的比热容是指进、出口物料的定压平均比热容,对于进口物料取基准温度与物料进口温度的平均温度下的比热容;对于出口物料取基准温度与物料出口温度的平均温度下的比热容。
对于不同物料的比热容可查《化学工程手册》(第1册)或《化学工艺设计手册》(下),若查不到,各种估算方法求出相应温度下的比热容值。
(2)过程热效应Q3化学过程的热效应包括化学反应热与状态变化热。
纯物理过程只产生状态变化热;而对于化学反应过程,在产生化学反应的同时,往往还伴有状态变化热。
在热量衡算中,过程热效应Q3的符号为:放热为正;吸热为负。
(3)Q5与Q6的确定根据工艺操作经验,(Q5+Q6)一般为(Q4+Q5+Q6)的5%~10%,只要计算出Q4,就可以确定(Q5+Q6),从而计算出Q2。
4)Q2的计算由以上计算过程得到Q1、Q3、Q4、Q5、Q6后,根据热量平衡方程式求出设备的热负荷Q2。
Q2正值表示需对设备加热;负值表示需冷却 4.3热量衡算基础数据的计算和查取在热量衡算中,大部分物料的物性常数可通过相关的物性常数手册查取,如《化学工程手册》(第1册),《化工工艺设计手册》(下)。
当遇到手册中数据不全的情况时,就需通过一些公式来估算这些物性常数。

热量衡算与热交换计算热量衡算与热交换计算一、热量衡算传热计算根据总传热方程进行:Q=KA△tm对于一个热交换器,传热计算的内容有两种,一为设计计算,即根据给定的传热量,确定热交换器的几何尺寸和结构参数;二为校核计算,即对某些热交换器,根据它的尺寸和结构进行校核,看其能否满足传热量的要求。
这两种计算的关键都在于传热面积是否合适,计算的基本依据是总传热方程以及与之相关的热量衡算式,在第四节中,已对总传热方程进行了较为详细的讨论,下面介绍热交换中的热量衡算式。
当热损失为零时,对热交换器作热量衡算可得到单位时间的传热量,此传热量又叫热负荷,即式3-20中的传热速率Q。
热负荷分为两种,即工艺热负荷和设备热负荷,工艺热负荷是指工艺上要求的在单位时间内需要对物料加入或取出的热量,用QL表示,单位为W。
设备热负荷是热交换器所具备的换热能力,所以设备热负荷也就是热交换器的传热速率Q。
当热损失不可忽略时,为满足工艺要求,Q应大于QL。
由热量衡算得到的是工艺热负荷QL。
如果流体不发生相变化,比热取平均温度下的比热,则有:QL=whcph(T1-T2)=wccpc(t2-t1) ( 3-29)式中w----流体的质量流量,kg/s;cp----流体的平均定压比热,kJ/(kg•K);T----热流体温度,K;t----冷流体温度,K;(下标h和c分别表示热流体和冷流体,下标1和2表示热交换器的进口和出口)式3-29是热交换器的热量衡算式,也称为热平衡方程。
若流体在换热过程中有相变,例如饱和蒸汽冷凝成同温度冷凝液时,则有:QL=whr=wccpc(t2-t1) (3-30)式中wh----饱和蒸汽的冷凝速率,kg/s;r----饱和蒸汽的冷凝潜热,kJ/kg;当饱和蒸汽在热交换器中冷凝后,冷凝液液温度继续下降到T2,两部分热量(即潜热和显热)要加起来计算,这时:QL=wh[r+cph(Ts-T2)]=wccpc(t2-t1)式中cph-----冷凝液的比热,kJ/kg•K;Ts------冷凝液饱和温度,K。

热量衡算1计算方法与原则1.1热量衡算的目的及意义热量衡算的主要目的是为了确定设备的热负荷。
根据设备热负荷的大小、所处理物料的性质及工艺要求再选择传热面的形式、计算传热面积、确定设备的主要工艺尺寸。
传热所需的加热剂或冷却剂的用量也是以热负荷的大小为依据而进行计算的。
1.2热量衡算的依据及必要条件热量衡算的主要依据是能量守恒定律,其数学表达式为Q1+ Q2+Q3=Q4+Q5+Q6 式1其中:Q1——物料带入到设备的热量,kJQ2——加热剂或冷却剂传给设备和所处理物料的热量,kJQ3——过程热效应,kJQ4——物料离开设备所消耗的热量,kJQ5——加热或冷却设备所消耗的热量,kJQ6——设备向环境散失的热量,kJQ1(Q4)=Σ mC P(t2- t0) kJ式2m——输入或输出设备的物料质量,kgC P——物料的平均比热容,kJ/(kg•℃)t2——物料的温度,℃t0——基准温度,℃Q5=Σ C P M (t2-t1) kJ式3M——设备各部件的质量,kgC P——设备各部件的比热容,kJ/(kg•℃)t1——设备各部件的初始温度,℃t——设备各部件的最终温度,℃2Q5+Q6=10%Q总式4热量衡算是在车间物料衡算的结果基础上而进行的,因此,车间物料衡算表是进行车间热量衡算的首要条件。
其次还必须收集有关物质的热力学数据,例如比热容,相变热,反应热等。
本设计还将涉及到的所有物料的热力学数据汇总成表4,以便于后期的计算。
1.3热量衡算基准因为物料衡算计算的是各个岗位的天处理量,所以热量衡算计算的也是某个设备天换热介质消耗量,同时温度基准采用的是0℃做基准。
当然,进行传热面积校核时,是根据批处理量计算。
2全车间物料热力学数据的估算2.1所用纯化合物比热的推算0i i pMc n C ∑=式 5式中M ——化合物分子量;n i ——分子中同种元素原子数; c i ——元素的原子比热容,kJ/(kg•℃)查《制药工程工艺设计》P111,得到原子的摩尔热容相关数据,见表1表1 元素原子的摩尔热容单位:kcal/( kmol•℃)(当物质为固体时,各原子的C a 取值近似值)原子 C a 原子 C a 原子 C a 碳C 2.8 氧O 6.0 氮N 2.6 氢H4.3硫S7.4其他8.0(当物质为液体时,各原子的C a 取值近似值)而在实际生产的过程中遇到的物质大多是混合物,极少数的混合物有实验测定的热容数据,一般都是根据混合物内各种物质的热容和组成进行推算的,其中杂质的含量极少,热效应可以忽略不计。

第五章能量衡算第一节概述第二节热量衡算第三节过程的热效应第四节热量衡算举例第五节加热剂、冷却剂及其其他能量消耗的计算5.1 概述5.1.1 能量衡算的目的和意义计算过程能耗指标进行方案比较,选定先进生产工艺。
能量衡算数据是设备选型和计算的依据;是组织、管理、生产、经济核算和最优化的基础5.1.2 能量衡算的的依据及必要条件依据为能量守恒定律条件:物料衡算的数据,相关热力学物性数据。
5.1.3 能量守恒的基本方程输出能量+消耗能量+积累能量=输入能量+生成能量5.1.4 能量衡算的分类单元设备的能量衡算和系统的能量衡算5.2 热量衡算5.2.1 热量平衡方程式Q —物料带入设备的热量,kJ ;Q2—加热剂或冷却剂传给设备及所处理物料的热量,kJ ;Q3 —过程的热效应,kJ;(注意符号规定)Q4—物料带出设备的热量,kJ ;Q5—加热或冷却设备所消耗的热量或冷量,kJ ;Q6 —设备向环境散失的热量,kJ。
注意各Q勺符号规定Q为设备的热负荷。
若Q为正值,需要向设备及所处理的物料提供热量; 反之,表明需要从设备及所处理的物料移走热量。
对间歇操作,按不同的时间段分别计算Q的值,并取其最大值作为设备热负荷的设计依据。
522 各项热量的计算1、计算基准一般情况下,可以0C和1.013 105Pa为计算基准有反应的过程,也常以25C和1.013 105Pa为计算基准。
2、Q或Q的计算无相变时物料的恒压热容与温度的函数关系常用多项式来表示:若知物料在所涉及温度范围内的平均恒压热容,贝心3、Q的计算过程的热效应由物理变化热Q和化学变化热Q两部分组成物理变化热是指物料的浓度或状态发生改变时所产生的热效应。
若过程为纯物理过程,无化学反应发生,如固体的溶解、硝化混酸的配制、液体混合物的精馏等,则Q C= 0 。
化学变化热是指组分之间发生化学反应时所产生的热效应,可根据物质的反应量和化学反应热计算。
4、Q的计算稳态操作过程Q 5= 0非稳态操作过程由下式求QQ=' GC (T2-T1)G-设备各部件的质量,kg;G—设备各部件材料的平均恒压热容,kJ kg-1「C-1;T1—设备各部件的初始温度,C;T2—设备各部件的最终温度,C。



第二章 能量衡算2.1 能量衡算概述物料衡算完成后,对于没有传热要求的设备,可以由物料处理量,物料的性质及工艺要求进行设备的工艺设计,以确定设备的型式,台数,容积以及重要尺寸。
对于有传热要求的设备则必须通过能量衡算,才能确定设备的主要工艺尺寸。
无论进行物理过程的设备或是化学过程的设备,多数伴有能量传递过程,所以必须进行能量衡算。
2.2 能量衡算目的对于新设计的生产车间,能量衡算的主要目的是为了确定设备的热负荷。
根据设备热负荷的大小,所处理物料的性质及工艺要求在选择传热面的型式,计算传热面积,确定设备的主要尺寸。
传热所需要的加热剂或冷却剂的用量也是以热负荷的大小为依据而进行计算的。
对于有些伴有热效应的过程,其物料衡算也要通过与能量衡算的联合求解才能得出最后的结果。
2.3 能量衡算依据能量衡算的主要依据是能量守恒定律。
能量守恒定律是以车间物料衡算的结果为基础而进行的。
2.4 能量衡算过程 2.4.1 反应釜的热量衡算反应工段的热量衡算主要体现在反应釜和夹套。
对于有传热要求的的设备,其热量衡算为:654321Q Q Q Q Q Q ++=++;式中 1Q —物料带入到设备的热量kJ ; 2Q —加热剂传给设备的热量kJ ; 3Q —物理变化及化学反应的热效应kJ ; 4Q —物料离开设备所带走的热量kJ ; 5Q —消耗于提高设备本身温度的热量kJ ; 6Q —设备向环境散失的热量kJ 。
物料热量衡算以天为单位。
1Q 与4Q 的计算1Q 与4Q 均可按照下式计算:()tkJ mc Q Q p ∑=41式中m —输入或输出设备的物料量,kgp c —物料的平均比热容,()C kg kJ ︒⋅/t —物料的温度,℃。
该式的计算标准是标准状态,即Pa C 3101013.10⨯︒及为计算标准。
固体和液体的比热容可以采用下式计算:Mn c c p∑⋅=α184.4; []1式中:αc —元素的原子比热容,()C kg kJ ︒⋅/ ;n —分子中同一原子的原子数;M —化合物的分子量,kmol kg /。

热量衡算§ 4.4 热量衡算Q CD, H DF,Z FH FV’BL’W, X W, H W热量衡算说明:①泡点进料,泡点回流;②以20℃常温下液态混合物状态为基准。
H F + Q B = Q C + H D + H WH F :进料焓H D :塔顶产品焓H W:塔底产品焓Q C:全凝器冷凝负荷Q B :再沸器热负荷1. 进料焓的计算H FT F=380.1019K=106.9519℃所以进料液体的定性温度(T F + 20℃)/2=63.47595℃查石油化工基础数据手册并由插值法得定性温度下的比热:C FPCT=42.59 cal/mol•℃C FOCT=42.55 cal/mol•℃则进料液体的平均比热:C Fm= C FOCT×Z F + C FPCT×(1-Z F)=42.55cal/mol•℃×40%(mol)+42.59cal/mol•℃×(1-40%)(mol)=42.574 cal/mol•℃则进料液体焓:H F= F ×C Fm×(T F ―20℃)=0.9875kmol/h×42.574 cal/mol•℃×(106.9519℃―20℃)=3655.62kcal/h=15295.48kJ/h2. 塔顶产品焓的计算H DT D=99.5252℃定性温度=(T D + 20℃)/2=59.7626℃查石油化工基础数据手册并由插值法得定性温度下的比热:C DPCT=42.32 cal/mol•℃C DOCT=42.28 cal/mol•℃则塔顶产品的平均比热:C Dm= C DOCT×XD + C DPCT×(1-X D)=42.28 cal/mol•℃×80%(mol)+ 42.32 cal/mol•℃×(1-80%)(mol)=42.288 cal/mol•℃则H D= D ×C Dm×(T D―20℃)=0.329167kmol/h×42.288 cal/mol•℃×(99.5252℃―20℃)=1106.976kcal/h=4631.70kJ/h3. 塔底产品焓的计算H WT W=384.3198K=111.1698℃定性温度=(T W + 20℃)/2=65.5849℃查石油化工基础数据手册并由插值法得定性温度下的比热:C WPCT=42.74 cal/mol•℃C WOCT=42.70 cal/mol•℃则进料液体的平均比热:C Wm= C WOCT×X W + C WPCT×(1-X W)=42.70 cal/mol•℃×20%(mol)+ 42.74 cal/mol•℃×(1-20%)(mol)=42.732 cal/mol•℃则塔底产品焓:H W= W ×C Wm×(T W ―20℃)=0.658333kmol/h×42.732 cal/mol•℃×(111.1698℃―20℃)=2564.78kcal/h=10731.30kJ/h4. 全凝器冷凝负荷的计算Q CQ1 (r m) Q2 (C pm)塔顶蒸汽T顶饱和液体过冷液体20℃=99.5252℃释放冷凝潜热 冷却降温Q 1 = V ×r m = (R+1)D ×r mr m =r OCT × X D +r PCT × (1-X D )Q 2 = V × C pm × (T 顶 – 20)①算Q 1 :由Ct B A p +-=log 得 2)(10ln 1*log C t B p dt dp dt p d +== 22)15.273(10ln *Ct t RB p RT dt dp r v ++== mol J C t t RB r T T OCT /10*1568.4)486.2195252.9915.2735252.99(*10ln *990.1590*3143.8)15.273(10ln 42200=++=+=+ mol J C t t RB r pT T PCT/10*2123.4)519.2185252.9915.2735252.99(*10ln *490.1602*3143.8)15.273(10ln 4220=++=++=混合汽化潜热:molJ x r x r r PCT D OCT m /10*1679.42.0*10*2123.48.0*10*1568.4)1(4440=+=-+=h kJ r D R r V Q mm /10*5228.2610*1679.4*)13324.18(*329167.0*)1(*441=+=+==②算Q 2 :t 顶=99.5252℃由内插法得C p OCT(99.5252℃)=45.0672 Cal/(mol·℃)C p OCT(20℃) =39.34Cal/(mol·℃)同理由内插法得C p PCT(99.5252℃)=45.1168 Cal/(mol·℃)C p PCT(20℃) =39.38Cal/(mol·℃)平均比热:C m =XD (C p OCT(99.5252℃)+ C p OCT(20℃))/2+(1-X D )(C p PCT(99.5252℃)+C p PCT(20℃))/2 =80%×(45.0672+39.34)/2+(1-80%)(45.1168+39.38)/2 = 42.2126Cal/(mol·℃)Q2=V×C m (t 顶-20)=6.363588×42.2126×(99.5252-20)=21362.3455kcal/h=8.9382×104kJ/hQ C =Q 1+Q 2=26.5228×104+8.9382×104=35.461×104kJ/h ③ 冷却水用量:取进口水温为30℃,出口水温为40℃,则△t 水=10℃ 水的定性温度为:(30+40)/2=35℃ 查《化工原理》附录水的比热容为:C p 水(35℃)=4.174kJ/(kg ·K)W=Q C /C p 水 △t 水=10174.410461.354⨯⨯=8495.69 kg/h5. 再沸器热负荷的计算 Q BH L’ + Q B = H V’ + H WQ B = H V’ + H W - H L’H L’ = L ’ × C m L’ × (T 底 – 20)H V’ = V ’ ×r m V’ + V ’ × C m V’×(T V ’-20) H W = W × C m W × (T W - 20)⑴计算倒数第二块板的焓H L’由Aspen plus 计算结果:t L’=110.9493℃ x L’= 0.21561268 L ’=7.04494355kmol/h定性温度 t m =( t L’+20℃)/2=65.4747℃ 由插值法:C p PCT, 65.4747℃ =42.7287 Cal/(mol·℃) C p OCT, 65.4747℃ =42.6887 Cal/(mol·℃)C m = C p PCT (1- x L’)+ C p OCT x L’=42.7287*(1-0.2156)+42.6887*0.2156= 42.7201Cal/(mol·℃)=178.7451J/(mol·℃) H L’=L’C m (t L ’-20)=7.0449*178.7451*(110.9493-20)=11.4527*104kJ/h⑵计算离开再沸器的相焓H V’P 底 =170.00148mmHgx W =0.2 y V ’=0.21722207 V ’=6.38661055kmol/h t V’=t W =111.1698℃t m =( t V’+20)/2=65.5849℃由插值法:C p PCT, 65.5849℃ =42.7365 Cal/(mol·℃) C p OCT, 65.5849℃ =42.6965 Cal/(mol·℃) C m = C p PCT (1- x W )+ C p OCT x W=42.7365*(1-0.2)+42.6965*0.2=42.7822 Cal/(mol·℃)=179.005J/(mol·℃) Q 1=V’C m (t v’-20)=6.3866*179.005*(111.1698-20) =10.4261*104kJ/h2)15.273(10ln Ct t RB r V ++= mol J r OCT /10*1147.4)486.219111.169815.273111.1698(*10ln *99.1590*3143.842=++=mol J r PCT /10*1644.4)592.218111.169815.273111.1698(*10ln *49.1601*3143.842=++=r m =r OCT y V’+r PCT (1-y V’)=4.1147*104*0.2172+4.1664*104*(1-0.2172)=4.1552*104 J/molQ2=V’r m =6.3866*4.1552*104=26.5376*104 kJ/hH V’ = Q1 + Q2 =36.9637* 104 kJ/h⑶塔底产品的焓H WH W = 10731.30kJ/h(前已述及)⑷Q BQ B=H V’+H W-H L’=36.9637*104+1.0731*104-11.4527*104=26.5841* 104 kJ/h在0.3Mpa时,r水蒸汽=2168kJ/kg蒸汽用量W汽=Q B /r水蒸汽=122.62 kg/h热量衡算方程为:H F + Q B = Q C + H D + H W等式左边=H F + Q B =15295.48+26.5841* 104=28.1136kJ/h等式右边=Q C+H D + H W=35.461×104+4631.70+10731.30=36.9973kJ/h。
2.1设备的热量平衡方程式对于有传热要求的设备,其热量平衡方程式为:Q1+Q2+Q3=Q4+Q5+Q6式中 Q1—物料带入到设备的热量kJ;Q2—加热剂或冷却剂传给设备和所处理物料的热量kJ;Q3—过程热效应kJ;Q4—物料离开设备所带走的热量kJ;Q5—加热或冷却设备所消耗的热量kJ;Q6—设备向环境散失的热量kJ。
(1)Q1与Q4Q1与Q4均可用下式计算:Q1(Q4)=∑mtCp kJ 式中 m—输入(或输出)设备的物料量kg;Cp—物料的平均比热容kJ/kg·℃;t—物料的温度℃。
该式的计算基准是标准状态,即0℃及1.013×105Pa为计算基准。
因为物料的比热容是温度的函数,上式中物料的比热容是指进、出口物料的定压平均比热容,对于进口物料取基准温度与物料进口温度的平均温度下的比热容;对于出口物料取基准温度与物料出口温度的平均温度下的比热容。
对于不同物料的比热容可查《化学工程手册》(第1册)或《化学工艺设计手册》(下),若查不到,各种估算方法求出相应温度下的比热容值。
(2)过程热效应Q3化学过程的热效应包括化学反应热与状态变化热。
纯物理过程只产生状态变化热;而对于化学反应过程,在产生化学反应的同时,往往还伴有状态变化热。
在热量衡算中,过程热效应Q3的符号为:放热为正;吸热为负。
(3)Q5与Q6的确定根据工艺操作经验,(Q5+Q6)一般为(Q4+Q5+Q6)的5%~10%,只要计算出Q4,就可以确定(Q5+Q6),从而计算出Q2。
4)Q2的计算由以上计算过程得到Q1、Q3、Q4、Q5、Q6后,根据热量平衡方程式求出设备的热负荷Q2。
Q2正值表示需对设备加热;负值表示需冷却 4.3热量衡算基础数据的计算和查取在热量衡算中,大部分物料的物性常数可通过相关的物性常数手册查取,如《化学工程手册》(第1册),《化工工艺设计手册》(下)。
当遇到手册中数据不全的情况时,就需通过一些公式来估算这些物性常数。
5 热量衡算5.1 合成塔热量衡算相关计算式全塔热平衡方程式为:∑Q 1 +∑Qr = ∑ Q 2 + ∑Q 3 +Q 4 (式5.1) 式中: Q 1——入塔气各气体组分热量,kJ/hQr ——合成反应和副反应的反应热,kJ/h Q 2 —— 出塔气各气体组分热量,kJ/h Q 3 ——合成塔热损失,kJ/h Q 4——蒸汽吸收的热量,kJ/h∑Q 1=∑(G 1×Cp 1×T 1) (式5.2) 式中: G 1——入塔气各组分流量,kmol/h ;Cp 1 ——入塔各组分的比热容,kJ/(m 3.k ); T 1——入塔气体温度,k ;∑Q 2=∑(G 2×Cp 2×T 2) (式5.3) 式中: G 2——出塔气各组分流量kmol/h ;Cp 2 ——出塔各组分的热容,kJ/(m 3.k ); T 2—— 出塔气体温度,k ;∑Qr= Qr 1 +Qr 2 +Qr 3+ Qr 4+ Qr 5 +Qr 6 + Qr 7 (式5.4) 式中: Qr 1、Qr 2 、Qr 3、 Qr 4、 Qr 5 、Qr 6、Qr 7——分别为甲醇、甲烷、二甲醚、异丁醇、水、辛烷的生成热,kJ/h ; 式中: Gr ——各组分生成量,kmol/h ;△H ——生成反应的热量变化,kJ/mol5.1.1 合成塔入塔热量计算查《化学化工物性数据手册》[17]得在498.15K 、5.2MPa 下各组分气体的定压热容如下表所示:表5.1 组分气体定压热容气体 CH 3OH H 2 CO CO 2 N 2 Ar CH 4 热容kJ/(kmol ·k )65.8329.1230.5747.6930.2321.5447.61由pi i i Q C G =⨯ 得入塔气中各组分的热量:表5.2 各组分带进合成塔的热量气体 CH 3OH H 2 CO CO 2 N 2 Ar CH 4 热容kJ/(kmol ·k ) 65.8329.1230.5747.6930.2321.5447.61含量kmol/h 14.02 18477.75 2844.89 740.42 635.31 163.50 373.71入塔热量kJ/(h ·k )922.94538072.0886968.2935310.63 19205.42 3521.79 17792.33则每小时入塔热量:∑Q 1=922.94+538072.08+86968.29+35310.63+19205.42+3521.79+17792.33 =701793.48kJ/(h ·k )所以总热量∑Q 1=701793.48×498.15=349598422.06kJ/h5.1.2 合成塔的反应热由i ri H Q G =∆⨯得:各组分生成的热量如下表5.3 甲醇合成塔内反应热气体 CH 3OH ( CH 3 )2O C 4H 9OH CH 4 CO C 8H 18生成热kJ/mol 97.73 49.62 200.39 115.69 -42.92 957.98生成量kmol/h 1108.957 3.811 1.466 2.837 109.52 1.171 反应热kJ/h108378367.61189101.82293771.74328212.53-4700598.41121794.58则合成塔每小时生成的反应热:∑Q r =108378367.61+189101.82+293771.74+328212.53+1121794.58-4700598.4=104433356.74kJ/h5.1.3 合成塔出塔热量计算查《化学化工物性数据手册》得在528.15K 、5.2MPa 下各组分气体的定压热容如下表5.4所示:表5.4 组分气体定压热容气体CH 3OHH 2COCO 2N 2ArCH 4热容kJ/(kmol ·k )67.82 29.13 30.69 48.23 30.32 21.45 49.23由pi i i Q C G =⨯ 得出塔气中各组分的热量:表5.5 各组分带出合成塔的热量气体 热容kJ/(kmol ·k )含量kmol/h 出塔热量kJ/(h ·k )CH 3OH 67.82 1231.17 83497.95 H 2 29.13 16083.28 468505.95 CO 30.69 1815.14 55706.65 CO 2 48.23 617.69 29791.19 N 2 30.32 636.67 19303.83 Ar 21.45 162.33 3481.98 CH 4 49.23 337.36 16608.23 H 2O35.36130.714621.91则,每小时出塔热量:∑Q 2=83497.95+468505.95+55706.65+29791.19+19303.83+3481.98+16608.23+4621.91=681517.69kJ/(h ·k )总出塔热量∑Q 2=681517.69×528.15=359943565.65kJ/h 5.2 合成塔热量损失假设合成塔的热量损失为5%,则损失的这部分能量的值为:Q 3=(∑Q 1+∑Q r )×5%=(349598422.06+104433356.74)×5%=22701588.94kJ/h5.3 蒸汽吸收的热量全塔热平衡方程式为:∑Q 1 +∑Qr = ∑ Q 2 + ∑Q 3 +Q 4 得: 蒸汽吸收的热量为:41r 23Q Q Q Q Q =+--∑∑∑=349598422.06+104433356.74-359943565.65-22701588.94=71386624.21kJ/h水蒸气入口温度为200℃,出口温度为224℃,查《化工工艺设计手册》得:水蒸气的平均热容为3.224KJ/(kg ·K),则由p Q F t C =⨯⨯∆ 得: 水蒸气的用量:4pQ F t C =⨯∆=71386624.21/(3.224×297.15)=74515.41kg/h=74.515吨/h表5.6 合成塔的热量平衡表气体气体显热反应热热损失 蒸汽吸收合计 入塔气kj/h 349598422.06104433356.74--454031778.8出塔气kj/h 359943565.6-22701588.94 71386624.21 454031778.855.4 合成气换热器的热量衡算 5.4.1 合成气入换热器的热量入换热器的合成气温度为60℃,查《化学化工物性数据手册》得各组分的比热容,由pi i i Q C G =⨯,计算得各组分带进换热器的热量如下表所示:表5.7 合成气带进的热量气体 CH 3OH H 2 CO CO 2 N 2 Ar CH 4 热容kJ/(kmol ·k ) 46.60 28.92 30.92 58.66 31.01 22.78 41.11 含量kmol/h 14.02 18477.75 2844.89740.42635.31 163.50 373.71 带进热量kJ/(h ·k )653.33534376.5387963.99 43433.0419700.963724.5315363.22则每小时的热量:Q 入换热器=653.33+534376.53+87963.99+43433.04+19700.96+3724.53+15363.22 =705215.61kJ/(h ·k )合成气带进换热器的总热量:Q 总入换热器=705215.61×333.15=234942576.51kJ/h5.4.2 合成气出换热器的热量由工艺流程可知,合成气出换热器的热量与入合成塔的热量相等,则合成气出换热器的热量为:Q 出换热器=349598422.06kJ/h5.5 换热器的热量衡算5.5.1 入换热器的出合成塔气热量由工艺流程可知,在忽略管路热损失的条件下,入换热器的出合成塔气热量与合成塔出塔气的热量相等,,即入换热器的出合成塔气热量为:Q 5=359943565.65kJ/h5.5.2 出换热器的出合成塔气热量由换热器的热量衡算得:出合成塔气进入换热器后能量降低,降低的这部分能量用于入换热器的合成气的加热,即合成气热量的增值等于出合成塔气热量的减少值。
§ 4.4 热量衡算C,H DDB, H WW热量衡算说明:①泡点进料,泡点回流;②以20℃常温下液态混合物状态为基准。
H F + Q B = Q C + H D + H WH F :进料焓H D :塔顶产品焓H W:塔底产品焓Q C:全凝器冷凝负荷Q B :再沸器热负荷1. 进料焓的计算H FT F=380.1019K=106.9519℃所以进料液体的定性温度(T F + 20℃)/2=63.47595℃查石油化工基础数据手册并由插值法得定性温度下的比热:C FPCT=42.59 cal/mol•℃C FOCT=42.55 cal/mol•℃则进料液体的平均比热:C Fm= C FOCT×Z F + C FPCT×(1-Z F)=42.55cal/mol•℃×40%(mol)+42.59cal/mol•℃×(1-40%)(mol)=42.574 cal/mol•℃则进料液体焓:H F= F ×C Fm×(T F ―20℃)=0.9875kmol/h×42.574 cal/mol•℃×(106.9519℃―20℃)=3655.62kcal/h=15295.48kJ/h2. 塔顶产品焓的计算H DT D=99.5252℃定性温度=(T D + 20℃)/2=59.7626℃查石油化工基础数据手册并由插值法得定性温度下的比热:C DPCT=42.32 cal/mol•℃C DOCT=42.28 cal/mol•℃则塔顶产品的平均比热:C Dm= C DOCT×XD + C DPCT×(1-X D)=42.28 cal/mol•℃×80%(mol)+ 42.32 cal/mol•℃×(1-80%)(mol) =42.288 cal/mol•℃则H D= D ×C Dm×(T D―20℃)=0.329167kmol/h×42.288 cal/mol•℃×(99.5252℃―20℃)=1106.976kcal/h=4631.70kJ/h3. 塔底产品焓的计算H WT W=384.3198K=111.1698℃定性温度=(T W + 20℃)/2=65.5849℃查石油化工基础数据手册并由插值法得定性温度下的比热:C WPCT=42.74 cal/mol•℃C WOCT=42.70 cal/mol•℃则进料液体的平均比热:C Wm= C WOCT×X W + C WPCT×(1-X W)=42.70 cal/mol•℃×20%(mol)+ 42.74 cal/mol•℃×(1-20%)(mol) =42.732 cal/mol•℃则塔底产品焓:H W= W ×C Wm×(T W ―20℃)=0.658333kmol/h×42.732 cal/mol•℃×(111.1698℃―20℃)=2564.78kcal/h=10731.30kJ/h4. 全凝器冷凝负荷的计算Q CQ 1 = V ×r m = (R+1)D ×r mr m =r OCT × X D +r PCT × (1-X D )Q 2 = V × C pm × (T 顶 – 20)①算Q 1 :由Ct B A p +-=log 得 2)(10ln 1*log C t B p dt dp dt p d +== 22)15.273(10ln *Ct t RB p RT dt dp r v ++== mol J C t t RB r T T OCT /10*1568.4)486.2195252.9915.2735252.99(*10ln *990.1590*3143.8)15.273(10ln 42200=++=+=+ m o l J C t t RB r pT T PCT /10*2123.4)519.2185252.9915.2735252.99(*10ln *490.1602*3143.8)15.273(10ln 4220=++=++= 混合汽化潜热:molJ x r x r r PCT D OCT m /10*1679.42.0*10*2123.48.0*10*1568.4)1(4440=+=-+= hkJ r D R r V Q mm /10*5228.2610*1679.4*)13324.18(*329167.0*)1(*441=+=+==②算Q 2 :t 顶=99.5252℃由内插法得C p OCT(99.5252℃)=45.0672 Cal/(mol·℃)C p OCT(20℃) =39.34Cal/(mol·℃)同理由内插法得C p PCT(99.5252℃)=45.1168 Cal/(mol·℃)C p PCT(20℃) =39.38Cal/(mol·℃) 平均比热:C m =XD (C p OCT(99.5252℃)+ C p OCT(20℃))/2+(1-X D )(C p PCT(99.5252℃)+C p PCT(20℃))/2 =80%×(45.0672+39.34)/2+(1-80%)(45.1168+39.38)/2 = 42.2126Cal/(mol·℃)Q2=V×C m (t 顶-20)=6.363588×42.2126×(99.5252-20)=21362.3455kcal/h=8.9382×104kJ/hQ C =Q 1+Q 2=26.5228×104+8.9382×104=35.461×104kJ/h ③ 冷却水用量:取进口水温为30℃,出口水温为40℃,则△t 水=10℃ 水的定性温度为:(30+40)/2=35℃查《化工原理》附录水的比热容为:C p 水(35℃)=4.174kJ/(kg ·K)W=Q C /C p 水 △t 水=10174.410461.354⨯⨯=8495.69 kg/h5. 再沸器热负荷的计算 Q BH L’ + Q B = H V’ + H WQ B= H V’ + H W - H L’H L’= L’ × C m L’ × (T底– 20)H V’= V’ ×r m V’ + V’ × C m V’×(T V’-20)H W = W × C m W × (T W - 20)⑴计算倒数第二块板的焓H L’由Aspen plus 计算结果:t L’=110.9493℃x L’=0.21561268 L’=7.04494355kmol/h定性温度t m =( t L’+20℃)/2=65.4747℃由插值法:C p PCT,65.4747℃=42.7287 Cal/(mol·℃)C p OCT,65.4747℃=42.6887 Cal/(mol·℃)C m = C p PCT (1- x L’)+ C p OCT x L’=42.7287*(1-0.2156)+42.6887*0.2156= 42.7201Cal/(mol·℃)=178.7451J/(mol·℃)H L’=L’C m(t L’-20)=7.0449*178.7451*(110.9493-20)=11.4527*104kJ/h⑵计算离开再沸器的相焓H V’P底=170.00148mmHgx W =0.2 y V’=0.21722207 V’=6.38661055kmol/ht V’=t W =111.1698℃t m =( t V’+20)/2=65.5849℃由插值法:C p PCT, 65.5849℃ =42.7365 Cal/(mol·℃) C p OCT, 65.5849℃ =42.6965 Cal/(mol·℃) C m = C p PCT (1- x W )+ C p OCT x W=42.7365*(1-0.2)+42.6965*0.2=42.7822 Cal/(mol·℃)=179.005J/(mol·℃) Q 1=V’C m (t v’-20)=6.3866*179.005*(111.1698-20) =10.4261*104kJ/h2)15.273(10ln Ct t RB r V ++= mol J r OCT /10*1147.4)486.219111.169815.273111.1698(*10ln *99.1590*3143.842=++=mol J r PCT /10*1644.4)592.218111.169815.273111.1698(*10ln *49.1601*3143.842=++=r m =r OCT y V’+r PCT (1-y V’)=4.1147*104*0.2172+4.1664*104*(1-0.2172) =4.1552*104 J/molQ 2=V’r m =6.3866*4.1552*104=26.5376*104 kJ/h H V’ = Q 1 + Q 2 =36.9637* 104 kJ/h ⑶塔底产品的焓H WH W = 10731.30kJ/h(前已述及) ⑷Q BQ B =H V’+H W -H L’=36.9637*104+1.0731*104-11.4527*104 =26.5841* 104 kJ/h在0.3Mpa时,r水蒸汽=2168kJ/kg蒸汽用量W汽=Q B /r水蒸汽=122.62 kg/h热量衡算方程为:H F + Q B = Q C + H D + H W等式左边=H F + Q B =15295.48+26.5841* 104=28.1136kJ/h等式右边=Q C+H D + H W=35.461×104+4631.70+10731.30=36.9973kJ/h。
热量衡算1计算方法与原则1.1热量衡算的目的及意义热量衡算的主要目的是为了确定设备的热负荷。
根据设备热负荷的大小、所处理物料的性质及工艺要求再选择传热面的形式、计算传热面积、确定设备的主要工艺尺寸。
传热所需的加热剂或冷却剂的用量也是以热负荷的大小为依据而进行计算的。
1.2热量衡算的依据及必要条件热量衡算的主要依据是能量守恒定律,其数学表达式为Q1+ Q2+Q3=Q4+Q5+Q6 式1其中:Q1——物料带入到设备的热量,kJQ2——加热剂或冷却剂传给设备和所处理物料的热量,kJQ3——过程热效应,kJQ4——物料离开设备所消耗的热量,kJQ5——加热或冷却设备所消耗的热量,kJQ6——设备向环境散失的热量,kJQ1(Q4)=Σ mC P(t2- t0) kJ式2m——输入或输出设备的物料质量,kgC P——物料的平均比热容,kJ/(kg•℃)t2——物料的温度,℃t0——基准温度,℃Q5=Σ C P M (t2-t1) kJ式3M——设备各部件的质量,kgC P——设备各部件的比热容,kJ/(kg•℃)t1——设备各部件的初始温度,℃t——设备各部件的最终温度,℃2Q5+Q6=10%Q总式4热量衡算是在车间物料衡算的结果基础上而进行的,因此,车间物料衡算表是进行车间热量衡算的首要条件。
其次还必须收集有关物质的热力学数据,例如比热容,相变热,反应热等。
本设计还将涉及到的所有物料的热力学数据汇总成表4,以便于后期的计算。
1.3热量衡算基准因为物料衡算计算的是各个岗位的天处理量,所以热量衡算计算的也是某个设备天换热介质消耗量,同时温度基准采用的是0℃做基准。
当然,进行传热面积校核时,是根据批处理量计算。
2全车间物料热力学数据的估算2.1所用纯化合物比热的推算0i i pMc n C ∑=式 5式中M ——化合物分子量;n i ——分子中同种元素原子数; c i ——元素的原子比热容,kJ/(kg•℃)查《制药工程工艺设计》P111,得到原子的摩尔热容相关数据,见表1表1 元素原子的摩尔热容单位:kcal/( kmol•℃)(当物质为固体时,各原子的C a 取值近似值)原子 C a 原子 C a 原子 C a 碳C 2.8 氧O 6.0 氮N 2.6 氢H4.3硫S7.4其他8.0(当物质为液体时,各原子的C a 取值近似值)而在实际生产的过程中遇到的物质大多是混合物,极少数的混合物有实验测定的热容数据,一般都是根据混合物内各种物质的热容和组成进行推算的,其中杂质的含量极少,热效应可以忽略不计。
在本次设计中所涉及到得液体混合物的热容可以采用类似理想气混合物的热容的按分子组成加和的规律进行计算。
即C P = Σ X i C Pi 0 式 6式中 C P ——液体混合物的定压摩尔热容,kJ/(kmol•℃)X i ——液体混合物中i组分的摩尔分数; C Pi 0——液体混合物中纯i组分的定压摩尔热容原子 C a 原子 C a 原子 C a 碳C 1.8 氧O 4.0 氮N 2.6 氢H2.3硫S5.5其他6.2对于2(C13H20N3O2Cl M=285.77)C0P(2)=4.187x91.4/285.77=1.34 kj/kg.℃对于联硼酸频哪醇酯(C12H24B2O4 M=231.18)C P(C12H24B2O4)=4.187*105.2/231.18=1.91kj/kg.℃对于醋酸甲(C2H3O2K M=98.14)C P(C2H3O2K)=4.187*38.8/98.14=1.66 kj/kg.℃对于二甲亚砜(C2H6SO M=83.95)C P(C2H6SO)=4.187*45.4/83.95=2.26 kj/kg.℃对于(PdCl2 M=175.84)C P(PdCl2)=4.187*48/175.84=1.14 kj/kg.℃对于3(C19H32O4N3B M= 377.29)C P(C19H32O4N3B)=4.187*1377.8/377.29=1.53 kj/kg.℃对5(C18H19O3N2Cl2BrF M=480.10)C P(C18H19O3N2Cl2BrF)=4.187*118.1/480.10=1.03 kj/kg.℃对于碳酸钠(Na2CO3M= 105.99)C P(Na2CO3)=4.187*26.2/105.99=1.03 kj/kg.℃对于4 (C31H39N5O3Cl2F M=650.57)C P(C31H39N5O3Cl2F)=4.187*189.1/650.57=1.22 kj/kg.℃查《化工工艺设计手册》(第四版上册)P1189得到下列物质比热容数据对于水(H 2O M= 18.01)20P() 4.18kJ/(kg )H C O C =•︒对于二氧化碳(CO 2 M= 44.01)20P() 2.84kJ/(kg )C C O C =•︒对于二氧化硫(SO 2 M= 64.06)20P()0.37kJ/(kg )S C O C =•︒对于氯化氢(HCl M= 36.46)P() 4.00kJ/(kg HCl C )C =•︒对于乙酸乙酯(C 4H 8O 2 M= 88.11) 20P48() 3.28kJ/(kg C H C )O C =•︒2.2各物质燃烧热的估算有机物燃烧热的估算可采用卡拉奇法。
主要是适用于液体有机物,固体相差熔化热即相变热。
如果设想碳原子与氢原子之间的键是有一对电子形成的,那么在有机物燃烧时所放出的热,就可以看作是这些电子从碳原子和氢原子转移到氧原子上的结果。
根据对大多数化合物分子的结果表明,每个电子的转移会释放109.07kJ 的热量。
)P H C 4(07.109109.07n QC-+==式 7式中Q C ——物质的燃烧热,kJ/molC——化合物中C 原子数 H——化合物中H 原子数 P——C,H 已和O 结合的电子书n——化合物燃烧时,C,H 向氧转移的电子数查《化工工艺设计手册》(第四版上册)P1225表21-122摘录如表2基团结构燃烧热的相关数据。
表2 部分基团结构燃烧热参数数据表取代基和键的性质结构式 热量校正值Δ/(kJ/mol)脂肪伯胺 R-NH 2 54.4 脂肪仲胺 R-NH-R 81.6 脂肪酮 R-CO- 27.2 取代酰胺 R-NH-COR 27.2 羧酸 -COOH 41.2 脂肪化合物中的溴 R-Br 69.1 脂肪化合物中的氯R-Cl-32.2对于2(C 13H 20N 3O 2Cl M=285.77)其充分燃烧所需的氧原子数n=2*13+20/2-2=34对其结构分析:包括结构有基值1,羧酸1,脂肪化合物中的氯1。
△H=-Q C =-1528.21KJ/mol同理,对于 联硼酸频哪醇酯(C12H24B2O4 M=231.18) △H=-Q C =-1482.01KJ/mol对于3(C19H32O4N3B M= 377.29 △H=-Q C =-2727.71KJ/mol5(C18H19O3N2Cl2BrF M=480.10) △H=-Q C =--6109.84KJ/mol 对于4 (C31H39N5O3Cl2F M=650.57)△H=-Q C =--3162.99KJ/mol2.4某些工况下物质汽化热的估算方法液体汽化所吸收的热量成为汽化热,亦称为蒸发潜热。
在一些化工手册中能查到一些物质在常压沸点下的汽化热,有时也能找出一些物质在25℃的汽化热,但很少有其他操作条件下的数据,本次设计根据对比压强、对比温度求汽化热能很好地解决上述问题。
任何温度、压强下,化合物的汽化热均可按下列公式计算:10T T r cHP v r T r (28.5)log []0.62(1-)∆=- 式 8式中ΔH v ——汽化热,kJ/kg ; T c ——临界温度,K ;T r ——对比温度(实际温度与临界温度之比);P r ——对比压强(实际压强与临界压强之比)。
3部分岗位热量衡算3.1取代反应岗位 (1)Q 3的计算反应热的计算公式如下:kJ/mol )(-)(产物r反应物rci i rq q H q∑∑=∆∑=θθδ式中δi ——化学计量系数,反应物为负,生成物为正;ΔH ci θ——各物质的标准燃烧热,kJ/mol ;反应物产物ci i rrr3r()-() kJ/mol1528.21206.001482.01-252.20kJ/mol1180.4310000.918n -252.20-1786576.99kJ152.97qq q H qQθθθδ=∑∆=∑∑=--+=⨯⨯=⨯=⨯=(2)Q 1的计算各物料带入的能量如下: 2带入的热量:Q 2=C 2*M 2*(t 进-t 出)=34232.47kj同理,联硼酸频哪醇酯带入的热量: Q 酯=C 2*M 2*(t 进-t 出)=35563.33kj 物料带入总热量: Q 1=Q 2+Q 酯=69795.80kj(2)Q 4的计算各物料带出的能量如下: 3带出的热量 出来80℃ Q 3=C 3*M 3*(t 出—t 进)=195859.30kj 同理,二甲亚砜带出的热量 Q 二甲亚砜=43803.10kj 其他物质带出热量 Q 杂质=14185.44kj物料带出的热量:Q 4=Q 3+Q 二甲亚砜+Q 杂质=253847.84kj(4)Q 2的计算通常Q 5+Q 6=(Q 1+Q 2+Q 3)⨯10%∴Q 2=Q 4/(1-10%)-(Q 1+Q 3)=253847.84 /(1-10%)-(69795.80-1786576.99)=1998834.35kJ(5)换热介质批用量的计算方便估算全车间蒸汽消耗量,从而确定锅炉房大小,本岗位计算的是蒸汽消耗量,但实际上,在工艺操作中考虑到环合反应温度控制比较低,我们不用蒸汽加热,不好精准控温,容易过热甚至有可能导致环合反应釜出现危险,所以工艺中实际是用水蒸气和冷水混合后生成的热水加热。
本次设计的加热介质采用133.5℃三个大气压下饱和水蒸气间接加热,查表的该状态下饱和水蒸气的热焓H=2725.5 kJ/kg ,计算公式如下:η])273-T (C -[H D Q2=式 9式中 D——加热蒸汽的用量,kg;Q 2——由加热剂所提供的热量,kJ;H——水蒸气的热焓,kJ/kg;C——冷凝水的比热容,可取4.18kJ/(kg•℃) T——冷凝水的最终温度,K ;η——为热利用率,保温设备为0.97-0.98(取0.975), 不保温设备为0.93-0.95则此岗位水蒸气的用量为2D 855.89kg[H-C (T-273)][2725.5-4.18(79-0)]0.91998834.3755Qη===氯化反应岗位热量衡算结果如表5-3所示:表3取代反应岗位热量平衡及介质消耗表热类型 值/kJ 热类型 值/kJ(kg)Q 1 69795.80 Q 4 253847.84Q 2 1998834.35 Q 5+6 28205.31Q 3-1786576.99 D 蒸汽(3atm )855.893.2缩合反应岗位(计算跟第一工段一样) (1)Q 3的计算反应热的计算公式如下:kJ/mol )(-)(产物r反应物rci i rq q H q∑∑=∆∑=θθδ式中δi ——化学计量系数,反应物为负,生成物为正;ΔH ci θ——各物质的标准燃烧热,kJ/mol ;反应物产物ci i rrr3r()-() kJ/mol1482.011513.512727.71-267.81kJ/mol 1153.6110000.987n -267.81-1778858.75kJ171.42qq q H qQθθθδ=∑∆=∑∑=--+=⨯⨯=⨯=⨯=(2)Q 1的计算各物料带入的能量如下: 3带入的热量: Q 3=36627.12KJ 5带入的热量:Q 5=36955.28KJPdCl 2带入的热量: Q PdCl2=1801889kj 物料带入总热量:Q 1=∑Q n =1801889kj (3)Q 4的计算各物料带出的能量如下: 4带出的热量: Q 4=-10323.52KJ其它物质带出的热量:Q 其=-1606.883kj水带出的热量:Q 水=-103113.50kj副产物带出的热量:Q 副=-3359039kjPdCl 2带出的热量:Q Pdcl2=-2204.84kj物料带出的热量:Q 4=∑Q=-479032.09KJ(4)Q 2的计算通常Q 5+Q 6=(Q 1+Q 2+Q 3)⨯10%∴Q 2=Q 4/(1-10%)-(Q 1+Q 3)=-479032.09 /(1-10%)-(2383061.34-1778858.75)=-1136460.468kJ(5)换热介质批用量的计算在换热过程中,冷却介质不发生相变,冷却剂的用量可由下式计算Q 2W C (-)T T K H =式中 W —— 冷却剂的用量,kg ;Q 2 —— 从冷却剂中移走的热量,kJ ;C —— 冷却剂的平均比热容,kJ/(kg•℃);T K —— 冷却剂的最终温度,℃;T H —— 冷却剂的最初温度,℃;则此岗位冷冻盐水的用量为:2K H 1136460.4W 6876.392kg C (-) 3.3(68-5-0)Q T T ===-缩合反应岗位热量衡算结果如表5-4所示:表4缩合反应岗位热量平衡及介质消耗表热类型值/kJ热类型值/kJ(kg) Q12383061.34Q4-479032.09 Q2-1136460.47Q5+6-53225.796876.40 Q3-1778858.75D冷冻盐水(3atm)。