第5章气体动理论与热力学
- 格式:ppt
- 大小:1.68 MB
- 文档页数:74

第十三章 气体动理论本章从理想气体的微观组成出发,假以统计性假设,推出理想气体的压强和温度公式,揭示了压强和温度的本质;提出了理想气体内能的概念,介绍了理想气体能量按自由度均分原理;阐述了理想气体的麦克斯韦速率分布率。
这称为气体动理论。
气体动理论的产生和发展凝聚了众多物理学家的智慧和心血。
早在1678年,胡克就提出了气体压强是由大量气体分子与器壁碰撞的结果的观点。
之后,在1738年,伯努利根据这一观点推导出压强公式,并且解释了玻意耳定律。
1744年,俄国的罗蒙诺索夫提出了热是分子运动表现的观点。
在19世纪中叶,气体动理论经克劳修斯、麦克斯韦和玻耳兹曼的努力而有了重大发展。
1858年,克劳修斯提出气体分子平均自由程的概念并导出相关公式。
1860年,麦克斯韦指出,气体分子的频繁碰撞并未使它们的速度趋于一致,而是达到稳定的分布,导出了平衡态气体分子的速率分布和速度分布。
之后,麦克斯韦又建立了输运过程的数学理论。
1868年,玻耳兹曼在麦克斯韦气体分子速率分布律中又引进重力场。
第一节理想气体状态方程一、状态参量1.状态参量概念如何描述系统的冷热变化规律,这就需要一些物理量。
假设气体的质量为 m ,其宏观状态一般可以用气体的压强p 、体积V 和温度T 三个物理量来描述。
如果在热力学过程中伴随着化学反应,还需要物质的量、摩尔质量 、物质各组分的质量等物理量来描述。
如果热力学系统处于磁场中,还需要电场强度E 、电极化矢量P 、磁场强度H 和磁化强度M 等物理量来描述。
选择几个描写系统状态的参量,称为状态参量。
2.状态参量分类按照不同的划分标准,状态参量可作如下划分:(1)按状态参量描写系统的性质划分可分为:V P E P H M几何参量:描述系统的空间广延性。
如体积 。
力学参量:描述系统的强度。
如压强 。
化学参量:描述系统的化学组分。
如各组分的质量,物质的量。
电磁参量:描述系统的电磁性质。
如电场强度 ,电极化强度 ,磁场强度 ,磁化强度 。



第五章 气体动理论练 习 一一. 选择题1. 一个容器内贮有1摩尔氢气和1摩尔氦气,若两种气体各自对器壁产生的压强分别为1p 和2p ,则两者的大小关系是( C )(A ) 21p p >; (B ) 21p p <; (C ) 21p p =; (D ) 不确定的。
2. 一定量的理想气体贮于某一容器中,温度为T ,气体分子的质量为m. 根据理想气体的分子模型和统计假设,分子速度在x 方向的分量平方的平均值为( D )(A ) 2x v =m kT 3; (B ) 2x v = (1/3)m kT 3 ; (C ) 2x v = 3kT /m ; (D ) 2x v = kT/m 。
3. 设M 为气体的质量,m 为气体分子质量,N 为气体分子总数目,n 为气体分子数密度,0N 为阿伏伽德罗常数,下列各式中哪一式表示气体分子的平均平动动能( A )(A )pV M m ⋅23; (B ) pV M Mmol⋅23; (C ) npV 23; (D ) 023N pV M M mol ⋅。
4. 关于温度的意义,有下列几种说法,错误的是( D ) (A ) 气体的温度是分子平动动能的量度;(B ) 气体的温度是大量气体分子热运动的集体表现,具有统计意义; (C ) 温度的高低反映物质内部分子运动剧烈程度的不同; (D ) 从微观上看,气体的温度表示每个气体分子的冷热程度。
二.填空题1. 在容积为10-2m 3的容器中,装有质量100g 的气体,若气体分子的方均根速率为200m/s ,则气体的压强为ap 51034⨯。
2. 如图1所示,两个容器容积相等,分别储有相同质量的N 2和O 2气体,它们用光滑细管相连通,管子中置一小滴水银,两边的温度差为30K ,当水银滴在正中不动时,N 2和O 2的温度为2N T = 210k ,2O T = 240k 。
( N 2的摩尔质量为28×10-3kg/mol,O 2的摩尔质量为32×10-3kg/mol)3.分子物理学是研究大量微观粒子的集体运动的统计表现 的学科, 它应用的方法是 统计学 方法。


第5章气体动理论一、选择题1.两种不同的理想气体,若它们的最概然速率相等,则它们的()。
A.平均速率相等,方均根速率相等B.平均速率相等,方均根速率不相等C.平均速率不相等,方均根速率相等D.平均速率不相等,方均根速率不相等【答案】A【解析】因为平均速率、方均根速率与最概然速率一样,都与成正比,成反比。
2.范德瓦耳斯方程中()。
A.实际测得的压强是,体积是VB.实际测得的压强是p,体积是VC.实际测得的压强是p,V是1mol范氏气体的体积D.实际测得的压强是;1mol范氏气体的体积是(V-b)【答案】C3.1mol单原子分子理想气体从状态A变为状态B,如果不知是什么气体,变化过程也不知道,但A、B两态的压强、体积和温度都知道,则可以求出()。
A.气体所做的功B.气体内能的变化C.气体传给外界的热量D.气体的质量【答案】B【解析】单原子分子的自由度i=3,摩尔数ν=1,内能是状态量,只取决于状态(温度);内能的变化只与始末状态有关,与是什么气体,经历什么变化过程无关。
4.按照经典的能均分定理,由刚性双原子分子组成的理想气体的定体摩尔热容量是理想气体常数R的()。
A.1倍B.1.5倍C.2倍D.2.5倍【答案】D【解析】刚性双原子分子的自由度是i=5,其定体摩尔热容量。
5.质量为m,摩尔质量为M的理想气体,经历了一个等压过程,温度增量为ΔT,则内能增量为()。
A.B.C.D.【答案】B二、填空题1.在平衡态下,已知理想气体分子的麦克斯韦速率分布函数为f(υ)、分子质量为m、最概然速率为υp,试说明下列各式的物理意义:(1)表示______;(2)表示______。
【答案】(1)分布在0~∞速率区间的分子数占总分子数的百分比;(2)分子平动动能的平均值。
2.某种刚性双原子分子理想气体,处于温度为T的平衡态,则其分子的平均平动动能为______,平均转动动能为______,平均总能量为______,lmol气体的内能为______。

第五章气体的热力性质5.1 理想气体性质 (1)5.1.1 理想气体状态方程 (2)5.1.2 理想气体热系数 (3)5.1.3 理想气体热力学能和焓的特性 (4)5.1.4 理想气体熵方程 (4)5.2 理想气体比热容及参数计算 (5)5.2.1 比热容的单位及其换算 (5)5.2.2 理想气体比热容与温度的关系 (5)5.2.3 平均比热容 (6)5.2.4 理想气体性质特点 (11)5.3 实际气体状态方程 (11)5.3.1 范德瓦尔斯状态方程 (12)5.3.2 其它状态方程 (14)5.3.3 维里(Virial) 状态方程 (16)5.3.4 对比态状态方程 (17)5.4 实际气体比热容及焓、熵函数 (20)5.4.1 实际气体状态函数的推导方法 (20)5.4.2 计算气体热力性质的三种方法 (22)思考题及答案 (22)5.1 理想气体性质工质在通常的参数范围内可呈现为气、液、固三种聚集状态,或称三种相。
这里所谓的气体是指在其工作的参数范围内总是呈现为气态的工质。
例如空气、气体燃料、燃气(燃料燃烧生成的气体),以及组成它们的单元气体氮、氢、氧、二氧化碳等等。
本节主要讲述理想气体性质。
理想气体性质是指当压力减小到趋于零时,气体热力性质趋近的极限情况。
这时,表达气体热力性质的各状态函数有最简单的形式。
在压力很低时,气体的比体积大而内部分子自身占有的体积相对极小;分子间的平均距离大,使分子间的相互作用力很小,以致可以忽略分子自身占有的体积和分子间的相互作用力对气体宏观热力性质的影响。
因此,常将分子自身不占有体积和分子之间无相互作用力作为理想气体的微观模型。
这也是理想气体性质有简单表达形式的内在原因。
尽管理想气体性质不能很精确地表达气体,特别是较高压力下气体的热力性质,但它在工程中还是具有很重要的实用价值和理论意义。
这是因为:第一,在通常的工作参数范围内,按理想气体性质来计算气体工质的热力性质具有足够的精确度,其误差在工程上往往是允许的。


物理学简明教程第五章课后习题答案高等教出版社第五章 气体动理论和热力学5-1 图示两条曲线分别表示在相同温度下氧气和氢气分子的速率分布曲线.如果2O P )(v 和2H P )(v 分别表示氧气和氢气的最概然速率,则( )(A) 图中a 表示氧气分子的速率分布曲线且4)()(22H P O P =v v (B) 图中a 表示氧气分子的速率分布曲线且41)()(22H P O P =v v (C) 图中b 表示氧气分子的速率分布曲线且41)()(22H P O P =v v (D) 图中b 表示氧气分子的速率分布曲线且4)()(22HP O P =v v分析与解 由MRTv 2P =可知,在相同温度下,由于不同气体的摩尔质量不同,它们的最概然速率P v 也就不同.因22O H M M <,故氧气比氢气的P v 要小,由此可判定图中曲线a 应是对应于氧气分子的速率分布曲线.又因16122OH =M M ,所以=22HP O P )()(v v 4122OH =M M .故选(B).题 5-1图5-2 在一个体积不变的容器中,储有一定量的某种理想气体,温度为0T 时,气体分子的平均速率为0v ,分子平均碰撞次数为0Z ,平均自由程为0λ,当气体温度升高为04T 时,气体分子的平均速率v 、平均碰撞频率Z 和平均自由程λ分别为()(A) 004,4,4λλZ Z ===0v v (B) 0022λλ===,,Z Z 0v v (C)00422λλ===,,Z Z 0v v (D)00,2,4λλ===Z Z 0v v分析与解 理想气体分子的平均速率M RT π/8=v ,温度由0T 升至04T ,则平均速率变为0v 2;又平均碰撞频率v n d Z 2π2=,由于容器体积不变,即分子数密度n 不变,则平均碰撞频率变为0Z 2;而平均自由程nd 2π21=λ,n 不变,则λ也不变.因此正确答案为(B).5 -3 处于平衡状态的一瓶氦气和一瓶氮气的分子数密度相同,分子的平均平动动能也相同,则它们( )(A) 温度,压强均不相同 (B) 温度相同,但氦气压强大于氮气的压强 (C) 温度,压强都相同 (D) 温度相同,但氦气压强小于氮气的压强 分析与解 理想气体分子的平均平动动能23k /kT =ε,仅与温度有关.因此当氦气和氮气的平均平动动能相同时,温度也相同.又由物态方程,当两者分子数密度n 相同时,它们压强也相同.故选(C).5—4 一物质系统从外界吸收一定的热量,则( )。

05章 气体动理论一、填空题 (一)易(基础题)1、一定质量的气体处于平衡态,则气体各部分的压强 相等 (填相等或不相等),各部分的温度 相等 (填相等或不相等)。
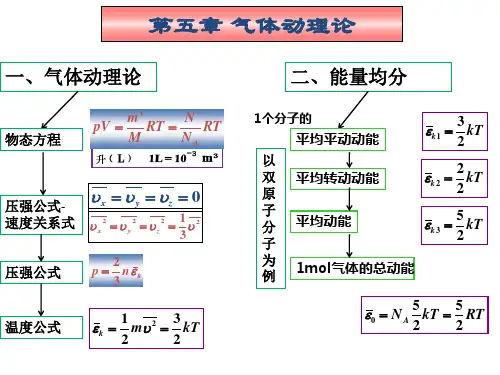
2、根据能量按自由度均分原理,设气体分子为刚性分子,分子自由度为i ,则当温度为T时,(1)一个分子的平均能量为(平均总动能) 12i kT ⋅;(2)ν摩尔理想气体的内能为2i RT ν⋅ ;(3)一个双原子分子的平均转动动能为 kT 。
3、对于单原子分子理想气体,①32RT 代表的物理意义为: 1mol 单原子分子理想气体的内能; ②R 23代表的物理意义为:单原子分子理想气体的定体摩尔热容 。
4、自由度数为i 的一定量的刚性分子理想气体,其体积为V,压强为p 时,其内能E=2iPV 。
5.两瓶不同种类的理想气体,它们温度相同,压强也相同,但体积不同,则它们分子的平均平动动能 相同,单位体积内分子的总平动动能 相同。
(均填相同或不相同) 6.一定量的某种理想气体,装在一个密闭的不变形的容器中,当气体的温度升高时,气体分子的平均动能 增大 ,气体分子的密度 不变 ,气体的压强 增大 ,气体的内能 增大 。
(均填增大、不变或减少)7、理想气体的压强公式为 P nkT = ,理想气体分子的平均平动动能与温度的关系为 32k kT ε=。
8、有两瓶气体,一瓶是氧气,另一瓶是氢气(均视为刚性分子理想气体),若它们的压强、体积、温度均相同,则氧气的内能是氢气的▁▁1▁▁倍。
9、一容器内贮有气体,其压强为1atm,温度为27ºC,密度为31.3kg m -⋅,则气体的摩尔质量为__33210-⨯____1kg mol -⋅,由此确定它是__氧____气.10、()Nf d u u 表示的物理意义是 表示速率分布在~d υυυ+内的分子数 ------------------------------------。
11、21()f d u u u u ò表示的物理意义是 表示速率分布在12~υυ范围内的分子数占总分子数的比率.12、在相同条件下,氧原子的平均动能是氧分子的平均动能的___35___倍.(二)中(一般综合题)1、如图1所示,两条曲线分别表示相同温度下,氢气和氧气分子的速率分布曲线,则a 表示▁氧▁▁气分子的速率分布曲线;b 表示▁▁氢▁气分子的速率分布曲线。