s 区元素
- 格式:pptx
- 大小:7.58 MB
- 文档页数:72



第十二章S 区元素·教学基本要求·⑴熟悉碱金属和碱土金属的通性。
⑵掌握碱金属和碱土金属的氢化物、氧化物、过氧化物、超氧化物的生成和基本性质; 熟悉碱金属和碱土金属氢氧化物碱性强弱的变化规律、重要盐类的溶解性和热稳定性。
⑶了解锂、铍的特殊性和对角线规则。
·重点内容摘要·⒈ s 区元素的通性S 区元素包括ⅠA 族和ⅡA 族元素,即碱金属和碱土金属。
碱金属和碱土金属原子的价层电子构型分别为 1ns 和 2ns ,它们很容易失去 ns 电子。
碱 金属和碱土金属的常见氧化值分别为+1和+2。
S 区元素的化合物大多是离子型化合物。
碱金属和碱土金属都是轻金属,密度小,硬度小,熔点和沸点较低,导电性和导热性好。
碱金属和碱土金属都是活泼金属,具有强还原性。
S 区元素基本性质的递变规律归纳如下:⒉ s 区元素的氢化物金属性还原增强电离能、电负性减小原子半径增大原子半径减小,电离能、电负性增大金属性、还原性减弱I ALi Na K Rb Cs ⅡA Be Mg Ca Sr Ba⑴氢化物碱金属和碱土金属中的镁、钙、锶、钡可以分别形成离子型氢氧化物。
离子型氢氧化物具有强还原性,它们与水反应生成相应的氢氧化物和氢气。
⑵氧化物碱金属和碱土金属在空气中燃烧的主要产物如下:Li 2O (Li 3N) Na 2O 2 KO 2 RbO 2 CsO 2BeOMgO (Mg 3N 2)CaO (Ca 3N 2)SrO BaO (BaO 2)S 区元素的正常氧化物与水反应生成相应的氢氧化物;过氧化物与水反应生成氢氧化物 和 H 2O 2,例如:Na 2O 2 + 2H 2O ® 2NaOH + H 2O 2超氧化物与水反应生成氢氧化物、H 2O 2 和 O 2,例如:2KO 2 + 2H 2O ® 2KOH + H 2O 2 + O 2⑶氢氧化物碱金属和碱土金属氢氧化物的溶解度大小和碱性强弱的次序如下:⑷重要盐类性质的递变规律碱金属的盐大多是离子型化合物,它们的熔点、沸点较高。


无机化学S区元素概述单质及其物理化学性质S区元素是指周期表中第三周期的元素,包括Sc、Ti、V、Cr、Mn、Fe、Co、Ni、Cu和Zn。
这些元素的单质是指它们在自然界中以纯态存在的形态。
下面将对这些S区元素的单质及其物理化学性质进行概述。
Scandium(Sc)是一种银白色金属,熔点1541℃,沸点2836℃。
它的密度为2.989 g/cm³,熔化热为15.8 kJ/mol。
Scandium的化学性质活泼,可以与氢气、氧气和氮气反应。
它可以形成多种化合物,如ScCl3、Sc2O3等。
Titanium(Ti)是一种银灰色金属,熔点1668℃,沸点3260℃。
它的密度为4.506 g/cm³,熔化热为13.8 kJ/mol。
Titanium具有低密度、高强度和良好的耐腐蚀性。
它与氧、氮、氢等非金属元素反应生成化合物,如TiO2、TiN等。
Vanadium(V)是一种银白色金属,熔点1890℃,沸点3380℃。
它的密度为6.0 g/cm³,熔化热为21.5 kJ/mol。
Vanadium的化学性质活泼,可以与氧气、氮气和氟气反应。
它可以形成多种氧化态,如V2O5、VO2等。
Chromium(Cr)是一种银灰色金属,熔点1907℃,沸点2672℃。
它的密度为7.18 g/cm³,熔化热为20.5 kJ/mol。
Chromium的外层电子构型为3d54s1,具有良好的抗腐蚀性。
它可以形成多种化合物,如Cr2O3、CrCl3等。
Manganese(Mn)是一种银灰色金属,熔点1244℃,沸点1962℃。
它的密度为7.21 g/cm³,熔化热为13.2 kJ/mol。
Manganese与氧气反应生成二氧化锰(MnO2),具有一定的催化性能。
它还可以形成多种化合物,如MnCl2、MnSO4等。
Iron(Fe)是一种银灰色金属,熔点1538℃,沸点2861℃。
它的密度为7.874 g/cm³,熔化热为13.8 kJ/mol。

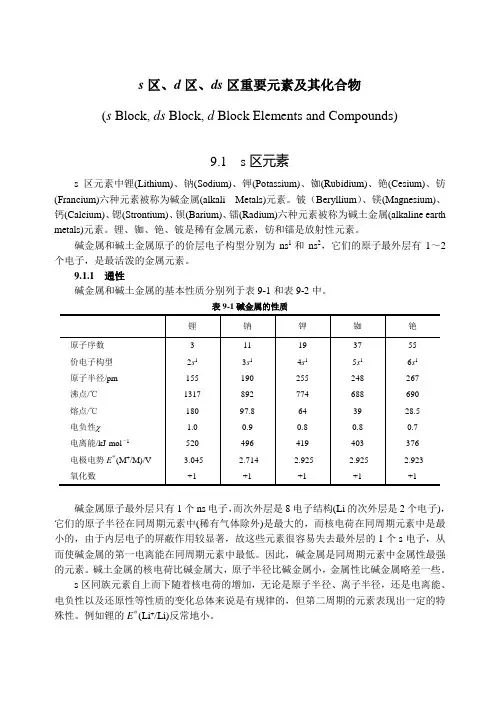
s区、d区、ds区重要元素及其化合物(s Block, ds Block, d Block Elements and Compounds)9.1 s区元素s区元素中锂(Lithium)、钠(Sodium)、钾(Potassium)、铷(Rubidium)、铯(Cesium)、钫(Francium)六种元素被称为碱金属(alkali Metals)元素。
铍(Beryllium)、镁(Magnesium)、钙(Calcium)、锶(Strontium)、钡(Barium)、镭(Radium)六种元素被称为碱土金属(alkaline earth metals)元素。
锂、铷、铯、铍是稀有金属元素,钫和镭是放射性元素。
碱金属和碱土金属原子的价层电子构型分别为ns1和ns2,它们的原子最外层有1~2个电子,是最活泼的金属元素。
9.1.1 通性碱金属和碱土金属的基本性质分别列于表9-1和表9-2中。
表9-1碱金属的性质碱金属原子最外层只有1个ns电子,而次外层是8电子结构(Li的次外层是2个电子),它们的原子半径在同周期元素中(稀有气体除外)是最大的,而核电荷在同周期元素中是最小的,由于内层电子的屏蔽作用较显著,故这些元素很容易失去最外层的1个s电子,从而使碱金属的第一电离能在同周期元素中最低。
因此,碱金属是同周期元素中金属性最强的元素。
碱土金属的核电荷比碱金属大,原子半径比碱金属小,金属性比碱金属略差一些。
s区同族元素自上而下随着核电荷的增加,无论是原子半径、离子半径,还是电离能、电负性以及还原性等性质的变化总体来说是有规律的,但第二周期的元素表现出一定的特殊性。
例如锂的EΘ(Li+/Li)反常地小。
表9-2碱土金属的性质s区元素的一个重要特点是各族元素通常只有一种稳定的氧化态。
碱金属的第一电离能较小,很容易失去一个电子,故氧化数为+1。
碱土金属的第一、第二电离能较小,容易失去2个电子,因此氧化数为+2。
在物理性质方面,s区元素单质的主要特点是:轻、软、低熔点。


s中s元素的化合价化合价是指元素在化合物中与其他元素结合时所具有的电荷数目。
它是描述元素化学性质的重要参数之一,对于理解元素间的化学反应和化合物的性质至关重要。
本文将详细介绍s区中各个元素的化合价及其相关特点。
1. 氢(H)氢是最简单的元素,其原子核只含有一个质子,没有中子。
在大多数情况下,氢原子只能形成+1价离子(H+)。
但在某些特殊情况下,氢可以捕获一个电子形成-1价离子(H-)。
2. 铷(Rb)、铯(Cs)、钾(K)、钠(Na)、锂(Li)这些元素都属于碱金属,它们具有非常活泼的性质。
在化合物中,它们通常以+1价离子形式存在。
3. 镁(Mg)镁是一种碱土金属,在大多数情况下以+2价离子形式存在。
4. 钙(Ca)、锶(Sr)、钡(Ba)这些元素也属于碱土金属,它们通常以+2价离子形式存在。
5. 铝(Al)铝是一种典型的金属元素,它通常以+3价离子形式存在。
6. 碳(C)碳是一种非金属元素,它在化合物中可以形成多种化合价,最常见的是+4价和-4价。
+4价的碳形成了许多常见的有机物,如甲烷(CH4)、乙烷(C2H6)等。
-4价的碳则形成了一些特殊的化合物,如二氧化碳(CO2)。
7. 硼(B)硼是一种金属loid元素,在大多数情况下以+3价离子形式存在。
8. 氮(N)氮是一种非金属元素,它在化合物中通常以-3价离子形式存在。
例如,在氨气(NH3)中,氮原子带有三个额外的电子。
9. 氧(O)氧是一种非金属元素,它在化合物中通常以-2价离子形式存在。
例如,在水分子(H2O)中,氧原子带有两个额外的电子。
10. 硫(S)硫也是一种非金属元素,在大多数情况下以-2或+6价离子形式存在。
例如,在硫化物(如硫化氢,H2S)中,硫以-2价存在;而在二氧化硫(SO2)中,硫以+6价存在。
11. 氟(F)氟是一种非金属元素,它在化合物中通常以-1价离子形式存在。
例如,在氟化钠(NaF)中,氟原子带有一个额外的电子。

s区元素在医药中的应用
s区元素在医药中有广泛的应用,主要体现在以下方面:
1.作为药物的有效成分:例如,硫元素在天然产物和药物分子中广泛存在。
二价硫原子可以与氮、氧或π体系等电子供体形成类似氢键的作用,对于调节分子的构象和活性有良好效果。
因此,硫原子常用于调节分子中杂环化学排布。
2.用于药物的合成与制备:由于硫元素的极性调节和离子态的调节,含有二硫亚砜或磺胺类化合物的药物更易于合成。
同时,将硫引入杂环或替换芳香环C,可以提高化合物的选择性和配体靶标的适应性。
请注意,虽然s区元素在医药中有重要应用,但也需要考虑其潜在的风险和副作用。
在使用这些药物时,应严格遵守医嘱和用药指南,以确保安全和有效。