高一化学黄剑芳01氧化还原基本概念
- 格式:doc
- 大小:80.00 KB
- 文档页数:5
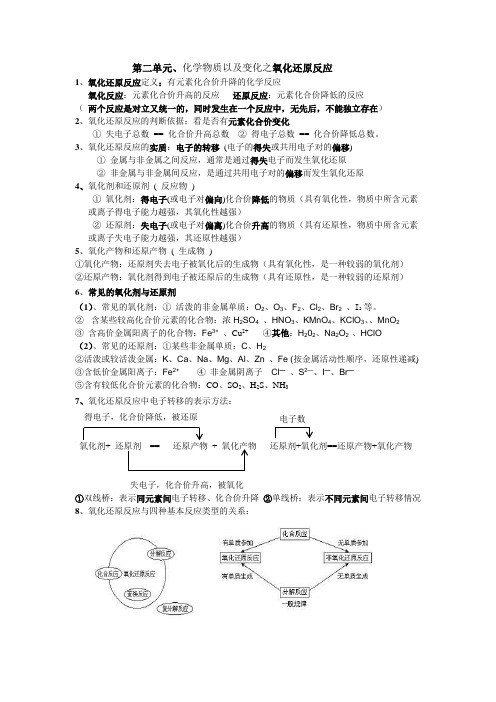
第二单元、化学物质以及变化之氧化还原反应1、氧化还原反应定义:有元素化合价升降的化学反应氧化反应:元素化合价升高的反应还原反应:元素化合价降低的反应(两个反应是对立又统一的,同时发生在一个反应中,无先后,不能独立存在)2、氧化还原反应的判断依据:看是否有元素化合价变化①失电子总数== 化合价升高总数②得电子总数== 化合价降低总数。
3、氧化还原反应的实质:电子的转移(电子的得失或共用电子对的偏移)①金属与非金属之间反应,通常是通过得失电子而发生氧化还原②非金属与非金属间反应,是通过共用电子对的偏移而发生氧化还原4、氧化剂和还原剂( 反应物)①氧化剂:得电子(或电子对偏向)化合价降低的物质(具有氧化性,物质中所含元素或离子得电子能力越强,其氧化性越强)②还原剂:失电子(或电子对偏离)化合价升高的物质(具有还原性,物质中所含元素或离子失电子能力越强,其还原性越强)5、氧化产物和还原产物( 生成物)①氧化产物:还原剂失去电子被氧化后的生成物(具有氧化性,是一种较弱的氧化剂)②还原产物:氧化剂得到电子被还原后的生成物(具有还原性,是一种较弱的还原剂)6、常见的氧化剂与还原剂(1)、常见的氧化剂:①活泼的非金属单质:O2、O3、F2、Cl2、Br2、I2 等。
②含某些较高化合价元素的化合物:浓H2SO4、HNO3、KMnO4、KClO3、、MnO2③含高价金属阳离子的化合物:Fe3+、Cu2+ ④其他:H202、Na2O2 、HClO(2)、常见的还原剂:①某些非金属单质:C、H2②活泼或较活泼金属:K、Ca、Na、Mg、Al、Zn 、Fe (按金属活动性顺序,还原性递减)③含低价金属阳离子:Fe2+④非金属阴离子Cl—、S2—、I—、Br—⑤含有较低化合价元素的化合物:CO、SO2、H2S、NH37、氧化还原反应中电子转移的表示方法:氧化剂+ 还原剂== 还原产物+ 氧化产物还原剂+氧化剂==还原产物+氧化产物①双线桥:表示同元素间电子转移、化合价升降②单线桥:表示不同元素间电子转移情况8、氧化还原反应与四种基本反应类型的关系:得电子,化合价降低,被还原失电子,化合价升高,被氧化电子数9、氧化还原反应的规律:(1)守恒律:氧化还原反应中,化合价有升必有降,化合价升高总数等于化合价降低总数;电子有得必有失,得电子总数等于失电子总数。

高考化学氧化还原知识点解析在高考化学中,氧化还原反应是一个极其重要的知识点,它贯穿于化学学习的多个方面,对于理解化学反应的本质和规律具有关键意义。
接下来,咱们就一起来深入解析一下这部分内容。
一、氧化还原反应的基本概念氧化还原反应的特征是元素化合价的升降。
化合价升高的物质被氧化,发生氧化反应;化合价降低的物质被还原,发生还原反应。
而氧化还原反应的本质是电子的转移,包括电子的得失和电子对的偏移。
氧化剂是在反应中得到电子(或电子对偏向)的物质,具有氧化性,在反应中使其他物质被氧化,自身被还原,对应的产物是还原产物。
还原剂则是在反应中失去电子(或电子对偏离)的物质,具有还原性,在反应中使其他物质被还原,自身被氧化,对应的产物是氧化产物。
例如,在反应 2H₂+ O₂= 2H₂O 中,氢气(H₂)中的氢元素化合价从 0 价升高到+1 价,氢气被氧化,是还原剂,发生氧化反应,生成的水(H₂O)是氧化产物;氧气(O₂)中的氧元素化合价从 0 价降低到-2 价,氧气被还原,是氧化剂,发生还原反应,生成的水(H₂O)是还原产物。
二、氧化还原反应的表示方法1、双线桥法用双线桥法表示氧化还原反应时,要分别从反应物中化合价发生变化的元素指向对应的生成物中的同一种元素,桥上标明“得到”或“失去”电子的总数以及化合价的升降情况。
以 2KClO₃= 2KCl + 3O₂↑为例,从氯酸钾(KClO₃)中氯元素指向氯化钾(KCl)中的氯元素,桥上标明“得到6e⁻,化合价降低6”;从氯酸钾(KClO₃)中氧元素指向氧气(O₂)中的氧元素,桥上标明“失去 12e⁻,化合价升高12”。
2、单线桥法单线桥法是从还原剂中化合价升高的元素指向氧化剂中化合价降低的元素,桥上标明转移电子的总数。
比如在反应 Fe + 2HCl = FeCl₂+ H₂↑中,从铁(Fe)指向盐酸(HCl)中的氢元素,桥上标明“2e⁻”。
三、常见的氧化剂和还原剂1、常见的氧化剂(1)活泼的非金属单质,如氧气(O₂)、氯气(Cl₂)等。

氧化还原反应的基本概念与分析方法氧化还原反应,又称为Redox反应,是化学反应中最基本的类型之一。
它涉及到电子的转移和原子的氧化态改变。
在氧化还原反应中,一个物质失去电子,被氧化,而另一个物质获得电子,被还原。
氧化还原反应在生物体内发挥着重要的作用,我们可以通过学习其基本概念和分析方法来更好地理解这个过程。
首先,我们来了解一下氧化还原反应的基本概念。
氧化是指物质失去电子的过程,同时伴随着其氧化态的增加。
还原则是指物质获得电子的过程,同时伴随着其氧化态的减少。
在氧化还原反应中,氧化和还原总是同时发生的,而且电子的转移是必不可少的。
氧化和还原在反应中以氧化数的变化来表示,氧化数是指原子的氧化态。
氧化还原反应可以通过氧化还原方程式来描述。
在方程式中,氧化物质写在左边,还原物质写在右边,中间用箭头分隔。
方程式中的配平要求原子和电荷都平衡。
例如,将铁与硫化物结合生成铁硫化物的方程式可以表示为:Fe + S → Fe S在这个方程式中,铁被氧化成了Fe2+,而硫化物(S2-)被还原成了S。
氧化数的变化使我们能够观察到氧化还原反应的过程。
为了实验室中准确分析氧化还原反应,我们可以利用一些分析方法。
其中最常用的是电化学方法,例如伏安法和电位滴定法。
伏安法是通过测量物质溶液中的电流和电势之间的关系来分析氧化还原反应。
这种方法可以用来确定氧化还原物质的浓度、反应速率以及进行电极反应研究。
电位滴定法则是通过在不断改变电势的条件下,滴定氧化还原反应中不同物质的溶液,从而推断出它们的浓度。
这种方法比较灵活,可以应用于各种不同的氧化还原反应。
除了电化学方法,我们还可以使用其他的分析方法来研究氧化还原反应。
比如,我们可以利用光谱学技术,如紫外-可见吸收光谱和荧光光谱,来测定氧化还原物质的浓度和反应机制。
光谱学技术通过物质在吸收或发射特定波长的光时吸收或发射特定的能量来进行分析。
这些技术的应用广泛,可以用于检测和定量不同物质中的氧化还原反应。

化学教案:了解氧化还原反应的基本概念一、氧化还原反应的基本概念氧化还原反应是化学中最基本、最重要的反应类型之一。
在这种反应中,物质(原子、离子或分子)的电荷状态发生变化,其中一个物质被氧化而失去电子,另一个物质被还原而获得电子。
本文将深入探讨氧化还原反应的基本概念,包括定义、常见表示方法和相关术语。
二、定义及常见表示方法1. 定义:氧化还原反应是指在一种化学反应中,一个物质丧失电子并增加价态时称为“氧化”,而另一个物质获取相同数量的电子并降低价态时称为“还原”。
简言之,氧化即是丧失电子,还原即是获得电子。
2. 表示方法:(1)使用元素符号和变价数表示:例如,2Na + Cl2 → 2NaCl 中的钠被氯气从0价态变为+1价态,因此钠发生了氧化;而氯气从0价态变为-1价态,则发生了还原。
(2)使用离子表达式:例如,在方程式CuO + H2 → Cu + H2O中,铜即是从+2价态转变到0价态,发生了还原;氧则是从-2价态转变到0价态,发生了氧化。
三、相关术语1. 氧化剂:在氧化还原反应中,能够接受电子并使其他物质氧化的物质称为氧化剂。
典型的氧化剂包括卤素、酸性溶液中的过氧化物以及活泼金属等。
2. 还原剂:在氧化还原反应中,能够提供电子并将其他物质还原的物质称为还原剂。
典型的还原剂包括金属、非金属元素和含有阴离子H-的碱金属水合物等。
3. 氧化数(价数):也被称为“形式电荷”,指一个元素在某个化合物或离子中所带的电荷数值。
通过确定元素价数,在反应方程式中可以判断其是否发生氧化或还原。
四、案例分析1. 锌与盐酸反应生成氢气:Zn + 2HCl → ZnCl2 + H2在这个反应中,锌(Zn)由于失去了两个电子而从0价态被氯(Cl)转变成+2价态,因此锌发生了氧化。
而氯反过来由-1价态转变为0价态,因此氯发生了还原。
氧化剂:HCl还原剂:Zn2. 二氧化碳与水反应生成葡萄糖:6CO2 + 6H2O → C6H12O6 + 6O2在这个反应中,二氧化碳(CO2)中的碳由+4价态转变为0价态,因此碳发生了还原。

2.3 氧化剂和还原剂一、氧化还原反应基本概念:1、从化合价变化的角度认识氧化还原反应氧化反应:物质所含元素化合价升高的反应。
还原反应:物质所含元素的化合价降低的反应。
氧化还原反应:物质所含元素的化合价有变化的反应。
2、从电子转移的角度认识氧化还原反应氧化反应:物质失去(或偏离)电子的反应。
还原反应:物质得到(或偏向)电子的反应。
氧化还原反应:有电子转移(得失或偏移)的反应。
3、氧化还原反应的特征和实质氧化还原反应的特征:元素的化合价的升降。
这也是判断一个反应是不是氧化还原反应的依据。
氧化还原反应的实质:电子转移(电子得失或共用电子对偏移)。
氧化还原反应中的守恒规律:得失电子总数相等,化合价的升降的总数相等,且化合价升降的总数等于电子转移总数。
4、氧化还原反应与四大基本反应类型的关系:分解反应不一定是氧化还原反应化合反应不一定是氧化还原反应置换反应一定是氧化还原反应复分解反应一定不是氧化还原反应二、氧化剂和还原剂1、基本概念(1)两种反应氧化反应:物质所含元素化合价升高的反应还原反应:物质所含元素化合价降低的反应(2)两种反应物氧化剂:在反应中得到电子(或电子对偏向)的物质还原剂:在反应中失去电子(或电子对偏离)的物质(3)两种生成物氧化产物:氧化反应得到的产物还原产物:还原反应得到的产物(4)两种性质氧化性:氧化剂所表现出的得到电子(或电子对偏向)的性质还原性:还原剂所表现出的失去电子(或电子对偏离)的性质2、常见的氧化剂和还原剂(1) 氧化剂:部分非金属单质,如:氧气、氯气含有高价态元素的化合物,如:高锰酸钾、硝酸、氯化铁(2) 还原剂:活泼的金属单质,如:铁、锌某些非金属单质,如:碳、氢气后写非金属氧化物,如:一氧化碳、二氧化硫3、氧化还原反应电子转移的表示方法(1) 双线桥法:(2) 单线桥法:4、判断物质的氧化性、还原性强弱的方法:5、氧化还原反应的基本规律(1) 守恒规律:得失电子总数相等(2) 强弱规律:氧化剂的氧化性>氧化产物的氧化性还原性的还原性>还原产物的还原性(3) 次序规律:一种氧化剂与多种还原剂相遇时,优先于还原性较强的还原剂反应(4) 归中规律:归中反应中,氧化剂降低到的化合价不得低于还原剂升高到的化合价,可以简单用“只靠拢不交叉”的规则来加强记忆主要事项:A、归中反应是指发生氧化还原反应的元素,反应后都变成了中间价态,B、歧化反应是指中间态的元素,反应后变成了不同的两边价态三、铁及其化合物1、铁单质:(1)物理性质:银白色金属,密度大,熔沸点高,具有磁性(2)化学性质:A、还原性:与弱氧化剂反应(比如硫单质、碘单质等),生成亚铁盐,与强氧化剂反应(比如氯气),生成铁盐,有一个特列,也氧气反应,生成四氧化三铁△B、与水反应:3Fe +4H2O Fe3O4 +4H2C、与酸反应:与非氧化性酸反应生成亚铁盐和氢气,Fe+2H+===Fe2++H2↑与氧化性酸反应得不到氢气铁,铝在冷的浓硝酸、浓硫酸中发生钝化D 、与盐反应:发生置换反应 2、铁的氧化物(1) 氧化亚铁:FeO 是一种黑色粉末,不稳定,在空气里受热,就迅速被氧化成Fe 3O 4(2) 四氧化三铁:Fe 3O 4是一种复杂的化合物,是具有磁性的黑色晶体,俗称磁性氧化铁(3) 氧化铁:Fe 2O 3是一种红棕色的粉末,俗称铁红,常用作涂料、油漆。

高一下化学知识点氧化还原氧化还原是化学中非常重要的一个概念,也是我们学习化学的基础知识之一。
本文将着重介绍高一下学期化学课程中涉及的一些常见的氧化还原知识点。
一、氧化还原的基本概念氧化还原反应是指在化学反应中原子、离子或分子失去或获得电子的过程。
其中,失去电子的物质称为氧化剂,获得电子的物质称为还原剂。
氧化还原反应可以通过电子的转移来实现,也可以通过氧原子或氢原子的转移来实现。
二、氧化还原反应的判断标准在氧化还原反应中,我们需要判断物质的氧化态和还原态的变化。
一般来说,氧化态增加的物质为被氧化物质(还原剂),氧化态减少的物质为氧化物质(氧化剂)。
同时,我们还可以利用氧化还原反应中电子的转移来判断。
三、氧化还原反应的实例应用氧化还原反应在日常生活和工业生产中有着广泛的应用。
下面将介绍一些常见的实例:1. 金属的锈蚀铁在潮湿的空气中会发生氧化反应,形成铁的氧化物,即铁锈。
这是一种典型的氧化还原反应,铁被氧化成了铁离子,氧气还原成了水。
2. 电池反应电池就是利用氧化还原反应来产生电能的装置。
例如,碱性电池中,铅通过氧化反应生成铅的四价阳离子,而氧化剂为氢氧根阴离子。
3. 酸碱中和反应酸与碱的中和反应也是一种氧化还原反应。
酸中的氧化物质被还原,而碱中的还原物质被氧化。
这个过程同时伴随着氢离子和氢氧根离子的结合形成水。
四、常见的氧化还原反应在化学中,有一些经典的氧化还原反应非常重要,我们在学习中需要重点掌握。
1. 金属与非金属的反应金属通常会失去电子成为阳离子,而非金属通常会获得电子成为阴离子。
例如,钠(Na)与氯(Cl)的反应,钠失去电子成为钠离子(Na+)而氯获得电子成为氯离子(Cl-)。
2. 过渡金属的氧化还原反应过渡金属能够具有多个氧化态,因此它们在氧化还原反应中非常重要。
例如,铁离子(Fe2+)可以被氧气氧化成铁离子(Fe3+)。
3. 单质与氧气的反应单质通常是不稳定的,容易与氧气发生氧化反应。
高中化学必修一氧化还原反应知识点
高中化学必修一氧化还原反应知识点
高中化学必修一氧化还原反应知识点
1.氧化还原反应的概念
(1)本质:有电子转移(得失或偏移)
(2)特征:元素化合价发生升降(不一定有氧的得失)
(3)各概念之间的关系:
降得还:氧化剂---氧化性---得电子---(降价)---被还原---发生还原反应---生成还原产物
升失氧:还原剂---还原性---失电子---(升价)---被氧化---发生氧化反应---生成氧化产物
2.化合价顺口溜:
一价钾钠氯氢银;
二价氧钙钡镁锌;
三铝四硅五价磷;
谈变价,也不难;
二三铁,二四碳;
二四六硫都齐全;
铜汞二价最常见;
正负变价要分清。
3.氧化还原反应与四大基本反应类型的的关系:
化合反应和分解反应不一定是氧化还原反应,但有单质参加的化合反应或有单质生成的分解反应一定属氧化还原反。
氧化还原反应基本概念
高中化学学习简谈
一、化学反应的基本类型
(根据反应物和生成物的类别以及反应前后物质种类的多少)
【思考1】请分析Fe2O3+3CO2Fe+3CO2的反应类型。
二、氧化还原反应
1、特征。
【思考2】分析下列哪些反应是氧化还原反应,哪些不是氧化还原反应?
2KCl+3O2↑(1)CaO+H2O=Ca(OH)2(2)2KClO3
2
(3)BaCl2+H2SO4=BaSO4↓+2HCl (4)CaCO3CaO+CO2↑(5)MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
(6)3Fe+4H2O(g)Fe3O4+4H2↑
(7)Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O
(8)3CCl4+2K2Cr2O7=2CrO2Cl2+3COCl2+2KCl
2、氧化还原反应与四种基本反应类型的关系
3、氧化还原反应的实质 。
4、氧化还原反应的定性分析(5对概念)
①氧化剂与还原剂; ②氧化产物与还原产物; ③被氧化与被还原;
④氧化反应与还原反应; ⑤氧化性与还原性
例1.从氧化还原反应定性角度分析反应Fe 2O 3+3CO
2Fe +3CO 2
5、氧化还原反应的定量分析(电子转移的方向与数目)
【氧化还原反应电子转移方向与数目的表示方法】
(1)电子得失法即双线桥法:箭头由反应物指向生成物,即氧化剂指向还原产物,还原剂指向氧化产物(对准同一种元素),在线上标出得失电子的数目-⨯ne m 。
一般失电子的一方写在上面,得电子的一方写在下面。
(2)电子转移法即单线桥法:箭头由还原剂中失电子的元素指向氧化剂中得电子的元素,在线上标出电子转移总数,但不写得、失。
例2.标出下列反应的电子转移方向与数目。
(1)H2+Cl2点燃2HCl (2)4Al+3O22Al2O3
【练习】标出下列反应的电子转移方向与数目。
2KCl+3O2↑(2)2H2S+3O2点燃2SO2+2H2O (1)2KClO3
MnO
2
问:反应(2)中氧化产物是,还原产物是,氧化产物与还原产物的质量比为(H1,O16,S32)。
(3)KClO3+6KOH+3MnO2=3K2MnO4+KCl+3H2O
(4)MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O(H1,Cl35.5,O16,Mn55)
问:发生还原反应的物质是;被氧化与被还原物质的质量比为。
(5)Cl2+2NaOH=NaCl+NaClO+H2O。