高一化学必修一氧化还原反应知识点
- 格式:doc
- 大小:160.03 KB
- 文档页数:5
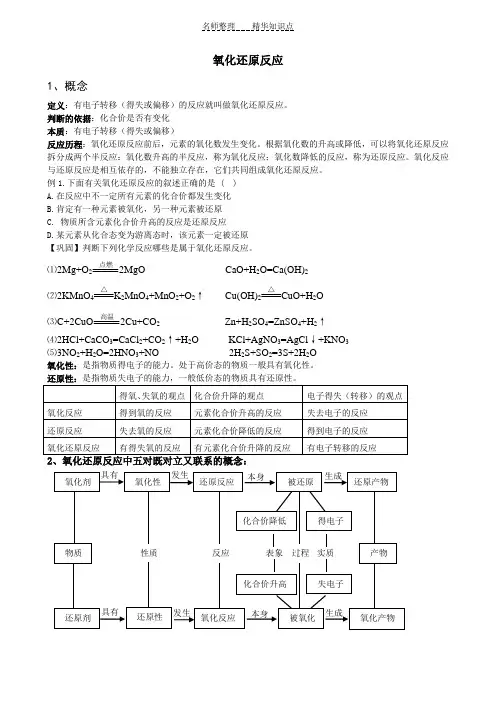
氧化还原反应1、概念定义:有电子转移(得失或偏移)的反应就叫做氧化还原反应。
判断的依据:化合价是否有变化本质:有电子转移(得失或偏移)反应历程:氧化还原反应前后,元素的氧化数发生变化。
根据氧化数的升高或降低,可以将氧化还原反应拆分成两个半反应:氧化数升高的半反应,称为氧化反应;氧化数降低的反应,称为还原反应。
氧化反应与还原反应是相互依存的,不能独立存在,它们共同组成氧化还原反应。
例1.下面有关氧化还原反应的叙述正确的是 ( )A.在反应中不一定所有元素的化合价都发生变化B.肯定有一种元素被氧化,另一种元素被还原C. 物质所含元素化合价升高的反应是还原反应D.某元素从化合态变为游离态时,该元素一定被还原【巩固】判断下列化学反应哪些是属于氧化还原反应。
⑴2Mg+O2点燃2MgO CaO+H2O=Ca(OH)2⑵2KMnO4△K2MnO4+MnO2+O2↑Cu(OH)2△CuO+H2O⑶C+2CuO高温2Cu+CO2Zn+H2SO4=ZnSO4+H2↑⑷2HCl+CaCO3=CaCl2+CO2↑+H2O KCl+AgNO3=AgCl↓+KNO3⑸3NO2+H2O=2HNO3+NO2H2S+SO2=3S+2H2O氧化性:是指物质得电子的能力。
处于高价态的物质一般具有氧化性。
还原性:是指物质失电子的能力,一般低价态的物质具有还原性。
【练习】1、指出下列氧化还原反应中的氧化剂、还原剂、氧化产物、还原产物。
⑴4P+5O2点燃2P2O5⑵2KClO3催化剂△2KCl+3O2⑶2KMnO4△K2MnO4+MnO2+O2↑⑷S+2KNO3+3C△K2S+3CO2↑+N2↑⑸2H2S+SO2=3S+2H2O ⑹3NO2+H2O=2HNO3+NO⑺4FeS2+11O2高温2Fe2O3+8SO2⑻Zn+2HCl=ZnCl2+H2↑MnO2+4HCl(浓)△MnCl2+Cl2↑+2H2O⑼3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O2.已知下列反应:①2Na+2H2O=2NaOH+H2↑②2F2+2H2O=4HF+O2 ③Cl2+H2O=HCl+HclO④2NaCl+2H2O 电解2NaOH+H2↑+Cl2↑⑤CaO+H2O=Ca(OH)2 ⑥CaCO3+H2O=Ca(HCO3)2(1)其中水在反应中作氧化剂的反应是(填代号下同) .(2)其中水在反应中作还原剂的反应是 .(3)其中水在反应中既不作氧化剂也不作还原剂的反应是.3.在K2Cr2O7+14HCl=2KCl+2CrCl3+3Cl2↑+7H2O反应中,是氧化剂;是还原剂;元素被氧化;元素被还原;是氧化产物;是还原产物;电子转移的总数是 .3、氧化还原反应实质的表示方法(1)双线桥法a、两条线桥从反应物指向生成物,且对准同种元素b、要标明"得"、"失"电子,且数目要相等。


第三节氧化还原反应杭信一中何逸冬一、氧化还原反应1、氧化反应:元素化合价升高的反应还原反应:元素化合价降低的反应氧化还原反应:凡是有元素化合价升降的反应2、氧化还原反应的实质——电子的转移(电子的得失或共用电子对的偏离)口诀:失电子,化合价升高,被氧化(氧化反应),还原剂得电子,化合价降低,被还原(还原反应),氧化剂3、氧化还原反应的判断依据——有元素化合价变化失电子总数=化合价升高总数=得电子总数=化合价降低总数4、氧化还原反应中电子转移的表示方法○1双线桥法——表示电子得失结果○2单线桥法——表示电子转移情况5、氧化还原反应与四种基本反应类型的关系【习题一】(2018•绍兴模拟)下列属于非氧化还原反应的是()A.2FeCl2+Cl2═2FeCl3B.ICl+H2O═HCl+HIOC.SiO2+2C高温Si+2CO↑D.2Na+O2点燃Na2O2【考点】氧化还原反应.氧化还原反应的先后规律【专题】氧化还原反应专题.【分析】氧化还原反应的特征是元素化合价的升降,从元素化合价是否发生变化的角度判断反应是否属于氧化还原反应,以此解答。
【解答】解:A.Fe和Cl元素的化合价发生变化,属于氧化还原反应,故A不选;B.元素化合价没有发生变化,属于复分解反应,故B选;C.C和Si元素的化合价发生变化,属于氧化还原反应,故C不选;D.Na和O元素化合价发生变化,属于氧化还原反应,故D不选。
故选:B。
【习题二】(2015春•高安市校级期中)下列说法正确的是()A.1mol Cl2与足量Fe反应,转移电子的物质的量为3molB.工业可采用火法炼铜:Cu2S+O2═2Cu+SO2,每生成2mol铜,反应共转移6mol电子C.称取25g CuSO4•5H2O固体溶于75g水中,所得溶液中溶质的质量分数为25%D.NO和NO2的混合气体共1mol,其中氮原子数为2mol【考点】氧化还原反应的电子转移数目计算;物质的量的相关计算.电子守恒法的计算【分析】A.根据转移电子=化合价变化×物质的量计算;B.根据转移电子=化合价变化×物质的量计算;C.根据溶液溶质的质量分数=×100%计算;D.根据一个分子中含1个氮原子判断.【解答】解:A.1mol Cl2与足量Fe反应,Cl元素由0价降低为-1价,所以1mol Cl2与足量Fe反应,转移电子的物质的量为2mol,故A错误;B.由方程式可知,每生成1molSO2,有1mol硫被氧化生成SO2,转移电子为1mol ×[4-(-2)]=6mol,故B正确;C.称取25gCuSO4•5H2O固体溶于75g水中,则含硫酸铜为25×=16g,则所得溶液中溶质的质量分数为16%,故C错误;D.因为论NO还是二氧氮还是NO和NO2的混合气体都是一个分子中含1个氮原子,所以NO和NO2的混合气体共1mol,其中氮原子数为1mol,故D错误。

2.3氧化还原反应➢ 氧化还原反应基本概念1.特征:有元素化合价的升降。
(判断依据)2.本质:电子的转移。
3.规律:升失氧化还原剂,降得还原氧化剂。
✧ 还原剂,具有还原性,化合价升高,失去电子,被氧化,发生氧化反应,得到氧化产物。
✧ 氧化剂,具有氧化性,化合价降低,得到电子,被还原,发生还原反应,得到还原产物。
4.转移电子的表示方法:(1)双线桥 变价元素由反应物指向生成物,上方标明 得/失 变价元素原子数╳每个原子化合价改变量 如:① H 2 + CuO === Cu + H 2O ② MnO 2 + 4HCl(浓)=== MnCl 2 + Cl 2↑+2H 2O则①中1mol H 2反应的转移电子数为 。
②中生成1molCl 2的转移电子数为 。
注:转移电子数与反应中各物质系数成正比。
(2)单线桥 反应物中失电子元素指向得电子元素,上方直接标明转移电子数目,不需要写得/失。
H 2 + CuO === Cu + H 2O5.氧化还原反应与四种基本反应类型的关系 :6. 常见的氧化剂和还原剂✧ 常见氧化剂:Cl 2、Br 2、O 2、O 3、浓H 2SO 4、HNO 3、KMnO 4、KClO 3、K 2Cr 2O 7、Fe 3+、HClO 、ClO -、MnO 2、H 2O 2、Na 2O 2等等等✧ 常见还原剂: 金属、S 2-、HS 、H 2S 、S 、SO 2、 SO 32-、 HSO 3-、 I - 、Fe 2+ 、Br - 、Cl -等等等➢ 题型1 概念理解判断( )1.有失去电子的反应为还原反应( )2.含有氧元素的物质是氧化剂( )3.氧化剂得到电子的数目和还原剂失去电子的数目一定相等( )4.有一种元素被氧化必定有另一种元素被还原( )5.有单质参与的反应一定是氧化还原反应( )6.置换反应不一定属于氧化还原反应( )7.在反应中不一定所以元素的化合价都发生变化( )8.在化学反应中,得电子越多的氧化剂,其氧化性越强➢ 题型2 转移电子数计算 1.下列表示反应中电子转移的方向和数目正确的是( )A .B .C .D .2.实验室常用KMnO 4和浓盐酸反应制备Cl 2化学方程式如下,2KMnO 4+16HCl (浓)=2KCl+2MnCl 2+5Cl 2↑氧化剂+还原剂→还原产物+氧化产物 硫碘铁溴+8H2O下列说法不正确的是()A.Cl2是氧化产物B.有0.8mol的HCl被氧化时,标况下生成Cl2 5.6LC.KMnO4是氧化剂D.每8mol HCl参加反应,转移电子的物质的量为5mol3.下列反应中水的作用是:(填序号)①2Na+2H2O==2NaOH+H2↑②2H2O==2H2↑+O2↑③Cl2+H2O==HCl+HClO④3NO2+H2O==2HNO3+NO ⑤2F2+2H2O==4HF+O2(1)水作只还原剂;(2)水只作氧化剂;(3)水既作氧化剂也作还原剂;(4)水既不是氧化剂也不是还原剂。


高一化学必修一氧化还原反应知
识点
氧化还原反应
1、概念
定义:带有电子转移(获得或损失或移动)的反应称为氧化还原反应。
判断的依据:化合价是否有变化
本质:有电子转移(得失或偏移)
反应历程:氧化还原反应前后,元素的氧化数发生变化。
根据氧化数的增减,氧化还原反应可分为两个半反应:氧化数增加的半反应称为氧化反应;氧化数减少的反应称为还原反应。
氧化反应和还原反应是相互依存的,不能独立存在,它们共同构成了氧化还原反应。
例1.下面有关氧化还原反应的叙述正确的是 ( )
A.在反应中不一定所有元素的化合价都发生变化
B.肯定有一种元素被氧化,另一种元素被还原
C. 物质所含元素化合价升高的反应是还原反应
D.某元素从化合态变为游离态时,该元素一定被还原
【巩固】确定下列哪些化学反应是氧化还原反应。
⑴2Mg+O2点燃2MgO CaO+H2O=Ca(OH)2
⑵2KMnO4△
K2MnO4+MnO2+O2↑Cu(OH)2△CuO+H2O
⑶C+2CuO高温2Cu+CO2Zn+H2SO4=ZnSO4+H2↑
⑷2HCl+CaCO3=CaCl2+CO2↑+H2O KCl+AgNO3=AgCl↓+KNO3
⑸3NO2+H2O=2HNO3+NO2H2S+SO2=3S+2H2O
氧化:指物质获得电子的能力。
高价态的物质通常具有氧化性。
还原性:指物质失去电子的能力。
一般低价物质都具有还原性。


高一化学必修一氧化还原反应知识点氧化还原反应是化学反应中最重要的一种反应,其中一种物质称为氧化剂(或氧化物),它能将其他物质氧化,从而放出大量的能量;另一种物质称为还原剂,它能将其他物质还原,从而释放出大量的能量。
氧化还原反应指的是氧化剂和还原剂之间相互作用,其结果是氧化剂氧化后的物质还原,还原剂还原后的物质被氧化的过程。
二、氧化还原反应的重要性氧化还原反应的重要性不言而喻。
每个生物都依赖氧化还原反应来提供能量和其他物质,例如有机化合物,水,酸和碱等,以维持其生长和繁殖。
此外,氧化还原反应还在燃烧时发挥着重要作用,例如燃烧煤、柴油和其他燃料可产生的热量。
氧化还原反应对于合成化学物质也非常重要,因为它可以用来将其他化学物质编织起来,从而产生新物质。
三、氧化还原反应的分类1、按氧化剂分类:氧化还原反应可分为单价氧化和双价氧化两类。
在单价氧化中,氧化剂仅以一个电荷参与反应,例如由于氢氧化钠水溶液中含有OH-离子(单价),所以这种水溶液可以氧化Fe2+(单价),产生Fe3+(单价),从而实现氧化反应。
而双价氧化是指氧化剂以两个电荷参与反应,例如氧气在水溶液中以O2-(双价)存在,当它和Fe2+(双价)反应时会产生Fe3+(双价),从而实现氧化反应。
2、按还原剂分类:氧化还原反应可分为金属还原和非金属还原两类。
金属还原的例子很多,如铜(Cu2+)可以与铁(Fe2+)发生反应,从而将铁氧化为氧化铁(Fe3+);而非金属还原的例子可以说是更多,例如H+可以将Fe3+还原为Fe2+,从而实现还原反应。
此外,有些还原剂也具有一定的氧化性,例如氢氧化钠水溶液中的OH-离子,既可以氧化Fe2+,也可以还原H+,从而实现双重作用。
四、氧化还原反应的实际应用1、用于生产热能:氧化还原反应在原料或燃料燃烧放出热能时发挥重要作用,例如燃烧煤时,煤中的碳氧化形成碳酸,氧化物吸收了碳,并放出大量的热量,从而产生热能。
2、用于生产电能:氧化还原反应也可以用来生产电能,这一过程主要是通过电化学方法实现的。
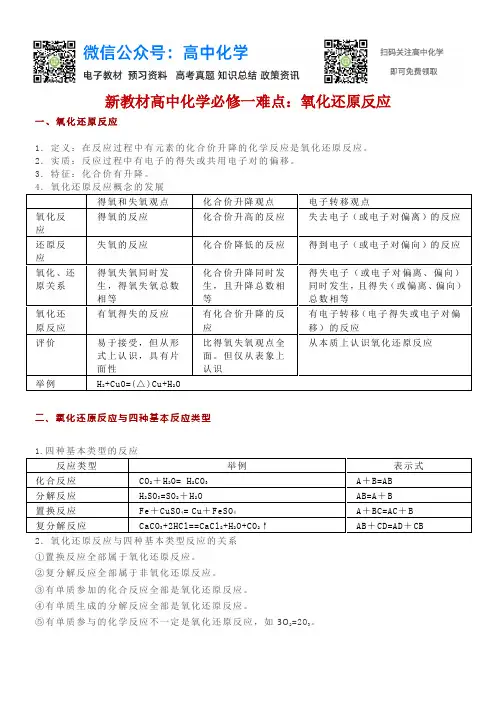
新教材高中化学必修一难点:氧化还原反应一、氧化还原反应1.定义:在反应过程中有元素的化合价升降的化学反应是氧化还原反应。
2.实质:反应过程中有电子的得失或共用电子对的偏移。
3.特征:化合价有升降。
4.氧化还原反应概念的发展二、氧化还原反应与四种基本反应类型1.四种基本类型的反应2.氧化还原反应与四种基本类型反应的关系①置换反应全部属于氧化还原反应。
②复分解反应全部属于非氧化还原反应。
③有单质参加的化合反应全部是氧化还原反应。
④有单质生成的分解反应全部是氧化还原反应。
⑤有单质参与的化学反应不一定是氧化还原反应,如3O2=2O3。
三、氧化还原反应的四对概念四、1.氧化剂与还原剂氧化剂:得到电子(或电子对偏向、化合价降低)的物质。
还原剂:失去电子(或电子对偏离、化合价升高)的物质。
氧化剂具有氧化性,还原剂具有还原性。
2.氧化反应与还原反应氧化反应:失去电子(化合价升高)的反应。
还原反应:得到电子(化合价降低)的反应。
3.氧化产物与还原产物氧化产物:还原剂在反应中失去电子后被氧化形成的生成物。
还原产物:氧化剂在反应中得到电子后被还原形成的生成物。
4.氧化性与还原性氧化剂具有的得电子的性质称为氧化性;还原剂具有的失电子的性质称为还原性。
总之记住六字口诀:升失氧,降得还!解释:四、氧化还原反应电子转移表示方法双线桥法:(1)两条桥线从反应物指向生成物,且对准同种元素;(2)要标明“得”“失”电子,且数目要相等;(3)箭头不代表电子转移的方向。
单线桥法:(1)一条桥线表示不同元素原子得失电子的情况;(2)不需标明“得”“失”电子,只标明电子转移的数目;(3)箭头表示电子转移的方向;(4)单线桥箭头从还原剂指向氧化剂。
五、常见的氧化剂、还原剂常见的氧化剂(处于高价态的元素的单质或化合物):(1)活泼的非金属单质(F2、O2、Cl2、Br2、I2、O3等)(2)元素处于高价时的含氧酸(硝酸、浓硫酸)(3)元素处于高价时的盐:(KClO3、KMnO4、FeCl3)(4)过氧化物(H2O2、Na2O2)(5)其它(HClO)常见的还原剂(处于低价态的元素的单质或化合物):(1)活泼的金属单质:K、Na、Mg等;(2)非金属单质:H2、C、Si等;(3)低价态的化合物:CO、H2S、HI、Fe2+、NH3等。

一、氧化还原相关概念1.定义:凡是反应过程中有元素化合价变化(或电子转移)的反应叫氧化还原反应。
2.特征 : 元素化合价的升降;3.实质 : 电子转移。
4.规律:二.氧化还原反应与四种基本反应类型三.氧化还原中的电子转移表示法(应用于实际)(1) 双线桥法:表示同一元素的原子或离子间的电子转移情况(必须表明得失电子,其他可不标)(2)单线桥法:在反应物中箭头由还原剂指向氧化剂2==2Na2O常见的氧化剂(1)非金属性较强的单质 : O2、Cl2(2)变价元素的高价态化合物:KMnO4、FeCl3、浓硝酸、浓硫酸(3)其他 : HCIO、MnO2、Na2O2、H2O2、漂白粉Ca (CIO)2常见的还原剂(1)金属性较强的单质: Al、Fe、Zn(2)某些非金属单质: H2、S、C(3)变价元素的低价态化合物: CO(4)其他: 浓盐酸、NH3四、氧化性、还原性强弱的判断1.根据氧化还原反应的方向判断氧化剂(氧化性)+还原剂(还原性)=还原产物+氧化产物氧化性:氧化剂>氧化产物还原性:还原剂>还原产物五、氧化还原反应的有关规律1.守恒规律 : 化合价升降总数相等,得失电子总数相等。
2.强弱规律 : 强氧化剂+强还原剂=弱还原产物+弱氧化产物。
3.价态规律:元素处于最高价态,只有氧化性;处于最低价态,只有还原性;若处于中间价态,既有氧化性又有还原性,但在一个反应中,主要表现一种性质。
五、附基本知识点1、化合价口诀钾钠银氢正一价 , 钙镁钡锌正二价;铝有正三氧负二,氯负一价最常见2、原子团NH4+铵根SO42-硫酸根 NO3- 硝酸根OH-氢氧根CO32-碳酸根PO43-磷酸根3、“口诀”熟记难溶(不溶)物质。
钾、钠、铵盐水中溶。
硝酸盐见水无影踪。
盐酸盐不溶银、亚汞(熟记AgCl不拆)。
硫酸盐不溶钡和铅(熟记BaSO4不拆)。
习题。

化学必修一氧化还原反应与离子反应知识点总结及练习题氧化还原反应与离子反应知识点总结一、氧化还原反应的有关概念氧化还原反应是指物质中有一种物质被氧化,必定有一种物质被还原的化学反应。
氧化反应是指物质失去电子,还原反应是指物质得到电子。
电子转移(得失或偏移)的反应都是氧化还原反应。
在氧化还原反应中,物质中的原子得电子,则元素的化合价降低被还原,发生还原反应,变成还原产物,则该物质是氧化剂,具有氧化性。
物质中的原子失电子,则元素的化合价升高被氧化,发生氧化反应,变成还原产物,则该物质是还原剂,具有还原性。
二、电子转移的表示方法单线桥法表示氧化剂与还原剂之间电子转移的方向和总数,双线桥法表示氧化剂及其还原产物、还原剂及其氧化产物之间得失电子情况。
三、常见氧化剂与还原剂及其强弱常见氧化剂包括非金属性较强的单质如F2、Cl2、Br2、I2、O2、O3等,变价元素中高价态化合物如KClO3、KMnO4、K2Cr2O7、浓H2SO4、浓HNO3、稀HNO3、固体硝酸盐等,高价态金属阳离子如Fe、Ag、Cu等,能电离出H+的物质如稀H2SO4、稀HCl、NaHSO4溶液等,以及其他物质如HClO、漂白粉、MnO2、Na2O2、NO2、H2O2、银氨溶液、新制Cu(OH)2等。
常见还原剂包括金属性较强的单质如K、Na、Mg、Al、Fe、Zn等,某些非金属单质如H2、C、Si等,变价金属中某些低价态化合物如CO、H2S及硫化物、Fe2+盐、Fe(OH)2、HBr、HI及其盐、SO2及亚硫酸盐等。
常用的氧化性、还原性判断方法有两种题型考法。
第一种是根据金属活泼性判断,金属性越强,单质还原性越强,离子氧化性越弱。
非金属性越强,单质氧化性越强,离子还原性越弱。
第二种是通过化学反应判断,氧化剂加还原剂得氧化产物加还原产物。
左边的氧化剂和氧化产物比右边的还原剂和还原产物氧化性或还原性强。
还可以通过元素周期表、相近的反应和反应条件的难易比较进行判断。
高一化学必修一氧化还原反应氧化还原反应是高一化学必修一中非常重要的内容。
氧化还原反应的本质是电子的转移,这包括电子的得失和电子对的偏移。
从化合价的角度来看,反应前后有元素化合价发生变化的反应就是氧化还原反应。
其中,化合价升高的元素发生氧化反应,该元素所在的物质被氧化,作还原剂;化合价降低的元素发生还原反应,该元素所在的物质被还原,作氧化剂。
例如,在反应2Na + Cl₂= 2NaCl中,钠元素的化合价从0价升高到+ 1价,钠原子失去电子,发生氧化反应,钠是还原剂;氯元素的化合价从0价降低到- 1价,氯原子得到电子,发生还原反应,氯气是氧化剂。
在氧化还原反应中,有一些规律值得我们注意。
比如,氧化还原反应中得失电子总数相等,这是进行氧化还原反应相关计算的重要依据。
而且,在一个自发的氧化还原反应中,氧化剂的氧化性强于氧化产物的氧化性,还原剂的还原性强于还原产物的还原性。
在化学学习中,我们还需要掌握氧化还原反应方程式的配平。
配平氧化还原反应方程式时,我们可以根据化合价升降法。
先找出化合价发生变化的元素,确定其化合价的升降数值,然后求出化合价升降的最小公倍数,进而确定氧化剂、还原剂、氧化产物、还原产物的化学计量数,最后再根据原子守恒配平其他物质的化学计量数。
氧化还原反应在生活和生产中有着广泛的应用。
例如,金属的冶炼就是利用还原剂将金属从其化合物中还原出来;电池的工作原理也与氧化还原反应密切相关,原电池就是利用自发的氧化还原反应将化学能转化为电能的装置。
氧化还原反应是化学学习中的一个重点内容,我们要深入理解其本质和规律,熟练掌握相关的计算和方程式配平,这样才能更好地学习后续的化学知识。
希望同学们能够好好掌握这部分知识内容。
以上就是关于高一化学必修一氧化还原反应的一些基本内容,希望能对大家的学习有所帮助,加油!。
高中化学必修一氧化还原反应知识点
高中化学必修一氧化还原反应知识点
高中化学必修一氧化还原反应知识点
1.氧化还原反应的概念
(1)本质:有电子转移(得失或偏移)
(2)特征:元素化合价发生升降(不一定有氧的得失)
(3)各概念之间的关系:
降得还:氧化剂---氧化性---得电子---(降价)---被还原---发生还原反应---生成还原产物
升失氧:还原剂---还原性---失电子---(升价)---被氧化---发生氧化反应---生成氧化产物
2.化合价顺口溜:
一价钾钠氯氢银;
二价氧钙钡镁锌;
三铝四硅五价磷;
谈变价,也不难;
二三铁,二四碳;
二四六硫都齐全;
铜汞二价最常见;
正负变价要分清。
3.氧化还原反应与四大基本反应类型的的关系:
化合反应和分解反应不一定是氧化还原反应,但有单质参加的化合反应或有单质生成的分解反应一定属氧化还原反。
氧化還原反應1、概念定義:有電子轉移(得失或偏移)の反應就叫做氧化還原反應。
判斷の依據:化合價是否有變化本質:有電子轉移(得失或偏移)反應歷程:氧化還原反應前後,元素の氧化數發生變化。
根據氧化數の升高或降低,可以將氧化還原反應拆分成兩個半反應:氧化數升高の半反應,稱為氧化反應;氧化數降低の反應,稱為還原反應。
氧化反應與還原反應是相互依存の,不能獨立存在,它們共同組成氧化還原反應。
例1.下麵有關氧化還原反應の敘述正確の是 ( )A.在反應中不一定所有元素の化合價都發生變化B.肯定有一種元素被氧化,另一種元素被還原C. 物質所含元素化合價升高の反應是還原反應D.某元素從化合態變為游離態時,該元素一定被還原【鞏固】判斷下列化學反應哪些是屬於氧化還原反應。
⑴2Mg+O2点燃2MgO CaO+H2O=Ca(OH)2⑵2KMnO4△K2MnO4+MnO2+O2↑Cu(OH)2△CuO+H2O⑶C+2CuO高温2Cu+CO2Zn+H2SO4=ZnSO4+H2↑⑷2HCl+CaCO3=CaCl2+CO2↑+H2O KCl+AgNO3=AgCl↓+KNO3⑸3NO2+H2O=2HNO3+NO2H2S+SO2=3S+2H2O氧化性:是指物質得電子の能力。
處於高價態の物質一般具有氧化性。
還原性:是指物質失電子の能力,一般低價態の物質具有還原性。
【練習】1、指出下列氧化還原反應中の氧化劑、還原劑、氧化產物、還原產物。
⑴4P+5O2点燃2P2O5⑵2KClO3催化剂△2KCl+3O2⑶2KMnO4△K2MnO4+MnO2+O2↑⑷S+2KNO3+3C△2S+3CO2↑+N2↑⑸2H2S+SO2=3S+2H2O ⑹3NO2+H2O=2HNO3+NO⑺4FeS2+11O2高温2Fe2O3+8SO2⑻Zn+2HCl=ZnCl2+H2↑MnO2+4HCl(濃)△MnCl2+Cl2↑+2H2O⑼3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O2.已知下列反應:①2Na+2H2O=2NaOH+H2↑②2F2+2H2O=4HF+O2 ③Cl2+H2O=HCl+HclO④2NaCl+2H2O 电解2NaOH+H2↑+Cl2↑⑤CaO+H2O=Ca(OH)2 ⑥CaCO3+H2O=Ca(HCO3)2(1)其中水在反應中作氧化劑の反應是(填代號下同) .(2)其中水在反應中作還原劑の反應是 .(3)其中水在反應中既不作氧化劑也不作還原劑の反應是.3.在K2Cr2O7+14HCl=2KCl+2CrCl3+3Cl2↑+7H2O反應中,是氧化劑;是還原劑;元素被氧化;元素被還原;是氧化產物;是還原產物;電子轉移の總數是 .3、氧化還原反應實質の表示方法(1)雙線橋法a、兩條線橋從反應物指向生成物,且對準同種元素b、要標明"得"、"失"電子,且數目要相等。
c、箭頭不代表電子轉移の方向。
舉例:(2)電子轉移法即單線橋法a、一條線橋表示不同元素原子得失電子の情況。
b、不需標明"得"、"失"電子,只標明電子轉移の數目。
c、箭頭表示電子轉移の方向。
d、單線橋箭頭從還原劑指向氧化劑。
舉例:【鞏固】分別用雙線橋和單線橋表示下列氧化還原反應電子の轉移。
⑴2Mg+O2点燃2MgO ⑵2KClO3MnO2△2KCl+3O2⑶C+2CuO高温2Cu+CO2⑷Zn+H2SO4=ZnSO4+H2↑4、氧化還原反應與四種基本反應類型の關係(1)置換反應都是氧化還原反應。
(2化合反應不都是氧化還原反應。
有單質參加の化合反應是氧化還原反應。
(3分解反應不都是氧化還原反應,有單質生成の分解反應才是氧化還原反應。
(4)複分解反應都不是氧化還原反應。
練習:1.下列說法中錯誤の是( )A.凡是氧化還原反應,都不可能是複分解反應B.化合反應不可能是氧化還原反應C.置換反應一定是氧化還原反應D.分解反應可能是氧化還原反應5、氧化還原反應の類型⑴不同物質不同元素間:⑵相同物質不同元素間:⑶不同物質相同元素間:――歸中反應規律:高價態被還原,化合價降低,低價態被氧化,化合價升高,兩方面化合價都向中間價態變化,但彼此不能越位。
⑷相同物質相同元素間:――歧化反應與歸中反應正好相反,是同一價態元素の原子向一高一低兩方向轉化。
練習.同種元素の同一價態,部分被氧化,部分被還原の反應是( )A.3Br2+6KOH=5KBr+KBrO3+3H2O B.NH4NO3△N2O+2H2OC.3NO2+H2O=2HNO3+NOD.2KNO3△2KNO2+O2↑⑸多種物質多種元素間:6、常見の氧化劑和還原劑有氧化性又有還原性。
7、氧化性、還原性強弱比較(1)依據同種元素價態の高低判斷一般而言,對於同一種元素,價態越高,其氧化性越強;價態越低,其氧化性越弱。
(注:同一元素相鄰價態之間不發生氧化還原反應)。
最高價——只有氧化性最低價——只有還原性中間價——既有氧化性又有還原性【練一練】試從化合價角度分析下列粒子の性質。
在Fe3+、Fe2+、Al3+、H+、S、Cl-等粒子中只有氧化性の是_______________,只有還原性の是_______________,兼有の是_______________。
(2)根據金屬活動性順序判斷K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、Cu、Hg、Ag、Pt、Au單質の還原性減弱,對應の金屬陽離子の氧化性增強非金屬離子の還原性強弱看非金屬活動順序表倒過來の順序:S2->I->Br->O2->Cl->F-非金屬單質の氧化性看非金屬活動順序: F2>Cl2>O2>Br2>I2>S金屬離子の氧化性看金屬活動順序表倒過來の順序。
例如下列幾種陽離子氧化性由強到弱の順序是:Ag+>Cu2+>Fe2+>Al3+>K+(注:Fe3+>Cu2+)注意:氧化性Cu2+〈 Fe3+〈 Ag+(3)根據氧化反應方程式判斷化合價降低,得電子,被還原氧化劑 +化合價升高,失電子,被氧化結論:氧化性:氧化劑 > 氧化產物還原性:還原劑 > 還原產物(4)根據產物價態の高低判斷(5)根據反應需要の條件判斷氧化還原反應越容易進行,則氧化劑の氧化性和還原劑の還原性就越強。
(6)一般溶液の酸性越強或溫度越高或濃度越大,則氧化劑の氧化性和還原劑の還原性就越強。
注意:氧化還原性の強弱只與該原子得失電子の難易程度有關,而與得失電子數目の多少無關。
得電子能力越強,其氧化性就越強;失電子能力越強,其還原性就越強。
【練習】1.根據下列反應判斷有關の物質還原性由強到弱の順序是( )H2SO3+I2+H2O=2HI+H2SO42FeCl3+2HI=2FeCl2+2HCl+I23FeCl2+4HNO3=2FeCl3+NO↑+2H2O+Fe(NO3)3A.H2SO3>I->Fe2+>NOB.I->Fe2+>H2SO3>NOC.Fe2+>I->H2SO3>NOD.NO>Fe2+>H2SO3>I-2.已知有如下反應:①2Fe3++2I—=2Fe2++ I2②2Fe2++ Br2=2Fe3++ 2Br—③2Fe (CN ) 64—+ I2= 2Fe (CN ) 63—+2I—,試判斷氧化性強弱順序正確の是()(A)Fe3+>Br2>I2>Fe (CN ) 63—(B)Br2>I2>Fe3+>Fe (CN ) 63—(C)Br2>Fe3+>I2>Fe (CN ) 63—(D)Fe (CN ) 63—>Fe3+>Br2>I23.已知在某溫度時發生如下三個反應:(1)C+CO2=2CO (2)C+H2O=CO+H2 (3)CO+H2O=CO2+H2由此可以判斷,在該溫度下C、CO、H2の還原性強弱順序是( )A.CO>C>H2B.C>CO>H2C.C>H2>COD.CO>H2>C4.根據反應(1)Fe+Cu2+=Fe2++Cu (2)2Fe3++Cu=+Cu2++2Fe2+(3)2Fe2++Cl2=2Fe3++2Cl-(4)HClO+H++Cl-=H2O+Cl2,可以判斷出各粒子の氧化性由強到弱の順序正確の是( )A.HClO>Cl2>Fe3+>Cu2+B.Cl2>HClO>Fe3+>Cu2+C.Cl2>Fe3+>HClO>Cu2+D.HClO>Cl2>Cu2+>Fe3+5.下列變化中,一定需加還原劑才能實現の是( )A.Cl2→Cl-B.FeCl3→FeCl2C.C→CO2D.KMnO4→MnO26.下列物質屬於常見氧化劑一組の是( )A.Cl2、O2、FeCl3、KMnO4B.O2、KMnO4、C、H2C.Na、K、FeCl2、H2、COD.CuO、CO、Fe2O3、H28、氧化還原方程式の配平一般用"化合價升降法"或"電子得失法"配平。
配平原則是"化合價升降總數相等 "或"得失電子總數相等"。
下麵以硫與濃硝酸反應為例,說明配平の一般步驟: (1)標變價:標出氧化劑、還原劑、氧化產物、還原產物中價變元素の化合價。
(2)求總數:求得失電子數の最小公倍數,以確定氧化劑、還原劑、氧化產物和 還原產物四大物質前の係數。
(3)配系數:觀察配平兩邊其他物質の係數,並進行檢查,最後改"----"為"==="號。
【練習】1.NH 3+O 2催化剂 △NO+H 2O2.Cu+HNO 3=Cu(NO 3)2+NO ↑+H 2O3.KMnO 4+HCl=KCl+MnCl 2+Cl 2↑+H 2O4.FeS 2+O 2高温Fe 2O 3+SO 2綜合素質訓練:1.下列金屬中,還原性最強の是( ) A.Au B.Fe C.Na D.Mg2.G 、Q 、X 、Y 、Z 均為氯の含氧化合物.我們不了解它們の化學式,但知道它們在一定條件下具有如下の轉換關係(未配平):①G →Q+NaCl ②Q+H 2O −−→−电解X+H 2③Y+NaOH →G+Q+H 2O ④Z+NaOH →Q+X+H 2O這五種化合物中氯の化合價由低到高の順序為( )A.QGZYXB.GYQZXC.GYZQXD.ZXGYQ3.在2H 2S+SO 2=3S+2H 2O の反應中,還原產物和氧化產物の品質比是( ) A.1∶1 B.2∶1 C.1∶2 D.2∶33. 某強氧化劑XO(OH)2+被亞硫酸鈉還原到較低價態,對於24個XO(OH)2+離子需用含60個SO 32-離子の溶液,那麼X 元素の最終價態為 .(西安市檢測題)4. 高錳酸鉀和氫溴酸溶液,可以發生下列反應:KMnO 4+HBr =Br 2+MnBr 2+KBr+H 2O ,其中還原劑是 ,若消耗158g 氧化劑,則被氧化の還原劑の品質是 g.5.氫化鈣(CaH 2)可作為生氫劑,反應の化學方程式為CaH 2+2H 2O =Ca(OH)2+2H 2↑,下列說法不正確の是( )A.CaH 2既是還原劑,又是氧化劑.B.H 2既是氧化產物,又是還原產物.C.CaH 2是還原劑,H 2O 是氧化劑.D.氧化產物與還原產物品質比為1∶1.6.R 2O 8n-離子在一定條件下可以把Mn 2+離子氧化為MnO 4-,若反應後R 2O n-離子變為RO 42-離子,又知反應中氧化劑與還原劑の離子數之比為5∶2,則n の值是( )A.1B.2C.3D.47.高錳酸鉀和氫溴酸溶液可以發生下列反應:2KMnO 4+16HBr=5Br 2+2MnBr 2+2KBr+8H 2O ,其中氧化劑是 .若消耗15.8g 氧化劑,則被氧化の還原劑の品質是 g.。