高三培优——H2O2与O3的结构、性质和用途
- 格式:docx
- 大小:106.66 KB
- 文档页数:3
过氧化氢和过氧酸H2O2为无色透明的液体,俗称双氧水。
市售浓度约为30%,主要化学性质以氧化性为基础。
医学上通常用3%的过氧化氢水溶液来消毒、杀菌。
轻纺工业上作漂白剂,纯的过氧化氢可达99%,可作高能燃料强氧化剂等。
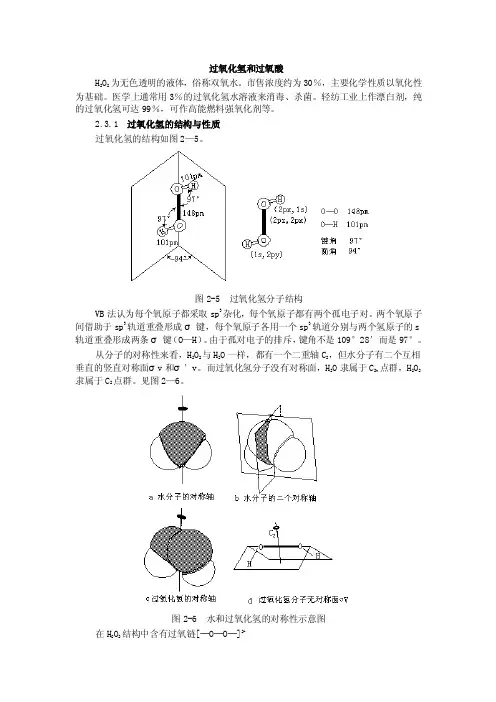
2.3.1 过氧化氢的结构与性质过氧化氢的结构如图2—5。
图2-5 过氧化氢分子结构VB法认为每个氧原子都采取sp3杂化,每个氧原子都有两个孤电子对。
两个氧原子间借助于sp3轨道重叠形成σ键,每个氧原子各用一个sp3轨道分别与两个氢原子的s 轨道重叠形成两条σ键(O—H)。
由于孤对电子的排斥,键角不是109°28′而是97°。
从分子的对称性来看,H2O2与H2O一样,都有一个二重轴C2,但水分子有二个互相垂直的竖直对称面σv和σ′v。
而过氧化氢分子没有对称面,H2O隶属于C2v点群,H2O2隶属于C2点群。
见图2—6。
图2-6 水和过氧化氢的对称性示意图在H2O2结构中含有过氧链[─O─O─]2-一般而言,H2O2在酸性介质中可以作为氧化剂,也可作为还原剂,在碱性介质中也是一种理想的氧化剂或还原剂。
由于H2O2参加反应后,不会给溶液带来杂质离子,所以稀的或30%的H2O2溶液是较为理想的氧化剂。
其电势图如下:H2O2在酸性介质中能将I-离子氧化,生成碘。
H2O2+2I-+2H+=I2+2H2OE=1.776-0.535=1.241VH2O2在碱性介质中能将Cr(OH)4-(四羟基铬[Ⅲ]阴离子)氧=0.87-(-0.13)=1.0V那么,在酸性介质中,高锰酸钾与H2O2反应,此时H2O2作氧化剂还是还原剂?的电极电势等于1.491,而的电极电势为+1.776V,的身份出现,而只能作为氧化剂的身份出现,将[—O—O—]2-氧化成O2,其反应为:E=1.491-0.682=0.809V同样,在碱性介质中高锰酸钾与H2O2相遇,H2O2也作为还原剂。
E=0.588-(-0.08)=0.668VH2O2在室温下分解很慢,倘若有MnO2、Fe2O3等重金属离子或其氧化物存在时,则剧烈地分解放出氧气。

臭氧过氧化氢臭氧和过氧化氢是两种常见的化学物质,它们在不同的领域中具有重要的应用价值。
本文将分别介绍臭氧和过氧化氢的性质、制备方法以及主要应用领域。
一、臭氧臭氧(O3)是一种具有强氧化性的无色气体。
它的分子由三个氧原子组成,相较于氧气(O2),臭氧的化学活性更强。
1. 性质臭氧具有较强的氧化能力和杀菌作用。
它能与许多物质发生反应,使其分解、氧化或脱色。
由于其活性极高,臭氧在空气中很快分解,因此无法长时间储存或运输。
2. 制备方法臭氧可通过电晕放电或紫外光照射氧气而制备。
电晕放电法是将氧气通入电晕放电装置中,通过高电压电晕放电使氧气分解生成臭氧。
紫外光照射法是利用高能紫外光照射氧气,使氧气分子发生裂解产生臭氧。
3. 应用领域臭氧具有强氧化性和杀菌作用,因此在水处理、污水处理和空气净化等领域具有广泛应用。
在水处理中,臭氧可用于去除水中的有机物、重金属和异味物质。
在污水处理中,臭氧可用于氧化分解有机污染物。
此外,臭氧还可以用于空气净化,去除空气中的有害气体和异味。
二、过氧化氢过氧化氢(H2O2)是一种无色液体。
它的分子由两个氧原子和两个氢原子组成,具有较强的氧化性。
1. 性质过氧化氢是一种稳定性较差的化合物,易于分解释放氧气。
它可以与许多物质发生反应,具有较强的氧化能力和杀菌作用。
2. 制备方法过氧化氢可通过电解水或氧化反应制备。
电解水法是将电流通入水中,使水分解产生过氧化氢和氧气。
氧化反应法是利用氧化剂氧化某些物质,使其产生过氧化氢。
3. 应用领域过氧化氢在医药、化工和环境等领域有重要应用。
在医药领域,过氧化氢可用作消毒剂和漂白剂。
在化工领域,过氧化氢可用于有机合成反应和废水处理等。
在环境领域,过氧化氢可用于土壤修复和环境污染治理等。
臭氧和过氧化氢是两种常见的化学物质,它们具有强氧化性和杀菌作用,在水处理、污水处理、空气净化、医药和化工等领域有重要应用。
我们可以通过合理利用臭氧和过氧化氢的性质和制备方法,发挥它们在不同领域的作用,为人类的生活和环境改善做出贡献。

H 2O 2与O 3的结构、性质和用途1.过氧化氢(其水溶液俗称双氧水)(1)过氧化氢的分子结构:过氧化氢分子中含有极性键和非极性键,其结构式为H —O —O —H ,电子式为H ··O ······O ······H 。
(2)过氧化氢的化学性质①氧化性:过氧化氢是绿色氧化剂,具有较强的氧化性。
例如:H 2O 2+2KI +2HCl===2KCl +I 2+2H 2O2Fe 2++H 2O 2+2H +===2Fe 3++2H 2O H 2O 2+H 2S===S ↓+2H 2OH 2O 2+SO 2===H 2SO 4注意 在酸性条件下H 2O 2的还原产物为H 2O ,在中性或碱性条件下其还原产物为OH -(或氢氧化物)。
②还原性:过氧化氢遇到强氧化剂被氧化生成氧气。
例如:2KMnO 4+5H 2O 2+3H 2SO 4===2MnSO 4+K 2SO 4+5O 2↑+8H 2O③不稳定性:过氧化氢在常温下缓慢分解生成氧气和水,加热或者加入催化剂(MnO 2、Cu 2+、Fe 3+等)快速分解。
2H 2O 2=====催化剂2H 2O +O 2↑2H 2O 2=====△2H 2O +O 2↑(3)过氧化氢的用途:作消毒剂、杀菌剂,作漂白剂、脱氯剂,纯H 2O 2还可作火箭燃料的氧化剂等。
2.氧气的同素异形体臭氧(O 3)(1)物理性质常温常压下,臭氧是一种有特殊臭味的淡蓝色气体,它的密度比氧气大,比氧气易溶于水。
吸入少量臭氧对人体有益,吸入过量对人体健康有一定危害。
(2)化学性质①不稳定性:2O 3=====一定条件3O 2②强氧化性:Ag 、Hg 等金属在臭氧中可以被氧化,O 3能使湿润的淀粉-KI 试纸变蓝,其反应的化学方程式如下:O 3+2KI +H 2O===I 2+2KOH +O 2③漂白和消毒:许多染料受到臭氧的强烈氧化会退色,臭氧还能杀死许多细菌。


一、过氧化氢性质归纳1、物理性质通常情况下,过氧化氢是一种无色粘稠液体,俗称双氧水,呈弱酸性。
实验室使用的是30%的双氧水溶液,食品级的是35%的双氧水溶液,消毒用的是3%的双氧水溶液。
2、化学性质H2O2中O呈-1价,属于0价和-2价之间的中间价态,H2O2表现为既有氧化性又有还原性,遇到强氧化剂时呈现还原性,遇到强还原剂时呈现氧化性,并以氧化性为主。
(1)氧化性:H2O2做氧化剂时,其还原产物为H2O,不会引入新的杂质,这是H2O2被称为环保型氧化剂的原因。
如:H2O2+SO2=H2SO42FeSO4+ H2O2+H2SO4=Fe2(SO4)3+2 H2O;2FeCl2+ H2O2+2HCl=2FeCl3+2 H2O ,因为H2O2具有的强氧化性,也可以用作漂白剂和消毒杀菌剂。
(2)还原性:H2O2做还原剂时,其氧化产物为O2 ,如:2KMnO4+5 H2O2+3H2SO4=2MnSO4+K2SO4+5 O2↑+8H2O ;2KMnO4+3 H2O2=2MnO2↓+2KOH+3O2↑+2H2O ;2KMnO4+ H2O2+2KOH= 2K2MnO4+ O2↑+2H2O ;H2O2 + Cl2 = 2HCl+O2↑;(3)不稳定性:2 H2O 2 2 H2O2+O2 ,实验室常用此反应制取氧气。
(4)弱酸性:过氧化氢呈弱酸性,相当于二元弱酸,电离方程式:H2O 2H+ +HO-2, HO-2H+ + O-22;过氧化氢与氢氧化钾溶液反应的化学方程式有以下情况:H2O2+KOH=KHO2+H2O ,KHO2 + KOH= K2O2+H2O ,H2O2+2KOH=K2O2+2H2O ,二、过氧化氢例题分析例1.过氧化氢的沸点比水高,但受热容易分解。
某试剂厂先制得7%~8%的过氧化氢溶液,再浓缩成30%溶液时,可采用的适宜方法是()A.常压蒸馏B.减压蒸馏C.加生石灰常压蒸馏D.加压蒸馏解题思路:相互混溶的液体被加热时,沸点低的液体先被蒸发出来。

双氧水物理化学性质双氧水,也被称为氢过氧化物,是一种稳定的化学物质,由氢和氧组成。
它具有广泛的应用领域,包括医疗、消毒、美容等。
本文将探讨双氧水的物理化学性质,以及它在不同环境中的行为。
1. 双氧水的分子结构双氧水的化学式为H2O2,它由两个氧原子连接在一起,形成一个类似于水分子的结构。
与水分子相比,双氧水分子中多了一个氧原子,使得它的化学性质与水有所不同。
2. 双氧水的物理性质双氧水是一种无色、无臭的液体,在常温下呈淡蓝色。
它具有比水更高的密度和比水更高的沸点。
双氧水在冰点以下可以形成固态结构,并且在低温下可以形成冰晶状的物质。
此外,双氧水在高温下可以发生分解,产生水和氧气。
3. 双氧水的化学性质双氧水是一种强氧化剂,并且与许多物质反应。
它可以与金属离子反应,生成相应的金属氧化物。
双氧水还可以与有机物反应,产生氧气和水,并氧化有机物分子中的碳原子。
这使得双氧水成为一种常用的消毒剂和漂白剂。
4. 双氧水的稳定性双氧水在常温下相对稳定,但在光照、高温和金属催化剂的存在下容易分解。
因此,双氧水通常需要在阴凉、暗处保存,并避免与金属接触。
5. 双氧水的应用双氧水广泛应用于医疗、消毒、美容等领域。
它常用于创伤消毒、口腔卫生以及池水处理中。
双氧水还被用于漂白和去除污渍,它可以去除衣物上的污渍,并为物体恢复原本的颜色。
在美容领域,双氧水被用于脸部清洁、治疗痤疮和染发等。
总结:双氧水是一种稳定的化学物质,具有特殊的物理化学性质。
它是一种强氧化剂,可以与金属和有机物反应。
双氧水在常温下相对稳定,但容易被光照和高温分解。
双氧水在医疗、消毒、美容等领域有广泛的应用,因其具有强氧化能力和漂白作用。
双氧水的物理化学性质使得它成为一种重要的化学物质,在日常生活和工业中发挥着重要的作用。
通过深入了解双氧水的性质和行为,我们可以更好地利用它的优势,促进科学发展和人类福祉的提升。

H 2O 2与O 3的结构、性质和用途1.过氧化氢(其水溶液俗称双氧水)(1)过氧化氢的分子结构:过氧化氢分子中含有极性键和非极性键,其结构式为H —O —O —H ,电子式为。
(2)过氧化氢的化学性质①氧化性:过氧化氢是绿色氧化剂,具有较强的氧化性。
例如:H 2O 2+2KI +2HCl===2KCl +I 2+2H 2O2Fe 2++H 2O 2+2H +===2Fe 3++2H 2OH 2O 2+H 2S===S ↓+2H 2OH 2O 2+SO 2===H 2SO 4注意 在酸性条件下H 2O 2的还原产物为H 2O ,在中性或碱性条件下其还原产物为OH -(或氢氧化物)。
②还原性:过氧化氢遇到强氧化剂被氧化生成氧气。
例如:2KMnO 4+5H 2O 2+3H 2SO 4===2MnSO 4+K 2SO 4+5O 2↑+8H 2O③不稳定性:过氧化氢在常温下缓慢分解生成氧气和水,加热或者加入催化剂(MnO 2、Cu 2+、Fe 3+等)快速分解。
2H 2O 2=====催化剂2H 2O +O 2↑2H 2O 2=====△2H 2O +O 2↑(3)过氧化氢的用途:作消毒剂、杀菌剂,作漂白剂、脱氯剂,纯H 2O 2还可作火箭燃料的氧化剂等。
2.氧气的同素异形体臭氧(O 3)(1)物理性质常温常压下,臭氧是一种有特殊臭味的淡蓝色气体,它的密度比氧气大,比氧气易溶于水。
吸入少量臭氧对人体有益,吸入过量对人体健康有一定危害。
(2)化学性质①不稳定性:2O 3=======一定条件3O 2。
②强氧化性:Ag 、Hg 等金属在臭氧中可以被氧化,O 3能使湿润的淀粉-KI 试纸变蓝,其反应的化学方程式如下:O 3+2KI +H 2O===I 2+2KOH +O 2。
③漂白和消毒:许多染料受到臭氧的强烈氧化会褪色,臭氧还能杀死许多细菌。
(3)产生方式:3O 2=====放电2O 3。
(4)臭氧层:能吸收来自太阳的大部分紫外线,是人类和其他生物的保护伞。

过氧化物与过氧化氢理解过氧化物与过氧化氢的性质与应用过氧化物和过氧化氢是化学中两种重要的化合物,它们具有特殊的性质和广泛的应用。
在本文中,我们将深入探讨过氧化物和过氧化氢的性质以及它们在不同领域中的应用。
一、过氧化物的性质过氧化物是一类化学化合物,它们的结构中含有一个或多个氧原子与另一个原子或原子团结合。
常见的过氧化物包括过氧化氢(H2O2)、过氧化钠(Na2O2)和过氧化钙(CaO2)等。
过氧化物具有一些特殊的性质,如下所述:1. 氧化性:过氧化物可以与其他物质发生氧化反应,将其氧化成更高的化合价态。
例如,过氧化氢可以氧化金属离子,将其还原成对应的金属阳离子。
2. 易分解性:过氧化物在适当的条件下,如加热、光照或存在催化剂的作用下,会分解成相应的氧气和水。
这种分解反应是自发进行的,释放出大量的氧气。
3. 漂白性:过氧化物具有强烈的漂白能力,可以将染料、颜料和有机物中的色素氧化还原成无色物质。
这使得过氧化物在纺织、造纸和染料工业中被广泛应用。
二、过氧化氢的性质过氧化氢是一种无色液体,化学式为H2O2。
它是一种强氧化剂,也具有一些特殊的性质:1. 高活性:过氧化氢具有高度的活性,可以与各种物质反应。
它可以与金属离子反应生成相应的金属氢氧化物,也可以与有机物反应生成有机过氧化物。
2. 易分解性:过氧化氢可以在适当的条件下迅速分解,释放出大量的氧气。
这种分解反应是自发进行的,产生的氧气可以用于燃烧或氧化反应。
3. 杀菌消毒:过氧化氢具有很强的杀菌和消毒作用。
它可以破坏微生物细胞膜和细胞核酸,从而杀灭细菌、病毒和真菌。
三、过氧化物和过氧化氢的应用由于过氧化物和过氧化氢的特殊性质,它们在多个领域中得到了广泛的应用,包括以下几个方面:1. 医疗卫生:过氧化氢可以用作外科手术和口腔护理的消毒剂。
它还可以用于治疗伤口感染、清洁创面并促进伤口愈合。
2. 化学工业:过氧化物可以作为化学反应的催化剂,加速反应速度并提高反应产率。
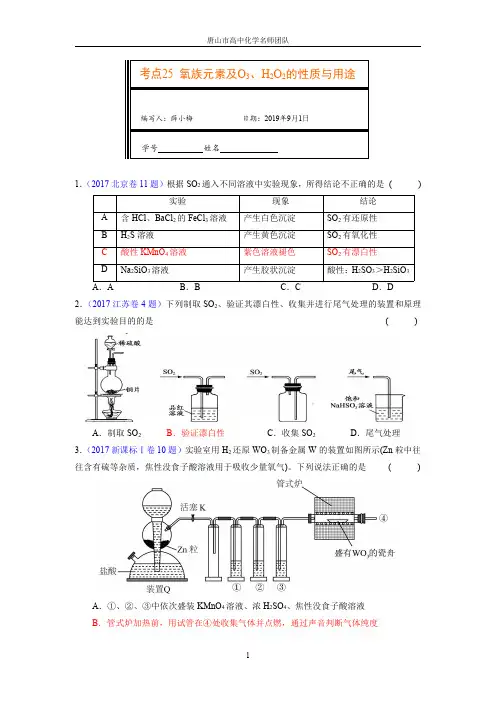
考点25氧族元素及O3、H2O2的性质与用途编写人:薛小梅日期:2019年9月1日学号姓名1.(2017北京卷11题)根据SO2通入不同溶液中实验现象,所得结论不正确的是()实验现象结论A含HCl、BaCl2的FeCl3溶液产生白色沉淀SO2有还原性B H2S溶液产生黄色沉淀SO2有氧化性C酸性KMnO4溶液紫色溶液褪色SO2有漂白性D Na2SiO3溶液产生胶状沉淀酸性:H2SO3>H2SiO3A.A B.B C.C D.D 2.(2017江苏卷4题)下列制取SO2、验证其漂白性、收集并进行尾气处理的装置和原理能达到实验目的的是()A.制取SO2B.验证漂白性C.收集SO2D.尾气处理3.(2017新课标Ⅰ卷10题)实验室用H2还原WO3制备金属W的装置如图所示(Zn粒中往往含有硫等杂质,焦性没食子酸溶液用于吸收少量氧气)。
下列说法正确的是()A.①、②、③中依次盛装KMnO4溶液、浓H2SO4、焦性没食子酸溶液B.管式炉加热前,用试管在④处收集气体并点燃,通过声音判断气体纯度C.结束反应时,先关闭活塞K,再停止加热D.装置Q(启普发生器)也可用于二氧化锰与浓盐酸反应制备氯气4.(2013广东卷11题)下列措施不合理的是() A.用SO2漂白纸浆和草帽辫B.用硫酸清洗锅炉中的水垢C.高温下用焦炭还原SiO2制取粗硅D.用Na2S作沉淀剂,除去废水中的Cu2+和Hg2+5.(2016四川卷3题)下列关于离子共存或离子反应的说法正确的是() A.某无色溶液中可能大量存在H+、Cl-、MnO4-B.pH=2的溶液中可能大量存在Na+、NH4+、SiO32-C.Fe2+与H2O2在酸性溶液中的反应:2Fe2++H2O2+2H+=2Fe3++2H2OD.稀硫酸和氢氧化钡溶液反应:H++SO42-+Ba2++OH-=BaSO4↓+H2O6.(2010天津卷5题)下列实验设计及其对应的离子方程式均正确的是() A.用FeCl3溶液腐蚀铜线路板:Cu+2Fe3+=Cu2++2Fe2+B.Na2O2与H2O反应制备O2:Na2O2+H2O=2Na++2OH-+O2↑C.将氯气溶于水制备次氯酸:Cl2+H2O=2H++Cl-+ClO-D.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O7.(2015四川卷9题)(NH4)2SO4是常见的化肥和化工原料,受热易分解。

【考点】O2、O3、H2O2的结构与性质解读本文发表于《高中数理化》,也是即将由山东科技出版社出版的《用原子的眼睛看世界——中学化学重点知识解读》内的一篇。
该书将于2021年底出版。
1. 为什么O2分子结构不可写作O=O?在探寻物质微观结构的过程中,人们首先发现了原子的“最外层8电子稳定结构学说”。
此学说可以很好地解释稀有气体原子、NaCl等离子化合物、HCl、H2O等小分子化合物以及卤素单质X2、N2等常见气体单质具有稳定结构。
那时,人们以为O2分子中两个原子间通过2个共用电子对结合,以满足彼此的最外层8电子结构,用如下电子式表示。
科学总是在不断发展的。
后续的深入研究中,人们发现,O2分子内存在成单电子——因为O2具有磁性(也叫“顺磁性”,具有顺磁性的物质在磁场内会受到磁场作用而产生磁极)。
如下图所示:现代物质结构理论指出,物质的磁性跟其内部含有的单电子有关。
如果一种物质内部的所有电子都是以电子对的形式存在,该物质就不可能具有磁性,它在磁场中不会受到影响。
比如,上图所示的实验中,液氮可以依靠自身重力顺利穿过强磁场而流下,而液氧则不然,它囤积在N、S两磁极间的缝隙上方。
对此,“8电子学说”关于O2的分子结构的结论显然不能给出合理解释,因为上述电子式表达的意思是O2分子内所有原子均已成对。
为解释O2含有单电子的结构问题,科学家提出了分子轨道理论——在分子内,原子轨道相互作用形成不同能量的分子轨道,分子中的所有电子在所有分子轨道内依据泡利原理、能量最低原理、洪特规则进行填充。
氧原子价层的3个p轨道相互作用、组合成的新轨道为4组——按照能量由低到高依次为σ2p(1个轨道,能量低,称为“成键轨道”)、π2p(2个等价的成键轨道)、π*2p(2个等价轨道,能量高,称为反键轨道)、σ*2p(1个反键轨道)。
两个氧原子共8个2p电子在分子轨道内填充的结果是:σ2p2(满)、π2p4(2个等价轨道全满)、π*2p2(2个等价轨道均半满)、σ*2p0(1个轨道未填充电子)。

双氧水的结构摘要:一、双氧水的化学性质二、双氧水的应用领域三、双氧水的制备方法四、双氧水的安全性与注意事项五、总结正文:双氧水(H2O2)是一种常见的化学物质,其结构为一个氧原子与两个氢原子结合。
在自然界中,双氧水广泛存在于大气、水体和生物体内。
本文将介绍双氧水的化学性质、应用领域、制备方法以及安全性与注意事项。
一、双氧水的化学性质双氧水具有很强的氧化性,可以与许多物质发生化学反应。
在常温下,双氧水为无色透明液体,分子量为34.01。
双氧水的化学式表示为H2O2,其中两个氧原子之间存在一个共价键,氧原子与氢原子之间也存在共价键。
双氧水具有较强的酸性,其pKa值为-1.95。
二、双氧水的应用领域1.医疗领域:双氧水常用于消毒、杀菌和治疗伤口。
在医疗实践中,双氧水可以有效地消灭病原微生物,防止感染。
2.工业领域:双氧水广泛应用于化工、石油、纺织、食品等行业。
在工业上,双氧水常用于去除硫化物、脱氯、脱臭等。
3.环境保护:双氧水在环境保护领域具有广泛应用,如水体净化、废气处理等。
4.日常生活:在日常生活中,双氧水可用于清洗、消毒、除臭等。
三、双氧水的制备方法双氧水的制备方法主要有两种:一是通过过氧化氢的合成,即将氢氧化钠与过氧化钠反应生成过氧化氢;二是通过电解水制备,即将水分解为氢气和氧气,然后将氢气与氧气反应生成双氧水。
四、双氧水的安全性与注意事项1.安全性:双氧水具有较强的氧化性和酸性,因此在使用过程中应注意安全防护,避免直接接触皮肤和眼睛。
2.注意事项:使用双氧水时,应遵循适量、正确的使用方法。
过量使用双氧水可能导致环境污染和人体健康损害。
五、总结双氧水是一种具有重要应用价值的化学物质,其化学性质、应用领域、制备方法以及安全性等方面的研究不断深入。
在各个领域中,双氧水发挥着重要作用,为人类生活带来诸多便利。
微题型42 H2O2、O3性质探究及应用时间:30分钟1.前几年,部分巨能钙被检出含有双氧水,而双氧水有致癌性,可加速人体衰老。
因此卫生部加紧调查巨能钙。
下列有关说法错误的是()A.H2O2、Na2O2都属于过氧化物,都存在共价键B.双氧水是绿色氧化剂,可作医疗消毒剂C.H2O2既有氧化性,又有还原性,与Cl2、KMnO4反应是表现H2O2的氧化性D.H2O2做漂白剂是利用其氧化性,漂白原理与HClO类似,与SO2不同【答案】C【详解】A. H2O2、Na2O2中都存在O-O共价键,A项正确;B. 双氧水有强氧化性,可做漂白剂和消毒剂,其还原产物为H2O,故被称为“绿色氧化剂”,B、D项正确;C. H2O2中O为-1价,故H2O2既有氧化性,又有还原性,当与具有很强氧化性的物质如KMnO4、Cl2等强氧化剂相遇时被氧化,H2O2表现还原性,C项错误;D. H2O2做漂白剂是利用其氧化性,漂白原理与HClO类似,而SO2不是因强氧化性而漂白,D项正确;答案选C。
2.下列关于臭氧性质的叙述中不正确的是()A.臭氧比氧气的氧化性更强,常温下能将Ag、Hg等较不活泼的金属氧化B.臭氧可以杀死许多细菌,是一种良好的消毒剂C.臭氧和活性炭一样,能够吸附有机色素,是一种很好的脱色剂D.臭氧和氧气在一定条件下可以相互转化【答案】C【详解】A. 臭氧的氧化性比氧气强,常温下能将Ag、Hg等较不活泼的金属氧化,A项正确;B. 臭氧具有强氧化性,可以杀死许多细菌,是一种良好的消毒剂,B项正确;C. 臭氧的漂白性利用的是强氧化性,是化学变化;活性炭能够吸附有机色素,是物理变化,C项错误;D. 氧气变成臭氧反应条件是闪电属于化学变化,臭氧常温下可分解为氧气,可以相互转化,D项正确。
答案选C。
3.过碳酸钠(2Na2CO3·H2O2),俗名固体双氧水,具有Na2CO3和H2O2双重性质,可用作无毒漂白剂和供氧剂。
一种利用双氧水和纯碱在稳定剂作用下制备过碳酸钠的工艺流稳定剂2Na2CO3·3H2O2稳定程如下图。
过氧化氢的结构
过氧化氢(氢氧化物)是一种具有重要意义的游离基,它具有易激发、稳定、电荷中
和以及自由基抑制的特性。
此外,该物质可用于氧化各类有机物质,是危险性、间接氧化
性和活性性多发病的主要原因。
过氧化氢(H2O2)是一种游离基,它由两个氢原子和一个氧原子组成,它易分解为水
和氧原子,形式如下:
H2O2(过氧化氢)→H2O(水)+O(氧)
虽然过氧化氢分子具有相同数量的原子,但两个氢原子不同,称为疤痕bond。
这种键的存在使得过氧化氢的分子形状与水的不同,其结构被称为“类肿瘤植物形式”。
该分子
的氢原子被称为中性原子,由两个氢原子和一个氧原子共同构成,经电荷中和,形成了一
个非中心对称的分子结构。
由于过氧化氢的结构,它不像水那样,存在两个非常紧密的键,而是具有一个蠕形的
结构。
这种结构使它更容易与其他氧化物结合,以此产生多种活性物质。
这些活性物质可
以发挥作用,如氧化各种有机物、氧化代谢物以及自由基对健康的有害影响等。
因此,过氧化氢(H2O2)的结构及其特性,对医学保健和环境保护有重要的意义。
它
可用作表面消毒和去除氯离子外污染物的反应剂,也可用于降解有害有机物和重金属离子,以及有用的水质保护、灭菌等。
高考化学过氧化氢的性质及其应用吕清文一、基础知识归纳过氧化氢(22O H )是一种无色黏稠液体,它的水溶液俗称双氧水,呈弱碱性。
市售双氧水中22O H 的质量分数一般为30%。
医疗上广泛使用稀双氧水作为消毒杀菌剂。
过氧化氢的电子式为HO O H ∙∙∙∙⨯∙∙∙∙∙∙∙⨯∙,结构式为H O O H ---。
22O H 中氧元素为1-价,介于0价与2-价之间,所以22O H 既具有氧化性,又具有还原性。
(1)弱酸性:其酸性比碳酸弱,电离方程式为:22O H +-+H HO 2、-2HO -++2O H 。
在碱性溶液中极不稳定,易分解生成22O O H 和。
如O H O Na 222与反应可分为两个阶段:22222O H 2NaOH 4O H 4O Na 2+=+、↑+=2222O O H 2O H 2。
叠加得总反应式:↑+=+2222O NaOH 4O H 2O Na 2(2)不稳定性:过氧化氢在常温下会缓慢分解为氧气和水。
对其水溶液加热、光照或加催化剂(如2MnO )都会促进其分解。
因此过氧化氢应保存在棕色瓶中并放置于阴凉处。
↑+22222O O H 2MnO O H 2(3)强氧化性:用22O H 作氧化剂时,还原产物为O H 2,不会引入新的杂质。
故过氧化氢是某些物质制备和除杂时较为理想的氧化剂。
①O H 4PbSO PbS O H 42422+=+白色油画颜料里的碱式碳酸铅长期与空气中微量的S H 2作用,会生成黑色的硫化铅(PbS ),用双氧水涂沫可使PbS 变成白色硫酸铅(4PbSO ),该反应用于油画整新。
②作脱氯剂:2222O HCl 2Cl O H +=+;作火箭燃料:O H 4N H N O H 2224222+↑=+ ③漂白性:工业上用10%的双氧水漂白毛、丝以及羽毛等。
④O H 2I KCl 2HCl 2KI 2O H 2222++=++22O H 能使湿润的KI 淀粉试纸变蓝;用硫代硫酸钠溶液滴定22O H 与酸性KI 溶液反应析出的碘,可用于22O H 的定量分析。
突破全国卷小专题4 H 2O 2与O 3的结构、性质与用途[专题精讲]一、过氧化氢(其水溶液俗称双氧水)1.分子结构过氧化氢分子中含有极性键和非极性键,其结构式为H —O —O —H ,电子式为。
2.化学性质(1)氧化性:过氧化氢是一种绿色氧化剂,具有较强的氧化性。
例如:H 2O 2+2KI +2HCl===2KCl +I 2+2H 2O2Fe 2++H 2O 2+2H +===2Fe 3++2H 2OH 2O 2+H 2S===S ↓+2H 2OH 2O 2+SO 2===H 2SO 4在酸性条件下H 2O 2的还原产物为H 2O ,在中性或碱性条件下其还原产物为OH -(或氢氧化物)。
(2)还原性:过氧化氢遇到强氧化剂被氧化生成氧气。
例如:2KMnO 4+5H 2O 2+3H 2SO 4===2MnSO 4+K 2SO 4+5O 2↑+8H 2O 。
(3)不稳定性:过氧化氢在常温下缓慢分解生成氧气和水,加热或加入催化剂(MnO 2、Cu 2+、Fe 3+等)快速分解:2H 2O 2=====△2H 2O +O 2↑;2H 2O 2=====催化剂2H 2O +O 2↑。
(4)弱酸性:H 2O 2为二元弱酸,在水中分步电离:H 2O 2H ++HO -2,HO -2H ++O 2-2;H 2O 2可与碱反应:H 2O 2+Ba(OH)2===BaO 2↓+2H 2O 。
3.用途做消毒剂、杀菌剂,做漂白剂、脱氯剂,纯H 2O 2还可做火箭燃料的氧化剂等。
二、氧气的同素异形体——臭氧(O 3)1.物理性质:常温常压下,臭氧是一种有特殊臭味的淡蓝色气体,它的密度比氧气的大,比氧气易溶于水。
吸入少量臭氧对人体有益,吸入过量对人体健康有一定危害。
2.化学性质(1)不稳定性:2O 3=====一定条件3O 2。
(2)强氧化性:Ag 、Hg 等金属在臭氧中可以被氧化,O 3能使湿润的淀粉-KI 试纸变蓝,其反应的化学方程式为O 3+2KI +H 2O===I 2+2KOH +O 2。
高三培优——H 2O 2与O 3的结构、性质和用途
知识梳理
1.过氧化氢(其水溶液俗称双氧水)
(1)过氧化氢的分子结构:过氧化氢分子中含有极性键和非极性键,其结构式为H—O—O—H ,电子式为。
(2)过氧化氢的化学性质
①氧化性:过氧化氢是绿色氧化剂,具有较强的氧化性。
例如:
H 2O 2+2KI +2HCl===2KCl +I 2+2H 2O
2Fe 2++H 2O 2+2H +===2Fe 3++2H 2O
H 2O 2+H 2S===S ↓+2H 2O
H 2O 2+SO 2===H 2SO 4
注意 在酸性条件下H 2O 2的还原产物为H 2O ,在中性或碱性条件下其还原产物为OH -(或氢氧化物)。
②还原性:过氧化氢遇到强氧化剂被氧化生成氧气。
例如:2KMnO 4+5H 2O 2+3H 2SO 4===2MnSO 4+K 2SO 4+5O 2↑+8H 2O
③不稳定性:过氧化氢在常温下缓慢分解生成氧气和水,加热或者加入催化剂(MnO 2、Cu 2+、Fe 3+等)快速分解。
2H 2O 2=====催化剂2H 2O +O 2↑
2H 2O 2=====△2H 2O +O 2↑
(3)过氧化氢的用途:作消毒剂、杀菌剂,作漂白剂、脱氯剂,纯H 2O 2还可作火箭燃料的氧化剂等。
2.氧气的同素异形体臭氧(O 3)
(1)物理性质
常温常压下,臭氧是一种有特殊臭味的淡蓝色气体,它的密度比氧气大,比氧气易溶于水。
吸入少量臭氧对人体有益,吸入过量对人体健康有一定危害。
(2)化学性质
①不稳定性:2O 3=======一定条件3O 2。
②强氧化性:Ag 、Hg 等金属在臭氧中可以被氧化,O 3能使湿润的淀粉-KI 试纸变蓝,其反应的化学方程式如下:
O 3+2KI +H 2O===I 2+2KOH +O 2。