荧光原位杂交
- 格式:ppt
- 大小:1.55 MB
- 文档页数:30

荧光原位杂交(FISH)综述摘要本文简单介绍了荧光原位杂交(FISH)技术的一些基础理论知识以及常用操作方法和步骤。
关键词:荧光原位杂交;1.发展荧光原位杂交(fluorescent in situ hybridization,FISH)是一种细胞遗传学技术,可以用来对核酸进行检测和定位。
荧光标记的核酸探针只和具有高度相似性的核酸杂交,可用于染色体上基因的定位,或在分子生态学中用来标记不同分类细菌或古菌中的核糖体RNA[1]。
1969年,Pardue等和John两个研究小组发明了原位杂交技术,放射性标记的DNA 或28s RNA 被杂交到细胞制备物上,通过放射自显影技术(m icroautoradiography, MAR)检测杂交位点,这一技术可以在保持细胞形态完整性的条件下,使核酸序列在细胞内被检测[2]。
2.原理通过特定分子的荧光标记探针在细胞内与染色体上特意的互补核酸序列原位杂交,通过激发杂交探针的荧光来检测信号。
由于荧光燃料收到一定波长的(即激发波长)的光激发后会发射荧光(即发射波长),所以就滤光镜选择合适的激发波长的光,即可显示某一特定的荧光染料,于是就可以直接显示特定细胞核中或染色体上的DNA序列间相互位置关系[2]。
原位杂交的处理:染色体上杂交的位点提供了DNA探针序列的定位信息。
所以应用该方法时,需打开维持染色体DNA双螺旋结构的碱基配对以使其形成单链分子(这称为DNA变性)。
只有这样染色体DNA才能与探针杂交。
变性染色体DNA而不破坏其形态的标准方法是将染色体干燥在玻璃载玻片上,再用甲酰胺处理[1]。
3.关于探针的发展早期原位杂交技术中探针是放射性标记的,但这个方法并不令人满意,因为放射性标记很验证同时满足灵敏度和分辨率这两个原位杂交成功的必要条件。
灵敏度要求放射性标记具有高中辐射能(例如用32P标记),当标记物能量过高时,会因为信号散射导致分辨率过低。
如果使用低辐射能的放射性标记物,如3H可以得到较高的分辨率,但由于灵敏度低而需要长时间曝光,并由此导致背景过高,难以分辨出真正的信号。

荧光原位杂交技术荧光原位杂交技术(fluorescence in situ hybridization),简称FISH。
是利用荧光标记的特异核酸探针与细胞内相应的靶DNA分子或RNA分子杂交,通过在荧光显微镜或共聚焦激光扫描仪下观察荧光信号,来确定与特异探针杂交后被染色的细胞或细胞器的形态和分布,或者是结合了荧光探针的DNA区域或RNA分子在染色体或其他细胞器中的定位。
中文名fish外文名fluorescent in situ hybridization建立时间1986年发展历程1969年,Pardue和John等两个研究小组开始采用放射性标记DNA或28S RNA发明了原位杂交技术(ISH)。
尽管当时原位杂交技术已经具有较高的特异性和灵敏度,但鉴于放射性同位素自身特性的局限,如安全性、空间分辨率低、不稳定性等问题,这项技术仅限于实验室研究方面的应用。
1986年科研工作者开始利用异硫氰酸盐荧光素来标记探针,并在荧光显微镜下进行观察分析,建立了荧光原位杂交技术(FISH)。
1989年,Delong首次使用荧光标记寡核苷酸探针检测单个微生物细胞。
由于FISH技术具有敏感度高、信号强、背景低、快速等优点,该方法在环境微生物的检测中得到了广泛的应用。
随着科技的迅速发展,FISH探针标记物越来越多,不仅从单一荧光发展到多色荧光检测,而且应用范围也进一步扩大,不仅可以用于分裂相细胞而且可以用于间期细胞检测,为FISH技术的临床应用打下了坚实的基础。
操作步骤编辑播报(1)样品的固定;(2)样品的制备和预处理;(3)预杂交;(4)探针和样品变性;(5)用不同的探针杂交以检测不同的靶序列;(6)漂洗去除未结合的探针;(7)检测杂交信号,进行结果分析·荧光信号观察:将处理好的样品置于荧光显微镜下,选择分散较好的区域来观察。
三色(或者更多)荧光激发下,观察到不同颜色的荧光图像。
通常选用20X物镜来扫描样品杂交区域,40X或100X物镜下观察样品,从一定的方向进行计数,并对计数情况进行分析。
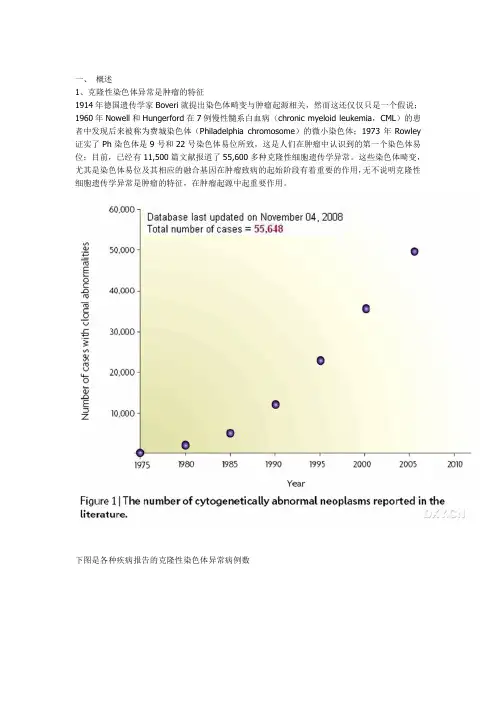
一、概述1、克隆性染色体异常是肿瘤的特征1914年德国遗传学家Boveri就提出染色体畸变与肿瘤起源相关,然而这还仅仅只是一个假说;1960年Nowell和Hungerford在7例慢性髓系白血病(chronic myeloid leukemia,CML)的患者中发现后来被称为费城染色体(Philadelphia chromosome)的微小染色体;1973年Rowley 证实了Ph染色体是9号和22号染色体易位所致,这是人们在肿瘤中认识到的第一个染色体易位;目前,已经有11,500篇文献报道了55,600多种克隆性细胞遗传学异常。
这些染色体畸变,尤其是染色体易位及其相应的融合基因在肿瘤致病的起始阶段有着重要的作用,无不说明克隆性细胞遗传学异常是肿瘤的特征,在肿瘤起源中起重要作用。
下图是各种疾病报告的克隆性染色体异常病例数2、染色体异常的常见类型染色体异常指数目异常和结构异常两类:前者包括整条染色体数目的扩增和缺失;后者包括染色体易位、插入、倒置、区带的缺失或扩增等。
下图是染色体数目异常染色体结构异常3、染色体异常的检测方法染色体异常的识别得益于二十世纪六十年代后发展起来的胰蛋白酶-姬姆萨染色和常规显带技术,使得常规筛查全基因组染色体异常和检测染色体核型改变成为可能。
染色体显带是细胞遗传学分析技术中标准和常用的方法,但耗时且依赖于获得良好的分裂相,还难于分析复杂和隐匿的异常。
PCR或荧光原位杂交(FISH,fluorescent in situ hybridization)对染色体异常的检出依赖于引物或探针与模板的结合,因此较常规显带具有更高的特异性,是高通量检测染色体异常的敏感和特异的方法。
二、荧光原位杂交及其探针1、荧光原位杂交的原理染色体荧光原位杂交始于传统的细胞遗传学和DNA技术的结合,这种结合开创了一门新的学科——分子细胞遗传学。
其基础是Southern blot原理,以半抗原如生物素、地高辛间接标记或以荧光素直接标记的已知核酸分子为探针,探针和靶序列双链DNA变性后杂交,互补的异源单链DNA分子在适宜的温度和离子强度下退火形成稳定的异源双链DNA,通过荧光标记的亲和素或抗地高辛抗体将半抗原显示出来,通过荧光显微镜观察杂交信号。


荧光原位杂交荧光原位杂交(Fluorescence in situ hybridization,FISH)是一种分子生物学技术,可以用来检测DNA或RNA序列的存在、位置和数量。
该技术通常使用荧光染料标记DNA或RNA的探针来识别特定的序列。
在荧光原位杂交中,常常使用单链DNA或RNA的Oligonucleotide探针。
探针的序列与待检测样品中的特定DNA或RNA序列互相互补,使得探针和样品DNA或RNA序列可以杂交在一起。
探针可以被标记成许多不同的荧光染料,如荧光素、罗丹明等,以使得检测到的探针可根据颜色进行区分。
荧光原位杂交过程包括以下步骤:1. 选择合适的探针。
选择的探针实际上就是一个人工合成的核酸分子,其长度在20-200bp不等,可以与靶序列DNA或RNA中的任意位置相互匹配,检测的种类也包括基因、病毒、染色体等。
2. 标记探针。
标记探针是指把荧光染料等标记物与探针进行化学共价修饰,使之形成标记的探针,标记的探针使用单染色荧光或双染色荧光。
3. 处理样品。
把检测样品进行前处理、处理固定等。
4. 杂交。
把标记的探针打入处理好的样品中,如细胞、组织、染色体等,探针就会与相应的靶分子发生杂交,然后把样品用适当的盐洗。
5. 检测结果。
通过荧光显微镜进行探针的显示,可以看到细胞核内亮相区域,确定靶序列的定位和相应的染色体编号,并可以通过比较实验组和对照组的信号强度,得到目标序列的数量和比例。
荧光原位杂交在基因检测、疾病诊断、癌症诊断和治疗中都有广泛应用。
在基因诊断中,荧光原位杂交可以检测微观缺失、染色体重排列和染色体数目异常等,具有高准确度、高敏感度、高特异性和可显性等特点。
在肿瘤诊断和治疗中,荧光原位杂交是一种高效而准确的技术,可以评估患者的病情、选择合适的治疗方案,预测预后。
因此,荧光原位杂交在生命科学研究和医学诊断中的应用前景非常广阔。

荧光原位杂交技术(FISH)在产前诊断中的应用一直备受关注。
近年来,随着该技术在临床实践中的不断深入和发展,专家共识也逐渐形成。
在本文中,将从深度和广度上对荧光原位杂交技术在产前诊断中的专家共识进行全面评估,并撰写一篇有价值的文章,以便读者能更深入地理解这一领域的最新进展和专家观点。
1. 荧光原位杂交技术概述- 荧光原位杂交技术是一种基于DNA的细胞遗传学技术,能够定位和检测细胞中特定DNA序列的存在和定位。
该技术通过使用标记了荧光物质的探针,使得特定的DNA序列在细胞或组织的显微镜下呈现出荧光信号,从而实现对细胞遗传信息的定量和定位检测。
在产前诊断中,荧光原位杂交技术能够用于检测胎儿染色体异常、基因突变等遗传性疾病,具有高灵敏度和特异性的优势。
2. 专家共识的形成- 随着荧光原位杂交技术在产前诊断中的广泛应用,越来越多的专家学者参与其中,并在临床实践和科研工作中积累了大量的经验和数据。
通过学术会议、专家讨论会、文献研究等形式,专家们逐渐达成了对荧光原位杂交技术在产前诊断中应用的共识。
这些共识涵盖了该技术的临床适应症、操作规范、质控要求、结果解读等方面,为该领域的规范化和标准化提供了重要指导。
3. 专家共识的内容和意义- 在产前诊断中,荧光原位杂交技术的专家共识主要包括对该技术的临床应用范围和标准化操作流程的制定。
专家们一致认为,该技术在胎儿染色体异常、染色体结构异常、基因突变等方面具有重要应用意义,可以为胎儿遗传疾病的早期筛查和诊断提供可靠依据。
专家共识还对该技术的样本采集、实验操作、结果解读等方面提出了具体要求,以确保临床应用的准确性和可重复性。
4. 个人观点和理解- 就我个人来说,我认为荧光原位杂交技术在产前诊断中的应用具有重要的临床意义和发展前景。
通过该技术,我们可以更准确地了解胎儿遗传信息,及时发现和诊断潜在的遗传疾病,为家庭和社会减少遗传疾病的发病率和负担提供了可能。
专家共识的形成也为该技术在临床实践中的标准化和规范化提供了重要支持,有助于推动该领域的进一步发展和应用。


荧光原位杂交荧光原位杂交(FluorescenceInSituHybridization,FISH)是一种非常有效的分子生物学技术,用于检测DNA或RNA位点特异性引物与目标序列的杂交,从而直接识别和定位某些具体的DNA序列或RNA序列。
它可以用于细胞内检测和定位指定片段的序列特异性,以及在细胞间,组织切片中检测特定的基因等。
FISH技术最初由美国科学家Edward T. Krick在1980年发展出来,之后又发展出多种改良的技术,如碱基特异性FISH(DNA-FISH)、RNA固定FISH(RNA-FISH)、组织芯片FISH(Tissue Chip FISH)、荧光原位杂交芯片技术(FISH Chip)及基于ROMA的荧光原位杂交(ROMA-FISH)等。
荧光原位杂交技术可以用于研究和检测多种特定的基因或序列,这些基因或序列可能具有调节多种生物过程的功能,如细胞分化、细胞扩增、细胞凋亡、表达特定基因、或影响基因组稳定性,如癌症和其他遗传性疾病等。
FISH技术主要用于检测和定位染色体位点、染色体重组、非特异性和特异性的序列变异,还可以用于诊断疾病、研究发育分化等生物学过程。
荧光原位杂交技术的基本原理是:荧光探针的核酸碱基特异性与目标序列中的碱基结合形成杂交结合物,然后荧光探针发出特定的荧光信号,从而识别和定位目标序列。
FISH技术可以用不同的荧光探针显示出各种不同的颜色,从而检测不同的特定序列。
由于它的高灵敏度和特异性,FISH技术在临床诊断、癌症研究、多基因组学研究和其他生物学研究中得到了广泛应用。
荧光原位杂交技术的具体实施方法包括:(1)设计荧光探针,将其碱基特异性的序列选择性地与目标序列结合;(2)改变荧光探针的位置,使其较为精确地和目标序列结合;(3)观察荧光探针和目标序列结合后所产生的特征荧光信号;(4)对荧光信号进行识别和定位,以及与荧光探针的结合强度等进行估计。
荧光原位杂交技术的应用已经扩展到更多领域,如Karyotyping、FACS Analysis、Flow Cytometry、Chromatin Immunoprecipitation (ChIP)、分子影像学(Molecular Imaging)和系统生物学(Systems Biology)等,它们都是用于研究疾病,以及有助于对疾病的诊断和治疗提供依据的技术。

荧光原位杂交技术(fish)的基本原理和应用理论说明1. 引言1.1 概述荧光原位杂交技术(Fluorescence in situ Hybridization,简称FISH)是一种广泛应用于生物学研究的重要技术。
它通过在细胞或组织水平上定位和检测特定DNA或RNA序列的分布情况,可以提供关于基因组结构、功能和表达的有价值信息。
该技术最早于20世纪80年代被开发出来,并且经过不断改进与扩展,如今已成为分子生物学研究中不可或缺的工具之一。
1.2 文章结构本文将首先介绍荧光原位杂交技术的基本原理,包括DNA探针的选择与设计、杂交反应条件的优化以及检测与可视化方法。
然后,我们将深入探讨荧光原位杂交技术在生物医学研究领域、植物遗传研究领域和动物进化研究领域的应用实例。
接下来,我们将评述荧光原位杂交技术的优势与局限性,包括其高灵敏度、高分辨率等优势以及对样本处理要求高、无法确定基因功能等局限性。
最后,我们将给出结论并展望荧光原位杂交技术的未来发展方向。
1.3 目的本文的目的是系统地介绍荧光原位杂交技术的基本原理和应用领域,以帮助读者深入了解这一重要技术。
通过阅读本文,读者将能够全面了解荧光原位杂交技术在生物学研究中的作用和意义,并对该技术的优势与局限性有所了解。
此外,本文也将探讨该技术未来可能的发展方向,为读者提供展望与思考。
2. 荧光原位杂交技术基本原理:2.1 DNA探针的选择与设计:荧光原位杂交技术(FISH)是一种利用DNA或RNA分子作为探针,通过特异性互补配对识别和定位目标序列的方法。
在进行FISH实验时,首先需要选择合适的DNA探针。
DNA探针通常由由人工合成的寡聚核苷酸(oligonucleotide)或从天然来源提取得到的全长DNA片段构建而成。
选择DNA探针时,需要考虑以下因素:首先是目标序列的特异性,即该序列在待检测样品中是否具有较高的丰度,并且只存在于感兴趣的目标区域中。
其次是探针长度和两个主要互补区域之间核苷酸序列的碱基组成比例。

荧光原位杂交-更新荧光原位杂交(Fluorescence in situ hybridization,FISH)是一种基于DNA分子杂交技术,可以用于研究细胞核内DNA序列的空间分布,基因表达与功能等问题的一种重要方法。
相比于传统的DNA杂交方法,荧光原位杂交具有高灵敏度、高特异度、高分辨率、无需PCR扩增等优点,被广泛应用于在形态学及遗传水平对真核生物的相关研究。
本文将介绍荧光原位杂交的原理、方法和应用。
一、原理荧光原位杂交的原理是利用标记有荧光染料(如荧光素、rhodamine等)的DNA探针与待检测样品(常为细胞核、染色体、tissue或者section等)中的目标DNA特异性结合,形成稳定的探针-靶DNA杂交物,通过检测荧光发射信号的方法来确定目标DNA序列的位置和数量。
探针的设计是荧光原位杂交成功的关键,因为它们必须具有真确的互补性,绑定到目标DNA的特定区域上。
如何选择探针的特异性,通常取决于所要研究的问题,例如检测某一基因的副本数,探测非编码RNA,或发现肿瘤细胞中的染色体异常等。
二、方法1. 获取样品荧光原位杂交技术所需的样品通常以细胞核或组织切片的形式存在,依据所要研究的问题,通过相应方法处理,如:细胞核的分离、组织的固定剂的处理、剪切不同的组织块、制备Paraffin等经典样品处理方法。
2. 样品前处理对于切片和细胞各种杂质如化学物质、染料、蛋白质等的影响,靠的是样本的处理方法。
主要有以下几种:1) 催化游离的核酸:这一步的主要目的是去除待测样品中的核酸,包括double-stranded 的DNA和single-stranded的RNA。
当使用非常规杂交试剂或非常规探针(如bacterial artificial chromosome、cosmid probe)时,可能需要使用一些高效的去掉毛糙杂质的试剂。
2) 前处理(预处理):固定、脱水、变性、去除RNA、去除单链DNA(ssDNA)、吉姆萨染色、荧光染色、脱色剂去除等多项操作。

荧光原位杂交目录1荧光原位杂交2荧光原位杂交(FISH)技术详解3荧光原位杂交技术的发展历程1荧光原位杂交简介荧光原位杂交方法是一种物理图谱绘制方法,使用荧光素标记探针,以检测探针和分裂中期的染色体或分裂间期的染色质的杂交。
荧光原位杂交(fluorescence in situ hybridization, FISH)是在20世纪80年代末在放射性原位杂交技术的基础上发展起来的一种非放射性分子细胞遗传技术,以荧光标记取代同位素标记而形成的一种新的原位杂交方法,探针首先与某种介导分子(reporter molecule)结合,杂交后再通过免疫细胞化学过程连接上荧光染料.FISH的基本原理是将DNA(或RNA)探针用特殊的核苷酸分子标记,然后将探针直接杂交到染色体或DNA纤维切片上,再用与荧光素分子偶联的单克隆抗体与探针分子特异性结合来检测DNA序列在染色体或DNA纤维切片上的定性、定位、相对定量分析.FISH具有安全、快速、灵敏度高、探针能长期保存、能同时显示多种颜色等优点,不但能显示中期分裂相,还能显示于间期核.同时在荧光原位杂交基础上又发展了多彩色荧光原位杂交技术和染色质纤维荧光原位杂交技术.。
应用背景对于利用rRNA的荧光原位杂交来说,如下原因可导致较低的荧光信号强度:较低的细胞核糖体含量较低的细胞周边的通透性较低的目标序列可接触性(由于rRNA的折叠产生的构象,有些位置与rRNA分子内其他链或其他rRNA或蛋白紧密接触,从而使探针无法和目标序列杂交)为检验细胞中的目标序列是否容易被探针杂交,及测试最佳杂交温度,可利用“克隆荧光原位杂交”(clone-FISH)进行试验:将rRNA基因结合入质粒,转化至大肠杆菌中表达,构成核糖体,再用荧光标记的探针杂交。
FISH可与流式细胞术联用,对特定荧光标记的细胞进行计数或者分离。
[1]变体酶联荧光原位杂交(CARD-FISH)2荧光原位杂交(FISH)技术详解1974年Evans首次将染色体显带技术和染色体原位杂交联合应用,提高了定位的准确性。
端粒绝对长度荧光原位杂交端粒绝对长度荧光原位杂交是一种用于测量染色体末端端粒的方法。
端粒是染色体末端的重要结构,它们在维持染色体的稳定性和功能方面起着关键作用。
端粒绝对长度的测量可以提供有关细胞老化、癌症发展和干细胞功能的重要信息。
在这篇文章中,我们将探讨端粒绝对长度荧光原位杂交的原理、技术和在科学研究中的应用。
端粒绝对长度荧光原位杂交的原理是基于原位杂交的技术。
它使用与端粒DNA互补的荧光标记的探针与细胞中的端粒DNA结合,通过荧光显微镜观察和测量。
这种方法可以提供与其他已有方法不同的优势,例如,它对单个细胞进行测量,可以提供更准确和细致的端粒测量结果。
在进行端粒绝对长度荧光原位杂交前,首先需要制备与端粒DNA互补的荧光标记的探针。
这些探针可以通过合成DNA序列和荧光染料标记的方法制备而成。
然后,将这些探针与细胞进行杂交反应,在适当的条件下,使探针与端粒DNA结合。
之后,使用荧光显微镜对样本进行观察,并使用相应的图像分析软件进行端粒的测量和分析。
端粒绝对长度荧光原位杂交不仅可以提供端粒绝对长度的测量,还可以用于观察端粒的结构和形态变化。
通过在不同细胞类型、组织类型以及不同生理条件下进行端粒绝对长度的测量,可以比较不同样本之间的端粒长度差异,进而研究细胞老化、发育过程以及癌症发展等相关问题。
在科学研究中,端粒绝对长度荧光原位杂交有着广泛的应用。
例如,在细胞老化研究中,测量细胞端粒绝对长度的变化可以提供有关细胞老化过程的重要信息。
此外,它还被用于研究不同癌症类型的细胞端粒长度以及其与癌症进展的关系。
此外,由于干细胞具有较长的端粒,端粒绝对长度荧光原位杂交也被用于研究干细胞的功能和特性。
总之,端粒绝对长度荧光原位杂交是一种重要的技术,用于测量染色体末端的端粒。
它可以提供有关细胞老化、癌症发展和干细胞功能的重要信息。
在科学研究中,它已被广泛应用于各个领域,并取得了重要的研究进展。
随着技术的进一步发展,端粒绝对长度荧光原位杂交将继续在生命科学领域中发挥重要作用,并为我们深入了解染色体的端粒结构和功能提供更多的机会。