二组分系统气液平衡相图的绘制(含数据)
- 格式:doc
- 大小:99.00 KB
- 文档页数:5

双液系的气-液平衡相图一、实验目的1.掌握采用阿贝折光率仪确定二元液体组成的方法;2.掌握测定双组份液体的沸点及正常沸点的方法;3.绘制在恒压下环己烷-乙醇双液系的气-液平衡相图。
二、实验原理两种液态的物质混合而成的二组分体系称为双液系。
它可以分为完全互溶和部分互溶的双液系。
体系的沸点不仅与外压有关,而且与双液系的组成有关。
在恒压下做温度T对组成x的关系图即为T-x图。
由相律可知,对于双液系在恒压下气-液两相共存区域中,自由度为1。
当温度一定时,气-液两相的相对组成也就有了确定值。
根据杠杆原理,两相的相对量也确定了。
因此实验测定一系列不同组成的双液系溶液的气-液相平衡时的沸点及此时气相和液相的组成,即可得T-x图。
因此双液系气-液平衡相图实验主体上包括一系列混合体系的沸点测定和气-液相组成分析两个主要内容。
体系的沸点可用沸点仪测定的,其构造如图7.2所示。
采用电热丝直接加热溶液,以防止过热现象,同时该沸点仪用平衡蒸馏法分离气液两相,具有可便于取样分析及避免分馏等优点。
体系的气液相组成的分析是相图绘制的另一核心,可以根据待测体系的理化性质寻找多种合适的分析方法。
以完全互溶双液系环己烷-乙醇体系为例。
由于环己烷和乙醇两者的折光率相差较大,因此本实验可采用测定溶液折光率方法来确定两组分的组成,用阿贝折光仪测定两组分组成的折光率,可以测出折光率对组成的工作曲线,根据测得液体样品的折光率,从工作曲线上可查得两相的组成。
三、仪器与药品FDY双液系沸点测定仪,阿贝折光仪,超级恒温槽,长滴管,烧杯(50ml,250ml),具塞锥形瓶(10ml),刻度移液管(5ml)丙酮(AR级);环己烷(AR级);乙醇(AR级)图7-1FDY双液系沸点测定仪前面板示意图图7-1是沸点仪加热控制器的前面板示意图,各功能键的说明如下:1、电源开关2、加热电源调节调节所需的加热电源。
3、温度显示窗口显示所测温度值。
4、电压显示窗口显示加热输出电压值。

双液体系气—液平衡相图的绘制一、实验目的1. 绘制环己烷—异丙醇双液体系的沸点组成图,确定其恒沸组成和恒沸温度。
2. 掌握回流冷凝管法测定溶液沸点的方法。
3.掌握阿贝折射仪的使用方法。
二、实验原理两种液体物质混合而成的两组分体系称为双液系。
根据两组分间溶解度的不 同,可分为完全互溶、部分互溶和完全不互溶三种情况。
两种挥发性液体混合形成完全互溶体系时,如果该两组分的蒸气压不同,则混合物的组成与平衡时气相的组成不同。
当压力保持一定,混合物沸点与两组分的相对含量有关。
恒定压力下,真实的完全互溶双液系的气-液平衡相图(T -x ),根据体系对拉乌尔定律的偏差情况,可分为3类:(1)一般偏差:混合物的沸点介于两种纯组分之间,如甲苯-苯体系,如图 (a)所示。
(2)最大负偏差:存在一个最小蒸汽压值,比两个纯液体的蒸汽压都小,混合物存在着最高沸点,如盐酸—水体系,如图 (b)所示。
(3)最大正偏差:存在一个最大蒸汽压值,比两个纯液体的蒸汽压都大,混合物存在着最低沸点如图 (c))所示。
上图为二组分真实液态混合物气—液平衡相图(T-x 图)t At AtAt Bt B t Bt / o Ct / o t / o x Bx Bx BABAABB(a)(b)(c)x 'x '后两种情况为具有恒沸点的双液系相图。
它们在最低或最高恒沸点时的气相和液相组成相同,因而不能象第一类那样通过反复蒸馏的方法而使双液系的两个组分相互分离,而只能采取精馏等方法分离出一种纯物质和另一种恒沸混合物。
为了测定双液系的T-x相图,需在气-液平衡后,同时测定双液系的沸点和液相、气相的平衡组成。
本实验以环己烷-异丙醇为体系,该体系属于上述第三种类型,在沸点仪中蒸馏不同组成的混合物,测定其沸点及相应的气、液二相的组成,即可作出T -x相图。
本实验中两相的成分分析均采用折光率法测定。
三、仪器与试剂1、仪器:沸点仪1台;调压变压器1台;阿贝折射仪1台;温度计(0-100℃) 1支;长滴管1个;短滴管2支;2、试剂:环己烷(分析纯);异丙醇(分析纯)异丙醇—环己烷标准溶液(异丙醇分别为0.20,0.40,0.50,0.60,0.80,0.90)四、主要实验步骤1. 测定环己烷、异丙醇及标准溶液的折射率调节阿贝折射仪,用一支干燥的短滴管吸取环己烷数滴,注入折射仪的加液孔内,测定其折射率n,读数两次,取其平均值。





二组分气液平衡相图实验报告实验目的,通过实验,掌握二组分气液平衡相图的测定方法和实验技术。
实验原理,在一定温度下,将两种组分的混合物置于容器中,通过调节温度和压力,观察和记录气液相变的情况,最终绘制出气液平衡相图。
实验仪器,实验中所用的仪器有压力计、温度计、气液平衡相图测定装置等。
实验步骤:
1. 将两种组分混合物置于气液平衡相图测定装置中,调节温度和压力;
2. 观察和记录气液相变的情况,包括气液相变的压力和温度值;
3. 根据记录的数据,绘制出气液平衡相图。
实验结果与分析:
通过实验测定和数据处理,得到了二组分气液平衡相图。
在图中,我们可以清晰地看到气相和液相的边界,以及气液相变的压力和温度值。
根据相图的形状和数据分析,我们可以得出一些结论和规律。
实验结论:
1. 随着温度的升高,气相区域逐渐扩大,液相区域逐渐缩小;
2. 随着压力的升高,气相区域逐渐扩大,液相区域逐渐缩小;
3. 在一定温度下,压力越大,气相区域越大,液相区域越小;
4. 在一定压力下,温度越高,气相区域越大,液相区域越小。
实验总结:
通过本次实验,我们掌握了二组分气液平衡相图的测定方法和实验技术,了解了气液相变的规律和特点。
同时,也加深了对相图的理解和应用,为今后的实验和研究工作打下了坚实的基础。
结语:
二组分气液平衡相图实验是化学实验中的重要内容,通过本次实验,我们不仅学会了实验操作技巧,更重要的是对气液平衡相图有了更深入的理解。
希望通过今后的学习和实践,能够更好地运用这些知识,为科学研究和工程应用做出贡献。
二组分系统气液平衡相图的绘制一实验目的1.确定不同组成的环己烷——乙醇溶液的沸点及气、液两相的平衡浓度,由此绘制其沸点组成图。
2.掌握阿贝折射仪的原理及使用方法。
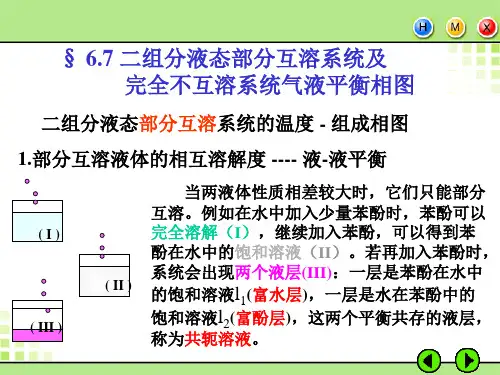
二实验原理本实验用回流冷凝法测定不同浓度的环己烷——乙醇溶液的沸点和气、液两相的组成,从而绘制T----x图。
下图为环己烷——乙醇的沸点组成图的大致形状,ADC和BEC为气相线,AD´C和BE´C 为液相线。
体系总组成为x的溶液开始沸腾时,气象组成为y ,继续蒸馏,气相量增加,液相量减少(总量不变),溶液温度上升,回流作用,控制了两相的量一定,沸点一定。
此时,气相组成为y´,与其平衡的液相组成为x´,体系的平衡沸点为t沸,此时气液两相服从杠杆原理。
当压力一定时,对两相共存区进行相律分析:独立组分K=2,相数P=2,则自由度f=K-P+1=2-2+1=1即有,体系温度一定,则气液两相成分确定。
总量一定时,亮相的量也一定。
在一实验装置中,控制气液两相的相对量一定,使体系温度一定,则气液组成一定。
用精密温度计可以测出平衡温度,取出气液两相样品测定其折射率可以求出其组成。
折射率和组成有一一对应关系,可以通过测定仪系列已知组成的样品折射率,绘出工作曲线。
测出样品就可以从工作曲线上找到未知样品的组成。
三仪器与药品仪器:阿贝折射仪、超级恒温槽、蒸馏瓶、调压变压器、1/10℃刻度温度计、25ml移液管一支、5ml、10ml移液管各两支、锥形瓶四个、滴管若干支药品:环己烷、乙醇、丙酮四实验步骤1.工作曲线的测定把超级恒温槽调至25℃,连接好恒温槽与阿贝折射仪,使恒温水流经折射仪。
准确配制下列溶液,测定纯环己烷,乙醇和下列溶液的折射率,并测定溶液温度。
环己烷 1 2 3 4ml乙醇 4 3 2 1ml2.测定环己烷的沸点按图装好仪器,调压变压器调至最小,将25ml苯加入蒸馏瓶,打开冷凝水,接通电源,缓慢增加电压,加压至12~16V,加压至液体沸腾使,记下温度稳定值。

实验四双液系气液平衡相图的绘制姓名:谭成彬班级:生物工程学院生物工程07级四班学号;07041010428一、实验目的1.测定常压下环己烷—乙醇二元系统的气液平衡数据,绘制沸点—组成相图。
2.掌握双组份沸点的测定方法,通过实验进一步理解分馏原理。
3.掌握阿贝斯折射仪的使用方法。
二、实验原理两种液体物质混合而成的两组分体系称为双液系。
根据两组间分溶解度不同,可分为完全互溶、部分互溶和完全不互溶三种情况。
两种挥发性液体混合成完全互溶体系时,如果该两组分的蒸汽压不同,则混合物的组成于平衡的气相的组成不同。
当压力保持一定,混合物沸点与两组分的含量有关。
恒定压力下,真实的完全互溶双液系的气—液平衡相图(T—x图),根据体系对拉乌尔的偏差情况,可分为三类:1)一般偏差:混合物的沸点介于两种纯组分之间,如果苯—苯体系,如图1(a)所示。
2)最大负偏差:混合物存在最高沸点,如盐—水体系,如图1(b)所示。
3)最大正偏差:混合物纯在最低沸点,如正丙醇—水体系,如图1(c)所示。
(a) (b)(c)图1 二组分也太混合物气——液平衡相图(T—x图)对于后两种情况,为具有沸点的双系相图。
他们爱最高或最低衡沸点时气相和液相组成相同,因而不能像第一类那样通过反复蒸馏的方法而使双液系的两个组分分离,而只能采取精馏扥那个方法分离出一种纯物质和另一种衡沸混合物。
为了测定双液系的T—x图,需要在气—液平衡后,同时测定双液系的沸点和液相、气相的平衡组成。
本实验一环己烷—乙醇为体系,该体系属于上述第三类型,在沸点仪中蒸馏不同组成的混合物,、液二相组成,即可作出T—x 相图。
本实验气液两相的组成均采用折光率测定。
折光率是物质的一个特征数值,天宇物质的浓度计温度有关,因此在测定物质的折光率是要求温度恒定。
溶液的浓度不同、组成不同,折光率也不同,因此可先配制一系列已知组成的溶液,在恒定温度下扯其折光率,作出折光率—组成曲线,便可通过折光率的大小在工作曲线上找出未知溶液的组成。
22二组分理想混合物的气液平衡相图鉴于理想液体混合物中的组分都遵守Raoult 定律,这种混合物的气液平衡相图是可以通过计算得到的,它是各种实际气液平衡相图研究的基础。
本专题便来介绍这种模型混合物的气液平衡相图,并从中引出杠杆规则等重要的概念。
1. 相律分析对于一个二组分气液平衡系统,若两个组分间没有化学反应,也没有其他独立的限制条件,则由相律可得系统的自由度为:πππ−=−−+−=′−−+−=400222R R K F (22-1)由于系统至少有一个相,自由度最多等于3。
这就是说,要构作二组分气液平衡相图需要三个坐标,是一个T 、p 、B x 或B y 的三维立体图。
然而,为了简单和易读,人们常常使其中一个强度性质保持不变,而去表示其它两者的关系,从而将立体相图变成两个平面相图。
例如,在T 保持不变的条件下,构作B x 或B y 与p 的关系图,此图称为恒温相图。
或者,也可在保持p 不变的条件下,构作B x 或B y 与T 的关系图,此图称为恒压相图。
因此,所有二组分气液平衡系统,都可有两个平面相图。
2. 恒温相图专题17已述,理想混合物中的所有组分,在任意温度和压力下,都遵守Raoult 定律。
如果气液平衡时气相压力较低,则可得总压B *B B *A B A )1(x p x p p p p +−=+= (22-2)AB *A B p p p p x −−= (22-3) 式(22-3)便是液相组成B x 与压力p 的关系式。
式中*A p 、*B p 分别为两个纯组分的饱和蒸气压,对于确定的系统,在指定的温度下是两个常数。
不难看出,式(22-2)是一个线性关系,在图22-1所示的恒温相图中,是一条直线(如实线所示),它称为液相线。
又因气相中组分B 的平衡分压可由下式表示B *B B B x pp p p y == (22-4) 故将式(22-3)代入式(22-4),可得)()(*A *B *A *B B p p p p p p y −−= (22-5)式(22-5)便是气相组成B y 与压力p 的关系式。
二组分完全互溶系统的气——液平衡相图周韬摘要:测定了乙醇--环己烷完全互溶系统的气--液平衡相图。
在相图上,以环己烷占互溶系统的摩尔含量作为横坐标,以混合物的沸点为纵坐标,分别从分析纯的乙醇出发和分析纯的环己烷出发,制作出完整的混合溶液相图。
实验中通过控制压力相等的条件测定相图需要的各项数据,混合物溶液各组分的含量利用折光率不同来确定。
实验结果与理论值能够很好的符合。
关键词:相律;折射率;沸点。
1 前言许新华,王晓岗,刘梅川等人的“双液系气液平衡相图实验的新方法研究”①中讨论了自制工作曲线和引用文献数据的优良,由于实验环境等因素的影响,文献值之间也会有差别,所以文献数据并不能很好地反映真实情况,而自制工作曲线由于溶液配制时会挥发,准确浓度的溶液配制又有难度。
另一方面气相测折光率确定组分是,由于气相冷凝液非常少,难以进行平行测定,偶然误差比较大。
他们在文献中提到的解决办法是,用气相色谱法是进行微量样品分析。
借鉴气相色谱实验定量配制混合样品的方法,比较精确地配制出乙醇-环己烷标准组成溶液。
对最后得出的实验数据用Origin 处理得到如下的工作曲线(图1):进行实验时,由于器材和时间的限制,我们采用直接引用文献数据和测定折光率的方式。
最后的数据进行温度校正之后作图,得到的工作曲线依然可以很好地和文献相吻合。
2实验部分 2.1原理两种液态物质若能以任意比例混合,则称为二组分完全互溶混合物系统。
当其蒸气压与外压相当时,溶液就会沸腾,此时的温度称为沸点,沸腾的溶液也产图 1 文献的工作曲线生了气相和液相两种相数。
在一定压力下,二组分完全互溶混合物系统的沸点可能有三种情况:①混合物的沸点介于两种纯液体的沸点之间,这种混合物,气液两项的组成不同,可以通过精馏使系统的两个组分完全分离开;②混合物有沸点极大值;③混合物有沸点极小值。
②、③两种由于实际系统严重偏离了拉乌尔定律,②项负偏差很大,在相图上有沸点极大值,③项的正偏差很大,会产生沸点极小值,后面两种混合物情况,难以用精馏的方式将两种液体分离开②。
二组分系统气液平衡相图的绘制
一实验目的
1.确定不同组成的环己烷——乙醇溶液的沸点及气、液两相的平衡浓度,由此绘制其沸点组成图。
2.掌握阿贝折射仪的原理及使用方法。
二实验原理
本实验用回流冷凝法测定不同浓度的环己烷——乙醇溶液的沸点和气、液两相的组成,从而绘制T----x图。
下图为环己烷——乙醇的沸点组成图的大致形状,ADC和BEC为气相线,AD´C和BE´C 为液相线。
体系总组成为x的溶液开始沸腾时,气象组成为y ,继续蒸馏,气相量增加,液相量减少(总量不变),溶液温度上升,回流作用,控制了两相的量一定,沸点一定。
此时,气相组成为y´,与其平衡的液相组成为x´,体系的平衡沸点为t沸,此时气液两相服从杠杆原理。
当压力一定时,对两相共存区进行相律分析:独立组分K=2,相数P=2,则自由度f=K-P+1=2-2+1=1
即有,体系温度一定,则气液两相成分确定。
总量一定时,亮相的量也一定。
在一实验装置中,控制气液两相的相对量一定,使体系温度一定,
则气液组成一定。
用精密温度计可以测出平衡温度,取出气液两相样品
测定其折射率可以求出其组成。
折射率和组成有一一对应
关系,可以通过测定仪系列已知组成的样品折射率,绘出
工作曲线。
测出样品就可以从工作曲线上找到未知样品的
组成。
三仪器与药品
仪器:阿贝折射仪、超级恒温槽、蒸馏瓶、调压
变压器、1/10℃刻度温度计、25ml移液管一支、5ml、
10ml移液管各两支、锥形瓶四个、滴管若干支
药品:环己烷、乙醇、丙酮
四实验步骤
1.工作曲线的测定
把超级恒温槽调至25℃,连接好恒温槽与阿贝折
射仪,使恒温水流经折射仪。
准确配制下列溶液,测定纯环己烷,乙醇和下列
溶液的折射率,并测定溶液温度。
环己烷 1 2 3 4ml
乙醇 4 3 2 1ml
2.测定环己烷的沸点
按图装好仪器,调压变压器调至最小,将25ml苯加入蒸馏瓶,打开冷凝水,接通电源,
缓慢增加电压,加压至12~16V,加压至液体沸腾使,记下温度稳定值。
3.停止加热,按(1ml 2ml 4ml 5ml 7ml)次序加入乙醇
每次加完后,测其沸点及气、液两相的折射率,乙醇可以从支管加入,当温度稳定不变后,记下温度值。
停止加热,立即取出小槽中的气相样品测其折射率,然后取液相测定其折射率,要点是先气相后液相。
4.完成上述试验后,拔下电源插头,回收母液,再用电吹风吹干仪点仪,加入25ml乙醇,测其沸点,按(1ml 3ml 5ml 7ml 7ml)的次序加入环己烷,分别测其沸点及气液两相的折射率,然后拔下电源插头,一切恢复原状。
五.数据记录
室温:气压:
1.计算出标准溶液的质量百分数,做出折射率——组成图,即工作曲线。
由附表可知,乙醇的密度为0.789g/ml,环己烷的密度为0.778g/ml。
所以:环己烷%=v环己烷*p环己烷/(V环己烷*P环己烷+V乙醇*P乙醇)
2.作曲线的绘制
3.沸点组成图绘制
4.由沸点——组成图上求出最低恒沸点和恒沸混合物的组成。
由图像可知,最低恒沸点为59.81℃,
恒沸混合物组成为:环己烷质量百分数为61.17%
乙醇的质量百分数为38.83%.
六.关键操作和注意事项
1.由于蒸馏瓶中的气相外壁处在室温下,气相有精馏作用。
即高度不同,气相成分不同,在接近液面的气相组成比较正确,因此冷凝管的进气管应当尽量的低,或者下段气相加以保温。
盛气相样品的小槽有0.5ml已够,则可较快达到平衡。
但操作时,液面也不可过高,加热不可过猛,以免液沫进入气相样品中。
2.阿贝折射仪使用经验:
1)明暗分界线从上和从下趋向十字交点,其数值常不一致。
取两者的平均值,或所有测定,连同校准都从一个方向趋向十字交点,即可消除此项误差。
2)丙酮或其他易挥发性液体从棱镜上挥发后,棱镜温度有所降低,因此棱镜干燥后要和上一段时间或者样品加好后过一会再测。
3)由于气相样品(冷凝管)挥发性较大,量少,蒸发面大,只有在停止加热后迅速取样测定,才能气相组成的正确性。
至于液相,因为量多,挥发性小,很少发生不正常情况,故可从容测定。
4)用滴管取样,注意滴管的倾斜度,不要让样品流入橡皮帽。
七.思考与讨论
1.绘制工作曲线的目的是什么?
答:绘制工作曲线的目的是为了确定环己烷和乙醇不同质量比的条件下的折射率,好为沸点——组成图和找出最低恒沸点打基础。
2.每次加入乙醇及环己烷的量是否要求准确?
答:每次加入乙醇和环己烷的量可以不是很准确。
3.实验测得的沸点与标准大气压的沸点是否一致?
答:实验测得的沸点与标准大气压的沸点不一致。