5-2 配合物的晶体场理论
- 格式:ppt
- 大小:1.49 MB
- 文档页数:32


.配位化合物的价键理论配合物的晶体场理论一.配合物的构型与中心的杂化方式二中心杂化轨道的形成1. ns np nd 杂化1 个 4s 空轨道,3 个 4p 空轨道和2 个 4d 空轨道形成 sp3d2杂化轨道,正八面体分布。
6 个F-的 6 对孤对电子配入sp3d2空轨道中,形成正八面体构型的配合单元。
例 2 Ni(CO)4的成键情况在配体 CO 的作用下,Ni 的价层电子重排成 3d104s0形成 sp3杂化轨道,正四面体分布,4 个CO 配体与 sp3杂化轨道成配键,形成的 Ni(CO)4构型为正四面体。
例 1 和例 2 的相同点是,配体的孤对电子配入中心的外层空轨道, 即 ns np nd 杂化轨道, 形成的配合物称外轨型配合物. 所成的键称为电价配键. 电价配键不是很强.例 1 和例 2 的不同点是,CO 配体使中心的价电子发生重排,这样的配体称为强配体。
常见的强配体有 CO、 CN-、NO2-等;例1 中 F-不能使中心的价电子重排,称为弱配体。
常见的弱配体有 F-、Cl-、H2O 等。
而 NH3等则为中等强度配体。
对于不同的中心,相同的配体其强度也是不同的。
2. (n-1) d ns np 杂化例 3 讨论的成键情况形成 d2sp3杂化,使用 2 个 3d 轨道, 1 个 4s 轨道,3个4p 轨道。
用的内层 d 轨道。
形成的配离子为正八面体构型。
空出 1 个内层 d 轨道,形成 dsp2杂化轨道,呈正方形分布。
故构型为正方形。
例 3 和例 4 中,杂化轨道均用到了 ( n - 1 ) d 内层轨道,配体的孤对电子进入内层,能量低,称为内轨配合物,较外轨配合物稳定。
所成的配位键称为共价配键。
三价键理论中的能量问题内轨配合物稳定,说明其键能 E内大,大于外轨的 E外,那么怎样解释有时要形成外轨配合物呢?其能量因素如何?上面的例题中我们看到,形成内轨配合物时发生电子重排,使原来平行自旋的 d 电子进入成对状态,违反洪特规则,能量升高。





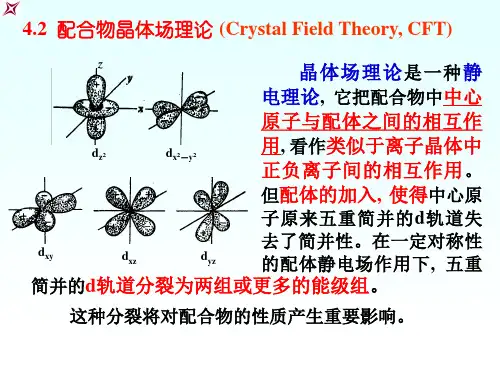
晶体场理论晶体场理论(英语:Crystal field theory,首字母縮略字:CFT)是配位化学理论的一种,1929-1935年由汉斯·贝特和约翰·哈斯布鲁克·范扶累克提出。
它以过渡金属配合物的电子层结构为出发点,可以很好地解释配合物的磁性、颜色、立体构型、热力学性质和配合物畸变等主要问题,但不能合理解释配体的光谱化学序列和一些金属有机配合物的形成。
晶体场理论将配位键看成纯离子键,着眼于中心原子的d轨道在各种对称性配位体静电场中的变化,简明直观,结合实验数据容易进行定量或半定量的计算。
但在实际配合物中,纯离子键或纯共价键都很罕见,目前配合物的结构理论兼有晶体场理论和分子轨道理论的精髓,称之为配位场理论。
[编辑]概述晶体场理论认为,配合物中心原子处在配体所形成的静电场中,两者之间完全靠静电作用结合,类似于正负离子之间的作用。
在晶体场影响下,五个简并的d 轨道发生能级分裂,d电子重新分布使配合物趋于稳定。
[编辑]能级分裂d原子轨道分为、、、和五种,其空间取向各不相同,但能级却是相同的,参见原子轨道。
在一定对称性的配体静电场(负)作用下,由于与配体的距离不同,d轨道中的电子将不同程度地排斥配体的负电荷,d轨道开始失去简并性而发生能级分裂。
能级分裂与以下因素有关:∙金属离子的性质;∙金属的氧化态,高氧化态的分裂能较大;∙配合物立体构型,即配体在金属离子周围的分布;∙配体的性质。
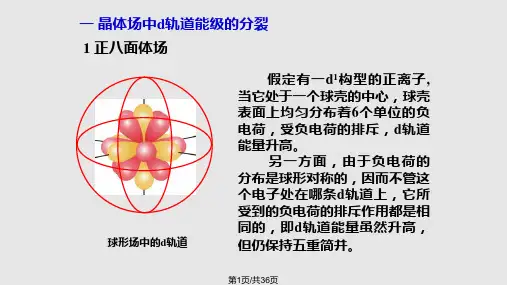
最常见的配合物构型为八面体,其中中心原子位于八面体中心,而六个配体则沿着三个坐标轴的正、负方向接近中心原子。
先将球形场的能级记为。
和轨道的电子云极大值方向正好与配体负电荷迎头相碰,排斥较大,因此能级升高较多,高于。
而、和轨道的电子云则正好处在配体之间,排斥较小,因此能级升高较小,低于。
因而d轨道分裂为两组能级:∙和轨道,能量高于,记为或轨道;∙、和轨道,能量低于,记为或轨道。
和是来自于群论的对称性符号。


.配位化合物的价键理论配合物的晶体场理论一.配合物的构型与中心的杂化方式二中心杂化轨道的形成1. ns np nd 杂化1 个 4s 空轨道,3 个 4p 空轨道和2 个 4d 空轨道形成 sp3d2杂化轨道,正八面体分布。
6 个F-的 6 对孤对电子配入sp3d2空轨道中,形成正八面体构型的配合单元。
例 2 Ni(CO)4的成键情况在配体 CO 的作用下,Ni 的价层电子重排成 3d104s0形成 sp3杂化轨道,正四面体分布,4 个CO 配体与 sp3杂化轨道成配键,形成的 Ni(CO)4构型为正四面体。
例 1 和例 2 的相同点是,配体的孤对电子配入中心的外层空轨道, 即 ns np nd 杂化轨道, 形成的配合物称外轨型配合物. 所成的键称为电价配键. 电价配键不是很强.例 1 和例 2 的不同点是,CO 配体使中心的价电子发生重排,这样的配体称为强配体。
常见的强配体有 CO、 CN-、NO2-等;例1 中 F-不能使中心的价电子重排,称为弱配体。
常见的弱配体有 F-、Cl-、H2O 等。
而 NH3等则为中等强度配体。
对于不同的中心,相同的配体其强度也是不同的。
2. (n-1) d ns np 杂化例 3 讨论的成键情况形成 d2sp3杂化,使用 2 个 3d 轨道, 1 个 4s 轨道,3个4p 轨道。
用的内层 d 轨道。
形成的配离子为正八面体构型。
空出 1 个内层 d 轨道,形成 dsp2杂化轨道,呈正方形分布。
故构型为正方形。
例 3 和例 4 中,杂化轨道均用到了 ( n - 1 ) d 内层轨道,配体的孤对电子进入内层,能量低,称为内轨配合物,较外轨配合物稳定。
所成的配位键称为共价配键。
三价键理论中的能量问题内轨配合物稳定,说明其键能 E内大,大于外轨的 E外,那么怎样解释有时要形成外轨配合物呢?其能量因素如何?上面的例题中我们看到,形成内轨配合物时发生电子重排,使原来平行自旋的 d 电子进入成对状态,违反洪特规则,能量升高。