金属的钝化
- 格式:ppt
- 大小:484.00 KB
- 文档页数:4







金属的钝化有的金属(或合金)由于受某些氧化剂作用后其表面状况发生了改变,使金属(或合金)的化学活动性大大降低,耐腐蚀性大大增强,这种现象称为金属的钝化。
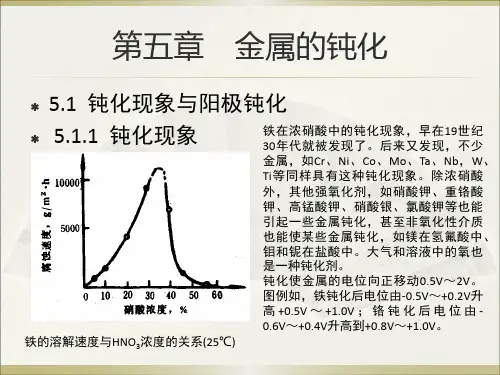
例如:Fe可与稀HNO3反应而溶解,但是,如果把Fe浸在密度大于1.25 g/cm3的浓HNO3中,铁却钝化而不溶。
Fe在浓HNO3中钝化后,不仅在稀HNO3中也不能再溶解,而且不能从铜盐(如CuSO4)溶液中置换出铜。
不仅铁,其它多种金属也可以发生钝化。
例如:Cr、Ni、Co、Mo、Al、Ta、Nb和W 等,其中最易钝化的金属是Cr、Mo、Al、Ni。
不仅硝酸,其它强氧化剂如浓H2SO4、氯酸、碘酸、重铬酸钾、高锰酸钾等,都可以使某些金属钝化,甚至空气中的氧气也能使有的金属(如Al、Cr等)钝化。
有许多因素能破坏钝化状态,或者阻止金属钝态生成。
将溶液加热或加入活性离子如Cl—、Br—、I—等和还原性气体如H2(特别在加热时)都能使钝态金属活化。
为什么金属会发生钝化现象?现在大多认为金属的钝化是由于金属跟介质作用而生成了一层极薄的肉眼看不见的保护膜的结果。
这层薄膜最经常的是金属的氧化物。
如铁与浓HNO3作用,铁表面被氧化成结构较复杂,组成为Fe8O11的氧化物。
这层氧化膜厚度是30×10-10~40×10-10m ,化学性质很不活泼,将Fe表面和介质完全隔绝,从而使铁处于钝态。
某些金属的钝化也可由阳极氧化来实现。
阳极氧化是将金属制件作阳极利用电解法使其表面上形成氧化物薄膜的过程。
像Al、Mg、Cu、钢等制件都可用此法钝化。
为了提高某些金属的抗蚀性能(有时同时增加美观),可采用化学方法或阳极氧化方法,使金属钝化。
金属的钝化在机械制造,仪器制造、武器、飞机及某些金属日常用品的制造中,以在某些金属制件表面生成防锈层或同时还有装饰性的覆盖层而广泛地被采用。
选自《中学生化学报》作者:阿元林、梁冬梅。
金属的钝化在现代工业生产中,我们常常会遇到金属钝化现象。
一些较活泼的金属,在某些特定的环境介质中,会呈现惰性状态。
如金属的电极电位因外加阳极电流或局部阳极电流而向正方向移动,当超过一定数值后,金属的溶解速度反而剧烈地减小了,铁和不锈钢在硫酸中进行阳极极化时便观察到此现象。
金属阳极溶解过程中的这种“反常”现象称为金属的钝化过程。
§1-1钝化现象及其分类一、钝化现象及定义如果在室温时试验铁片在硝酸中的反应速率以及和硝酸浓度的关系,我们将会发现铁的反应速率,最初是随硝酸浓度增大而增大的。
当硝酸浓度增加到30%~40%时,溶解度达到最大值,若继续增大硝酸的浓度(>40%),铁的溶解度却突然成万倍下降,并使表面处于一种特殊的状态。
这时即使把它转移到硫酸中去,也不会再受到酸的浸蚀。
也就是说当硝酸增大到一定程度时,它的反应速率迅速减小,继续增大浓度时,它的反应速率更小,最后不再起反应,即铁变得“稳定”了,或者像一般说的,铁发生“钝化”了。
除了铁之外,其他一些金属也可以发生钝化。
例如,Cr、Ni、Co、Mo,Al、Ta、Nb和W等,其中最容易钝化的金属是Cr、Al、Mo,Ni、Fe,称作自钝化金属,能在空气中发生自钝化。
不仅硝酸,其他强氧化剂如浓硫酸、氯酸、碘酸、重铬酸钾、高锰酸钾等,都可以引起金属钝化。
但是钝化现象的发生虽然通常和氧化性介质作用有关,但是有些金属却可在非氧化性介质中钝化。
例如镁可以在氢氟酸中钝化,钼和铌可以在盐酸中钝化,汞和银可以在氯离子的作用下发生钝化,不锈钢在硝酸中钝化等等。
金属钝化的定义:在一定条件下,当金属的电位由于外加阳极电流或局部阳极电流而移向正方向时,原来活泼地溶解着的金属表面状态会发生某种突变,同时金属的溶解速度急速下降,这种表面状态的突变过程叫做钝化。
二、金属钝化的几种类型金属钝化可以分为三种类型:化学钝化、阳极钝化、机械钝化1.化学钝化又称自动钝化(autopassivation)。

