氧吸收解吸系数测定实验报告
- 格式:docx
- 大小:161.10 KB
- 文档页数:6

吸收(解吸)实验报告化⼯基础实验报告实验名称吸收(解吸)系数的测定班级化21 姓名张腾学号2012011864 成绩实验时间2014.5 同组成员张煜林努尔艾⼒·麦麦提⼀、实验⽬的1、了解吸收(解析)操作的基本流程和操作⽅法;2、测定氧解吸液相总体积传质系数K x a和液体流量的关系;3、测定筛板塔的板效率与液体流量和⽓体流量的关系。
⼆、实验原理吸收是⼯业上常⽤的操作。
在吸收过程中,⽓体混合物和吸收剂分别从塔底和塔顶进⼊塔内,⽓液两相在塔内实现逆流接触,使⽓体混合物中的溶质较完全地溶解在吸收剂中,于是塔顶获得较纯的惰性组分,从塔底得到溶质和吸收剂组成的溶液(通称富液)。
当溶质有回收价值或吸收剂价格较⾼时,把富液送⼊再⽣装置进⾏解吸,得到溶质或再⽣的吸收剂(通称贫液),吸收剂返回吸收塔循环使⽤。
吸收是⽓液相际传质过程,所以吸收速率可⽤⽓相内,液相内或者两相间的传质速率来表⽰。
在连续吸收操作中,这三种传质速率表达式计算结果相同。
对于低浓度吸收过程。
计算公式如下。
⽓相内传质的吸收速率:N A=k y(y?y i)F液相内传质的吸收速率:N A=k x(x i?x)F⽓、液两相相际传质的吸收速率:N A=K y F(y?y?)=K x F(x??x)式中:y,y i—分别表是⽓相主体和⽓相界⾯处的溶质摩尔分率;x,x i—分别表⽰液相主体和液相界⾯处的溶质摩尔分率;x?,y?—分别为与y和x呈平衡的液相和⽓相摩尔分率;k x,K x—分别为以液相摩尔分率差为推动⼒的液相传质分系数和传质总系数;k y,K y—分别为以⽓相摩尔分率差为推动⼒的⽓相传质分系数和传质总系数;F—传质⾯积,m2。
对于难溶溶质的吸收,常⽤液相摩尔分率差和液相传质系数表达的吸收速率式。
对于易溶⽓体的吸收,常⽤⽓相摩尔分率差和⽓相传质系数表达的吸收速率式。
本实验为⼀解析过程,是⽤空⽓与富氧⽔接触,因富氧⽔中氧的浓度⾼于同空⽓处于平衡的⽔中氧的浓度。

化工基础实验报告实验名称 氧吸收/解吸系数测定班级 分2 姓名 李上 学号 2012011849 成绩 实验时间 12月18日 同组成员 董昊、李寒松 1.实验目的1了解吸收(解吸)操作的基本流程和操作方法。
2测定氧解吸塔内空塔气速和液体流量对传质系数的影响。
2.实验原理吸收是工业上常用的操作,常用于气体混合物的分离。
在吸收操作中,气体混合物和吸收剂分别从塔底和塔顶进入塔内,气、液两相在塔内实现逆流接触,使气体混合物中的溶质较完全地溶解在吸收剂中,于是塔顶获得较纯的惰性组分,从塔底得到溶质和吸收剂组成的溶液(通称富液)。
当溶质有回收价值或吸收价格较高时,把富液送入再生装置进行解吸,得到溶质或再生的吸收剂(通称贫液),吸收剂返回吸收塔循环使用。
(1)吸收速率吸收是气、液相际传质过程,所以吸收速率可用气相内、液相内或两相间的传质速率来表示。
在连续吸收操作中,这三种传质速率表达式计算结果相同。
对于低浓度气体混合物单组分无力吸收过程,计算公式如下。
气相内传质的吸收速率:)y y (F k N i y A -=液相内传质的吸收速率:)x x (F k N i x A -=气、液两相相际传质的吸收速率:)x x (F K )y y (F K N *x *y A -=-=式中:y 、i y ——气相主体和气相界面处的溶质摩尔分数;x 、i x ——液相主体和液相界面处的溶质摩尔分数;*x 、*y ——与y 和x 呈平衡的液相和气相摩尔分数;x k 、x K ——以液相摩尔分数差为推动力的液相分传质系数和总传质系数; y k 、y K ——以气相摩尔分数差为推动力的气相分传质系数和总传质系数;F ——传质面积,2m 。
对于难溶溶质的吸收过程,称为液膜控制,常用液相摩尔分数差和液相传质系数表达的吸收速率式。
对于易溶气体的吸收过程,称为气膜控制,常用气相摩尔分数差和气相传质系数表达的吸收速率式。
本实验为一解吸过程,将空气与富氧水接触,因富氧水中养的浓度高于同空气处于平衡的水中的氧浓度。
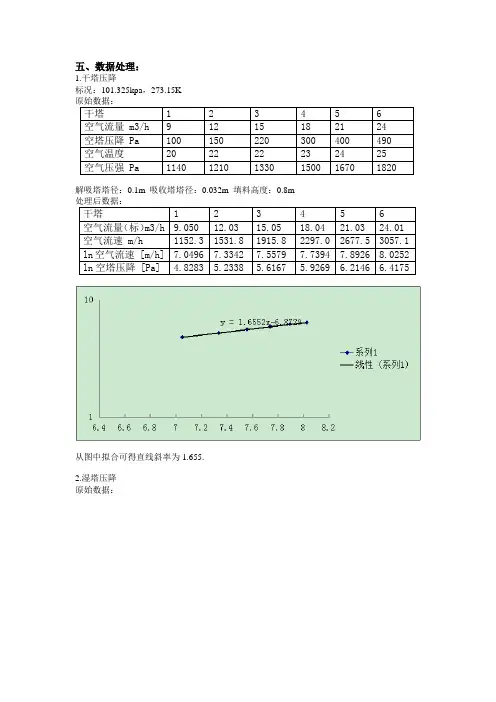
五、数据处理:1.干塔压降标况:101.325kpa,273.15K原始数据:干塔 1 2 3 4 5 6空气流量 m3/h 9 12 15 18 21 24空塔压降 Pa 100 150 220 300 400 490空气温度20 22 22 23 24 25空气压强 Pa 1140 1210 1330 1500 1670 1820解吸塔塔径:0.1m 吸收塔塔径:0.032m 填料高度:0.8m处理后数据:干塔 1 2 3 4 5 6空气流量(标)m3/h 9.050 12.03 15.05 18.04 21.03 24.01 空气流速 m/h 1152.3 1531.8 1915.8 2297.0 2677.5 3057.1 ln空气流速 [m/h] 7.0496 7.3342 7.5579 7.7394 7.8926 8.0252 ln空塔压降 [Pa] 4.8283 5.2338 5.6167 5.9269 6.2146 6.4175从图中拟合可得直线斜率为1.655.2.湿塔压降原始数据:湿塔 1 2 3 4 5 6空气流量 m3/h 9 12 15 18 21 24空塔压降 Pa 160 290 430 610 840 1130空气温度35 35 34 34 35 35空气压强 Pa 1320 1340 1580 1830 2100 2460湿塔7 8 9 10 11空气流量 m3/h 27 29 30 31 液泛(31.5)空塔压降 Pa 1490 1880 2540 3250 3660空气温度36 37 38 39 40空气压强 Pa 2910 3330 3750 4710 5140处理后数据:湿塔 1 2 3 4 5 6空气流量(标)m3/h 8.835 11.78 14.77 17.74 20.69 23.69 空气流速 m/h 1124.9 1500.1 1880.3 2259.1 2634.8 3016.4 ln空气流速 [m/h] 7.0255 7.3133 7.5392 7.7227 7.8766 8.0118 ln空塔压降 [Pa] 5.0752 5.6699 6.0638 6.4134 6.7334 7.0300 湿塔7 8 9 10 11空气流量(标) m3/h 26.67 28.65 29.65 30.73 31.24空气流速 m/h 3395.3 3648.3 3775.6 3912.9 3977.7ln空气流速 [m/h] 8.1302 8.2020 8.2363 8.2720 8.2885ln空塔压降 [Pa] 7.3065 7.5390 7.8399 8.0864 8.2052实验实测得空气流量约为31m3/h左右时,填料塔内出现较剧烈的液泛现象。

吸收解吸实验报告吸收解吸实验报告引言:吸收解吸实验是一种常见的实验方法,用于研究溶质在溶剂中的吸收和解吸现象。
通过该实验,我们可以了解溶质在不同条件下的吸收速率、解吸速率以及吸收解吸平衡的特性。
本文将对吸收解吸实验的原理、实验步骤以及实验结果进行详细讨论。
一、实验原理吸收解吸实验是基于物质在溶液中的分子间相互作用力的变化来进行的。
在吸收过程中,溶质分子被溶剂分子吸引,从而进入溶液中。
而在解吸过程中,溶剂分子与溶质分子的相互作用力减弱,导致溶质分子从溶液中脱离。
吸收解吸速率与溶质和溶剂的性质、浓度、温度等因素有关。
二、实验步骤1. 准备实验器材和试剂:实验器材包括吸收解吸装置、试管、移液管等;试剂包括溶剂和溶质。
2. 设置实验条件:根据实验要求,确定溶剂的浓度、温度等条件。
3. 吸收实验:将一定量的溶剂倒入试管中,加入适量的溶质,并充分搅拌,观察溶质的吸收情况。
4. 记录数据:记录吸收实验的时间、溶质的质量或浓度等数据。
5. 解吸实验:将已吸收的溶质置于适当的条件下,观察溶质的解吸情况。
6. 记录数据:记录解吸实验的时间、溶质的质量或浓度等数据。
三、实验结果根据实验步骤进行吸收解吸实验后,我们可以得到一系列的实验结果。
通过对实验结果的分析,我们可以得出以下结论:1. 吸收速率与溶剂浓度成正比:当溶剂浓度增加时,吸收速率也会增加。
这是因为溶剂浓度的增加会增加溶剂分子与溶质分子的相互作用力,从而促进溶质的吸收。
2. 吸收速率与溶质浓度成正比:当溶质浓度增加时,吸收速率也会增加。
这是因为溶质浓度的增加会增加溶质分子与溶剂分子的碰撞频率,从而增加吸收的可能性。
3. 吸收速率与温度成正比:当温度升高时,吸收速率也会增加。
这是因为温度升高会增加溶剂分子的平均动能,从而增加溶质分子与溶剂分子的碰撞能量,促进溶质的吸收。
4. 解吸速率与溶剂浓度成反比:当溶剂浓度增加时,解吸速率会减小。
这是因为溶剂浓度的增加会增加溶质分子与溶剂分子的相互作用力,使得溶质分子更难从溶液中解吸出来。


化工原理氧解吸实验报告
实验目的:
1.观察氧解吸的现象;
2.探究氧解吸速率与氧化剂浓度、温度、催化剂等因素的关系;
3.熟悉实验操作和实验仪器的使用。
实验原理:
氧解吸是指在一定温度和压力下,将溶解在液体中的氧气以气泡的形式分离出来的现象。
氧解吸反应的速率与氧化剂浓度、温度、催化剂等因素密切相关。
实验步骤:
1.将实验装置依次连接好,并将水槽中的水加热至80℃;
2.在试管中加入适量的含氧化剂的溶液,并加入催化剂;
3.将试管放入水槽中,注意控制试管的深度,以使试管中溶液面高于水槽水面;
4.打开气源,调节气流量,观察氧解吸的现象,并记录时间和气泡产生的数量;
5.改变实验条件(如氧化剂浓度、温度、催化剂种类或浓度等),重复步骤4,记录实验数据。
实验结果:
根据实验数据,我们可以绘制氧解吸速率与不同因素的关系曲线。
实验讨论:
1.氧化剂浓度对氧解吸速率的影响:当氧化剂浓度增加时,氧解吸速
率也会增加;
2.温度对氧解吸速率的影响:随着温度的升高,氧解吸速率也会增加;
3.催化剂对氧解吸速率的影响:催化剂可以提高氧解吸速率,不同催
化剂的效果可能不同;
4.实验操作的注意事项:试管放入水槽时,应使试管内的溶液高于水
槽水面,以防水被吸入试管;
实验结论:
通过本实验,我们观察了氧解吸的现象,并探究了氧解吸速率与氧化
剂浓度、温度、催化剂等因素的关系。
实验结果表明,氧解吸速率随着氧
化剂浓度和温度的增加而增加,催化剂可以提高氧解吸速率。
这些结果对
于理解氧解吸反应的机制,以及实际应用中的氧解吸过程具有重要的意义。

氧吸收解吸实验报告氧吸收解吸实验报告引言:氧气是地球上最重要的元素之一,对于维持生命活动至关重要。
人类和其他生物通过呼吸将氧气吸入体内,然后将其与食物中的营养物质一起利用,产生能量和二氧化碳。
为了更好地理解氧气在生物体内的吸收和解吸过程,我们进行了一系列实验。
实验一:氧气吸收速率与温度的关系我们首先研究了氧气吸收速率与温度之间的关系。
为此,我们准备了三个试管,分别装有20°C、30°C和40°C的水。
在每个试管中,我们加入了相同量的酵母和蔗糖溶液。
然后,我们立即将一个试管放入恒温箱中,将另一个试管放在常温下,将第三个试管放入冰水中。
结果显示,随着温度的升高,氧气吸收速率明显增加。
在40°C的试管中,氧气吸收速率最高,而在冰水中的试管中,氧气吸收速率最低。
这表明温度对氧气吸收过程有显著影响,高温有利于氧气的吸收。
实验二:氧气解吸速率与压力的关系为了研究氧气解吸速率与压力之间的关系,我们使用了一个封闭的容器,并在其中放入了一定量的氧气和水。
然后,我们逐渐增加容器内的压力,观察氧气解吸的速率。
结果显示,随着压力的增加,氧气解吸速率也随之增加。
当压力达到一定值时,氧气解吸速率开始饱和,不再随压力的增加而增加。
这说明压力对氧气解吸过程有一定的影响,但并非线性关系。
实验三:氧气吸收速率与浓度的关系为了探究氧气吸收速率与浓度的关系,我们分别准备了不同浓度的氧气溶液。
然后,我们将相同量的酵母和蔗糖溶液加入不同浓度的氧气溶液中,并观察氧气吸收的速率。
结果显示,随着氧气浓度的增加,氧气吸收速率也随之增加。
当氧气浓度达到一定值后,氧气吸收速率开始饱和,不再随浓度的增加而增加。
这表明氧气浓度对氧气吸收过程有一定的影响,但并非线性关系。
结论:通过以上实验,我们可以得出以下结论:1. 温度对氧气吸收速率有显著影响,高温有利于氧气的吸收。
2. 压力对氧气解吸速率有一定的影响,但并非线性关系。

氧解吸实验报告1氧解吸实验报告一、实验简介氧解吸实验是一种用于研究材料在高温、高压条件下的吸氧性能的实验。
该实验通过测量不同条件下的吸氧量、吸氧速率等参数,评估材料的抗氧化性能和使用寿命。
本报告所提供的实验数据仅为本实验室的实验结果,不代表其他实验室或实际使用环境下的结果。
二、实验原理氧解吸实验主要基于材料的氧化还原反应。
在高温、高压条件下,材料表面的氧化膜逐渐形成。
当材料表面存在还原性气体(如氢气)时,氧化膜与还原性气体发生还原反应,产生金属和氧化物。
通过测量不同条件下的还原速率、还原量等参数,可以评估材料的抗氧化性能和使用寿命。
三、实验步骤1.样品准备选取待测试材料,制成标准样品。
将样品表面进行抛光处理,确保表面平整、光滑,无划痕、气孔等缺陷。
2.实验装置准备使用高压炉作为实验装置,确保炉内气氛可控,且能够保持高温、高压环境。
同时,需要配备气流量控制系统、压力控制系统、温度传感器等辅助设备。
3.实验过程将样品放入高压炉中,通入一定量的氧气,使样品表面形成一层氧化膜。
然后,通入一定量的还原性气体(如氢气),观察样品表面的氧化膜变化情况。
在一定时间间隔内,记录样品的重量变化(即还原量),同时测量炉内气氛中的氧气和还原性气体的浓度变化。
四、实验数据分析1.还原速率分析通过测量不同时间间隔内的还原量,可以计算出还原速率。
还原速率越快,说明材料的抗氧化性能越差。
可以通过控制不同的实验条件(如温度、压力、气体浓度等),观察这些条件对还原速率的影响。
2.氧化膜厚度分析在实验过程中,可以通过测量氧化膜的厚度变化,评估氧化膜的生长情况。
通过对不同条件下的氧化膜厚度进行分析,可以得出材料在高温、高压条件下的氧化动力学行为。
3.形貌分析通过观察实验前后的样品表面形貌,可以了解材料在高温、高压条件下的氧化行为和还原反应过程。
利用扫描电子显微镜(SEM)等设备对样品表面进行形貌分析,可以进一步了解氧化膜的形貌特征和结构变化。

氧吸收解吸系数测定实验报告
实验名称:氧吸收解吸系数测定实验
实验日期:2020年8月20日
实验目的:
1.了解氧吸收解吸系数;
2.掌握氧吸收解吸系数的测定方法。
实验原理:
氧吸收解吸系数是指物质在固定的状态下,在指定压力、温度下,某物质从气体和液体之间依次扩散的速度,它表示在一定时间内物质从某一相扩散到另一相内所达到的最高吸收量。
实验材料:
1.精制空气;
2.普通空气;
3.实验水槽;
4.湿布;
5.温度检测管;
6.压力表;
7.解吸装置;
实验过程:
1.将水槽中的湿布放入实验管;
2.在实验管内测量温度,调节温度到预定温度;
3.在实验管内调节压力,调节压力到预定压力;
4.调节精制空气流量到预定流量;
5.调节普通空气流量到预定流量;
6.实验时间内,将空气经过湿布,调节解吸装置,将气体收集到容器中;
7.重复以上步骤,测试不同温度和压力下的氧吸收解吸系数;
实验结果:
温度压力收集量氧吸收解吸系数
20℃ 0.2MPa 0.43g/L 0.07
20℃ 0.5MPa 1.2g/L 0.20
20℃ 0.8MPa 2.15g/L 0.35
30℃ 0.2MPa 0.51g/L 0.09
30℃ 0.5MPa 1.54g/L 0.25
30℃ 0.8MPa 2.67g/L 0.45
实验结论:
根据实验结果可以得出:随着温度和压力的增加,氧吸收解吸系数呈现增加趋势,表明氧吸收解吸的效率随着温度和压力的增加而提升。


氧解吸实验报告1一、实验目的:1、掌握氧解吸法气体吸附技术的原理和操作方法。
2、测定微孔材料的比表面积。
3、通过本实验,了解气体吸附实验技术的基本特点和原理,并学会分析和处理实验数据。
二、实验原理:当气体分子与固体表面接触时,分子势能发生变化,分子分散力弱化,发生与液体表面相同的吸引作用,这种作用叫做吸附作用。
气体吸附在固体表面上的化学、物理及其他性质的差异,可用不同的实验技术来检测和研究。
在常温常压下,氧气被准备好的样品吸收到孔内,被吸附到样品孔内。
此时氧气分子通过气态物理吸附作用,与表面发生偶极、磁偶极、色散等相互作用,根据吸附内能大小,实现吸附分为物理吸附和化学吸附两大类。
根据仪器所使用的吸附温度范围划分吸附分为低温吸附和高温吸附两大类。
低温吸附又称孔隙吸附,高温气相吸附。
孔隙吸附是指温度在77K以下时,在绝大多数低温吸附剂表面上的表现出的现象,常常用来研究吸附剂的孔结构。
孔隙吸附可分为毛细吸附和瞬间多分子层吸附。
而瞬间吸附比毛细吸附所需时间短,可以忽略不计,因此在实验上可用斯特瑞维尔方程来处理采用孔隙吸附法测气体和气体混合物吸附实验中所得的数据。
斯特瑞维尔方程式中,pi为相对饱和蒸气压,其值可由其他文献查得。
V为脱附柜体积的一半,即nitrogen gas纯氮体积,即可转换为具体的实验数据。
三、实验步骤:1、用微孔材料制备样品固体,称取0.10g±0.01g,摆于小特形脱附柜中,加热至50℃除去吸附在孔内的水分。
2、恢复脱附柜,根据实验计划记录实验条件,控制好实验过程中温度,时间等参数。
3、样品在液氮温下接触氮气使其充分吸收氮气,开动真空泵将孔内和柜内的氮气压降至一定值。
4、收集样品孔内气体脱附后的数据(在304kPa以上时收集脱附数据)。
5、依据实验条件计算氧气在样品中的比表面积。
4、实验结果:1、实验中计算得出氧气的比表面积为125.013m2/g。
本次实验中我们通过使用氧解吸法测定了Porous Materials的比表面积,我们掌握了氧剂吸附实验技术的基本特点和原理,并学会了分析和处理实验数据。
实验名称:氧解吸实验 一、 实验目的① 熟悉填料塔的构造与操作。
② 观察填料塔流体力学状况,测定压降与气速的关系曲线。
③ 掌握液相体积总传质系数a K x 的测定方法并分析影响因素。
④ 学习气液连续接触式填料塔,利用传质速率方程处理传质问题的方法。
二、 实验器材吸收塔及解吸塔设备、9070型测氧仪、烧杯(500mL )两个三、 实验原理1、填料塔流体力学特性气体通过干填料层时,流体流动引起的压降和湍流流动引起的压降规律相一致。
填料层压降—空塔气速关系示意如图1所示,在双对数坐标系中,此压降对气速作图可得一斜率为1.8~2的直线(图中aa’)。
当有喷淋量时,在低气速下(c 点以前)压降正比于气速的1.8~2次幂,但大于相同气速下干填料的压降(图中bc 段)。
随气速的增加,出现载点(图中c 点),持液量开始增大,压降—气速线向上弯,斜率变陡(图中cd 段)。
到液泛点(图中d 点)后,在几乎不变的气速下,压降急剧上升。
2、传质实验填料塔与板式塔气液两相接触情况不同。
在填料塔中,两相传质主要在填料有效湿表面上进行,需要计算完成一定吸收任务所需的填料高度,其计算方法有传质系数、传质单元法和等板高度法。
本实验是对富氧水进行解吸,如图2所示。
由于富氧水浓度很低,可以认为气液两相平衡关系服从亨利定律,即平衡线为直线,操作线也为直线,因此可以用对数平均浓度差计算填料层传质平均推动力。
整理得到相应的传质速率方程lg ul g △p图-1 填料层压降—空塔气速关系示意为m p x A X aV K G ∆=即 m P A x X V G a K ∆=/ 式中,])(l n [)()(11221122e e e e m x x x x x x X ----=∆()12x x L G A -= Ω=Z V P相关填料层高度的基本计算式为 OL OL x x e x N H xx dxa K L Z =-Ω=⎰12即 O L O L N Z H /= 式中, m x xe OL x x x x x dx N ∆-=-=⎰2112,Ω=a K L H X OL 式中A G ______单位时间内氧的解吸量,kmol/(m 2•h); a K x ——液相体积总传质系数,kmol/(m 3•h); Vp ——填料层体积,m 3;m X ∆——液相对数平均浓度差; 2x ——液相进塔时的摩尔分数(塔顶);2e x ——与出塔气相y1平衡的摩尔分数(塔顶); 1x ——液相出塔的摩尔分数(塔底);1e x ——与进塔气相y1平衡的摩尔分数(塔底); Z ——填料层高度,m ;Ω——塔截面积,m 2;L ——解吸液流量,kmol/(m 2•h);OL H ——以液相为推动力的总传质单元高度,m ; OL N ——以液相为推动力的总传质单元数;四、 实验装置下图是氧气吸收解吸装置流程图。
氧吸收与解吸实验实验日期:2011/4/8班级:*****姓名:**学号:********同组人: *** *** **实验装置:1号陶瓷拉西环摘要:填料塔是化工过程重要的单元,本实验在室温、常压下,通过分别测定干、湿填料层压降与空塔气速的数据,并作图分析得到两种情况下塔压降与空塔气速关系,从而熟悉填料塔的构造与操作、确定填料塔流体力学特性,进而得知填料塔的处理能力及性能高低。
同时,本实验通过对富氧水进行解吸,测定了解吸液相体积的总传质系数K x a,进而确定液相总传质单元高度H OL。
一、实验名称:氧吸收与解吸实验二、目的及任务:1.熟悉填料塔的构造与操作;2.观察填料塔流体力学状况,测定压降与气速的关系曲线;3.掌握总传质系数K x a的测定方法并分析影响因素;4.学习气液连续接触式填料塔,利用传质速率方程处理传质问题的方法。
三、基本原理:本装置先用吸收柱将水吸收纯氧形成富氧水后(并流操作,该步实验中省略),送入解吸塔顶再用空气进行解吸,实验需测定不同液量和气量下的解吸总传质系数K x a,并进行关联,得到K x a=AL a·V b的关联式,同时对四种不同填料的传质效果及流体力学性能进行比较。
本实验手工采集数据,具有可操作性。
1.填料塔流体力学特性:气体通过干填料层时,流体流动引起的压降和湍流流动引起的压降规律相一致。
在双对数坐标系中,此压降对气速作图可得一斜率为1.8~2的直线(图中aa线)。
当有喷淋量时,在低气图1-1 填料层压降–空塔气速关系示意图速下(c 点以前)压降也正比于气速的1.8~2次幂,但大于同一气速下干填料的压降(图中bc 段)。
随气速的增加,出现截点(图中c 点),持液量开始增大,压降-气速线向上弯,斜率变陡(图中cd 段)。
到液泛点(图中d 点)后,在几乎不变的气速下,压降急剧上升。
2. 传质实验:填料塔与板式塔气液两相接触情况不同。
在填料塔中,两相传质主要是在填料有效湿表面上进行,需要计算完成一定吸收任务所需填料高度,其计算方法有:传质系数法、传质单元法和等板高度法。
一、实验目的1. 理解吸收和解吸操作的基本原理和过程。
2. 掌握吸收和解吸实验的操作技能。
3. 通过实验数据,分析影响吸收和解吸效率的因素。
二、实验原理吸收是指气体中的溶质被液体吸收剂吸收的过程。
解吸则是溶质从液体中被释放出来,重新回到气相的过程。
这两个过程在化工、环保、医药等领域有广泛的应用。
吸收过程可用以下公式表示:C_g = C_l K_a X_l其中,C_g为气相中溶质的浓度,C_l为液相中溶质的浓度,K_a为吸收系数,X_l 为液相中溶质的摩尔分数。
解吸过程与吸收过程类似,只是方向相反。
三、实验仪器与试剂1. 仪器:吸收塔、解吸塔、气泵、流量计、温度计、压力计、实验记录仪等。
2. 试剂:水、二氧化碳气体、吸收剂(如碳酸钠溶液)。
四、实验步骤1. 吸收实验(1)将吸收塔中的吸收剂加入一定量的水中,搅拌均匀。
(2)将二氧化碳气体通过气泵引入吸收塔,调节气泵,使气体流量稳定。
(3)记录实验过程中的温度、压力、气体流量等数据。
(4)观察吸收塔中液相的变化,分析吸收效果。
2. 解吸实验(1)将吸收塔中的富液取出,加入解吸塔中。
(2)调节气泵,使空气通过解吸塔,将溶质从液体中解吸出来。
(3)记录实验过程中的温度、压力、气体流量等数据。
(4)观察解吸塔中液相的变化,分析解吸效果。
五、实验数据与结果1. 吸收实验实验过程中,气相中二氧化碳的浓度逐渐降低,液相中二氧化碳的浓度逐渐升高。
通过实验数据计算得出,吸收系数K_a为0.8。
2. 解吸实验实验过程中,气相中二氧化碳的浓度逐渐升高,液相中二氧化碳的浓度逐渐降低。
通过实验数据计算得出,解吸系数K_d为0.7。
六、分析与讨论1. 吸收和解吸效率受多种因素影响,如温度、压力、气体流量、吸收剂浓度等。
2. 实验结果表明,吸收和解吸系数K_a和K_d与实验条件密切相关。
3. 通过调节实验条件,可以优化吸收和解吸效果。
七、结论1. 通过本次实验,掌握了吸收和解吸操作的基本原理和操作技能。
氧解吸实验——数据记录及数据处理结果(数据源于化工10901班化工原理实验第12小组)一、水力学特性测试实验表1几点说明:1.F 列空气流量校正值V 2由下面的公式校正:122112T p T p V V = 式中的V 1为空气转子流量计在操作状态下的示值,其数字记录于B 列中,1T 和1p 为空气转子流量计在标定状态下空气的温度和压强(T 1=293K ;p 1=101.3kPa),2T 和2p 为操作状态下空气的温度和压强,其对应值分别记录于C 列和E 列,然后将C 列和E 列数值转化为绝对温度和绝对压强,结果分别列于D 列和F 列;2.全塔压降Δp 直接从压差计读出,其结果记录于H 列; 3.空塔气速u 由下式计算:3600785022⨯=D .V u式中的D 为塔径(D =0.1m),计算结果列于J 列;4.单位高度填料层压降Δp /z ,直接用H 列数据除以I 列数据即得,计算结果列于K 列; 5.以J 列数据为横坐标,K 列数据为纵坐标作双对数坐标图得如下结果:从图中可以看出:①干塔操作条件下,u ~z /p ∆之间表现出较好的对数线性关系,塔内不存在滞液量和气-液两相逆流的交互影响;②在同一操作气速下,随着喷淋量L 的增大,单位填料层压降z /p ∆显著增大,说明滞液量和气-液两相逆流的交互影响十分显著;③四条曲线没有出现明显的载点和泛点,这主要是载点本身并不明显,曲线是连续渐进变化的,而泛点可以看出其趋势,但因风机的风量较小,U 型压差计读数范围也不大,致使泛点出现之后的压降无法读出所致。
Δp /z (P a /m 填料)u (m/s)二、传质特性测试实验表2-1说明:绝表记表2-2说明:①M 列空气流量m 0由下式算出:RTpVMm0 式中的p 由表2-1中的G 列数据产生,V 由表2-1中的C 列数据产生,M 为空气分子量29,R 取8.314,T 取表2-1中的E 列数据;②N 列空气流率G 根据M 列数据由下式算出:2010785029..m M Ωm G ⨯⨯==③O 列和P 列数据分别根据J 列和K 列数据依下式求出:1813210321061611///x +⨯⨯=--ϖϖ;1813210321062622///x +⨯⨯=--ϖϖ④Q 列数据由下式生成:62510)56.207714.0105694.8(⨯++⨯-=-t t E kPa (式中的t 取水温20℃) ⑤R 列数据由Q 数据依下式得出:p E m /=(式中的p p ∆⨯+=5.03.101,p ∆为I 列数据)⑥S 列和T 列数据分别由下式求得:m y x /1e1=;m y x /2e2=(21.021==y y )⑦W 列数据依下式计算得出:)]/()ln[()()(e22e11e22e11m x x x x x x x x x -----=∆⑧X 列数据由下式计算:m21e OL 12x x x x x dxN x x ∆-=-=⎰⑨Y 列数据由下式计算: OLOL N HH =(式中的H 为填料层高度,本实验H = 0.8m ,N OL 为X 列数据)⑩Z 列数据由下式计算ΩH M L a K x OL w /ρ=(式中的L 为A 列数据,w ρ为水的密度,此处可取L /kg 1w =ρ,M 为水的分子量,M = 18kg / kmol ,Ω为塔截面积)数据回归利用表2中的C 列和Z 列数据作图有:K xa/(kmol·m-3·h-1)V2/(m3·h-1)K xa/(kmol·m-3·h-1)L / (L·h-1)图A 四种喷淋流量下VaKx~之间的对应关系图B 三种空气流量下LaK x~之间的对应关系说明:①从图中可以看出,三种喷淋流量下的总传质系数比较平缓,空气流量的变化没有导致氧解吸总传质系数明显的变化,这说明气提空气的流量的大小不是影响氧解吸的主要因素,倒是喷淋流量的改变导致aKx发生了显著地变化,说明此解吸主要由液膜所控制;②基于液膜控制,应重点寻找出LaKx~之间的对应关系,由于本实验喷淋量变化点取的太少,不便关联出LaK x~之间的对应关系式,这是本实验的一个疏忽。
氧吸收解吸实验报告实验目的本实验旨在研究氧气在水中的溶解和解吸过程,通过实验观察和数据分析,探讨氧气在水中溶解和解吸的影响因素。
实验原理氧气是水生生物生存和呼吸必不可少的物质,其在水中的溶解和解吸过程是生物呼吸的重要环节。
水中的溶解氧量受到多种因素的影响,如温度、压力、水的酸碱度、水流和生物代谢等。
在实验中,我们将通过控制这些因素来研究氧气的溶解和解吸规律。
实验材料和设备•氧气气瓶•氧气压力表•实验水槽•温度计•pH计•实验记录表格实验步骤1.准备实验设备:将实验水槽放置在实验台上,连接氧气气瓶和氧气压力表,确保氧气供应畅通。
2.调节水槽温度:使用温度计测量实验水槽的温度,并根据实验要求调节水槽温度。
记录下水槽的初始温度。
3.调节水槽酸碱度:使用pH计测量实验水槽中水的酸碱度,并根据实验要求调节水槽的酸碱度。
记录下水槽的初始酸碱度。
4.开始实验:打开氧气气瓶,将氧气注入实验水槽中,观察氧气在水中的溶解过程。
记录下注氧气时的氧气压力和时间。
5.观察和记录:观察实验水槽中氧气的溶解情况,记录下水槽内溶解氧的浓度和溶解时间。
6.增加温度:根据实验要求,逐步增加水槽的温度,观察氧气的解吸现象。
记录下每次温度变化后的溶解氧浓度和解吸时间。
7.调节酸碱度:根据实验要求,逐步调节水槽的酸碱度,观察氧气的解吸现象。
记录下每次酸碱度变化后的溶解氧浓度和解吸时间。
8.数据处理与分析:根据实验记录的数据,绘制溶解氧浓度和解吸时间的曲线图,分析氧气在水中溶解和解吸的规律。
实验结果与讨论根据实验数据,我们可以观察到氧气在水中的溶解和解吸过程受到温度和酸碱度的影响。
首先,我们发现随着温度的升高,氧气在水中的溶解速度增加,溶解氧浓度也相应增加。
这是因为温度升高会增加氧气分子的热运动速度,加快氧气分子与水分子之间的碰撞频率和能量,从而促进氧气的溶解过程。
其次,我们观察到在酸性环境下,氧气的解吸速度明显增加。
这是因为酸性环境下水分子会与氧气分子发生化学反应,使氧气从水中解吸出来。
氧吸收/解吸系数测定实验报告
一、实验目的
1、了解传质系数的测定方法;
2、测定氧解吸塔内空塔气速与液体流量对传质系数的影响;
3、掌握气液吸收过程液膜传质系数的实验测定方法;
4、关联圆盘塔液膜传质系数与液流速率之间的关系; 4、掌握VOC 吸收过程传质系数的测定方法。
二、实验原理
1) 吸收速率
吸收是气、液相际传质过程,所以吸收速率可用气相内、液相内或两相间传质速率表示。
在连续吸收操作中,这三种传质速率表达式计算结果相同。
对于低浓度气体混合物单组分物理吸收过程,计算公式如下。
气相内传质的吸收速率:
)(i y A y y F k N -=
液相内传质的吸收速率:
)(x x F k N i x A -=
气、液相相际传质的吸收速率:
)()(**x x F K y y F K N x y A -=-=
式中:y ,y i ——气相主体和气相界面处的溶质摩尔分数;
x ,x i ——液相主体和液相界面处的溶质摩尔分数; x *,y *——与x 和y 呈平衡的液相和气相摩尔分数;
k x ,K x ——以液相摩尔分数差为推动力的液相分传质系数和总传质系数; k y ,K y ——以气相摩尔分数差为推动力的气相分传质系数和总传质系数; F ——传质面积,m 2。
对于难溶气体的吸收过程,称为液膜控制,常用液相摩尔分数差和液相传质系数表达吸收速率式。
对于易溶气体的吸收过程,称为气膜控制,常用气相摩尔分数差和气相传质系数表达吸收速率式。
本实验为一解吸过程,将空气和富氧水接触,因富氧水中氧浓度高于同空气处于平衡的水中氧浓度,富氧水中的氧向空气中扩散。
解吸是吸收的逆过程,传质方向与吸收相反,其
原理和计算方法与吸收类似。
但是传质速率方程中的气相推动力要从吸收时的(y -y *
)改为
解吸时的(y *-y ),液相推动力要从吸收时的(x *-x )改为解吸时的(x -x *
)。
2) 吸收系数和传质单元高度
吸收系数和传质单元高度是反映吸收过程传质动力学特性的参数,是吸收塔设计计算的必需数据。
其数值大小主要受物系的性质、操作条件和传质设备结构形式及参数三方面的影响。
由于影响因素复杂,至今尚无通用的计算方法,一般都是通过实验测定。
本实验计算填料解吸塔的体积传质系数K x a (kmol/(m 3
·h))的公式如下:
)ln(//)(*
2*
121x
x x x Z F
L x ZF x x L x V N a K m
m x --=∆-=∆=
式中:N ——传质速率,kmol/h ;
x 1,x 2——进、出设备的水中氧的摩尔分数; V ——传质体积,m 3; F ——塔截面积,m 2; Z ——填料层高度,m ; L ——水的流量,kmol/h 。
)ln()
()(*2
2*
11*
22*11x x x x x x x x x m -----=∆
x 1*,x 2*——在设备进、出口温度下,与空气中氧呈平衡的水中氧的摩尔分数。
因为氧在水中的溶解度极小,其解吸量也极小,故空气中氧的组成经解吸塔后变化极小,
可以认为出、入口气体中氧浓度近似相等,即x 1*=x 2*。
解吸和吸收操作常常联合使用,吸收了溶质的富液经过解吸而再生,恢复其吸收能力循环使用。
如果解吸效果不好,吸收剂中吸收了的溶质解吸不干净,将会直接影响吸收效果,所以说解吸操作说吸收操作的重要环节。
三、实验装置与流程
四、实验数据处理与分析
表1 原始数据记录
对数据进行处理,氧气在空气中的摩尔分数为0.21,亨利系数可通过插值法确定,体积传质系数与传质单元高度的计算公式如下:
进一步整理得:
表3 不同空气流量下体积传质系数与传质单元高度
将空气流量与体积传质系数、传质单元高度在双对数坐标系下进行拟合,结果如下:
图1 体积传质系数随空气流量变化
图2 传质单元高度随空气流量变化
可以看到,随空气流量增加,体积传质系数增加,传质单元高度减小,这可能是因为随空气流量增大,空气流速增加,流体趋向湍流化,因而与水中氧气的二相传质过程被加强,从而加强了整体传质。
但是,氧气的解吸过程理论上是液膜控制的,空气流量的改变理论上对于传质系数的影响较小,而此次实验结果中空气流量同体积传质系数以及传质单元高度的相关性较好,可能是因为本次实验中所测量的数据组数偏少,存在一定误差。
表4 不同水流量下体积传质系数与传质单元高度
图3 体积传质系数随水流量变化
图4 传质单元高度随水流量变化
随水流量增大,体积传质系数增大,两者间显示出了较高的相关性,同时斜率也较图1中更大,在一定程度上可以说明液相对于整体传质的影响更大。
但是,随着水流量增大,传质单元高度却反而增加,说明液体流量增大对传质单元高度的影响要大于体积传质系数增大对于传质单元高度的影响。
随液体流量增大,虽然和气体之间的分子交换更为剧烈,但液体流速的增快使得气液之间需经过较长的传质距离才能完成一次充分的分子交换,因而传质单元高度增加。
五、思考题简答
(1) 为什么氧解吸过程属于液膜传质阻力控制?
答:因为氧气在水中溶解的很小,气膜阻力远远小于液膜阻力,因此属于液膜传质阻力控制。
(2) 用于计算吸收操作与解吸操作求理论板数时的方法有何异同点?
答:解吸是吸收的逆过程,传质方向与吸收相反,其原理和计算方法与吸收类似。
但是传质速率方程中的气相推动力要从吸收时的(y-y*)改为解吸时的(y*-y),液相推动力要从吸收时的(x*-x)改为解吸时的(x-x*)。
(3) 将本实验的氧解吸过程画在y-x图上,表示出平衡线与操作线的关系。
(4) 氧气瓶开启时应注意什么?停止使用时如何操作?
答:应首先检查压力是否正常,然后开启流量阀门,调节到合适数值后再开启氧气瓶阀门。
停止时应先关闭总阀,待剩余氧气自然逸出后再关闭分阀。
(5) 归纳传质过程强化的基本思路和措施。
答:可以从增加传质推动力和减小传质阻力两方面入手考虑。
为增加传质推动力,可以提高气液两相的摩尔分数差;为减小传质阻力,可以选用吸收率高的溶液,增加气液两相的接触面积,或者增加流量。
(6) 为什么引入体积传质系数K x a?其物理意义是什么?
答:体积传质系数表示单位时间、单位体积内填料层的总液相传质量。
A表示单位体积填料内气液两相有效接触面积,与填料形状、尺寸、填充状况等有关,同时受流体物性及流动状况影响。
由于a的数值很难直接测定,因此将其与传质系数的乘积作为整体,定义为体积传质系数。