最新金属有机化学期末考试
- 格式:doc
- 大小:2.28 MB
- 文档页数:18

*****************************级化学工程与工艺专业*******班《有机化学》期末考试试卷题号 一 二 三 四 五 六 总分 核分人 得分-------------------------------------------------------------------------------------------------------------------一、命名下列化合物或写结构式(每小题1分,共10分)1.CH 3CHC ≡ CCH 2CH 3OH2.CH 2CHClCHCH 2CHC 2H 5|||OCH 33 –已炔–2–醇 5–甲基–2–氯–1,3–环氧庚烷3.NO 2CH 3CONH4.CH(NH 2)CH 3对硝基乙酰苯胺 α–苯基乙胺(2–苯基乙胺)5.OCOOH6.NCH 33–氧代环戊甲酸 N –甲基吡咯 7.3–甲基–2–丁烯醛 8.溴化四乙铵 (CH 3)2C=CHCHO (C 2H 5)4N +Br -9.戊二酸酐 10.5–甲基–1,3苯二酚OO O OHOHCH 3二、单顶选择题(每小题1分,共20分)1.下列化合物与NaHSO 3亲核加成反应活性由快至慢顺序排列正确的是 ( C )a .ClCH 2CHOb .CH 3COCH 3c .Cl 3CCHOd .CH 3CHOA .b>d>a>cB .a>d>b>cC .c>a>d>bD .d>b>a>c 2.下列化合物的沸点由高至低排列顺序正确的是 ( B )a .CH 3(CH 2)2CONH 2b .CH 3(CH 2)3CH 2OHc .CH 3(CH 2)2COCH 3d .CH 3(CH 2)2COOHA .d>a>b>cB .a>d>b>cC .c>a>b>dD .c>b>a>d 3.下列化合物在弱酸性条件下,能与C 6H 5N 2Cl 发生偶联反应的是 ( D )A .OHCH 3B .OHClClClC .NHCOCH 3D .NH 24.下列化合物酸性由强到弱排列顺序正确的是 ( A )a .COOHO 2Nb .COOHc .COOHH 3Cd .COOHH 2NA .a>b>c>dB .b>a>c>dC . b>d>a>cD .d>b>c>a 5.下列化合物最容易烯醇化的是 ( C )A .CH 3CH 2CHOB .CH 3COCH 2CH 3C .CH 3COCH 2COCH 3D .CH 3COCH 2COOCH 36.能经HIO 4氧化,生成的产物与Ag(NH 3)2发生银镜反应的是 ( B )得分 阅卷人得分阅卷人A.HOHOHHB.H HHOHOH C.HO OH D.OHO7.下列化合物不能与Ph3P=CHCH2CH3发生反应的是( A ) A.MeCOOEt B.EtCOEt C.PhCHO D.环己基乙醛8.下列化合物与I2的NaOH溶液反应,能生成二元羧酸钠盐的是( D )A.OHCOCH3B.CHOHCH3OHC.OCOCH3D.COOHCOCH39.下列化合物与Lucss反应由快至慢顺序排列正确的是( C ) a.苄醇b.二苯甲醇c.三苯甲醇d.甲醇A.a>c>b>d B.b>a>c>d C.c>b>a>d D.d>b>c>a 10.下列化合物在酸性条件下,最容易脱水成烯的是( D ) A.(CH3)2CHOH B.CH3CHOHC2H5C.CH3CH2CH2OH D.CH2=CHCH2OH11.下列化合物属于内酯的是( A ) A.O O B.OC.O CHO D.O O O12.NaOC2H5OC2H5+CH(COOC2H5)2CH3CH=CH COC2H5OHaOC2H5OC2H5+CH2(COOC2H5)2CH3CH=CH COC2H5OHCH3CHCH2CO2C2H5CH(COOC2H5)2是( B )A.Wittig反应B.Michael缩合反应C.Claisen加成反应D.Cannizzaro反应13.下列化合物按碱性的强弱顺序排列正确的是( A )a.CH3CONH2b.CH3NH2c.(CH3)2NH d.C6H5NH2A.c>b>d>a B.b>d>a>c C.b>c>d>a D.d >c>b>a14.下列化合物能发生歧化反应的是( B )A.吡咯B.糠醛C.呋喃D.苯乙醛15.喹啉和KNH2在二甲苯100 ℃下作用,生成的产物是( D )A.8–氨基喹啉D.5–氨基喹啉C.3–氨基喹啉D.2–氨基喹啉16.下列糖中是还原性糖的是( C )A.淀粉B.果糖C.麦芽糖D.蔗糖17.下列糖类化合物溶于水后有变旋现象的是( B )A.蔗糖B.麦芽糖C.甲基–α–D–甘露糖苷D.葡萄糖苷18.下列羧酸酐在H+催化下发生水解反应速率最快的是( C )A.(CH3CH2CO)2O B.[(CH3)2CHCO]2OC.HCOOCOH D.(CH3CO)2O19.能把CH3CH≡CHCH2COOC2H5还原为CH3(CH2)4OH应选择的还原剂是( D )A.LiAlH4B.NaBH4C.Na/C2H5OH D.H2/Pt20.+CH3COCH2CH2N CH2CH3CH3CH2CH2CH3OH-热消除的主要产物是( A )A.CH3COCH=CH2B.CH3COCH2CH2NC2H5CH3C.CH2=CH2D.CH3CH=CH2得分阅卷人三、完成下列化学反应(每一步反应1分,共19分)1.ArCH 2OH −−→−3PBrArCH 2Br2.OCH2CH=CHCH 3CH(CH 3)CH=CH 2OH3.ClBrMg Et 2O(1)(2)H 3+OO CH 2CH 2OHClCrO 3吡啶CH 2CHOCl4.(CH 3CO)2O CHOOH+ CH 3COONa CH=CHCOONa OHH +/-H 2OO =O5.CH 3COCH 3−→−MgMe 2COHCOHMe 2−−→−∆+/H Me 3CCOMe −−−−−→−+OH NaOH I 32.2/.1Me 3CCOOH (Na) + CHI 36.O−−→−OH CH 3−−−→−+O H H 2/(CH 3)2CH ||CH 2OH |OCH 37.ArCH =CHCHO −−−−−→−+OH EtMgBr 3)2(,)1(ArCH =CHCHOHEt 8.H 3CCH 2CH 2COOH−−→−2SOCl CH 2CH 2COClH 3C−−→−3NH CH 2CH 2CONH 2H 3C −−−→−-OH Br /2CH 2CH 2NH 2H 3C9.NCOOCH 3LiAlH 480℃N HOH 2C10.SCH 3HNO3H 2SO 4SNO 2CH 3 11.CH 2COOEtCH 2COOEtNaOEtO CO 2C 2H 5(1)HO -/H 2O (2)H 3O +,OZn-Hg/HCl四、用化学方法鉴别和分离提纯化合物 (每小题5分,共15分 )1. 鉴别:A. 乙醛酸;B. 甲酸;C. 乙二酸⎪⎩⎪⎨⎧↓⎩⎨⎧↓−−−−−→−⎩⎨⎧↓−−−−−→−⎪⎭⎪⎬⎫+)1()1()1()1()1(4,223分黄分分无变化无黄分)(分二硝基苯肼A B Ag C C B C B A NH Ag2. 鉴别:A. 正丁醇;B. 叔戊醇;C. 2–丁醇,⎪⎩⎪⎨⎧↓⎩⎨⎧−−−−−−→−⎩⎨⎧↓−−−−→−⎪⎭⎪⎬⎫--)1()1()1()1()1(22分黄分立即混浊分无变化无黄分溶液分C B A B A C B A HCl ZnCl NaOH I3.分离提纯:A. 苯胺;B. 苯酚;C. 苯甲酸⎪⎪⎩⎪⎪⎨⎧−−→−−−→−⎪⎩⎪⎨⎧−−→−−−→−−−→−−→−−−→−−−−−−→−−−→−−−−−→−+)()()(H )O (Et CO )NaOH (分苯胺分苯酚分苯甲酸蒸馏油层抽滤固体抽滤水层分水层分1111/122得分阅卷人五、推断题(共21分)1.化合物A(C 5H 12O)室温下不与金属钠反应,A 与过量的热HBr 作用生成B ,C 。

有机化学模拟考试试题一一、 选择填空(共10题,每题1分) 1、下列化合物常温、常压是液体的是( ) A 丁烷 B 丁烯 C 丁醇 D 异丁烷 2、下列化合物在水中溶解度最大的是( ) A 丙醇 B 丙烯 C 苯酚 D 丙烷 3、下列化合物不能使酸性高锰酸钾褪色的是( ) A 1-丁烯 B 甲苯 C 丙烷 D 2-丁醇4、化合物33和33的关系是( )A 同一化合物B 内消旋体C 对应异构体D 普通的同分异构体(非旋光性) 5、下列化合物酸性最弱的是( )OHNO 2OH NO 2OHNO 2OHABCD6、合成化合物CH 3OC(CH 3)3的最佳方法是( )A 甲醇和叔丁醇分子间脱水B 甲基氯和叔丁醇钠反应C 甲醇钠和叔丁基氯反应7、反应+(CH 3)2CHCH 2Cl得到的产物是( )CHCH 2CH 3CH 3CH 2CH(CH 3)2C(CH 3)3ABC8、下列醇与卢卡斯试剂反应活性最高的是( ) A CH 3CH 2CH 2CH 2OH B CH 3CH(OH)CH 2CH 3 C (CH 3)2CHCH 2OH D (CH 3)3COH 9、组成杂环化合物最常见的杂原子是( )A Si,B,PB S,O,NC F,Cl,BrD Cr,Ni,Al 10、下列化合物在IR 的3700 2700无吸收的是( ) A 乙醚 B 乙烯 C 二氯甲烷 D 四氯化碳二、 写出下列化合物的名称或结构式(共10题,每题1分) 1、(E)-3,4-二甲基-3-庚烯 2、C 12H 25SO 3Na3、(CH 3)3C4、OH5、 N,N-二甲基对亚硝基苯胺6、Me7、CH 3(CH 2)4CH=CHCH 2(CH 2)7COOH8、3-甲基吡啶 9、COOHNO 2NO 210、 -D- (+)-葡萄糖(Haworth 式)三、 填空题(共29空,20题2分,其余每空1分)1、CH 3CH=C(CH 3)2 1.2.2622-2?2、CH 3CH=CCH 2CH 3 HOBr CH 3+3、4、CH 3CH=CCH 2CH 2CH 3CH 35、+CH 3CH 2CH 2Cl34H SO 6、Cl 2+CH 3Mg7、Cl 2+CH 3FeCl 38、BrCH 3KOH 乙醇9、CH 2CHCH 3OHH 2SO 4170C 10、OCH 3 HI +11、CH 3CH 2CHO+H 2N NH CONH 212、CHO H 2C=O+13、稀 NaOHCH 3CH 214、CCH 2CH OZn/Hg HCl15、N H 3足量Ag 2O H O加热Ag 2O H O3足量16、?OH OH17、?1.2. BH 322-CH 3OH18、 1.?2.?19、CH 3CH 2CH(OH)CH 31.Na3?20、CH 3ph H ClHphEtONa ?217最稳定的构象是四、用简单的方法鉴别下列化合物(共2题,每题5分) 1、戊烷 乙醚 正丙醇 丙酸2、苯甲醇苯甲醛2-己酮3-己酮五、合成下列化合物(共4题,每题6分)1、用五个碳以下的醇及氯苯合成CHCH3CH2CH32、以乙烯为原料合成CH3CH2CH2CH2OH3、由苯合成COOHNO2 O2N4、由四个碳原子以下(含四个碳原子)的有机化合物合成OCH3六、机理题(共1题,每题8分)写出尽量详细的反应历程,并用单箭头标出电子转移方向。

2013-2014学年第一学期金属有机化学复习(本)2013年12月一、写出下列有机配体、金属配合物、有机金属化合物的结构或名称1、Zeise 盐2、Vaska3PIrClCOPPh3CH3I3、Wilkinson配合物ClRh (Ph3P)34、BINAP5、9-BBN6、二环辛二烯合镍Ni7、双(η5-环戊二烯基)合铁8、三(羰基)(1-6-η6-环庚三烯)合铬CrCO9、Ni(COD)210、RhCl(PPh 3)3 Wilkinson配合物11、η5- CpMn(CO)312、Fe (CO )513、MoH 4(PPh 3) 414、η5- Cp 2Zr(CH 3)215、Et 2AlCl 二乙基氯化铝二、解释下列各名词1、金属有机化合物含有金属-碳键(M-C)的化合物定义为金属有机化合物2、过渡金属有机化合物含有过渡金属-碳键(M-C)的化合物,过渡金属含有d电子,在(n-1)d, ns, np原子构型中,(n-1)d轨道能级与ns接近,它们皆可参与成键。
符合18电子规则。
3、18电子规则对于稳定的单核反磁过渡金属络合物,其金属外层的电子数与配体配键的电子数的总和等于18。
只有当金属具有稳定的惰性气体结构时才能形成热力学稳定的过渡金属有机化合物。
4、EAN电子规则过渡金属配合物的中心(形成体)倾向于与一定数目的配体结合,以使自身周围的电子数等于同周期稀有气体元素的电子数5、环状多烯π-金属配合物6、高自旋配合物成对能(P)大于分裂能(△)的配合物,当P>△时, 因电子成对需要的能量高, 电子将尽量以单电子排布分占不同的轨道, 取高自旋状态。
7、低自旋配合物成对能(P)小于分裂能(△)的配合物,当P<△时, 电子成对耗能较少, 此时将取低自旋状态。
8、反馈π-键烯烃的π电子配位到金属的σ空轨道,形成σ授予键,同时充满电子的金属d 轨道与烯的反键空轨道π*相重叠,形成π反馈键。
9、晶体场分裂能中心离子的d轨道的简并能级因配位场的影响而分裂成不同组能级之间的能量差,以△表示10、电子成对能所谓成对能是电子在配对时为了克服静电场的排斥作用所需的能量, 通俗地讲就是使自旋成对的两个电子占据同一轨道所必须付出的能量, 以P表示。
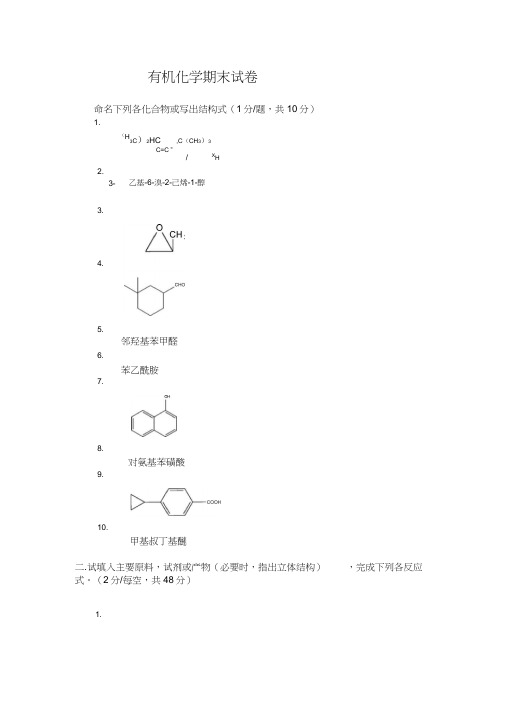
1.有机化学期末试卷命名下列各化合物或写出结构式(1分/题,共10分)1.(H3C)2HC,C (CH 3)3C=C ”/XH甲基叔丁基醚二.试填入主要原料,试剂或产物(必要时,指出立体结构) 式。
(2分/每空,共48分)2. 3- 乙基-6-溴-2-己烯-1-醇3.4.5.6.7.8.9.10.邻羟基苯甲醛苯乙酰胺对氨基苯磺酸,完成下列各反应CH 二 CHBr9.CH 3COCI7.CH2CI ANaOHH 2OCl8.CH 3O +出0OHCISN 1历程2. CH 2CIKCN/EtOH ------------- A+ c 〔2 咼温、咼压「① O 3 _ ② H 2O Zn 粉 _____________________________3.J CH = CH 2HBr Mg__________ 醚① CH S COCH S ._______________ d ② HQ, H +6.1, B 2H 6”2, H 2O 2, OH -'1, Hg(OAc)2,H 2O-THF T 2, NaBH 4 "OBr 2 NaOHNaNO 2 H 3PO 2 -- ►〔 ) -------------- ► ( ) ---------- ------- \H 2SO 4l丿三.选择题。
(2分/每题,共14分)1. 与NaOH 水溶液的反应活性最强的是()(A). CH 3CH 2COCH 2Br (B). CH s CH z CyCH 2Br (C). (CH 3)3CH 2Br (D). CH 3(CH 2)2CH 2Br CH 32. 对CH 3Br 进行亲核取代时,以下离子亲核性最强的是:()(A). CH 3COO - (B). CH 3CH 2O - (C). C 6H 5O - (D). OH -3. 下列化合物中酸性最强的是()(A) CH 3CCH (B) H 2O (C) CH 3CH 2OH (D) P-O 2NC 6H 4OH(E) C 6H 5OH(F) P-CH 3C 6H 4OHC, (2R, 3S, 4S)-2,4-二氯-3-戊醇JC CH3O+ CH 2=CH_C_CH 3C 2H 5ONa C z H s ONa10.Zn EtOH*HNO 3 H 2SO 4Fe,HCI (CH 3CO) 2O4.下列化合物具有旋光活性得是:COOH2.由指定原料及不超过四个碳原子的化合物和必要的试剂合成:3. 由指定原料及不超过四个碳原子的化合物和必要的试剂合成:CH CH4. 由苯、丙酮和不超过 4个碳原子的化合物及必要的试剂合成:5.下列化合物不发生碘仿反应的是 A C 6H5COCH C 、 CH s CHCOC t CH()B 、C 2H 5OHD 、CHCOC 2CH 6.与HNO 作用没有Nz 生成的是( A 、H2NCONH B C 、C 6H5NHCHD)、CHCH( NH 2) COOH、C 6H5NH 7.能与托伦试剂反应产生银镜的是( A CCbCOOH BC 、 CH 2CICOOH D)、CHCOOH 、HCOOH四.鉴别下列化合物(共6分) 苯胺、苄胺、苄醇和苄溴 五•从指定的原料合成下列化合物。

有机化学期末考试试卷一、选择题(每题2分,共20分)1. 下列哪个化合物不是芳香烃?A. 苯B. 甲苯C. 环己烯D. 萘2. 羧酸的酸性比醇强,这主要是因为:A. 羧酸分子中氧原子的电负性B. 羧酸分子中碳原子的电负性C. 羧酸分子中氢原子的电负性D. 羧酸分子中氧原子的诱导效应3. 以下哪个反应是亲电加成反应?A. 氢氧化钠与苯酚反应B. 溴与烯烃反应C. 氢气与烯烃反应D. 乙醇与氢溴酸反应4. 以下哪个化合物属于烯醇?A. 乙醇B. 丙酮C. 丙烯D. 丙醛5. 以下哪种反应类型不是碳正离子的重排反应?A. 1,2-重排B. 1,3-重排C. 1,4-重排D. 1,5-重排二、填空题(每空2分,共20分)6. 有机化学中,碳原子的杂化轨道类型有______、______和sp3。
7. 芳香族化合物的典型反应是______反应。
8. 碳正离子的稳定性与其电荷分布有关,通常______碳正离子比______碳正离子更稳定。
9. 酯化反应是醇与______反应生成酯和水的过程。
10. 有机分子中的手性中心是指具有______的碳原子。
三、简答题(每题10分,共30分)11. 简述有机化学反应中的SN1和SN2反应机制的区别。
12. 解释何为共振结构,并给出一个具体的例子。
13. 描述自由基取代反应的特点。
四、计算题(每题15分,共30分)14. 某化合物A的分子式为C3H6O,其红外光谱显示有羰基的吸收峰,核磁共振氢谱显示有3个不同的峰,峰面积比为6:1:1。
请计算A的不饱和度,并推测A的可能结构。
15. 给定一个反应方程式:CH3Br + NaOH → CH3OH + NaBr,计算当消耗1摩尔CH3Br时,生成CH3OH的摩尔数。
五、综合题(共30分)16. 设计一个实验方案,用于合成对硝基苯酚,并简要说明实验步骤和预期产物。
17. 描述如何通过核磁共振氢谱区分以下化合物:苯、甲苯和乙苯,并解释它们谱图上的主要差异。

2..命名下列各化合物或写出结构式(每题 1分,共10 分)1.(H 3C )2HCC(CH 3)3c=c"HH2. 3- 乙基-6-溴-2-己烯-1-醇3.5.邻羟基苯甲醛6.苯乙酰胺10.甲基叔丁基醚.试填入主要原料,试剂或产物(必要时,指出立体结构) 式。
(每空2分,共48分)1.7.8.9.对氨基苯磺酸,完成下列各反应4.OHCOOHi'll + C12高温、高压.①。
3 _②_____________________________ H20 zn粉__________________________________3.CH = CH2 HBL^Mg _ ① CH3COCH3 -醯~ ____________________ 一②出0 H+ __*CH3COCI 厂4.5.1, B2H6 -2, H2O2, 0H-*1, Hg(OAc)2,H2O-THF T2, NaBH4 *6.7.NaOHH2O _出0 OH— _SN1历程9.C2H5ONa C2H5ONa10.三.选择题。
(每题2分,共14分)1.与NaOH水溶液的反应活性最强的是((A). CH3CH2COCH2Br (B). CH3CH2CHCH 2Br (C). (CH3)3CH2Br (D). CH3(CH2)2CH2BrCH3对CH3Br进行亲核取代时,以下离子亲核性最强的是:(A). CH3COO- (B). CH3CH2O- (C). C6H5O- (D). OH-3.下列化合物中酸性最强的是( )(A) CH3CCH(E) C6H5OH(B) H2O (C) CH3CH2OH (D) P-O2NC6H4OH(F) P-CH3C6H4OH4.下列化合物具有旋光活性得是:()COOHC, (2R, 3S, 4S)-2,4-二氯-3-戊醇5. 下列化合物不发生碘仿反应的是()A、C6H5COCHB、C2H5OHC、CH3CHCOC2CHD、CHCOC2CH12. —CH3(2)HNO 3H2SO4Fe,HCI (CH3CO) 2OBr2亠(NaOH NaNO2H3PO2* (H2SO42.2 OO3 OH4 O由苯、丙酮和不超过 4个碳原子的化合物及必要的试剂合成:四.鉴别下列化合物(共6分)苯胺、苄胺、苄醇和苄溴由指定原料及不超过四个碳原子的化合物和必要的试剂合成:6.与HNO 作用没有N2生成的是( A HzNCONH B C 、C s HsNHCHD)、CHCH(NH ) COOH 、@HsNH 7.能与托伦试剂反应产生银镜的是 A 、 CCbCOOH BC 、 CH 2CICOOHD 五•从指定的原料合成下列化合物。
有机化学期末考试一试卷A一、按系统命名法命名以下化合物(每题1 分,共 5 分)。
O1、 CH C HCHCHN(CH )22、 CH 3CH 2CH-C-N(CH 2CH 3)32 23 CHCl3CHO3、-COOH 4、NOCH3OHONO 25、 CH--C-3二、写出以下反响的主要产物(每空1 分,共 35 分)1、 CH 3CH 2CH 2CH 2OHNaBr NaCNH SO24OH2、2CHCH OH32CO-H SOOH243、 CHCHCOOH Cl 2(1)NaOH3 2 P(2) +H 3O4、 (CH 3) 3COH NaCH CHBr3 2Mg (1)CH 2-CH 25、 BrCH 3OEt 2O(2) +H 3OOAl[OCH(CH 3) 2] 36、CHCH=CHCHCH+33CH 3CCH 3OHNH NHCONH7、 CH 3CH=CHCH 2OHCrO 3(C 5H 5N) 222CHCl22O8、 CH 3CH 2C-OHSOClNH(CHCH)2223H +3OLiAlH 49、CH 3(1) CH 3I( 过度 )N (2)Ag 2O.H 2OH(1) CH 3I.(2)Ag 2O H 2O(3) 加热10、- -CH 3 + 2- CH 3NaOHHOClN -0-5 C11、-OCHCH+HI23NH 2(CH 3CO)2OHNO12、3H SO2 4CH 3(CH 3CO)2O(C H ) P=CHCH13、6 53 3AlCl 3ONaOCH14、2CH CHC-OC H25322 5OH 215、CHO--C-ClHCHO浓 -OH3Pd/BaSO 4O C16、O CONHBr 2 3H 2ONaOH17、-NO 2 +(NH 4) 2SNO 2Br 218、 S19、CHCOOH 室温3Cl--CH 2Br + NaI三、选择填空(每题 2 分,共 10 分)。
一.命名以下各化合物或写出构造式〔每题1分,共10分〕1.C(CH3)3(H3C)2HCCCHH2.3-乙基-6-溴-2-己烯-1-醇3.OCH34.CHO5.邻羟基苯甲醛6.苯乙酰胺7.OH8.对氨基苯磺酸9.COOH10.甲基叔丁基醚二.试填入主要原料,试剂或产物〔必要时,指出立体构造〕,完成以下各反响式。
〔每空2分,共48分〕1.CHCHBrKCN/EtOHCH2Cl2.1+C12高温、高压O3①②H2OZn粉3. CH=CH2CHHBrMg3COCH3①+H2O醚H②CH3COC14.+CO2CH35.1,B2H6-2,H2O2,OH1,Hg(OAc)2,H2O-THF2,NaBH46.OOOOO7.CH2ClNaOHH2OCl8.CH3-+H2OOHClSN1历程+9.OOCH3C2H5ONaC2H5ONa+CH2=CHCCH3O10.2BrZnEtOHBr11.OC +CH 3+Cl 2H12.CH 3 (2)HNO 3 H 2SO 4Fe,HCl(CH 3CO)2O Br 2NaOHNaNO 2H 3PO 2H 2SO 4三.选择题。
〔每题2分,共14分〕1.与NaOH 水溶液的反响活性最强的是〔〕(A).CH 3CH 2COCH 2Br (B).CH 3CH 2CHCH 2Br (C).(CH 3)3CH 2Br (D).CH 3(CH 2)2CH 2BrCH 32.对CH 3Br 进展亲核取代时,以下离子亲核性最强的是:〔〕(A).CH 3COO-(B).CH 3CH 2O -(C).C 6H 5O -(D).OH -3.以下化合物中酸性最强的是〔〕(A)CH 3CCH (B)H 2O (C)CH 3CH 2OH (D)p-O 2NC 6H 4OH (E)C 6H 5OH (F)p-CH 3C 6H 4OH4.以下化合物具有旋光活性得是:〔〕COOHOHHCH 3A,B,HOHCOOHCH 3C,(2R,3S,4S)-2,4-二氯-3-戊醇 5.以下化合物不发生碘仿反响的是()A 、C 6H 5COC 3HB 、C 2H 5OHC、CH 3CH 2COC 2H C H 3D 、CH 3COC 2H C H 3 36.与HNO2作用没有N2生成的是()A、H2NCON2HB、CH3CH〔NH2〕COOHC、C6H5NHCH3D、C6H5NH27.能与托伦试剂反响产生银镜的是()A、CCl3COOHB、CH3COOHC、CH2ClCOOHD、HCOOH四.鉴别以下化合物〔共6分〕苯胺、苄胺、苄醇和苄溴五.从指定的原料合成以下化合物。
化学有机期末考试题及答案一、选择题(每题2分,共20分)1. 下列化合物中,哪一个是芳香族化合物?A. 甲烷(CH4)B. 乙炔(C2H2)C. 苯(C6H6)D. 甲醛(CH2O)答案:C2. 以下哪个反应属于取代反应?A. 卤代烷的消去反应B. 醇的脱水反应C. 醛的氧化反应D. 醇与氢卤酸的反应答案:D3. 以下哪个是烯烃的同分异构体?A. 环己烷B. 环戊烷C. 1-丁烯D. 2-丁烯答案:D4. 以下哪个反应是可逆反应?A. 酯化反应B. 水解反应C. 聚合反应D. 裂化反应答案:A5. 以下哪个是羧酸的衍生物?A. 醇B. 醛C. 酯D. 醚答案:C6. 以下哪个是酮类化合物?A. 丙酮B. 乙醇C. 乙酸D. 甲酸答案:A7. 以下哪个是氨基酸的α-碳原子?A. 羧基的碳原子B. 氨基的碳原子C. 连接羧基和氨基的碳原子D. 连接R基团的碳原子答案:C8. 以下哪个是糖类物质?A. 葡萄糖B. 甘油C. 甘油三酯D. 氨基酸答案:A9. 以下哪个是蛋白质的一级结构?A. 氨基酸序列B. 蛋白质的空间结构C. 蛋白质的二级结构D. 蛋白质的四级结构答案:A10. 以下哪个是核酸的组成部分?A. 氨基酸B. 核苷酸C. 脂肪酸D. 单糖答案:B二、简答题(每题10分,共30分)1. 描述有机化学反应中的亲电取代反应和亲核取代反应的区别。
答案:亲电取代反应是指亲电试剂攻击含有孤对电子的原子,如卤素离子攻击烷烃中的碳原子,形成新的化学键。
亲核取代反应是指亲核试剂(如氢氧根离子)攻击带正电或部分正电的原子,如醇的羟基攻击酯中的羰基碳原子,形成新的化学键。
2. 什么是手性碳原子?请举例说明。
答案:手性碳原子是指一个碳原子上连接四个不同的原子或原子团,这种结构导致分子具有非超posable的镜像异构体,即手性。
例如,乳酸分子中的第二个碳原子就是一个手性碳原子。
3. 描述什么是消去反应,并给出一个例子。
**************************学年第一学期《有机化学》期末考试试卷第 1 页( 共 4 页)院: 专业: 班级: 姓名: 学号:------------------------------------------------------------------------------------------------------------------------------------------ ---------------------------------------装-----------------------------订---------------------------线----------------------------------****************级化学工程与工艺专业*****班《有机化学》期末考试试卷题号 一 二 三 四 五 六 总分 核分人 得分-------------------------------------------------------------------------------------------------------------------一、命名下列化合物或写结构式(每小题1分,共10分)1.||OH |OHNH 22.H 5C 2OHH H3. 4.5.CH=CHCONH 26.CH 3CHCH 2CHO OH7.3–戊烯–1–炔 8.乙酸丁酯9.3–乙基喹啉 10.邻硝基对甲苯磺酸二、单项选择题(每小题1分,共20分)1.下列化合物能与Ph 3P =CHCH 2CH 3 发生反应的是 ( ) A .MeCOOEt B .EtCOCl C .环己酮 D .EtCONH 22.下列碳正离子最稳定的是 ( )A .CH 2=CHCH 2B .(CH 3)2CHC .CH 2=CCH 3D .CH 3CH 2 3.下列化合物能发生傅—克酰基化反应的是 ( )A .吡啶B .苯C .硝基苯D .2–硝基吡咯 4.下列化合物酸性最弱的是 ( )A .苯酚B .对硝基苯酚C .对甲基苯酚D .对羟基苯酚 5.下列化合物沸点最低的是 ( )A .正己烷B .2–甲基己烷C 正庚烷.D .3,3–二甲基戊烷 6.下列化合物水解反应速度由大到小排列顺序正确的是 ( )a .CH 3CH 2COClb .CH 3CH 2CO 2CH 3c .CH 3CONH 2d .(CH 3CO)2O A .a>d>b>c B .a>b>d>c C .c>b>a>d D .b>c>d>a 7.下列化合物构象最不稳定的是 ( )A .MeCMe 3B .CMe 3Me C .Me CMe 3D .CMe 3Me8.下列化合物按羰基亲核加成反应活性最小的是 ( )A .HCHOB .C 6H 5CHO C .C 6H 4COCH 3D .CH 3COCH 3 9.下列糖中是非还原性二糖的是 ( ) A .蔗糖 B .纤维二糖 C .纤维素 D .淀粉10.下列化合物亲电取代反应活性由大至小排列顺序正确的是 ( ) a .吡咯 b .吡啶 c .呋喃 d .苯A .a>b>c>dB .a>c>d>bC .c>a>b>dD .b>c>a>d 11.下列化合物在酸性条件下,分子内脱水的活性顺序排列正确的是 ( )a .Me 2COHCHMe 2b .Me 2CHCHOHMe得分 阅卷人得分阅卷人**************************学年第一学期《有机化学》期末考试试卷第 2 页(共 4 页)院: 专业: 班级: 姓名: 学号:------------------------------------------------------------------------------------------------------------------------------------------ ---------------------------------------装-----------------------------订---------------------------线----------------------------------c . Me 2CHCH 2CHOHMed .Me 2CHCH 2CH 2CH 2OHA .d>c>b>aB .b>a>c>dC .a>b>c>dD .b>c>a>d 12.下列二元酸受热生成酸酐的是 ( ) A .丙二酸 B .乙二酸 C .己二酸 D .戊二酸 13.下列化合物与异戊二烯按Diels ―Alder 反应的活性大小顺序排列正确的是 ( )①|CH 3②|CN③|CH 2Cl|OCH 3④A .①>②>③>④B .③>②>①>④C .④>②>③>①D .②>③>①>④ 14.下列化合物不能发生歧化反应的是 ( ) A .CH 3COCH 3 B .HCHO C .(CH 3)3CCHO D .C 6H 5CHO 15.下列化合物为S 构型的是 ( )HA.ClIOHCH 3B.HD Ph |CH 3C.H COOH OH C ||CH 3NH 2D.D COOH C |16.下列化合物与HBr 加成反应的相对活性大小顺序排列正确的是 ( )① CH 3CH=CHCH=CH 2 ② CH 2=CHCH 2CH 3③ CH 3CH=CHCH 3 ④ CH 2=CHCH=CH 2A .①>②>③>④B .①>④>③>②C .④>②>③>①D .②>③>①>④ 17.下列化合物能发生碘仿反应,但不能和饱和NaHSO 3溶液反应的是 ( ) A .C 6H 5CHOHC 2H 5 B .C 6H 5COCH 2I C .CH 3COCH 2I D .CH 3CH 2CHO 18.下列化合物与AgNO 3 醇溶液反应速度最快的是 ( )A .BrCH 2CH=CH 2B .CH 3CBr=CH 2C .CH 2CHBrCH 2D .CH 3CH 2Br 19.下列化合物没有芳香性的是 ( )A .B .C .D .20.下列化合物碱性最弱的是 ( )A .NH 3B .C 6H 5NH 2 C .CH 3CH 2NH 2D .(CH 3)2CHNH 2三、完成下列化学反应(每空1分,共20分)1.CH 3CH =CH 2 ( ) 2.Br 2/CCl 43. ( )4.CH 3CH 2C≡CH +H 2O −−−−→−+422/SOH Hg ( ) 5.C 6H 5C ≡CC 6H 5+ H 2−−−−→−催化剂Lindlar ( )6.CH 3 + KMnO 4|△H +7.CH 3CH =CH 2 ()−−−−→−︒C Cl500/2( ) 8.ZnCl 2+ HCHO + HCl9.(1)LiAlH 4(2)H 3O +N HO10.CH 3CH 2CHCH 2CH 3 + HBrOCH 311.(CH 3)3CCCH 3O2.H 3O 1.Cl 2/OH12.OOHNH 2NH 213.OCH 3CHO 稀OHCHO14.PhCHO + HCHONaOH( ) + ( )15.CH 3COClCH 2CH 2NH 2得分 阅卷人( )H 3B 2H 6H 2O 2,OH-C 6H 5CH=CH 2 +HBr ROOR ( )( ) ( )( )+( ) ( )( )( )( )**************************学年第一学期《有机化学》期末考试试卷第 3 页( 共 4 页)院: 专业: 班级: 姓名: 学号:------------------------------------------------------------------------------------------------------------------------------------------ ---------------------------------------装-----------------------------订---------------------------线----------------------------------16.H 2OCH 3INCH 3Ag 2O四、用化学方法鉴别和分离提纯化合物 (每小题5分,共15分 )1.鉴别A. 己烯,B. 乙炔,C. 甲苯2.鉴别A. 正丁醇,B. 叔戊醇,C. 2–丁醇,D. 3–戊醇3.分离提纯A. 苯胺,B. 二苯胺,C. 三苯胺五、推断题(共20分)1.某烃A(C 4H 8),在低温下与氯气作用生成B(C 4H 8Cl 2),在高温下与氯气作用则生成C(C 4H 7Cl)。
2014级金属有机化学期末考试一、写出下列有机配体、金属配合物、有机金属化合物的结构或名称1、Zeise 盐2、Vaska3PIr ClCOPPh3CH3I3、Wilkinson配合物ClRh (Ph3P)34、BINAP5、9-BBN6、二环辛二烯合镍Ni7、双(η5-环戊二烯基)合铁8、三(羰基)(1-6-η6-环庚三烯)合铬CrCO9、Ni(COD)210、RhCl(PPh 3)3 Wilkinson配合物11、η5- CpMn(CO)312、Fe (CO )513、MoH 4(PPh 3) 414、η5- Cp2ZrCl 215、Et 2AlCl 二乙基铝二、解释下列各名词1、金属有机化合物含有金属-碳键(M-C )的化合物定义为金属有机化合物2、过渡金属有机化合物含有过渡金属-碳键(M-C)的化合物,过渡金属含有d电子,在(n-1)d, ns, np原子构型中,(n-1)d轨道能级与ns接近,它们皆可参与成键。
符合18电子规则。
3、18电子规则对于稳定的单核反磁过渡金属络合物,其金属外层的电子数与配体配键的电子数的总和等于18。
只有当金属具有稳定的惰性气体结构时才能形成热力学稳定的过渡金属有机化合物。
4、EAN电子规则过渡金属配合物的中心(形成体)倾向于与一定数目的配体结合,以使自身周围的电子数等于同周期稀有气体元素的电子数5、环状多烯π-金属配合物6、高自旋配合物成对能(P)大于分裂能(△)的配合物,当P>△时, 因电子成对需要的能量高, 电子将尽量以单电子排布分占不同的轨道, 取高自旋状态。
7、低自旋配合物成对能(P)小于分裂能(△)的配合物,当P<△时, 电子成对耗能较少, 此时将取低自旋状态。
8、反馈π-键烯烃的π电子配位到金属的σ空轨道,形成σ授予键,同时充满电子的金属d 轨道与烯的反键空轨道π*相重叠,形成π反馈键。
9、晶体场分裂能中心离子的d轨道的简并能级因配位场的影响而分裂成不同组能级之间的能量差,以△表示10、电子成对能所谓成对能是电子在配对时为了克服静电场的排斥作用所需的能量, 通俗地讲就是使自旋成对的两个电子占据同一轨道所必须付出的能量, 以P表示。
11、光谱化学序列将一些常见配体按光谱实验测得的分裂能从小到大次序排列起来,便得光谱化学序列12、配位饱和及配位不饱和满足18电子规则的化合物称为配位饱和的络合物,否则为配位不饱和络合物13、插入反应不饱和烃或含有孤对电子的化合物插入过渡金属有机物的M-C, M-X或M-H键的反应称为插入反应,其逆反应称为反插入(脱出)反应14、还原消除反应还原消除(reductive elimination)是氧化加成反应的逆反应,其氧化态及配位数均降低2。
还原消除反应是一个协同过程,伴随着氧化数降低和配位数减少,其实质是过渡金属有机物的一种分解反应。
还原消除反应是催化反应中给出有机产物的一步。
15、氧化加成反应中性分子加到配位不饱和的低价过渡金属有机配合物上,使配合物中心金属的配位数和氧化态都同时上升的反应16、Heck反应在三乙胺存在下,醋酸钯催化卤代芳烃与烯烃反应生成苯乙烯型化合物17、Suzuki偶联反应在Pd(PPh3)4催化下,芳基硼酸与溴或碘代芳烃的交叉偶联反应.该反应因具有反应条件温和、可容忍多种活性官能团、受空间位阻影响不大、产率高以及芳基硼酸经济易得且对潮气不敏感等优越性而成为普遍适用的C一C键偶联方法。
三、完成下列合成反应Bu t Oi,t BuMgClii,H3O+?(1)HOBu tBu ti3ii,H2O?(2)Tl(TFA)TFAH TFA=trifuoroacetate hv???(3)Br+Ni(CO)4DMF25C?(4)7.CCHH 3C (CH 3CH 2)2BHCCH 3CHB(CH 3CH 2)2H,+8.Al 1.5H 2+2Et 3AlC 5-30MPa9.4PPh 32RhCl 3+RhCl(PPh 3)3 ,NO 2OCIr PPh 3Ph 3P103CH 2=CH 2 + Al + 3/2H 2(CH 3CH 2)3Al11.C 6H 5Br + LiC 6H 5Li, (C 6H 5)2CuLi 13.Fe + 5CO197压力3CFe(CO)5,14.CoCO 3++8CO压加147CO2H 2Co 2(CO)8, Co 4(CO)1215.+Ni(acac)2OPhPPh 3Ni(COD)2,17.n-C 4H 9Br + 2Li3n-C 4H 9Li,CCHC 3H 7H 3CPh+19.BuLiCH TMEDAO1)3CH 2Li,HCPhCEtEt2 BuLi 20.+ CuI2(Bu)2CuLi,PhCH=CHCH 2Bu21.+THF(BH 3)2HB,BGrignard试剂合成方程式为:RX + Mg RMgXEthers/THF硼氢化反应方程式为:硼氢化反应是反马氏规则的顺式加成四、1970年Monsanto公司最先在工业上实现了手性铑配合物催化C=C不对称加氢,合成治疗帕金森综合症的特效药L-Dopa。
催化剂就是含手性双膦配体(R, R)-Dipamp的Wilkinson型配合物,得到94%ee的L-Dopa。
直到20世纪90年代Burk (杜邦公司)发现更好(99%ee)的配体DuPhos。
后来,Noyori发现新类型的手性配体(R) or (S)-BINAP,其Rh络合物催化不对称氨基酸合成的ee%最高达100%;后来用其Ru络合物催化各种官能化烯烃的氢化,如用来合成非麻醉性消炎止痛药Naproxen(萘普生)和i-Buprofen(S-异丁基布洛芬)。
试写出这三种手性配体的结构式。
五、完成下列叙述题1、举例说明何谓有机金属化合物,何谓金属配合物,它们在结构和性能上有何异同。
金属有机化合物含有金属-碳键(M-C)的化合物金属与有机配体键合,但不存在直接的金属-碳键,也不是金属有机化合物,而是配位化合物。
2、简述有机金属化合物的特性。
3、简述配合物的18电子规则,并应用18电子规则说明下列化合物的稳定性差异。
(1)Fe(η5-C5H5)2(2) Ti(η5-C5H5)2 (3) Co(η5-CH5)25Fe(η5-C5H5)2 Fe2+ 6电子C5H5- 6电子6+2*6=18Ti(η5-C5H5)2 Ti2+2电子C5H5- 6电子2+2*6=14 不稳定Co(η5-C5H5)2 Co 2+ 6电子C5H5- 6电子6+2*6=18 不稳定,但可以再失1个电子来稳定4、简述配合物的EAN规则和18电子规则,并应用18电子规则说明二茂铁与二茂镍的稳定性差异。
(1)Fe(η5-C5H5)2(2) Ni(η5-CH5)25Fe(η5-C5H5)2 Fe2+ 6电子C5H5- 6电子6+2*6=18Ni(η5-C5H5)2 Ni 2+ 6电子C5H5- 6电子6+2*6=18 不稳定,但可以再失1个电子来稳定5、根据晶体场理论说明二价锌的配合物通常为无色配合物,而三价钛分别与不同配体结合后产生不同颜色,如:[Ti(OH2)6]3+带有紫色这是因为在晶体场的影响下,过渡金属离子的d轨道发生分裂,由于这些金属离子的d轨道没有充满,在吸收了一部分光能后,就可产生从低能量的d轨道向高能量d轨道的电子跃迁,这种跃迁称d-d跃迁。
配离子的颜色是从人射光中去掉被吸收的光,剩下来的那一部分可见光所呈现的颜色。
吸收光的波长越短,表示电子跃迁(被激发)所需要的能量越大,亦即Δ大,反之亦然。
而Zn2+d-d分裂能Δ值在可见光范围外~无色在配位场的作用下,裂分的这些d能级对理解经典的配位化合物的吸收光谱、磁性和esr谱十分重要。
但在金属有机化学中,因为过渡金属有机物中由d-d跃迁引起的光谱带常被强的“电荷转移”吸收所掩盖。
事实上,随着10DQ变大,d-d跃迁光谱移至紫外区域。
所以三价钛分别与不同配体结合后产生不同颜色,[Ti(OH2)6]3+带有紫色6、简述在八面体配合物中,d轨道裂分形成t2g轨道和eg轨道的原理并画出能级裂分图。
7、简述在四配位的正四面体过渡金属配合物中,d轨道裂分形成t2轨道和e轨道的原理并画出能级裂分图,标出相应能级的轨道符号,计算出△t值。
六、写出下列过渡金属催化反应的反应1、写出乙烯通过催化水合反应合成乙醛的反应机理(画出催化循环过程图),并说明每一步反应属于何种基元反应。
瓦克(Wacker)以顺时针方向分别是配体解离,烯烃配位,烯烃插入和氧化加成,还原消除。
2、由丁烯在Wilkinson催化剂作用下合成戊醛的反应机理(画出催化循环过程图),并写出每步基元反应的名称。
顺时针分别是烯烃配位,配体解离,氧化加成,烯烃插入,配体配位,还原消除,氧化加成,配体解离,烯烃配位。
3、由Ni(CO)4催化下,由乙炔、乙醇合成丙烯酸乙酯的反应机画出催化循环过程图,并写出每步基元反应的名称。
HC CH H 2C CH 2COOR4、写出在Wilkinson 配合物[RhCl (PPh 3)3]催化下,均相氢化合成4-(2-硝基乙基)亚甲二氧基苯的反应机理(画出催化循环过程图),并说明每一步反应属于何种基元反应。
O NO 2O ONO2100%5.给出金属有机化学基元反应的各个名称,并分别举例说明。
⑴配体的配位和解离;⑵ 氧化加成和还原消除;(3) 插入和脱出(反插入)反应; (4) 配体与外来试剂的反应CpCo(CD 3)2PPh 3 + CH 2=CH 2CpCo(CD 3)2CH 2=CH 2 + PPh 3RCOCo(CO)4RCOCo(CO)39+1+2×4 = 189+1+2×3 = 16RCOCo(PPh 3)(CO)39+1+2+2×3 =18- CO+ PPh 36.简述18电子规则的原理及应用,并举5个以上的典型例子加以说明。
18电子规则:对于稳定的单核反磁过渡金属络合物,其金属外层的电子数与配体配键的电子数的总和等于18。
只有当金属具有稳定的惰性气体结构时才能形成热力学稳定的过渡金属有机化合物。
它是一个经验规则,满足18电子规则的化合物称为配位饱和的络合物,否则为配位不饱和络合物。
18电子规则的重要性:根据n+2x(CN)=18, 当电子数n固定时, 配合物的最高配位数可推知, 同时也可以推测配合物的几何构型。
d6电子构型,为六配位的八面体;d10电子构型,为四配位四面体。
具有同种d电子构型的络合物,配位数和配合物的构型相同。
7.Fischer型卡宾和Schrock型卡宾在结构特点和反应性能上的不同之处在于:Fischer特点:含有一个或两个与卡宾C相连的杂原子(O, N )。