促卵泡成熟激素(FSH)作业指导书
- 格式:doc
- 大小:66.50 KB
- 文档页数:5

促卵泡生成素(FSH)检测标准操作程序一、目的:明确促卵泡生成素检测的操作规程,指导检验人员正确进行促卵泡生成素的检测,保证检测结果及时可靠。
二、范围:适用于进行促卵泡生成素检测的检验人员。
三、职责:实验操作人员应严格按操作规程进行实验。
四、检测原理:本试剂盒采用化学发光技术,用于对临床血清或血浆标本中的促卵泡生成素检测,本品可用于对诊断和治疗垂体和性腺功能紊乱起辅助作用。
本品的检测灵敏度为0.1mIU/mL,定量测定范围最高可达170 mIU/mL。
五、试剂:1. 来源:美国Siemens Medical Solutions Diagnostics[国食药监械(进)字2010第2402535号]。
2. 规格:100人份/盒。
3. 试剂盒组成:六、仪器:IMMULITE 1000七、操作程序1、仪器准备1.1接通电源,打开UPS,启动仪器。
1.2打开计算机,显示器和打印机。
1.3检察蒸馏水瓶、清洗液瓶和底物瓶,检查大、小注射器1.4打开升温程序,密切观察升温情况。
1.5仪器到达测量温度后,进行初始化操作。
1.6输入工作表。
2、样本处理用带滤芯吸嘴吸取150ul 血清,加入到0.5ml样本杯中,按样本编号依次加入。
注意:1、EDTA血浆不可当作样本使用。
2、必须确定离心处理前样本已经完全充分凝集,以避免纤维蛋白对结果得影响。
3、试剂准备将试剂瓶从4℃冰箱中取出,观察试剂量并打开盖子,装入试剂托盘,放入试剂仓。
4、检测程序4.1 将样本杯和测试杯放入平台4.2 仪器运行过程中需密切观察。
4.3 测试完成后,利用LIS将结果传入计算机,并打印中文报告5、清洗程序将清洗液放入试剂托盘1号位置,进入清洗程序,运行关机程序。
关机后,取出样本杯和测试杯,取出试剂托盘,盖好试剂瓶盖,放入冰箱。
关闭电源。
6.结果判断6.1 对于0.1≤测定结果<170 mIU/mL的样本,报告相应的测定结果。
6.2对于测定结果≥170 mIU/mL的样本,所测结果仅供参考,报告上注明≥170 mIU/mL。

促性腺激素释放激素刺激试验
促性腺激素释放激素刺激试验
促性腺激素释放激素刺激试验
促性腺激素释放激素(LHRH)为下丘脑分泌激素,主要刺激促黄体激素生成(LH)的
分泌,但也刺激促卵泡成熟激素(FSH)的分泌。
本试验主要了解垂体LH和FSH贮备功能,对进入青春发育期和骨龄超过12岁者进行此试验有较大的临床意义。
不必空腹,也可在空腹状态。
置塑料静脉管,以备取血。
取0时静脉血,测定LH,FSH及E2(女性)或睾酮(男性)。
静脉推入
LHRH2.5ug/kg,最大剂量为100ug,静脉注射后
15min、30min、60min、90min、120min分别取血测定LH和
FSH,在120min时同时测定雌二醇(女性)或睾酮(男性)。
无LH、FSH峰值出现者,考虑垂体病变或青春期前或少数
LH、FSH峰值增高,可发生于性早熟,Turner综合征,
Kallmann综合征,偶尔可见于甲状腺功能减退。
正常小儿对LHRH反应强度LH>FSH,注射后15~30min达
峰值,LH峰值至少为基础值2倍,FSH峰值常无明显规律。
正常反应见于体质性青春发育延迟。

促卵泡成熟激素(FSH)测定标准操作规程1 检验申请单独检验项目申请:血清促卵泡成熟激素(缩写FSH);临床医生根据需要提出检验申请。
2 标本采集与处理2.1标本采集2.1.1常规静脉采血约3ml,置普通试管中。
采用血清标本的也可采用含分离胶的真空采血管。
2.1.2检验申请单和血标本试管标上统一且唯一的标识符。
2.1.3急诊标本采集后,在检验申请单上填写标本采集时间。
2.1.4标本采集后与检验申请单一起及时运送至检验科,标本运送时应冷藏保温。
专人负责标本的接收并记录标本的状态,对不合格标本予以拒收。
2.1.5下列标本为不合格标本2.1.5.1标本量不足:少于0.5ml的全血标本,或少于0.3ml的血清或血浆。
2.1.5.2 对反应吸光度有干扰的标本,包括严重溶血、严重浑浊的标本。
2.1.5.3无法确认标本与申请单对应关系的。
2.1.5.4其他如标识涂改、标本试管破裂等。
2.2标本保存2.2.1接收标本后在30min内将标本离心分离出血清或血浆, 避免溶血。
离心必须达到4000rpm×15min,离心后的血浆或血清中不能含有颗粒物或微量纤维蛋白,并应尽快将血浆或血清与血细胞分离。
2.2.2标本保存时间:标本置2~8℃可稳定24h,需较长时间保存应将血清存放于-20℃。
2.2.3已完成测试的标本保持完整的识别号,置4~8℃冰箱内保存7d。
2.3标本采集的注意事项2.3.1采血前使受检者保持平静、松弛、避免剧烈活动,清晨禁食状态下采血。
3 方法原理ARCHITECT FSH检测是采用两步骤免疫检测,化学发光微粒免疫检测(CMIA)技术,对人血清中的FSH进行定量检测。
4 试剂及其他用品 4.1 试剂盒名称:FSH4.2 试剂盒来源/产品号:美国雅培公司。
4.3 试剂盒保存:在2~8℃冰箱保存下可稳定至有效期内,不可冰冻。
在仪器试剂仓内可稳定336h 。
4.4 试剂盒准备:液体试剂,开盖后即可使用。


促卵泡生成素测定标准操作规程1.检验原理:ARCHITECT尿促卵泡素项目采用两步法免疫检测,运用ChemifIeX技术,即化学发光微粒子免疫检测(CMTA)技术与灵活的检测模式结合,测定人血清和血浆中的尿促卵泡素。
第一步,混合样本和抗一B尿促卵泡素包被顺磁性微粒。
样本中的尿促卵泡素与抗一B尿促卵泡素包被微粒相结合。
冲洗后进入第二步,添加UY咤酯标记的抗一。
尿促卵泡素结合物。
向反应混合物中添加预激发液和激发液;然后测量产生的化学发光反应,用相对发光单位(RLUS)表示。
样本中的尿促卵泡素含量与ARCHITECTi光学系统检测到的RLUS值之间成正比。
2.试剂主要组成成分2.1试剂盒微粒子:抗-B尿促卵泡素(小鼠,单克隆)包被的微粒子,储存于含有蛋白(牛和鼠)稳定剂的2-(N-吗啡咻)乙磺酸(MES)缓冲液中。
最低浓度:0.1%固体物质。
防腐剂:抗菌剂。
结合物:1或4瓶(5.9mL∕26.3mL)口Y咤酯标记的抗一Q尿促卵泡素(小鼠,单克隆)结合物,储存于含有蛋白(牛)稳定剂的2-(2吗啡咻)乙磺酸(MES)缓冲液中。
最低浓度:45ng/mLo防腐剂:抗菌剂。
2.2需要但未提供的试剂预激发液:预激发液含有1.32%(W/V)过氧化氢激发液:激发液含有0.35N氢氧化钠浓缩清洗缓冲液:浓缩清洗缓冲液含有磷酸盐缓冲液。
防腐剂:抗菌剂。
3.样本要求:人血清(包括采集于血清分离管中的血清)或采集于肝素或EDTA 钾抗凝管中的血浆。
血清和血浆样本中应不含纤维蛋白、红细胞或其他颗粒物质。
2-8C可保存7天;TOC以下可保存6个月。
样本应避免反复冻融。
4.检验方法:仪器法(详见雅培i1000标准操作规程)6.1促卵泡生成素项目通过四参数Logistic曲线拟合数据约简法(4PLC,Y加权)生成一条校准曲线7.2结果单位换算:(浓度mIU∕mL)X(I)=IU/L7.检验方法的局限性7.1检测结果用于诊断时,应当与其他数据,如症状、其他检测结果、临床表现等结合使用。

促卵泡生成素测定试剂盒(化学发光免疫分析法)2.性能指标2.1试剂性能指标2.1.1外观和物理检查试剂盒各组分应齐全、完整,液体无渗漏;中文包装标签应清晰、明确、牢固,无划破或缺失部分。
其中:酶标记物应为清澈均匀的液体,无沉淀,无絮状物;磁微粒应无板结,液体内无絮状物,无异物;2.1.2装量试剂各组分实际装量不少于额定装量。
2.1.3最低检出限应不大于0.2mIU/mL。
2.1.4准确度试剂盒内校准品与相应浓度的国家标准品同时进行分析测定,用四参数拟合,要求两条剂量-反应曲线不显著偏离平行;以FSH国家标准品为对照品,试剂盒内校准品的实测值与标示值的效价比应在0.900~1.100之间。
2.1.5线性在0.3mIU/mL~190mIU/mL范围内,用四参数拟合,剂量-反应曲线的线性相关系数r应≥0.9900。
2.1.6精密度2.1.6.1分析内精密度测试试剂盒质控品各10次,其变异系数(CV)应不大于8.0%。
2.1.6.2批间精密度使用3个批号试剂检测试剂盒质控品,3个批号试剂之间的批间变异系数(CV)应不大于15.0%。
2.1.7质控品测定值同一套质控品的测定结果应在靶值范围内。
2.1.8特异性2.1.8.1与促甲状腺素(TSH),浓度不低于1000μIU/mL的TSH,在本试剂盒上的测定结果应不高于0.2mIU/mL。
2.1.8.2与人绒毛膜促性腺激素(HCG),浓度不低于20000m IU/mL的HCG,在本试剂盒上的测定结果应不高于0.2mIU/mL。
2.1.8.3与促黄体生成素(LH),浓度不低于250mIU/mL的LH,在本试剂盒上的测定结果应不高于0.2mIU/mL。
2.1.8.4与人生长激素(HGH),浓度不低于500ng/mL的HGH,在本试剂盒上的测定结果应不高于0.2mIU/mL。
2.1.8.5与人垂体催乳素(PRL),浓度不低于500ng/mL的PRL,在本试剂盒上的测定结果应不高于0.2mIU/mL。

《文件已阅声明表》《Procedure Circulation Form》文件名称(File Name): 卵泡刺激素(FSH)检测作业指导书《文件本次修改记录表》《Procedure Amendment Form》《文件信息表》《Procedure Information Form》卵泡刺激素检测作业指导书1.目的检测人血清或血浆样本中卵泡刺激素(FSH)的浓度,作临床辅助诊断用。
2.检测原理采用Chemiflex®的化学发光微粒子免疫检测(CMIA)技术,对人血清,血浆中卵泡刺激素进行定量测定。
第一步,将混合样本和抗-β卵泡刺激素包被顺磁性微粒。
样本中的卵泡刺激素与抗-β卵泡刺激素包被微粒相结合。
冲洗后进入第二步,添加抗-α卵泡刺激素抗体吖啶酯标记结合物。
然后向反应混合物中添加预激发液和激发液。
对产生的化学发光反应物进行测量,以相对光单位(RLUs)表示。
样品中的卵泡刺激素含量与ARCHITECT i光学系统检测到的RLUs值成正比。
3.样本的采集和贮存3.1 ARCHITECT卵泡刺激素项目可以使用人血清(包括采集于血清分离管中的血清)或采集于肝素钠、肝素锂或EDTA 钾抗凝管中的血浆。
3.2标本溶血超过+++以上的情况下退单。
3.3稳定性: 2-8℃可稳定7天3.4样本贮存: 2-8℃保存10天4.试剂和仪器4.1试剂成分:4.1.1检测试剂盒ARCHITECT促卵泡激素测定试剂盒(7K75)微粒子:1瓶或4瓶(6.6ml/27.0ml)抗-β卵泡刺激素(小鼠,单克隆)包被微粒,储存于MES缓冲液中(含鼠和山羊蛋白稳定剂)。
防腐剂:抗菌剂。
结合物:1瓶或4瓶(5.9ml/26.3ml)抗-α卵泡刺激素(小鼠,单克隆)吖啶酯标记结合物,储存于MES缓冲液中(含牛蛋白稳定剂)。
最低浓度:45ng/mL。
防腐剂:抗菌剂。
4.1.2项目专用稀释液 1瓶(100ML)ARCHITECT i多项目手工稀释液,含有磷酸盐缓冲盐溶液。

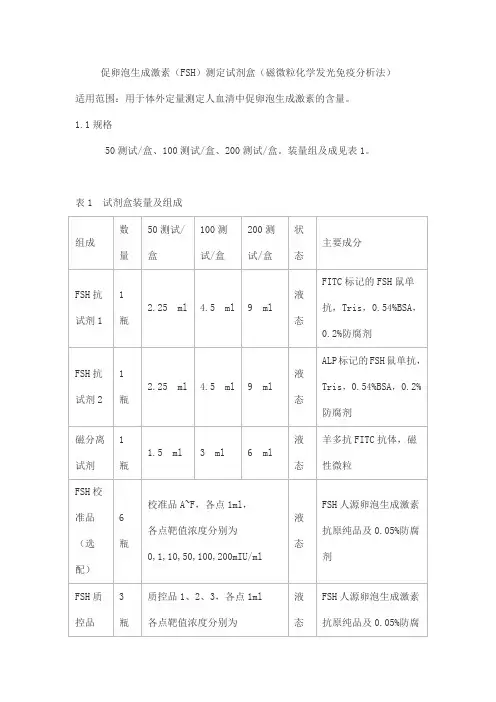
促卵泡生成激素(FSH)测定试剂盒(磁微粒化学发光免疫分析法)适用范围:用于体外定量测定人血清中促卵泡生成激素的含量。
1.1规格50测试/盒、100测试/盒、200测试/盒。
装量组及成见表1。
表1 试剂盒装量及组成2.1 外观2.1.1 试剂盒各组分应齐全、完整、液体无渗漏;2.1.2 磁分离试剂摇匀后为均匀悬浊液,无明显凝集;2.1.3 液体组分应澄清,无沉淀或絮状物;2.1.4 包装标签应清晰,无磨损。
2.2准确性试剂盒内校准品与相应浓度的国家标准品同时进行分析测定,用对数或其他适当的数字模型拟合,要求两条剂量-反应曲线不显著偏离平行;以FSH国家标准品(标准品编号:150533)为对照品,试剂盒内校准品的实测值与标示值的效价比应在0.9-1.1之间。
2.3最低检出限应不大于0.1mIU/ml。
2.4线性在(0.2,200)mIU/ml的测量范围内,试剂盒的相关系数r应≥0.99。
2.5精密度2.5.1分析内精密度变异系数(CV)应不大于8%。
2.5.2 分析间精密度在三次独立分析之间,质控品测定结果的变异系数(CV%)≤10%。
2.6质控品测值测值应在质控范围内。
2.7批间差批间变异系数(CV)应不大于15.0%。
2.8分析特异性2.8.1 与促甲状腺激素(TSH)含浓度不低于4000mIU/L TSH的零浓度FSH样本,在本试剂盒上测定的结果应不高于2.5mIU/ml。
2.8.2 与人绒毛膜促性腺激素(HCG)含浓度不低于500000 mIU/ml HCG的零浓度FSH样本,在本试剂盒上测定的结果应不高于3.0mIU/ml。
2.8.3 与促黄体生成素(LH)含浓度不低于5000mIU/ml LH的零浓度FSH样本,在本试剂盒上测定的结果应不高于0.2mIU/ml。
2.9稳定性效期稳定性:试剂盒在2~8℃贮存,有效期为12个月,到效期后检测试剂盒的外观、准确度、最低检出限、线性、分析内精密度和质控品测值,应符合2.1~2.5.1、2.6的要求。

促卵泡生成素(FSH)检测试剂盒(胶体金免疫层析法)适用范围:本产品用于体外定性检测人尿液样本中促卵泡生成素(卵泡刺激素)的水平。
1.1 包装规格条型:50人份/盒;板型:25人份/盒。
1.2 主要组成条型产品包括50人份的检测试纸条、干燥剂和尿杯。
板型产品包括25人份的检测卡(检测卡由检测试纸条和塑料卡塞两部分组成)、干燥剂、小吸管和尿杯。
检测试纸条主要由PVC塑料底板、样品垫、聚酯膜、硝酸纤维素膜和吸水板组合而成,聚酯膜上喷有胶体金标记的鼠抗人促卵泡生成素单克隆抗体,硝酸纤维素膜上分别包被了鼠抗人促卵泡生成素单克隆抗体和羊抗鼠多克隆抗体。
2.1 物理性状2.1.1 外观应整洁完整、无毛刺、无破损、无污染;材料附着牢固。
2.1.2 膜条宽度应≥2.5mm。
2.1.3 液体移行速度应≥10mm/min。
2.2 临界值及重复性产品的临界值为20mIU/mL。
a)重复检测25 mIU/mL的促卵泡生成素样品液20次,结果的阳性率应≥95%。
b)重复检测15 mIU/mL的促卵泡生成素样品液20次,结果的阴性率应≥95%。
2.3 特异性分别检测300mIU/mL促黄体生成素(LH)、20uIU/mL促甲状腺素(TSH)、200mIU/mL 人绒毛膜促性腺激素(HCG)样品液,结果应均为阴性。
2.4 HOOK效应检测浓度为600mIU/mL的促卵泡生成素样品液,反应结果应为阳性。
2.5 批间差抽取三个批次的试纸,按产品临界值及重复性的检验方法检测,各批次反应结果应一致并符合临界值及重复性检测的要求。
2.6 稳定性产品于4~30℃储存有效期为24个月,取到有效期后两个月内的产品进行检测,分别检测2.1、2.2和2.4项,检测结果应符合各项目的要求。
北京索莱宝科技有限公司
注射用垂体促卵泡素(FSH)
货号:F8470
规格:100单位
保存:遮光,密闭,在凉暗处保存,有效期2年。
性状:白色或类白色的冻干块状或粉末。
药理作用:在垂体促黄体素的协同作用下,本品能促进卵巢卵泡生长发育和雌激素的分泌引起正常的发情。
适应症:用于治疗卵巢静止、持久黄体、卵泡发育停滞等。
用法与用量:肌肉注射:一次量,马、驴200-300单位,每日或者隔一日一次,2-5次为一个疗程;乳牛100-150单位,隔2日一次,2-3次为一个疗程。
临用前,以灭菌生理盐水2-5ml稀释。
不良反应:母畜发情前大量剂量使用可引起超数排卵。
注意事项:用药前,必须检测查卵巢变化,并以此修正剂量和用药次数。
停药期:28天,奶7天。
第1页,共1页。
注射用重组人促卵泡激素制造及检定暂行规程本品系由含有高效表达人促卵泡激素基因的中国仓鼠卵巢(CHO)细胞,经过细胞培养,分离和高度纯化后冻干制成。
含有维持其稳定性作用的保护剂,不含防腐剂和抗生素。
适应症为①不排卵(包括多囊卵巢综合症[PCOD])且对枸橼酸克罗米酚治疗无反应的妇女。
②对于进行超排卵期或辅助生育技术,如体外受精-胚胎移植(IVF)、配子输卵管内移植(GIFT)和合子输卵管内移植(ZIFT)D的患者,本品可刺激多卵泡发育。
1.基本要求1.1设施与生产质量管理按中国《药品生产质量管理规范》要求实施。
1.2原料及辅料应符合现行《中华人民共和国药典》2005版二部或《中国生物制品主要原辅材料质控标准》的要求。
未纳入上述标准的化学试剂,应不低于化学纯。
1.3生产用水生产用水源水应符合饮用水标准,纯化水及注射用水应符合现行《中华人民共和国药典》2005版二部标准。
1.4生产用器具直接用于生产的金属或玻璃等器具,应经过严格清洗及去热原质处理或灭菌处理。
2.制造2.1工程细胞2.1.1名称及来源重组人促卵泡激素工程细胞系由带有人促卵泡激素α和β链基因的重组质粒共转染的CHO-K1细胞系。
2.1.2 种子库建立、传代及保存从原始细胞库的细胞传代,扩增后冻存于液氮中,作为主细胞库;从主细胞库传代,扩增后冻存于液氮中,建立工作细胞库。
每次传代不超过批准的代次。
细胞系冻存于液氮中,检定合格后方可用于生产。
2.1.3主细胞库及工作细胞库细胞的检定应符合“生物制品生产用动物细胞基质制备及检定规程”规定。
2.1.3.1外源因子检查细菌和真菌(附录XII A)、支原体(附录XII B)、病毒检查(附录XII C)。
2.1.3.2细胞鉴别实验应用同工酶分析、生物化学、免疫学、细胞学和遗传学标记物等任一方法进行鉴别,应为典型CHO细胞。
2.1.3.3重组人促卵泡激素表达量应不低于原始细胞库细胞表达量。
2.2原液2.2.1细胞的复苏与扩增从工作细胞库来源的细胞复苏后,于无血清、无蛋白培养基中进行传代和扩增,供转瓶或细胞培养罐接种用。