第2章 1生化实验中的缓冲液
- 格式:ppt
- 大小:233.50 KB
- 文档页数:73

缓冲液的作用缓冲液(Buffer)是一种在生物化学实验和生物技术应用中广泛使用的重要试剂。
缓冲液的作用是维持溶液的酸碱度,使溶液能够在一定范围内保持稳定的pH值。
它能够吸收或释放氢离子,防止溶液的pH值在生物样品制备过程中发生大的变化,从而保证实验结果的准确性和稳定性。
缓冲液的主要作用有以下几个方面:1. 维持稳定的pH值:生物系统对环境的pH值非常敏感,许多生物反应的速率和效率都与pH值密切相关。
在生物化学实验中,许多酶的活性和反应速率也与pH值密切相关。
使用缓冲液可以维持反应体系的稳定pH值,确保实验结果的准确性。
例如,在PCR反应中,利用缓冲液可以使DNA的两股链在适当的温度下解离,然后在合适的温度下进行扩增,从而保证PCR反应的稳定进行。
2. 抵消酸碱物质的影响:许多生物样品制备过程中会产生酸碱物质,如CO2、HCl、NaOH等。
这些酸碱物质的存在会对溶液的pH值产生影响,从而影响到实验结果。
而缓冲液具有一定的抗酸碱能力,可以吸收或释放一定数量的氢离子,从而防止酸碱物质对溶液pH值的影响。
3. 维持生物体内稳定的酸碱平衡:生物体内维持一定的酸碱平衡对于细胞正常的生理功能至关重要。
生物体内的酶活性、代谢过程、膜通透性等都与细胞的酸碱平衡密切相关。
使用缓冲液可以在一定程度上模拟细胞内的酸碱环境,从而保持细胞的正常功能。
4. 提高反应的效率和稳定性:许多生化反应需要在一定的酸碱环境中进行,缓冲液可以提供和维持适宜的酸碱环境,从而提高反应的效率和稳定性。
例如,在蛋白质电泳实验中,使用缓冲液可以使样品具有适当的电导率和离子浓度,从而保证电泳反应的正常进行。
总结起来,缓冲液在生物化学实验中扮演着至关重要的角色。
它能够维持溶液的稳定pH值,抵消酸碱物质的影响,维持生物体内的酸碱平衡,提高反应的效率和稳定性。
因此,正确选择和使用合适的缓冲液对于生物化学实验的成功与否至关重要。

生物化学常用缓冲液(一)基本概念⑴ Bronsted-Lowry酸碱理论(酸碱质子理论):1923年由丹麦化学家J.N.Brφnsted和英国化学家T.M.Lowry同时提出了酸碱质子学说,认为凡能释放质子的分子或离子(如:H2O,HCl,NH4+,HSO4- 等)称为酸,凡能接受质子的分子或离子(如:H2O,NH3,Cl-等)称为碱。
因此,一种酸释放质子后即成为碱,称为该酸的共轭碱,同样一种碱与质子结合后,形成对应的酸,称为该碱的共轭酸。
如盐酸在水中的解离:HCl Cl- +H+HCl是酸,Cl-是它的共轭碱。
pH = pKa+log{[质子受体]/[质子供体]}⑵缓冲体系的设计:1960年,N.E.Good和他的同事们提出,适合生命科学研究使用的缓冲体系应具有以下特性:① pKa值在6-8之间;②在水中的溶解度高;③不易穿透生物膜;④盐效应小;⑤离子浓度、溶液组成和温度对解离的影响小;⑥不与金属离子生成复合物或沉淀;⑦该缓冲剂化学稳定;⑧紫外和可见光波长范围内光吸收小;⑨易制得高纯度的盐。
(二)生物化学常用缓冲液⑴磷酸盐缓冲液:磷酸盐是生物化学研究中使用最广泛的一种缓冲剂,由於它们是二级解离,有二个pKa值,所以用它们配制的缓冲液,pH范围最宽:NaH2PO4: pKa1=2.12, pKa2=7.21Na2HPO4: pKa1=7.21, pKa2=12.32配酸性缓冲液:用NaH2PO4,pH=1-4,配中性缓冲液:用混合的两种磷酸盐,pH=6-8,配碱性缓冲液:用Na2HPO4,pH=10-12。
用钾盐比钠盐好,因为低温时钠盐难溶,钾盐易溶,但若配制SDS-聚丙烯酰胺凝胶电泳的缓冲液时,只能用磷酸钠而不能用磷酸钾,因为SDS(十二烷基硫酸钠)会与钾盐生成难溶的十二烷基硫酸钾。
磷酸盐缓冲液的优点为:①容易配制成各种浓度的缓冲液;②适用的pH范围宽;③pH受温度的影响小;④缓冲液稀释后pH变化小,如稀释十倍后pH的变化小于0.1。

实验室常用试剂和缓冲液配方实验室中常用的试剂和缓冲液种类繁多,根据实验需求,可以根据不同的试剂和缓冲液配方来满足实验要求。
以下是一些常见的试剂和缓冲液配方,以及其用途和制备方法。
1. 磷酸缓冲液(Phosphate buffer)磷酸缓冲液常用于生化和分子生物学实验中,用于控制溶液的pH值,适用于酸性和碱性条件下。
常见的配方包括0.1M磷酸盐缓冲液(pH7.2-7.4),需要用磷酸盐和盐酸或氢氧化钠来制备。
2. 氯化钠溶液(Sodium chloride solution)氯化钠溶液是实验室中常见的缓冲液配方之一,通常用于调节生物样品的渗透压和离子浓度。
可以制备不同浓度的氯化钠溶液,常见的配方为0.9%氯化钠溶液(生理盐水)。
3. 碳酸氢盐缓冲液(Bicarbonate buffer)碳酸氢盐缓冲液常用于细胞培养和生理实验中,用于维持细胞培养基或实验液的pH稳定。
一种常见的配方为10mM碳酸氢盐缓冲液(pH7.2-7.4),需要用碳酸氢钠和盐酸来制备。
4. Tris缓冲液(Tris buffer)Tris缓冲液是一种常见的生化实验缓冲液,可以调节到不同的pH值。
常见的配方为50 mM Tris缓冲液(pH 7.4),需要用Tris(三氯甲烷磺酸,Tris-HCl)和盐酸来制备。
5. PBS缓冲液(Phosphate-buffered saline)PBS缓冲液是一种用于细胞和组织处理的常见缓冲液,具有稳定pH值和离子浓度的特点。
常见的配方为10mMPBS缓冲液(pH7.4),需要用磷酸盐和盐酸或氢氧化钠来制备。
6. 甘氨酸缓冲液(Glycine buffer)甘氨酸缓冲液常用于蛋白质电泳实验中,用作电泳缓冲液和传递缓冲液。
常见的配方为25mM甘氨酸缓冲液(pH8.3),需要用甘氨酸和盐酸来制备。
7. BSA溶液(Bovine serum albumin solution)BSA溶液是实验室中常见的蛋白质标准物质,用于测定蛋白质浓度和酶活性等实验。

常用的三种标准缓冲溶液
1. 磷酸盐缓冲溶液,磷酸盐缓冲溶液是一种常用的生物化学和
分子生物学实验中使用的缓冲溶液。
常见的磷酸盐缓冲溶液包括磷
酸盐缓冲液(PBS)、Tris-HCl缓冲液等。
磷酸盐缓冲溶液的pH范
围广,能够在不同的实验条件下稳定维持所需的pH值。
2. 乙酸/乙酸钠缓冲溶液,乙酸/乙酸钠缓冲溶液是另一种常用
的生物化学实验中使用的缓冲溶液。
它主要由乙酸和乙酸钠组成,
能够在酸性条件下有效地维持所需的pH值。
乙酸/乙酸钠缓冲溶液
在许多生化实验中被广泛应用,如蛋白质电泳、核酸电泳等。
3. 碳酸氢盐缓冲溶液,碳酸氢盐缓冲溶液是一种常用的生物化
学实验中使用的缓冲溶液,由碳酸氢盐和碳酸盐组成。
碳酸氢盐缓
冲溶液通常用于在生理pH范围内进行实验,如细胞培养、酶反应等,能够有效地维持稳定的pH值。
这三种标准缓冲溶液在生物化学、分子生物学和生物医学实验
中被广泛应用,能够提供稳定的pH环境,保证实验的准确性和可重
复性。
在实验设计和操作中,选择合适的缓冲溶液对于实验结果的
准确性和稳定性至关重要。
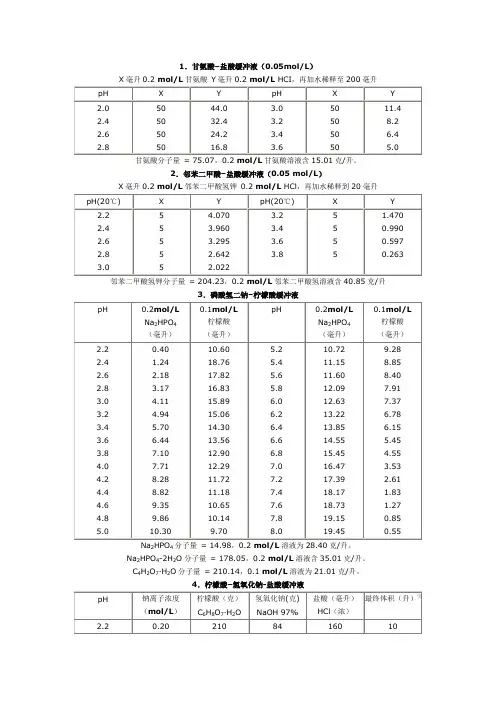
1.甘氨酸–盐酸缓冲液(0.05mol/L)X毫升0.2 mol/L甘氨酸Y毫升0.2 mol/L HCI,再加水稀释至200毫升甘氨酸分子量= 75.07,0.2 mol/L甘氨酸溶液含15.01克/升。
2.邻苯二甲酸–盐酸缓冲液(0.05 mol/L)X毫升0.2 mol/L邻苯二甲酸氢钾0.2 mol/L HCl,再加水稀释到20毫升邻苯二甲酸氢钾分子量= 204.23,0.2 mol/L邻苯二甲酸氢溶液含40.85克/升3.磷酸氢二钠–柠檬酸缓冲液24分子量= 14.98,0.2 mol/L溶液为28.40克/升。
Na2HPO4-2H2O分子量= 178.05,0.2 mol/L溶液含35.01克/升。
C4H2O7·H2O分子量= 210.14,0.1 mol/L溶液为21.01克/升。
4.柠檬酸–氢氧化钠-盐酸缓冲液① 使用时可以每升中加入1克克酚,若最后pH 值有变化,再用少量50% 氢氧化钠溶液或浓盐酸调节,冰箱保存。
②5.柠檬酸–柠檬酸钠缓冲液(0.1 mol/L )柠檬酸C 6872柠檬酸钠Na 3 C 6H 5O 7·2H 2O :分子量294.12,0.1 mol/L 溶液为29.41克/毫升。
6.乙酸–乙酸钠缓冲液(0.2 mol/L )2.63.84.0 4.2 4.4 4.60.75 1.20 1.80 2.65 3.70 4.909.25 8.80 8.20 7.35 6.30 5.104.85.0 5.2 5.4 5.6 5.85.90 7.00 7.90 8.60 9.10 9.404.10 3.00 2.10 1.40 0.900.60Na 2Ac·3H 2O 分子量 = 136.09,0.2 mol/L 溶液为27.22克/升。
7.磷酸盐缓冲液(1)磷酸氢二钠–磷酸二氢钠缓冲液(0.2)242Na 2HPO 4·2H 2O 分子量 = 358.22,0.2 mol/L 溶液为71.64克/升。

缓冲溶液缓冲液是一种能在加入少量酸或碱时抵抗pH改变的溶液。
在生化研究工作中,常常要用到缓冲溶液来维持实验体系的酸碱度。
缓冲液是一种能在加入少量酸或碱时抵抗pH改变的溶液。
PH缓冲系统对维持生物的正常pH值,正常生理环境起重要作用。
多数细胞仅能在很窄的pH 范围内进行活动,而且需要有缓冲体系来抵抗在代谢过程中出现的pH变化。
在生物体中有三种主要的pH缓冲体系,它们时蛋白质、重碳酸盐缓冲体系。
每种缓冲体系所占的分量在各类细胞和器官中是不同的。
在生化研究工作中,常常要用到缓冲溶液来维持实验体系的酸碱度。
研究工作的溶液体系pH值的变化往往直接影响到我们工作的成效。
如果提取酶实验体系的pH值变化或变化过大,会使酶活性下降甚至完全失活。
由弱酸及其盐组合一起使具有缓冲作用。
生化实验室常常用的缓冲系主要有磷酸、柠檬酸、碳酸、醋酸等系统,在生化实验或研究工作中要慎重地选择缓冲体系,因为有时影响实验结果的因素并不是缓冲液的pH值,而是缓冲液中的某种离子。
如硼酸盐、柠檬酸盐、磷酸盐和三羟甲基甲烷等缓冲剂都可能产生不需要的反应。
1. 可能反应硼酸盐:硼酸盐与许多化合物形成复盐、如蔗糖。
柠檬酸盐:柠檬酸盐离子容易与钙结合,所以存在有钙离子的情况下不能使用。
磷酸盐:在有些实验,它是酶的抑止剂或甚至是一个代谢物,重金属易以磷酸盐的形式从溶液中沉淀出来。
而且它在pH7.5以上时缓冲能力很小。
2.缓冲液的pH值的决定因素(1)缓冲液的pH值与该酸的电离平衡常数K及盐和酸的浓度有关。
弱酸一定,但酸和盐的比例不同时,可以得到不同的pH值。
当酸和盐浓度相等时,溶液的pH值与PK值相同。
(2)酸和盐浓度等比例也增减时,溶液的pH值不变。
(3)酸和盐浓度相等时,缓冲液的缓冲效率为最高,比例相差越大,缓冲效率越低,一般地说缓冲液有效缓冲范围为PK±1pH。
3.缓冲溶液在药物生产中的应用:在药物生产中,药物的疗效、稳定性、溶解性以及对人们的刺激性均必须全面考虑。

实验室常用试剂缓冲液的配制方法实验室中常常需要使用各种试剂和缓冲液,以下是一些常用试剂和缓冲液的配制方法及其用途。
1.NaCl溶液配制:NaCl作为实验室常用的盐类试剂,可用于生化、分子生物学等多个实验室操作中。
常用浓度为0.9%(w/v)的生理盐水。
配制方法如下:称取对应质量的NaCl加入蒸馏水中,搅拌溶解,用蒸馏水调整至最终体积。
2.血红蛋白溶液配制:血红蛋白溶液可用于实验室的一些生化、免疫学等实验。
常用方法如下:从新鲜血液中分离出血红蛋白,加入适量的生理盐水或缓冲液,控制pH值为7.4-7.6,并用密闭容器保存。
3. Tris-HCl缓冲液配制:Tris-HCl缓冲液在生物化学实验中广泛应用于DNA/RNA电泳、蛋白质电泳等实验。
常用方法如下:按需求称取Tris固体加入一定量的去离子水中,搅拌溶解,用强碱(比如氢氧化钠)或强酸(比如盐酸)调整pH值至所需范围。
1. Tris缓冲液配制:Tris缓冲液常用于酶反应、凝胶电泳等实验中,配制方法如下:称取适量的Tris固体加入适量的去离子水中,搅拌溶解,用浓盐酸或盐酸调节pH值至所需范围,并用去离子水稀释至最终体积。
2.PBS缓冲液配制:PBS缓冲液在生物学实验中用于细胞培养、免疫染色等操作中。
配制方法如下:称取适量的NaCl、KCl、Na2HPO4、KH2PO4固体加入适量的去离子水中,搅拌溶解,并用去离子水稀释至最终体积,调整pH值至所需范围。
3. Tris-Borate-EDTA(TBE)缓冲液配制:TBE缓冲液常用于核酸凝胶电泳中,配制方法如下:称取适量的Tris固体加入适量的去离子水中,搅拌溶解,用浓盐酸或盐酸调节pH值至所需范围,然后加入Boric acid和EDTA固体,继续搅拌溶解,并用去离子水稀释至最终体积。
以上仅是一些常见的试剂和缓冲液的配制方法,实验室中还会使用到很多其他试剂和缓冲液。
在配制试剂和缓冲液时,需要注意选择合适的纯度的试剂、使用无菌器具和操作台,并遵循相应的实验操作规范和安全要求。

缓冲液原理缓冲液是生物化学实验中常用的一种重要试剂,它可以维持溶液的酸碱度,防止PH值的剧烈波动,保护实验中的生物分子不受到PH值的影响。
那么,缓冲液是如何起到这样的作用的呢?接下来,我们将从缓冲液的原理入手,详细解释缓冲液是如何工作的。
缓冲液是由一种弱酸和它的盐或者一种弱碱和它的盐构成的。
当外界加入强酸或者强碱时,缓冲液中的弱酸或者弱碱会与外界加入的强酸或者强碱发生中和反应,从而抵消外界加入的酸碱物质,使溶液的PH值保持相对稳定。
这是因为弱酸和弱碱的共存形成了一个动态的平衡状态,当外界加入酸碱物质时,这个平衡状态会受到破坏,弱酸或者弱碱会向溶液中释放或者吸收H+离子,从而维持溶液的PH值。
在生物化学实验中,很多生物分子对PH值非常敏感,如果溶液的PH值发生剧烈波动,就会导致生物分子的结构和功能发生改变。
而缓冲液的作用就是可以防止这种情况的发生,它可以使实验环境保持在一个稳定的PH值下,保护生物分子不受到PH值的影响。
因此,缓冲液在生物化学实验中起着非常重要的作用。
此外,缓冲液的工作原理还可以通过麦克斯韦-玻尔兹曼分布定律来解释。
根据这个定律,当溶液中的H+离子浓度发生变化时,溶液中的弱酸或者弱碱会向溶液中释放或者吸收H+离子,从而使溶液的PH值保持相对稳定。
这种动态的平衡状态正是缓冲液起作用的原理之一。
总的来说,缓冲液的原理可以用弱酸和弱碱的共存形成动态平衡状态来解释,当外界加入酸碱物质时,缓冲液中的弱酸或者弱碱会与外界加入的酸碱物质发生中和反应,从而维持溶液的PH值。
这种原理使得缓冲液在生物化学实验中起着非常重要的作用,可以保护生物分子不受到PH值的影响,维持实验环境的稳定。
因此,了解缓冲液的原理对于进行生物化学实验是非常重要的。

生化中常用缓冲试剂及应用生化实验中常用的缓冲试剂包括盐酸/氯化钠缓冲液、磷酸缓冲液、Tris缓冲液、乙二胺四乙酸(EDTA)缓冲液、碳酸氢盐/碳酸钠缓冲液等。
首先,盐酸/氯化钠缓冲液是一种弱酸/弱碱缓冲液,常用于酶活性测定、蛋白质提取和分离等实验中。
其pH调节范围一般在2.0-7.5之间,具有很好的稳定性和可靠性。
然后,磷酸缓冲液可分为无机磷酸盐缓冲液和有机磷酸盐缓冲液。
无机磷酸盐缓冲液可以提供更广泛的pH范围,适用于分子生物学、酶学研究以及细胞培养等实验。
有机磷酸盐缓冲液常用于生物化学分离、柱层析、电泳等实验中。
Tris缓冲液是一种常用的弱酸/弱碱缓冲液。
由于其pKa值较接近生物体内的pH 值,所以在生化实验中被广泛应用。
Tris缓冲液的最适pH范围为7.0-9.0,适用于蛋白质电泳、DNA/RNA纯化等实验。
乙二胺四乙酸(EDTA)缓冲液常用于螯合金属离子,维持实验体系中金属离子的稳定性。
在细胞培养、核酸提取、膜蛋白分离等实验中,EDTA可有效地去除对实验干扰的金属离子。
碳酸氢盐/碳酸钠缓冲液在生化实验中用于模拟生物体内酸碱环境。
这种缓冲液根据需要可调节pH值,并且稳定性较高。
碳酸氢盐/碳酸钠缓冲液在酶活性测定、细胞生长等实验中被广泛应用。
这些缓冲试剂在生化实验中起到了非常重要的作用。
它们能够稳定实验环境的pH值,提供合适的酸碱条件,维持酶的活性,同时可以优化化学反应。
不同的缓冲试剂适用于不同的实验需求。
在实际操作中,要根据所需pH范围、实验样品的性质和实验条件的要求选择合适的缓冲试剂。
除了上述常见的缓冲液外,还有一些特定用途的缓冲试剂。
例如,Tris-EDTA(TE)缓冲液常用于储存DNA和RNA样品,以保持其稳定性。
Tween缓冲液常用于蛋白质或细胞膜的提取和溶解,起到增加样品溶解度和提高蛋白质提取效果的作用。
总之,缓冲试剂在生化实验中是不可或缺的。
它们通过调节溶液的酸碱度,稳定实验条件,保证实验结果的准确性和可重复性。

各种缓冲液配方范文缓冲液是一种在化学、生物学和其他实验室应用中常用的溶液,用于稳定试剂的pH值,以保持实验条件的稳定性。
下面列举了几种常见的缓冲液配方。
1. Tris缓冲液Tris缓冲液是一种非常常见的缓冲液,常用于酶反应和核酸电泳。
它的配方如下:- 200 mM Tris-相应量的盐酸(pH值调节)2.PBS缓冲液PBS缓冲液是一种用于细胞培养和免疫试剂的常用缓冲液。
它的配方参考如下:-137mMNaCl-2.7mMKCl-10mMNa2HPO4-2mMKH2PO4-(pH值调节)3.HEPES缓冲液HEPES缓冲液是一种用于细胞培养和生化实验的常用缓冲液。
它的配方如下:-25mMHEPES-115mMNaCl-5mMKCl-1mMMgCl2-1mMCaCl2-(pH值调节)4.MES缓冲液MES缓冲液是一种用于生化实验和电泳的常用缓冲液。
它的配方如下:-50mMMES- 50 mM Tris-1mMEDTA-相应量的盐酸(pH值调节)5.ACES缓冲液ACES缓冲液是一种用于生化实验和细胞培养的常用缓冲液。
它的配方如下:-10mMACES- 5 mM Tris-10mMCaCl2-(pH值调节)6.TE缓冲液TE缓冲液是一种用于DNA和RNA实验的常用缓冲液。
它的配方如下:- 10 mM Tris-1mMEDTA-(pH值调节)以上列举的是一些常见的缓冲液配方,具体的配方和浓度可能会因实验目的和样品类型而有所不同。
在制备缓冲液时,应该按照实验要求仔细调节pH值,并使用高质量的试剂和纯水来制备缓冲液。
此外,一些缓冲液可能需要在特定的温度下保存或使用,因此在实验之前要对缓冲液的相关要求进行仔细了解和准备。

生物化学实验常用缓冲液的配制方法1、0.2mol/L 磷酸缓冲液*组份浓度0.2mol/L (pH 6.0)*配制量1L*配置方法1.称取磷酸氢二钠.12水8.82 g。
2.称取磷酸二氢钠.2水27.34g。
3.用去离子水溶解并定容至1L。
室温保存。
注意:此为母液,使用时稀释40倍使用。
2、洗脱液*组份浓度0.15mol/L (含0.15mol/L 氯化钠的0.005mol/L pH 6.0的磷酸缓冲液)*配制量10L*配置方法1.称取氯化钠87.66g。
2.用0.2mol/L pH6.0的磷酸缓冲液250mL溶解。
3.用去离子水稀释至10L。
室温保存。
3、0.3mol/L 磷酸缓冲液*组份浓度0.3mol/L (pH7.8)*配制量0.5L*配置方法1.准确称取磷酸氢二钠.12水49.150g。
2.磷酸二氢钠.2水2.000g。
3.用去离子水溶解并定容至0.5L。
室温保存。
注意:此为母液,使用时稀释10 倍使用。
4、0.2mol/L 乙酸缓冲液*组份浓度0.2mol/L (pH4.6)*配制量2L*配置方法1.准确称取乙酸钠.3水54.44g。
2.加入23mL冰乙酸,溶解。
3.用去离子水溶解并定容至2L。
4℃保存。
5、0.2mol/L 磷酸-柠檬酸缓冲液(pH 2.6、4.6、6.6)*组份浓度0.2mol/L*配制量各1L*配置方法1.母液A(0.2mol/L 的Na2HPO4溶液):称取Na2HPO4.12 水143.256g,用去离子水定容至2L。
2.母液B(0.1mol/L 的柠檬酸溶液):称取柠檬酸.1水42.028g用去离子水溶解定容至2L。
3. pH2.6、4.6、6.6的三种缓冲液如下表配制:pH值A(mL)B(mL)2.6 109.0 891.04.6 467.5 532.56.6 727.5 272.54.按上表混匀后,4℃保存。
6、20×SSC 缓冲液*配制量1L(pH7.0)*配置方法1.准确称取175.2g氯化钠。
生物化学实验溶液配制手册序言目录收集各种实验体系用到的缓冲溶液:结构式,理化性质,配制方法第一章免疫学实验常用溶液配制(ELISA、荧光免疫、试纸条等用到的缓冲溶液)第二章分子生物学实常用溶液配制(PCR,基因表达,文库构建等)2.1植物、动物、微生物基因组DNA、RNA的提取与鉴定2.2PCR扩增2.3电泳缓冲液、染料和凝胶加样液2.4分子杂交技术2.5限制性内切酶消化2.6分子克隆全过程第三章细胞生物学实验常用溶液配制第4章生化实验常用溶液配制第5章其他常用溶液配制(抗体保存溶液、培养基配制、菌株保藏、)2.1植物、动物、微生物基因组DNA、RNA的提取与鉴定20×SSCSSC缓冲液主要由氯化钠、柠檬酸钠组成,主要用于RNA杂交(如Northern印迹)、(如Sorthern印迹)等核酸杂交。
Leagene SSC缓冲液(20×,pH7.0)其pH值为7.0主要用于核酸杂交,不同浓度作用不同:常用2×,及0.5×·SSC缓冲液中的盐离子(Na )中和RNA/DNA主链上的负电荷,使其呈电中性,这样可以使探针和把序列的结合比较容易进行。
·2×SSC:高盐洗膜,洗去部分非特异性结合的探针。
·0.5×SSC:低盐洗膜,增加核酸链的严紧性,使得RNA/DNA 之间的排斥力增加。
组份浓度 3.0 M NaCl,0.3 M Na3citrate·2H2O(柠檬酸钠)配制量 1 L配制方法 1.2.3滴加14 N HCl,调节pH值至7.0后,加去离子水将溶液定容至1 L。
4.高温高压灭菌后,室温保存。
20×SSPE Buffer基本信息英文别名:(Ethylenedinitrilo)tetraacetic acid,Edathamil【线性分子式】:(HO2CCH2)2NCH2CH2N(CH2CO2H)2【分子式】:C10H16N2O8【分子量】:292.248(注:EDTA二钠为372.2)。
常用缓冲溶液的配制方法缓冲溶液是在化学实验和生物实验中常用的一种溶液,用于调节溶液的pH值,使其保持在特定的pH范围内。
常用缓冲溶液的配制方法有许多种,下面将介绍几种常见的缓冲溶液的配制方法。
一、Tris缓冲液配制方法:Tris缓冲液是一种常用的生物学缓冲液,常用于蛋白质电泳、酶反应等实验中,其配制方法如下:1. 准备所需的试剂:Tris碱(Tris base,化学名三羟基甲基氨基甲烷)。
2. 在计量瓶中称取适量的Tris碱,并将其溶解于蒸馏水中,得到所需浓度的Tris碱溶液。
3. 调节溶液pH值:使用盐酸(HCl)或氢氧化钠(NaOH)调节Tris溶液的pH值。
通常,Tris缓冲液的pH范围为7-9,具体的pH值取决于实验的要求。
4.定容:将溶液调节至最终所需体积,通过加入蒸馏水来调节。
二、Phosphate缓冲液配制方法:Phosphate缓冲液是生化实验中常用的一种缓冲液,其配制方法如下:1.准备所需的试剂:磷酸二氢钠(NaH2PO4)和磷酸氢二钠(Na2HPO4)。
2.在计量瓶中称取适量的NaH2PO4和Na2HPO4,分别溶解于蒸馏水中,得到所需浓度的NaH2PO4和Na2HPO4溶液。
3.调节溶液pH值:根据所需pH范围选择NaH2PO4和Na2HPO4的比例,同时用盐酸(HCl)或氢氧化钠(NaOH)调节pH值。
4.定容:将溶液调节至最终所需体积。
三、Acetate缓冲液配制方法:Acetate缓冲液是一种常用的酸性缓冲液,在酶反应、DNA电泳等实验中常用,其配制方法如下:1. 准备所需的试剂:乙酸(Acetic acid)和醋酸钠(Sodium acetate)。
2.在计量瓶中称取适量的乙酸和醋酸钠,分别溶解于蒸馏水中,得到所需浓度的乙酸和醋酸钠溶液。
3.调节溶液pH值:根据所需pH范围选择乙酸和醋酸钠的比例,同时用盐酸(HCl)或氢氧化钠(NaOH)调节pH值。
4.定容:将溶液调节至最终所需体积。
缓冲溶液缓冲溶液是一类能够抵制外界加入少量酸和碱的影响,仍能维持pH值基本不变的溶液。
该溶液的这种抗pH变化的作用称为缓冲作用。
缓冲溶液通常是由一或两种化合物溶于溶剂(即纯水)所得的溶液,溶液内所溶解的溶质(化合物)称之为缓冲剂,调节缓冲剂的配比即可制得不同pH的缓冲液。
缓冲溶液的正确配制和pH值的准确测定,在生物化学的研究工作中有着极为重要的意义,因为在生物体内进行的各种生物化学过程都是在精确的pH值下进行的,而且受到氢离子浓度的严格调控,能够做到这一点是因为生物体内有完善的天然缓冲系统。
生物体内细胞的生长和活动需要一定的pH值,体内pH环境的任何改变都将引起与代谢有关的酸碱电离平衡移动,从而影响生物体内细胞的活性。
为了在实验室条件下准确地模拟生物体内的天然环境,就必须保持体外生物化学反应过程有体内过程完全相同的pH值,此外,各种生化样品的分离纯化和分析鉴定,也必须选用合适的pH值,因此,在生物化学的各种研究工作中和生物技术的各种开发工作中,深刻地了解各种缓冲试剂的性质,准确恰当地选择和配制各种缓冲溶液,精确地测定溶液的pH值,就是非常重要的基础实验工作。
下表列出某些人体体液的pH值:有以下特性:① pKa值在6~8之间;② 在水中的溶解度高;③ 不易穿透生物膜;④ 盐效应小;⑤ 离子浓度、溶液组成和温度对解离的影响小;⑥ 不与金属离子生成复合物或沉淀;⑦ 该缓冲剂化学稳定;⑧ 紫外和可见光波长范围内光吸收小;⑨ 易制得高纯度的盐。
按照这些要求可以设计和选择最为合适的缓冲剂来配制所需的缓冲溶液。
生物化学常用缓冲液⑴ 磷酸盐缓冲液磷酸盐是生物化学研究中使用最广泛的一种缓冲剂,由於它们是二级解离,有二个pKa值,所以用它们配制的缓冲液,pH范围最宽:NaH2PO4: pKa1=2.12, pKa2=7.21Na2HPO4: pKa1=7.21, pKa2=12.32配酸性缓冲液:用 NaH2PO4,pH=1~4,配中性缓冲液:用混合的两种磷酸盐,pH=6~8,配碱性缓冲液:用 Na2HPO4,pH=10~12。
生物化学实验常用缓冲液的配制方法
一、TRIS-HCl缓冲液的配制
1、TRIS-HCl缓冲液的配制原理
TRIS-HCl缓冲液,也称为三胍盐缓冲液,是一种有机盐缓冲液。
其配制原理是将三胍钠(三胍氢氯化钠)和氢氯化钠混合在一起,以获得所需的pH值,使其达到缓冲效果。
缓冲效果可以使溶液保持稳定的pH值。
2、TRIS-HCl缓冲液的配制
(1)准备实验室试剂
三胍钠(TRIS),氢氯化钠(NaCl)和蒸馏水
(2)计算配制配方
根据欲得到的pH值和需要的量,计算配制配方。
(3)放置容器
将三胍钠和氢氯化钠分别放入容器中。
(4)添加蒸馏水
用蒸馏水将两种盐分别稀释至相等比例。
(5)搅拌混合
用搅拌器或磁力搅拌器将两种盐混合均匀。
(6)温度调节
将混合物加热至37℃,保持温度,节省时间。
(7)校准pH
用pH计校正混合物的pH值,确保其在正确的pH范围内,调节pH值。
(8)放入瓶中
将缓冲液放入容器中,容器密封后存放,防止受污染。
二、枸橼酸缓冲液的配制
1、枸橼酸缓冲液的配制原理
枸橼酸液是一种有机碱性液,其原理是将枸橼酸(Citric acid)和碳
酸钙(CaCO3)混合在一起,以获得所需的pH值,使其达到效果。
常用缓冲溶液配置方法常用缓冲溶液得配制方法1.甘氨酸–盐酸缓冲液(0、05mol/L)X甘氨酸分子量= 75、07,0、2 mol/L甘氨酸溶液含15、01克/升。
2.邻苯二甲酸–盐酸缓冲液(0、05 mol/L)X邻苯二甲酸氢钾分子量= 204、23,0、2 mol/L邻苯二甲酸氢溶液含40、85克/升Na2HPO4分子量= 14、98,0、2 mol/L溶液为28、40克/升。
Na2HPO4-2H2O分子量= 178、05,0、2 mol/L溶液含35、01克/升。
C4H2O7·H2O分子量= 210、14,0、1 mol/L溶液为21、01克/升。
4①使用时可以每升中加入1克克酚,若最后pH值有变化,再用少量50% 氢氧化钠溶液或浓盐酸调节,冰箱保存。
②5柠檬酸C6H8O7·H2O:分子量210、14,0、1 mol/L溶液为21、01克/升。
柠檬酸钠Na3 C6H5O7·2H2O:分子量294、12,0、1 mol/L溶液为29、41克/毫升。
6.乙酸–乙酸钠缓冲液(0、2 mol/L)Na2Ac·3H2O分子量= 136、09,0、2 mol/L溶液为27、22克/升。
7.磷酸盐缓冲液(1)磷酸氢二钠–磷酸二氢钠缓冲液(0、2)Na2HPO4·2H2O分子量= 178、05,0、2 mol/L溶液为85、61克/升。
Na2HPO4·2H2O分子量= 358、22,0、2 mol/L溶液为71、64克/升。
Na2HPO4·2H2O分子量= 156、03,0、2 mol/L溶液为31、21克/升。
(2)磷酸氢二钠–磷酸二氢钾缓冲液(1/15 mol/L)Na2HPO4·2H2O分子量= 178、05,1/15M溶液为11、876克/升。
KH2PO4分子量= 136、09,1/15M溶液为9、078克/升。
8.磷酸二氢钾–氢氧化钠缓冲液(0、05M)X巴比妥钠盐分子量=206、18;0、04M溶液为8、25克/升10.Tris–盐酸缓冲液(0、05M,25℃)50毫升0、1M三羟甲基氨基甲烷(Tris)溶液与X毫升0、1N盐酸混匀后,加水稀释至100毫升。