碳钢在碳酸铵溶液中的极化曲线
- 格式:wps
- 大小:330.00 KB
- 文档页数:3

极化曲线原理1.在研究可逆电池的电动势和电池反应时电极上几乎没有电流通过,每个电极或电池反应都是在无限接近于平衡下进行的,因此电极反应是可逆的。
当有电流通过电池时,则电极的平衡状态被破坏,此时电极反应处于不可逆状态,随着电极上电流密度的增加,电极反应的不可逆程度也随之增大。
在有电流通过电极时,由于电极反应的不可逆而使电极电位偏离平衡值的现象称作电极的极化。
根据实验测出的数据来描述电流密度与电极电位之间关系的曲线称作极化曲线如图1所示。
金属的阳极过程是指金属作为阳极时,在一定的外电势下发生的阳极溶解过程,如下式所示:M→M n++ne -此过程只有在电极电位大于其热力学电位时才能发生。
阳极的溶解速度随电位变正而逐渐增大。
这是正常的阳极溶出,但当阳极电位正到某一数值时,其溶解速度达到一最大值。
此后阳极溶解速度随着电位变正,反而大幅度的降低,这种现象称为金属的钝化现象。
曲线表明,电位从a 点开始上升(即电位向正方向移动),电流密度也随之增加,电位超过b 点以后,电流密度迅速减至很小,这是因为在金属表面上生成了一层电阻高、耐腐蚀的钝化膜。
到达c点以后,电位再继续上升,电流仍保图1金属极化曲线ab 活性溶解区;b.临界钝化点;bc.过渡钝化区;cd.稳定钝化区;de.超(过)钝化区持在一个基本不变的很小的数值上,电位升到d点时,电流又随电位的上升而增大。
2.影响金属钝化过程的几个因素金属钝化现象已进行了大量的研究工作。
影响金属钝化过程及钝化性质的因素,可归纳为以下几点:(1)溶液的组成。
在中性溶液中,金属一般比较容易钝化,而在酸性或某些碱性的溶液中,则不易钝化;溶液中卤素离子(特别是Cl-)的存在,能明显地阻止金属的钝化;溶液中存在某些具有氧化性的阴离子(如CrO2-4)则可以促进金属的钝化。
(2)金属的化学组成和结构。
各种纯金属的钝化能力不尽相同,例如铁、镍、铬三种金属的钝化能力为铬>镍>铁。

1.电动势法测定AgCl的溶度积Ksp1.本实验可否使用KCl盐桥?为什么实验中不能使用自来水淋洗盐桥?答:本实验不能使用KCl 盐桥,选用盐桥的首要条件是盐桥不与溶液反应,溶液中含有Ag+,会于Cl-反应沉淀。
实验中不能用自来水淋洗盐桥,制备盐桥的首要条件是盐桥中正,负离子迁移速率相近,自来水中含有Ca2+,Mg2+等离子,用其冲洗盐桥,会使盐桥正,负离子迁移相近的条件受到破坏,从而给本实验的测定带来误差。
2. 为什么不能用伏特计直接测定电池电动势?答:电池电动势的测定必须在电流接近于零的条件下进行,倘若用伏特表直接测定,虽然伏特计的内阻非常大,远远大于电池电阻,但用伏特计测定时其电流远大于零,消耗在电池内阻上的电流是不可忽视的。
即使说实验误差偏大,所得实验值与真实值偏大。
3.使用UJ-25型直流电位差计时,长时间按下按钮接通测量线路,对标准电池电动势的标准性以及待测电池电动势的测量有无影响?答:标准电池是高度可逆电池,其工作条件是通过的电流无限大,长时间按下按钮接通测量线路,在电流非无限的条件,会破坏标准电池的可逆性。
标准电池作为标准,受到破坏后,其电动势就变了,再以EX/EN=Ac′/Ac公式计算时,其EN还用原值,从而待测电动势的测量就不准确。
4.使用UJ-25型直流电位差计时,在测定过程中,若检流计光标总往一个方向偏转,可能是哪些原因引起的?答:(1)电池(包括工作电池、标准电池和待测电池)的正负极接反了;(2)电路中的某处有断路;(3)标准电池或待测电池的电动势大于工作电池的电动势,超出了测量范围2.碳钢在碳酸氢铵溶液中极化曲线的测定1.阳极极化曲线对实施阳极保护有什么指导意义?答:分析研究极化曲线,是解释金属腐蚀的基本规律、揭示金属腐蚀机理和探讨控制腐蚀途径的基本方法之一。
2.恒电流法和恒电位法俩种方法所测绘出的极化曲线有何异同?答:恒电流法是恒定电流测定相应的电极电位,恒电位法是恒电位测定相应的电流。



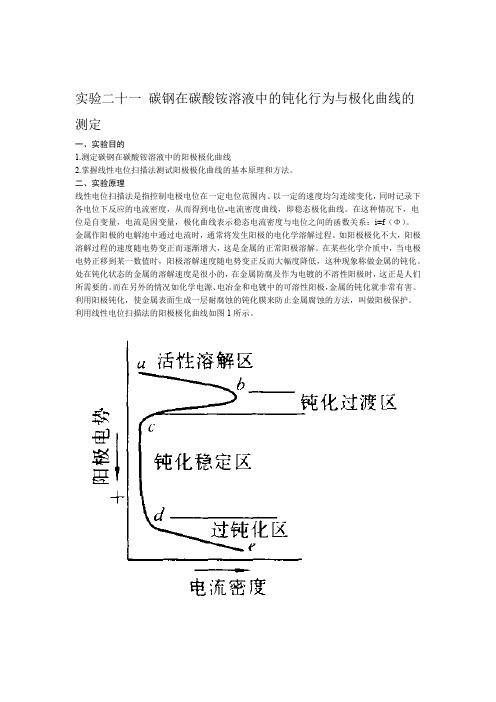
实验二十一碳钢在碳酸铵溶液中的钝化行为与极化曲线的测定一、实验目的1.测定碳钢在碳酸铵溶液中的阳极极化曲线2.掌握线性电位扫描法测试阳极极化曲线的基本原理和方法。
二、实验原理线性电位扫描法是指控制电极电位在一定电位范围内、以一定的速度均匀连续变化,同时记录下各电位下反应的电流密度,从而得到电位-电流密度曲线,即稳态极化曲线。
在这种情况下,电位是自变量,电流是因变量,极化曲线表示稳态电流密度与电位之间的函数关系:i=f(Φ)。
金属作阳极的电解池中通过电流时,通常将发生阳极的电化学溶解过程。
如阳极极化不大,阳极溶解过程的速度随电势变正而逐渐增大,这是金属的正常阳极溶解。
在某些化学介质中,当电极电势正移到某一数值时,阳极溶解速度随电势变正反而大幅度降低,这种现象称做金属的钝化。
处在钝化状态的金属的溶解速度是很小的,在金属防腐及作为电镀的不溶性阳极时,这正是人们所需要的。
而在另外的情况如化学电源、电冶金和电镀中的可溶性阳极,金属的钝化就非常有害。
利用阳极钝化,使金属表面生成一层耐腐蚀的钝化膜来防止金属腐蚀的方法,叫做阳极保护。
利用线性电位扫描法的阳极极化曲线如图1所示。
图1 阳极极化曲线曲线表明,电势从a点开始上升(即电势向正方向移动),电流也随之增大,电势超过b点以后,电流迅速减至很小,这是因为在碳钢表面上生成了一层电阻高、耐腐蚀的钝化膜。
到达c点以后,电势再继续上升,电流仍保持在一个基本不变的、很小的数值上。
电势升至d点时,电流又随电势的上升而增大。
从a点到b点的范围称为活性溶解区;b点到c点称为钝化过渡区;c点到d 点称为稳定区;d点以后称为过钝化区。
对应于b点的电流密度称为致钝电流密度;对应于c-d 段的电流密度称为维钝电流密度。
如果对金属通以致钝电流(致钝电流密度与表面积的乘积)使表面生成一层钝化膜(电势进入钝化区),再用维钝电流(维钝电流密度与表面积的乘积)保持其表面的钝化膜不消失,金属的腐蚀速度将大大降低,这就是阳极保护的基本原理。
极化曲线测量极化曲线测量董泽华为了探索电极过程的机理及影响电极过程的各种因素,包括各种⽔处理剂,缓蚀剂的评价和机理研究,都必须对电极过程进⾏研究,⽽在该研究过程中极化曲线的测定⼜是重要的⽅法之⼀。
⼀般进⾏进化曲线测量1.实验⽅法(⼀)碳钢在弱酸性溶液中的极化曲线(1)⼯作电极为PTFE或环氧树脂镶嵌的A3钢,⾯积为0.5cm2,⼯作电极⽤200,600,800号⾦相砂纸逐级打磨⾄光亮,以⽆⽔⼄醇和丙酮脱脂后,再⽤蒸馏⽔进⾏冲洗,放⼊⼲燥器内⼲燥30mins,然后浸⼊被测溶液中15~50mins, 待电位稳定后进⾏测量。
试验采⽤密闭的玻璃电解池,并置于恒温⽔浴中,试验过程中溶液未除氧。
放在丙酮中除去油污,⽤⽯腊涂抹剩余⾯积,备⽤。
(2)试验介质分别为1000 mg/l H2S+1000 mg/l HCl和1000 mg/l H2S+100 mg/l HCl。
温度为25℃和85℃。
缓蚀剂为某⽯油化⼯⼚提供的”HT-1”和”WS-1”,主要成分为咪唑啉酰胺为1mmol·L-1的盐酸溶液(pH=3),采⽤Pt⽚作为辅助电极,饱和⽢汞电极为参⽐电极。
将⼯作电极安装到装有250mL介质的四⼝烧瓶,与Pt辅助电极、饱和⽢汞电极组成三电极体系。
电解池的连接参见附件⼀。
(3)仪器采⽤华中科技⼤学研制的CS300型电化学测试系统进⾏极化曲线测量,测量控制和数据分析才采⽤corrTest进⾏。
从主菜单中选择“稳态测试”——“动电位扫描”或者直接按“F4”即可进⼊如下窗⼝,其参数设置如下图1所⽰。
温度控制在80℃(恒温⽔浴),扫描速率为0.5mv/s,极化范围为+/-100mV(相对开路电位),曲线采⽤⾮线性三参数⽅法来计算阴阳极Tafel斜率以及腐蚀速率、极化电阻等值。
图1极化曲线参数设置窗⼝电解池参数设置如下图2所⽰,⽤于设定⼯作电极的⾯积,材料化学当量,参⽐电极类型等,这些参数将⽤于腐蚀参数的计算。
图2.电极与电解池参数设置窗⼝此外,恒电位仪的参数设置⼀般可以依照下图3所⽰的参数进⾏,没有特殊需要⽆需修改。
物化实验⼀、蔗糖⽔解反应速度常数的测定蔗糖:本来⼆级反应可看成准⼀级反应:由于本反应中⽔作为溶剂,其量远⼤于蔗糖)蔗糖⽔解:蔗糖⾥加盐酸,蔗糖在盐酸的催化作⽤下反应,盐酸⾥加蔗糖反应速率太快:蔗糖⽔解⽤的仪器:(旋光仪)及测出的量:( 旋光度、⽐旋光度)(随着反应的进⾏,体系的右旋⾓不断减⼩,反应⾄某⼀瞬间,体系的旋光度可恰好等于零,⽽后就变成了左旋,直⾄蔗糖完全转化,这是左旋叫达到最⼤)蔗糖⽔解旋光度的变化:由于⽣物中果糖的左旋性⽐葡萄糖右旋性⼤,所以⽣物呈左旋性质。
因此随着反应的进⾏,体系的右旋⾓不断减⼩,反应⾄某⼀瞬间,体系的旋光度可恰好等于零,⽽后就变成了左旋,直⾄蔗糖完全转化,这是左旋叫达到最⼤5.在旋光度的测量中,为什么要对零点进⾏校正?在蔗糖⽔解反应速率常数的测定实验中若不进⾏校正,对结果是否有影响?如果在实验过程中记录反应开始的时间晚了⼀些,是否会影响到k值的测定?为什么?答:除了被测物有旋光性,可能还有其他物质有旋光性,⼀般要⽤空⽩试剂对零点进⾏校正。
本实验不需要校正,在数据处理中⽤的是两个旋光度的差值。
不影响。
不同时间所作的直线位置不同⽽已,但k(所作直线的斜率)相同。
8.在蔗糖⽔解反应速率常数的测定实验中,配制蔗糖溶液时称量不够准确,对测量结果k有⽆影响?若取⽤盐酸的体积不准呢?在混合蔗糖溶液和盐酸溶液时,我们将盐酸溶液加到蔗糖溶液⾥去,可否将蔗糖溶液加到盐酸溶液中?为什么?答:蔗糖的浓度不影响斜率,因⽽蔗糖的浓度不准对k的测量⽆影响。
H+在该反应体系中作催化剂,它的浓度会影响k的⼤⼩。
如果将蔗糖溶液加到盐酸溶液中,在瞬间体系中氢离⼦浓度较⾼,导致反应速率过快,不利于测定。
⼆、电导法测定弱电解质的电离平衡常数电导测定的应⽤(电离平衡常数、⽔的离⼦积、难容盐的溶度积)三、溶液表⾯张⼒的测定——最⼤⽓泡法如最⼤⽓泡法测表⾯张⼒,R的变化趋势(R的变化趋势先减⼩后增⼤;最⼤附加压⼒△Pm与R的趋势刚好相反;溶质的表⾯吸附量Γ先增⼤后趋于某个数值四、丙酮碘化速度常数的测定丙酮:⼆级反应丙酮碘化:先盐酸与碘混合再加丙酮15、丙酮的碘化反应实验中,通过分光光度法测定碘浓度随时间的变化来量度反应进程,所测量出来的量是:吸光度2.在丙酮的碘化反应实验中,实验时⽤分光光度计测量什么物理量?它和碘浓度有什么关系?在此实验中,将丙酮溶液加⼊盛有I2和HCl溶液的容量瓶中时,反应即开始,⽽反应时间却以溶液混合均匀并注⼊⽐⾊⽫中才开始计时,这样操作对实验结果有⽆影响?为什么?答:溶液吸光度、A=εLc、没有影响、原因:因为测得的是不同时间上的吸光度,根据吸光度作图得其斜率,不同时间所作的直线位置不同⽽已,但k(所作直线的斜率)相同。
碳钢在碳酸铵溶液中的极化曲线
【目的要求】
1. 掌握准稳态恒电位法测定金属极化曲线的基本原理和测试方法。
2. 了解极化曲线的意义和应用。
3. 掌握恒电位仪的使用方法。
【实验原理】
1. 极化现象与极化曲线
为了探索电极过程机理及影响电极过程的各种因素,必须对电极过程进行研究,其中极化曲线的测定是重要方法之一。
我们知道在研究可逆电池的电动势和电池反应时,电极上几乎没有电流通过,每个电极反应都是在接近于平衡状态下进行的,因此电极反应是可逆的。
但当有电流明显地通过电池时,电极的平衡状态被破坏,电极电势偏离平衡值,电极反应处于不可逆状态,而且随着电极上电流密度的增加,电极反应的不可逆程度也随之增大。
由于电流通过电极而导致电极电势偏离平衡值的现象称为电极的极化,描述电流密度与电极电势之间关系的曲线称作极化曲线,如图2-19-1
所示。
图2-19-1 极化曲线
A-B:活性溶解区;B:临界钝化点;B-C:过渡钝化区;
C-D:稳定钝化区;D-E:超(过)钝化区
金属的阳极过程是指金属作为阳极时在一定的外电势下发生的阳极溶解过程,如下式所示:
M→M n++n e
此过程只有在电极电势正于其热力学平衡电势时才能发生。
阳极的溶解速度随电位变正而逐渐增大,这是正常的阳极溶出,但当阳极电势正到某一数值时,其溶解速度达到最大值,此后阳极溶解速度随电势变正反而大幅度降低,这种现象称为金属的钝化现象。
图2-19-1中曲线表明,从A点开始,随着电位向正方向移动,电流密度也随之增加,电势超过B点后,电流密度随电势增加迅速减至最小,这是因为在金属表面生产了一层电阻高,耐腐蚀的钝化膜。
B点对应的电势称为临界钝化电势,对应的电流称为临界钝化电流。
电势到达C 点以后,随着电势的继续增加,电流却保持在一个基本不变的很小的数值上,该电流称为维钝电流,直到电势升到D点,电流才又随着电势的上升而增大,表示阳极又发生了氧化过程,可能是高价金属离子产生,也可能是水分子放电析出氧气,DE段称为过钝化区。
2. 极化曲线的测定
(1) 恒电位法
恒电位法就是将研究电极的电极电势依次恒定在不同的数值上,然后测量对应于各电位下的电流。
极化曲线的测量应尽可能接近体系稳态。
稳态体系指被研究体系的极化电流、电极电势、电极表面状态等基本上不随时间而改变。
在实际测量中,常用的控制电位测量方法有以下两种:
阶跃法将电极电势恒定在某一数值,测定相应的稳定电流值,如此逐点地测量一系列各个电极电势下的稳定电流值,以获得完整的极化曲线。
对某些体系,达到稳态可能需要很长时间,为节省时间,提高测量重现性,往往人们自行规定每次电势恒定的时间。
慢扫描法控制电极电势以较慢的速度连续地改变(扫描),并测量对应电势下的瞬时电流值,以瞬时电流与对应的电极电势作图,获得整个的极化曲线。
一般来说,电极表面建立稳态的速度愈慢,则电位扫描速度也应愈慢。
因此对不同的电极体系,扫描速度也不相同。
为测得稳态极化曲线,人们通常依次减小扫描速度测定若干条极化曲线,当测至极化曲线不
再明显变化时,可确定此扫描速度下测得的极化曲线即为稳态极化曲线。
同样,为节省时间,对于那些只是为了比较不同因素对电极过程影响的极化曲线,则选取适当的扫描速度绘制准稳态极化曲线就可以了。
上述两种方法都已经获得了广泛应用,尤其是慢扫描法,由于可以自动测绘,扫描速度可控制一定,因而测量结果重现性好,特别适用于对比实验。
(2) 恒电流法
恒电流法就是控制研究电极上的电流密度依次恒定在不同的数值下,同时测定相应的稳定电极电势值。
采用恒电流法测定极化曲线时,由于种种原因,给定电流后,电极电势往往不能立即达到稳态,不同的体系,电势趋于稳态所需要的时间也不相同,因此在实际测量时一般电势接近稳定(如1~3min内无大的变化)即可读值,或人为自行规定每次电流恒定的时间。
【仪器试剂】
电化学综合测试系统1套(或恒电位仪1台;数字电压表1只;毫安表1只) ;电磁搅拌器1台;饱和甘汞电极1支;碳钢电极2支(研究电极、辅助电极各1支);三室电解槽1只(见图2-19-2);氮气钢瓶1个。
(NH4)2CO3(2 mol·dm-3);H2SO4(0.5 mol·dm-3);H2SO4(0.5mol·dm-3)+KCl (5.0×10-3mol·dm-3);H2SO4 (0.5 mol·dm-3)+KCl(0.1 mol·dm-3)。
【实验步骤】
碳钢在碳酸铵溶液中的极化曲线
1. 碳钢预处理用金相砂纸将碳钢研究电极打磨至镜面光亮,在丙酮中除油后,留出1cm2面积,用石蜡涂封其余部分。
以另一碳钢电极为阳极,处理后的碳钢电极为
图2-19-2三室电解槽
1-研究电极; 2-参比电极; 3-辅助电极
阴极,在0.5 mol·dm-3H2SO4溶液中控制电流密度为5mA·cm-2,电解10min,去除电极上的氧化膜,然后用蒸馏水洗净备用。
2. 电解线路连接将2mol·dm-3 (NH4)2CO3溶液倒入电解池中,按照图2-19-2中所示安装好电极并与相应恒电位仪上的接线柱相接,将电流表串联在电流回路中。
通电前在溶液中通入N2 5~10min,以除去电解液中的氧。
为保证除氧效果可打开电磁搅拌器。
3. 恒电位法测定阳极和阴极极化曲线
阶跃法
开启恒电位仪,先测“参比”对“研究”的自腐电位(电压表示数应该在0.8V以上方为合格,否则需要重新处理研究电极),然后调节恒电位仪从+1.2V开始,每次改变0.02V,逐点调节电位值,同时记录其相应的电流值,直到电位达到-1.0V为止。
慢扫描法
(1) 测试仪器以LK98-II为例。
(2) 将测试体系的研究电极、辅助电极和参比电极分别和仪器上对应的接线柱相连
(3) 在windows98操作平台下运行“LK98BII”,进入主控菜单;打开主机电源开关,按下主机前面板的“RESET”键,主控菜单显示“系统自检通过”。
否则应重新检查各连接线。
(4) 选择仪器所提供的方法中的“线性扫描伏安法”。
“参数设定”中,“初始电位”设为-1.2V,“终止电位”设为1.0V,“扫描速度”设为10mV/s,“等待时间”设为120s。
选择“控制”子菜单中的“开始实验”,记录并保存实验结果。
(5) 依次降低扫描速度至所得曲线不再明显变化。
保存该曲线为实验测定的稳态极化曲线。
4. 恒电流法测定阳极极化曲线
采用阶跃法。
恒定电流值从0mA开始,每次变化0.5mA,并测量相应的电极电势值,直到所测电极电势突变后,再测定数个点为止。
【注意事项】
1.按照实验要求,严格进行电极处理。
2.将研究电极置于电解槽时,要注意与鲁金毛细管之间的距离每次应保持一致。
研究电极与
3.鲁金毛细管应尽量靠近,但管口离电极表面的距离不能小于毛细管本身的直径。
4.考察Cl-对镍阳极钝化的影响时,测试方式和测试条件等应保持一致
5.每次做完测试后,应在确认恒电位仪或电化学综合测试系统在非工作的状态下,关闭电源,取出电极。
【数据处理】
1. 对阶跃法测试的数据应列出表格。
2. 以电流密度为纵坐标,电极电势(相对饱和甘汞)为横坐标,绘制极化曲线。