第三单元_课题2《原子的结构》
- 格式:ppt
- 大小:649.50 KB
- 文档页数:34



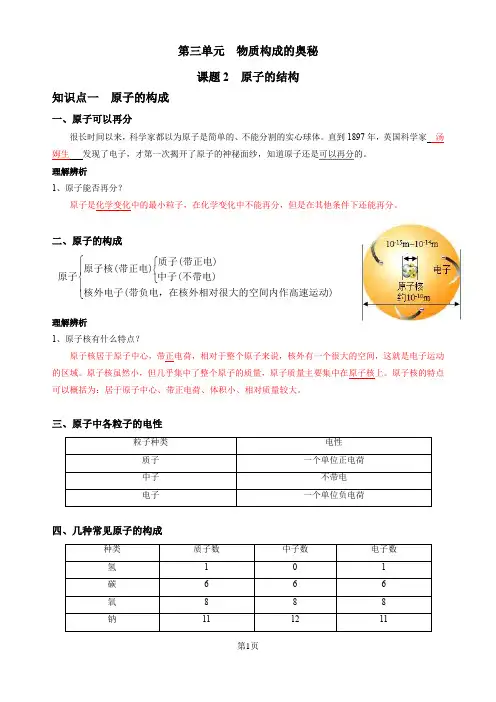
第三单元 物质构成的奥秘课题2 原子的结构知识点一 原子的构成一、原子可以再分很长时间以来,科学家都以为原子是简单的、不能分割的实心球体。
直到1897年,英国科学家 汤姆生 发现了电子,才第一次揭开了原子的神秘面纱,知道原子还是可以再分的。
理解辨析1、原子能否再分?原子是化学变化中的最小粒子,在化学变化中不能再分,但是在其他条件下还能再分。
二、原子的构成⎧⎧⎨⎪⎨⎩⎪⎩质子(带正电)原子核(带正电)原子中子(不带电)核外电子(带负电,在核外相对很大的空间内作高速运动)理解辨析1、原子核有什么特点?原子核居于原子中心,带正电荷,相对于整个原子来说,核外有一个很大的空间,这就是电子运动的区域。
原子核虽然小,但几乎集中了整个原子的质量,原子质量主要集中在原子核上。
原子核的特点可以概括为:居于原子中心、带正电荷、体积小、相对质量较大。
三、原子中各粒子的电性四、几种常见原子的构成理解辨析1、原子一定是由质子、中子、核外电子构成的吗?原子一般由质子、中子、电子这三种粒子构成,但某种氢原子中只有一个质子和一个核外电子,无中子。
五、原子中各种粒子之间的关系1、原子中,质子所带正电荷总数与核外电子所带负电荷总数相等,中子不带电,整个原子不显电性。
2、在原子中,核电荷数=质子数=核外电子数。
3、不同种类的原子,核内质子数不相等。
例题1、下列关于原子的叙述,正确的是( C)A.原子是不能再分的粒子B.一切原子的原子核都是由质子和中子构成的C.原子核内质子数等于核外电子数D.原子核内质子数必等于中子数例题2、有关原子带电情况的解释正确的是(B)A.原子中质子带浮负电,电子带正电B.原子核带正电C.电子不带电D.电子和中子电荷中和使得原子不带电例题3、在分子、原子、质子、中子、电子、原子核这些粒子中选择填空:(1)能保持物质化学性质的粒子是分子;(2)化学变化中的最小微粒是原子;(3)能直接构成物质的粒子是分子、原子;(4)构成原子核的粒子是质子、中子;(5)带正电的粒子是质子、原子核;(6)带负电的粒子是电子;(7)不带电的粒子是中子;(8)质量与氢-1原子质量近似相等的粒子是质子、中子;(9)质量最小的的是电子;(10)在同一原子中数目相等的是质子、电子。





课题2原子结构第1课时原子的构成相对原子质量教材分析一、课标分析认识原子的结构,掌握构成原子各粒子之间的数量关系,能根据原子的核电荷数判断质子数和核外电子数。
了解科学家探究原子结构的过程,培养敢于提出并坚持自己的见解,勇于修正或放弃错误观念的科学态度。
通过学习相对原子质量,让学生体会计算原子质量的大小有特定的标准,进而感悟科学计量的重要性,形成科学的计量观念和计量意识。
二、内容和地位分析本课时的内容是通过了解科学家探究原子的结构的过程,使原子的知识体系更加完整,明确原子的结构。
这是学生初次学习微观物质的内部结构,构建微观与宏观的联系,继续完善微粒观。
同时,对相对原子质量的深刻理解也是后续的定量研究化学物质和化学反应的基础。
本课时的内容具有承上启下的作用,是以后学生学习原子的核外电子排布、离子的基础。
学情分析通过前面的学习,学生已经建立了分子、原子的微观概念,认识了原子的结构,并且知道了原子质量很小,这是本课时的知识基础。
学生之前并没有接触过微观粒子的计量,而相对原子质量又比较抽象,对一般学生来讲理解起来有一定困难。
教学目标1.了解原子是由质子、中子和电子构成的,并能读懂原子结构示意图。
2.根据科学实验证明原子的构成,了解原子的结构,通过抽象的思维了解原子的大小及构成原子的粒子之间的性质特点。
3.通过探究物质构成的奥秘,培养学生的抽象思维能力、想象力和分析推理能力,激发学生对微观世界的探究欲和学习化学的兴趣。
4.能运用概念计算原子的相对原子质量。
5.能说出原子的实际质量与相对原子质量的区别与联系。
6.会查相对原子质量表。
核心素养建立化学观念:物质是由分子、原子构成的。
认识原子的结构以及原子内部各粒子之间的关系。
体会科学计量的重要性,培养学生科学的计量观和计量意识以及敢于提出质疑的科学精神。
重点难点重点:1.原子的构成。
2.相对原子质量的概念和计算。
难点:1.核电荷数、质子数和核外电子数的关系。
2.相对原子质量和原子的实际质量的比较。


人教版化学九年级上册第三单元课题2《原子的结构》教案一. 教材分析《原子的结构》是人教版化学九年级上册第三单元课题2的内容。
这部分教材主要介绍了原子的基本概念、原子核和电子的构成、原子的电子排布以及元素周期表的基本知识。
通过这部分内容的学习,学生可以深入理解原子的内部结构,掌握原子核和电子的相互作用,了解元素周期表的排列规律,为后续学习化学键、化学反应等知识打下基础。
二. 学情分析学生在学习本节课之前,已经掌握了原子和元素的基本概念,对化学学科有一定的认识。
但学生对原子的内部结构、原子核和电子的构成、电子排布等知识的理解还比较模糊,需要通过本节课的学习来进一步深化。
此外,学生对于元素周期表的知识了解较少,需要在本节课中进行引导和讲解。
三. 教学目标1.知识与技能:了解原子的基本概念,掌握原子核和电子的构成,理解原子的电子排布规律,熟悉元素周期表的基本知识。
2.过程与方法:通过观察模型、图示等,培养学生的观察能力和思维能力,提高学生运用科学方法解决问题的能力。
3.情感态度与价值观:激发学生对化学学科的兴趣,培养学生的科学思维,使学生感受到化学知识的广泛应用和实际意义。
四. 教学重难点1.重点:原子的内部结构,原子核和电子的构成,原子的电子排布规律,元素周期表的基本知识。
2.难点:电子排布的规律,元素周期表的排列规律。
五. 教学方法1.讲授法:讲解原子的基本概念,原子核和电子的构成,电子排布规律,元素周期表的基本知识。
2.模型演示法:展示原子模型,帮助学生直观理解原子的内部结构。
3.案例分析法:分析具体案例,引导学生了解元素周期表的实际应用。
4.小组讨论法:分组讨论,培养学生的合作能力和解决问题的能力。
六. 教学准备1.准备多媒体课件,包括原子模型、电子排布图示、元素周期表等。
2.准备相关案例,用于引导学生了解元素周期表的实际应用。
3.准备练习题,用于巩固所学知识。
七. 教学过程1.导入(5分钟)利用多媒体课件展示原子模型,引导学生思考原子的内部结构是什么样子,引出本节课的主题。