Q3C:杂质残留溶剂的指导原则
- 格式:doc
- 大小:138.50 KB
- 文档页数:23

ichq3c溶剂残留指导原则?
答:ICH Q3C是国际药品注册协调委员会(International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use,简称ICH)发布的一系列指导原则之一。
ICH Q3C溶剂残留指导原则旨在提供关于制药产品中有机溶剂残留限量的建议和指导。
这些指导原则主要适用于药品开发和注册过程中的有
机溶剂残留问题,并帮助制药行业确保药品制造过程中使用的有机溶剂不对人体产生不良影响。
ICH Q3C溶剂残留指导原则分为三个部分:
1.ICH Q3C(R6):这个文档提供了关于食品和药品制品中有机溶剂残留限量的概述和指南。
它包含了各种有机溶剂的分类、评估方法和安全性评价。
2.ICH Q3C(R8):这个文档是对Q3C(R6)的更新版本,添加了关于新的有机溶剂的信息,包括氯仿和四氢呋喃等。
3.ICH Q3C(R7):这个文档是对Q3C(R6)的进一步更新版本,修订了关于有机溶剂分类和限量的一些内容。
根据ICH Q3C溶剂残留指导原则,制药企业需要进行有机溶剂残留评估,并确保其产品中的有机溶剂残留量在国际上接受的安全水平范围内。
这有助于确保药品的质量、安全性和有效性。
请注意,具体的有机溶剂残留限量要求可能因地区和国家而异,制药企业在制定和执行相关政策时应考虑当地法规和准则。

杂质:残留溶剂的指导原则1.介绍本指导原则旨在介绍药物中残留溶剂在保证人体安全条件下的可接受量,指导原则建议使用低毒的溶剂,提出了一些残留溶剂毒理学上的可接受水平。
药物中的残留溶剂在此定义为在原料药或赋形剂的生产中,以及在制剂制备过程中产生或使用的有机挥发性化合物,它们在工艺中不能完全除尽。
在合成原料药中选择适当的溶剂可提高产量或决定药物的性质,如结晶型。
纯度和溶解度。
因此.有时溶剂是合成中非常关键的因素。
本指导原则所指的溶剂不是谨慎地用作赋形剂的溶剂,也不是溶剂化物,然而在这些制剂中的溶剂含量也应进行测定,并作出合理的判断。
出于残留溶剂没有疗效,故所有残留溶剂均应尽可能.去,以符合产品规范、GMP或其他基本的质量要求。
制剂所含残留溶剂的水平不能高于安全值,已知一些溶剂可导致不接受的毒性(第一类,表1),除非被证明特别合理,在原药、赋形剂及制剂生产中应避免使用。
一些溶剂毒性不太大(第二类,表2)应限制使用,以防止病人潜在的不良反应。
使用低毒溶剂(第三类,表3)较为理想。
附录1中列出了指导原则中的全部溶剂。
表中所列溶剂并非详尽无遗,其他可能使用的溶剂有待日后补充列人。
第一、二类溶剂的建议限度或溶剂的分类会随着。
新的安全性资料的获得而调整。
含有新溶剂的新药制剂、其上市申请的安全性资料应符合本指导原则或原料药指导原则(Q3A新原料药中的杂质)或新药制剂(Q3B新药制剂中的杂质)中所述的杂质控制原则,或者符合上述三者。
2. 指导原则的范围指导原则范围包括原料药、赋形剂或制剂中所含残留溶剂.因此,当生产或纯化过程中会出现这些溶剂时。
应进行残留溶剂的检验。
也只有在上述情况下,才有必要作溶剂的检查。
虽然生产商可以选择性地测定制剂,但也可以从制剂中各成分的残留溶液水平来累积计算制剂中的残留溶剂。
如果计算结果等于或低于本原则的建议水平,该制剂可考虑不检查残留溶剂,但如果计算结果高于建议水平则应进行检测,以确定制剂制备过程中是否降低了有关溶剂的量以达到可接受水平。

杂质:残留溶剂的指导原则1.介绍本指导原则旨在介绍药物中残留溶剂在保证人体安全条件下的可接受量,指导原则建议使用低毒的溶剂,提出了一些残留溶剂毒理学上的可接受水平。
药物中的残留溶剂在此定义为在原料药或赋形剂的生产中,以及在制剂制备过程中产生或使用的有机挥发性化合物,它们在工艺中不能完全除尽。
在合成原料药中选择适当的溶剂可提高产量或决定药物的性质,如结晶型。
纯度和溶解度。
因此.有时溶剂是合成中非常关键的因素。
本指导原则所指的溶剂不是谨慎地用作赋形剂的溶剂,也不是溶剂化物,然而在这些制剂中的溶剂含量也应进行测定,并作出合理的判断。
出于残留溶剂没有疗效,故所有残留溶剂均应尽可能.去,以符合产品规范、GMP或其他基本的质量要求。
制剂所含残留溶剂的水平不能高于安全值,已知一些溶剂可导致不接受的毒性(第一类,表1),除非被证明特别合理,在原药、赋形剂及制剂生产中应避免使用。
一些溶剂毒性不太大(第二类,表2)应限制使用,以防止病人潜在的不良反应。
使用低毒溶剂(第三类,表3)较为理想。
附录1中列出了指导原则中的全部溶剂。
表中所列溶剂并非详尽无遗,其他可能使用的溶剂有待日后补充列人。
第一、二类溶剂的建议限度或溶剂的分类会随着。
新的安全性资料的获得而调整。
含有新溶剂的新药制剂、其上市申请的安全性资料应符合本指导原则或原料药指导原则(Q3A新原料药中的杂质)或新药制剂(Q3B新药制剂中的杂质)中所述的杂质控制原则,或者符合上述三者。
2. 指导原则的范围指导原则范围包括原料药、赋形剂或制剂中所含残留溶剂.因此,当生产或纯化过程中会出现这些溶剂时。
应进行残留溶剂的检验。
也只有在上述情况下,才有必要作溶剂的检查。
虽然生产商可以选择性地测定制剂,但也可以从制剂中各成分的残留溶液水平来累积计算制剂中的残留溶剂。
如果计算结果等于或低于本原则的建议水平,该制剂可考虑不检查残留溶剂,但如果计算结果高于建议水平则应进行检测,以确定制剂制备过程中是否降低了有关溶剂的量以达到可接受水平。

杂质:残留溶剂的指导原则1 .介绍本指导原则旨在介绍药物中残留溶剂在保证人体安全条件下的可接受量,指导原则建议使用低毒的溶剂,提出了一些残留溶剂毒理学上的可接受水平。
药物中的残留溶剂在此定义为在原料药或赋形剂的生产中,以及在制剂制备过程中产生或使用的有机挥发性化合物,它们在工艺中不能完全除尽。
在合成原料药中选择适当的溶剂可提高产量或决定药物的性质,如结晶型。
纯度和溶解度。
因此.有时溶剂是合成中非常关键的因素。
本指导原则所指的溶剂不是谨慎地用作赋形剂的溶剂,也不是溶剂化物,然而在这些制剂中的溶剂含量也应进行测定,并作出合理的判断。
出于残留溶剂没有疗效,故所有残留溶剂均应尽可能.去,以符合产品规范、GMP或其他基本的质量要求。
制剂所含残留溶剂的水平不能高于安全值,已知一些溶剂可导致不接受的毒性(第一类,表1 ),除非被证明特别合理,在原药、赋形剂及制剂生产中应避免使用。
一些溶剂毒性不太大(第二类,表2 )应限制使用,以防止病人潜在的不良反应。
使用低毒溶剂(第三类,表3 )较为理想。
附录1 中列出了指导原则中的全部溶剂。
表中所列溶剂并非详尽无遗,其他可能使用的溶剂有待日后补充列人。
第一、二类溶剂的建议限度或溶剂的分类会随着。
新的安全性资料的获得而调整。
含有新溶剂的新药制剂、其上市申请的安全性资料应符合本指导原则或原料药指导原则(Q3A 新原料药中的杂质)或新药制剂(Q3B 新药制剂中的杂质)中所述的杂质控制原则,或者符合上述三者。
2. 指导原则的范围指导原则范围包括原料药、赋形剂或制剂中所含残留溶剂.因此,当生产或纯化过程中会出现这些溶剂时。
应进行残留溶剂的检验。
也只有在上述情况下,才有必要作溶剂的检查。
虽然生产商可以选择性地测定制剂,但也可以从制剂中各成分的残留溶液水平来累积计算制剂中的残留溶剂。
如果计算结果等于或低于本原则的建议水平,该制剂可考虑不检查残留溶剂,但如果计算结果高于建议水平则应进行检测,以确定制剂制备过程中是否降低了有关溶剂的量以达到可接受水平。

残留溶剂的指导原则 q3c(r8)下载提示:该文档是本店铺精心编制而成的,希望大家下载后,能够帮助大家解决实际问题。
文档下载后可定制修改,请根据实际需要进行调整和使用,谢谢!本店铺为大家提供各种类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by this editor. I hope that after you download it, it can help you solve practical problems. The document can be customized and modified after downloading, please adjust and use it according to actual needs, thank you! In addition, this shop provides you with various types of practical materials, such as educational essays, diary appreciation, sentence excerpts, ancient poems, classic articles, topic composition, work summary, word parsing, copy excerpts, other materials and so on, want to know different data formats and writing methods, please pay attention!残留溶剂的指导原则 Q3C(R8)残留溶剂是指工艺过程中无法完全去除的有机化合物。

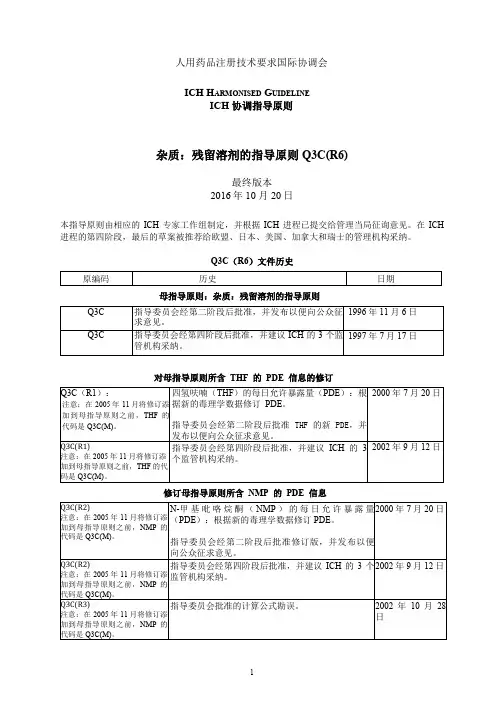
人用药品注册技术要求国际协调会ICH H ARMONISED G UIDELINEICH 协调指导原则杂质:残留溶剂的指导原则 Q3C(R6)最终版本2016年 10 月 20日本指导原则由相应的ICH 专家工作组制定,并根据ICH 进程已提交给管理当局征询意见。
在ICH 进程的第四阶段,最后的草案被推荐给欧盟、日本、美国、加拿大和瑞士的管理机构采纳。
Q3C(R6)文件历史母指导原则:杂质:残留溶剂的指导原则对母指导原则所含THF的PDE信息的修订修订母指导原则所含NMP的PDE信息母指导原则:杂质:残留溶剂的指导原则对母指导原则所含异丙基苯的PDE信息的修订修订母指导原则所含甲基异丁基酮的PDE信息,并纳入三乙胺的PDE乙二醇PDE修正I MPURITIES: G UIDELINE FOR R ESIDUAL S OLVENTS杂质:残留溶剂的指导原则TABLE OF CONTENTS目录PART I:IMPURITIES: GUIDELINE FOR RESIDUAL SOLVENTS (4)第一部分:杂质:残留溶剂的指导原则 (4)1.INTRODUCTION引言 (4)2.SCOPE OF THE GUIDELINE 指导原则的适用范围 (5)3.GENERAL PRINCIPLES通则 (6)3.1Classification of Residual Solvents by Risk Assessment基于风险评估的残留溶剂的分类 (6)3.2 Methods for Establishing Exposure Limits 建立暴露限度的方法 (6)3.3 Options for Describing Limits of Class 2 Solvents 2 类溶剂限度的表示方法 (7)3.4 Analytical Procedures分析方法 (9)3.5 Reporting levels of residual solvents残留溶剂的报告水平 (9)4.LIMITS OF RESIDUAL SOLVENTS 残留溶剂的限度 (10)4.1 Solvents to Be Avoided应避免的溶剂 (10)4.2 Solvents to Be Limited应限制的溶剂 (10)4.3 Solvents with Low Toxic Potential低潜在毒性的溶剂 (12)4.4 Solvents for which No Adequate Toxicological Data was Found 没有足够毒理学数据的溶剂 (13)GLOSSARY术语 (14)APPENDIX 1. LIST OF SOLVENTS INCLUDED IN THE GUIDELINE附录 1:指导原则中包括的溶剂列表 (15)APPENDIX 2. ADDITIONAL BACKGROUND附录 2:其他背景 (18)APPENDIX 3. METHODS FOR ESTABLISHING EXPOSURE LIMITS附录 3:建立暴露限度的方法 (19)PART II:IMPURITIES: RESIDUAL SOLVENTS (MAINTENANCE)PDE FOR TETRAHYDROFURAN第二部分:杂质:残留溶剂(修订)四氢呋喃的 PDE (23)PART III:IMPURITIES : RESIDUAL SOLVENTS (MAINTENANCE) PDE FOR N-METHYLPYRROLIDONE (NMP) 第三部分:杂质:残留溶剂(修订)N-甲基吡咯烷酮(NMP)的 PDE25 PART IV:IMPURITIES : RESIDUAL SOLVENTS (MAINTENANCE) PDE FOR CUMENEICH Harmonised Tripartite Guideline第四部分:杂质:残留溶剂(修订)异丙基苯的 PDE (27)PART V:IMPURITIES : RESIDUAL SOLVENTS (MAINTENANCE)PDE FOR TRIETHYLAMINE AND PDE OF METHYLISOBUTYLKETONE第五部分:杂质:残留溶剂(修订)三乙胺的 PDE 和甲基异丁基酮的 PDE (31)PART I:IMPURITIES: GUIDELINE FOR RESIDUAL SOLVENTS第一部分:杂质:残留溶剂的指导原则Having reached Step 4 of the ICH Process at the ICH Steering Committee meeting on 17 July 1997, this Guideline is recommended for adoption to the three regulatory parties to ICH在 1997 年 7 月 17 日的 ICH 指导委员会会议上进入 ICH 进程第四阶段,并建议 ICH 的三方监管机构采纳该指导原则1.INTRODUCTION引言The objective of this guideline is to recommend acceptable amounts for residual solvents in pharmaceuticals for the safety of the patient. The guideline recommends use of less toxic solvents and describes levels considered to be toxicologically acceptable for some residual solvents.本指导原则旨在建议为保证患者安全而应规定的药物中残留溶剂的可接受量。

杂质:残留溶剂的指导原则1.介绍本指导原则旨在介绍药物中残留溶剂在保证人体安全条件下的可接受量,指导原则建议使用低毒的溶剂,提出了一些残留溶剂毒理学上的可接受水平。
药物中的残留溶剂在此定义为在原料药或赋形剂的生产中,以及在制剂制备过程中产生或使用的有机挥发性化合物,它们在工艺中不能完全除尽。
在合成原料药中选择适当的溶剂可提高产量或决定药物的性质,如结晶型。
纯度和溶解度。
因此.有时溶剂是合成中非常关键的因素。
本指导原则所指的溶剂不是谨慎地用作赋形剂的溶剂,也不是溶剂化物,然而在这些制剂中的溶剂含量也应进行测定,并作出合理的判断。
出于残留溶剂没有疗效,故所有残留溶剂均应尽可能.去,以符合产品规范、GMP或其他基本的质量要求。
制剂所含残留溶剂的水平不能高于安全值,已知一些溶剂可导致不接受的毒性(第一类,表1),除非被证明特别合理,在原药、赋形剂及制剂生产中应避免使用。
一些溶剂毒性不太大(第二类,表2)应限制使用,以防止病人潜在的不良反应。
使用低毒溶剂(第三类,表3)较为理想。
附录1中列出了指导原则中的全部溶剂。
表中所列溶剂并非详尽无遗,其他可能使用的溶剂有待日后补充列人。
第一、二类溶剂的建议限度或溶剂的分类会随着。
新的安全性资料的获得而调整。
含有新溶剂的新药制剂、其上市申请的安全性资料应符合本指导原则或原料药指导原则(Q3A新原料药中的杂质)或新药制剂(Q3B新药制剂中的杂质)中所述的杂质控制原则,或者符合上述三者。
2. 指导原则的范围指导原则范围包括原料药、赋形剂或制剂中所含残留溶剂.因此,当生产或纯化过程中会出现这些溶剂时。
应进行残留溶剂的检验。
也只有在上述情况下,才有必要作溶剂的检查。
虽然生产商可以选择性地测定制剂,但也可以从制剂中各成分的残留溶液水平来累积计算制剂中的残留溶剂。
如果计算结果等于或低于本原则的建议水平,该制剂可考虑不检查残留溶剂,但如果计算结果高于建议水平则应进行检测,以确定制剂制备过程中是否降低了有关溶剂的量以达到可接受水平。

摘自Q3C-残留溶剂的指导选择一类溶剂:应避免致癌物;备受怀疑的致癌物;环境危害物二类溶剂:设定残余量,限量使用非基因性动物致癌物;可能导致不可逆中毒,比如神经性中毒,畸形;可能导致其他可逆性中毒三类溶剂: 低毒对人体有潜在毒性,可以接触,但不超过50mg/day。
If Class 1 solvents are likely to be present, they should be identified and quantified."Likely to be present" refers to the solvent used in the final manufacturing step and to solvents that are used in earlier manufacturing steps and not removed consistently by a validated process.ICH规定3类只要干失小于0.5, 但1,2类并不是不能出现。
按照毒性大小和对环境的危害程度,该指导原则将溶剂分成三类(所列举的溶剂并不完全,应对合成和生产过程所有可能的残留溶剂进行评估):第一类溶剂是指已知可以致癌并被强烈怀疑对人和环境有害的溶剂。
在可能的情况下,应避免使用这类溶剂。
如果在生产治疗价值较大的药品时不可避免地使用了这类溶剂,除非能证明其合理性,残留量必须控制在规定的范围内,如:苯(2ppm)、四氯化碳(4ppm)、1,2-二氯乙烷(5ppm)、1,1-二氯乙烷(8ppm)、1,1,1-三氯乙烷(1500ppm)。
第二类溶剂是指无基因毒性但有动物致癌性的溶剂。
按每日用药10克计算的每日允许接触量如下:2-甲氧基乙醇(50ppm)、氯仿(60ppm)、1,1,2-三氯乙烯(80ppm)、1,2-二甲氧基乙烷(100ppm)、1,2,3,4-四氢化萘(100ppm)、2-乙氧基乙醇(160ppm)、环丁砜(160ppm)、嘧啶(200ppm)、甲酰胺(220ppm)、正己烷(290ppm)、氯苯(360ppm)、二氧杂环己烷(380ppm)、乙腈(410ppm)、二氯甲烷(600ppm)、乙烯基乙二醇(620ppm)、N,N-二甲基甲酰胺(880ppm)、甲苯(890ppm)、N,N-二甲基乙酰胺(1090ppm)、甲基环己烷(1180ppm)、1,2-二氯乙烯(1870ppm)、二甲苯(2170ppm)、甲醇(3000ppm)、环己烷(3880ppm)、N-甲基吡咯烷酮(4840ppm)、。


杂质:残留溶剂的指导原则1.介绍本指导原则旨在介绍药物中残留溶剂在保证人体安全条件下的可接受量,指导原则建议使用低毒的溶剂,提出了一些残留溶剂毒理学上的可接受水平。
药物中的残留溶剂在此定义为在原料药或赋形剂的生产中,以及在制剂制备过程中产生或使用的有机挥发性化合物,它们在工艺中不能完全除尽。
在合成原料药中选择适当的溶剂可提高产量或决定药物的性质,如结晶型。
纯度和溶解度。
因此.有时溶剂是合成中非常关键的因素。
本指导原则所指的溶剂不是谨慎地用作赋形剂的溶剂,也不是溶剂化物,然而在这些制剂中的溶剂含量也应进行测定,并作出合理的判断。
出于残留溶剂没有疗效,故所有残留溶剂均应尽可能.去,以符合产品规范、GMP或其他基本的质量要求。
制剂所含残留溶剂的水平不能高于安全值,已知一些溶剂可导致不接受的毒性(第一类,表1),除非被证明特别合理,在原药、赋形剂及制剂生产中应避免使用。
一些溶剂毒性不太大(第二类,表2)应限制使用,以防止病人潜在的不良反应。
使用低毒溶剂(第三类,表3)较为理想。
附录1中列出了指导原则中的全部溶剂。
表中所列溶剂并非详尽无遗,其他可能使用的溶剂有待日后补充列人。
第一、二类溶剂的建议限度或溶剂的分类会随着。
新的安全性资料的获得而调整。
含有新溶剂的新药制剂、其上市申请的安全性资料应符合本指导原则或原料药指导原则(Q3A新原料药中的杂质)或新药制剂(Q3B新药制剂中的杂质)中所述的杂质控制原则,或者符合上述三者。
2. 指导原则的范围指导原则范围包括原料药、赋形剂或制剂中所含残留溶剂.因此,当生产或纯化过程中会出现这些溶剂时。
应进行残留溶剂的检验。
也只有在上述情况下,才有必要作溶剂的检查。
虽然生产商可以选择性地测定制剂,但也可以从制剂中各成分的残留溶液水平来累积计算制剂中的残留溶剂。
如果计算结果等于或低于本原则的建议水平,该制剂可考虑不检查残留溶剂,但如果计算结果高于建议水平则应进行检测,以确定制剂制备过程中是否降低了有关溶剂的量以达到可接受水平。
化学药物残留溶剂研究的技术指导原则一、概述药物中的残留溶剂系指在原料药或辅料的生产中、以及在制剂制备过程中使用或产生而又未能完全去除的有机溶剂。
根据国际化学品安全性纲要,以及美国环境保护机构、世界卫生组织等公布的研究结果,很多有机溶剂对环境、人体都有一定的危害,因此,为保障药物的质量和用药安全,以及保护环境,需要对残留溶剂进行研究和控制。
本指导原则是在参考人用药物注册技术要求国际协调会(International Conference on Harmonization of Technical Requirements for Registration of Pharmaceuticals for Human Use,ICH)颁布的残留溶剂研究指导原则,美国药典(the United States Pharmacopoeia,USP)、英国药典(British Pharmacopoeia, BP)、欧洲药典(European Pharmacopoeia,EP)、中国药典(Chinese Pharmacopoeia, ChP)相关内容的基础上,结合我国药物研发的特点,通过分析、研究残留溶剂问题与药物的安全性、有效性及质量可控性之间的内在关系而制定的。
本指导原则总结了对残留溶剂问题的一般认识,旨在帮助药物研发者科学合理的进行残留溶剂方面的研究,也为药物评价者提供参考。
考虑到残留溶剂研究涉及的范围比较广泛,本指导原则主要对原料药的残留溶剂问题进行讨论,并以此为基础,探讨和总结药物研究过程中对残留溶剂问题的一般性原则。
药物研发者可参考本指导原则对制剂和辅料的残留溶剂问题进行研究。
考虑到药物研究开发的阶段性,本指导原则适用于药物研发的整个过程。
二、基本内容(一)残留溶剂研究的基本原则1、确定残留溶剂的研究对象从理论上讲,药物制备过程中所使用的有机溶剂均有残留的可能,均应进行残留量的研究。
但是,药物研发者可以通过对有机溶剂的性质、药物制备工艺等进行分析,提出科学合理的依据,有选择性的对某些溶剂进行残留量研究,这样,既可以合理有效的控制产品质量,又有利于降低药物研究的成本,避免不必要的浪费。
杂质:残留溶剂(修订)N-甲基吡咯烷酮(NMP)的日允许接触剂量(PDE)ICH协议指南本指导原则于2002年9月12日ICH指导委员会上进入ICH进程的第四阶段,被推荐给三方管理当局采纳。
在1997年12月,ICH Q3C指南进入第5阶段。
专家工作组的成员达成一致意见:如果有可靠的和更确切的毒理资料作为参考,可以对相关品种的PDE作修改。
1999年形成了一个修订协议并组成一个专家修定工作组。
该协议提出对各种溶剂的PCE进行再审议并允许对指南的相关条例进行调整,包括对各种溶剂的PDE数据进行调整。
此外,协议还允许在有足够的毒性资料的前提下,可增加新的溶剂及其PDE数据。
去年下半年EWG收到有关N-甲基吡咯烷酮(NMP)新的毒性资料。
此内容已由NMP 产业集团上报给FDA。
这是一个由E.I.DUPONT DE Nemours和Co进行的为期二年的大鼠长期喂食实验(未公开发表)。
有关资料已呈送给EWA的成员们进行分析。
在当时看来,这些实验结果足以向指导委员会提出更改NMP毒性类别的建议。
在2002年2月28日至3月2日的ICH会议上,作者向指导委员会汇报了EWG分析的结论和达成的一致意见,即报NMP从第2类溶剂(PDE为48.4mg/天)改为第3类溶剂(PDE为207mg/天)。
但不久,EWG的成员又提供了能够得出更低PDE的进一步的资料和评价。
以下的章节包含如何计算新的PDE的合理的和更灵敏的方法。
动物毒性以下论文是用于计算NMP的PDE:“大鼠出生前接触NMP对其出生后成长和发育的影响”Hass U. 等,《神经毒理》致畸1994,16(3)241~249。
取怀孕Wistar大鼠,在孕期的7~20天的周期内通过吸入给药的方法给予NMP150ppm ×6小时/每日,孕期满后允许孕鼠产仔,结果未检测到对母鼠的毒性,幼仔的尺寸大小也未受给药的影响,同时未观察到机体异常。
出生后5周内,幼仔的体重下降(有显著意义)。
化学药物残留溶剂研究的技术指导原则指导原则编号:【H】G P H7-1化学药物残留溶剂研究的技术指导原则二OO五年三月目录一、概述 (1)二、基本内容 (2)(一)残留溶剂研究的基本原则 (2)1、确定残留溶剂的研究对象 (2)2、确定残留溶剂时需要考虑的问题 (2)3、残留溶剂分类及研究原则 (4)(二)研究方法的建立及方法学验证 (6)1、研究方法的建立 (6)2、方法学验证 (8)(三)研究结果的分析及质量标准的制定 (9)1、残留溶剂表示方法 (9)2、质量标准制定的一般原则及阶段性要求 (10)(四)需要关注的几个问题 (12)1、附录中无限度规定和未收载的有机溶剂 (12)2、未知有机挥发物 (12)3、多种有机溶剂综合影响 (13)4、中间体的残留溶剂 (13)5、制剂工艺对制剂残留溶剂的影响 (14)6、辅料残留溶剂的研究及对制剂的影响 (14)三、参考文献 (14)四、附录 (16)五、著者 (17)化学药物残留溶剂研究的技术指导原则一、概述药物中的残留溶剂系指在原料药或辅料的生产中、以及在制剂制备过程中使用或产生而又未能完全去除的有机溶剂。
根据国际化学品安全性纲要,以及美国环境保护机构、世界卫生组织等公布的研究结果,很多有机溶剂对环境、人体都有一定的危害,因此,为保障药物的质量和用药安全,以及保护环境,需要对残留溶剂进行研究和控制。
本指导原则是在参考人用药物注册技术要求国际协调会(International Conference on Harmonization of T echnical Requirements for Registration of Pharmaceuticals for Human Use,ICH)颁布的残留溶剂研究指导原则,美国药典(the United States Pharmacopoeia,USP)、英国药典(British Pharmacopoeia, BP)、欧洲药典(European Pharmacopoeia,EP)、中国药典(Chinese Pharmacopoeia, ChP)相关内容的基础上,结合我国药物研发的特点,通过分析、研究残留溶剂问题与药物的安全性、有效性及质量可控性之间的内在关系而制定的。
国家药监局关于适用《Q3C(R8):杂质:残留溶剂》国际人用药品注册技术协调会指导原则的公告
文章属性
•【制定机关】国家药品监督管理局
•【公布日期】2021.12.20
•【文号】国家药品监督管理局公告2021年第152号
•【施行日期】2021.12.20
•【效力等级】部门规范性文件
•【时效性】现行有效
•【主题分类】药政管理
正文
国家药监局公告
2021年第152号
关于适用《Q3C(R8):杂质:残留溶剂》国际人用药品
注册技术协调会指导原则的公告
为推动药品注册技术标准与国际接轨,经研究,国家药品监督管理局决定适用《Q3C(R8):杂质:残留溶剂》国际人用药品注册技术协调会(ICH)指导原则。
现就有关事项公告如下:
一、申请人需在现行药学研究技术要求基础上,按照Q3C(R8)指导原则的要求开展研究;本公告发布之日起2个月后开始的相关研究(以试验记录时间点为准),均适用Q3C(R8)指导原则,Q3C(R7)指导原则同时废止。
二、相关技术指导原则可在国家药品监督管理局药品审评中心网站查询。
国家药品监督管理局药品审评中心负责做好本公告实施过程中的相关技术指导工作。
特此公告。
国家药监局2021年12月20日。
重磅!CDE公开征求ICH《Q3C(R8):杂质:残留溶剂的
指导原则》指导原则草案意见
ICH《Q3C(R8):杂质:残留溶剂的指导原则》指导原则草案现进入第3阶段区域公开征求意见阶段。
按照ICH相关章程要求,ICH 的监管机构成员需收集本地区关于第2b阶段指导原则草案的意见并反馈ICH。
上述指导原则草案的原文和译文见附件,现向社会公开征求意见(反馈意见用中英文均可)。
为与ICH工作组统一,建议反馈意见时主要针对ICH英文原文,可具体标明原文行号,中文翻译稿可作为参考。
因时间仓促,译文质量难免存在不足之处,若对译文提出意见也可同步反馈。
社会各界如有意见,请于2020年6月10日前通过电子邮箱反馈。
联系人:何伍任连杰。
杂质:残留溶剂的指导原则页脚内容11.介绍本指导原则旨在介绍药物中残留溶剂在保证人体安全条件下的可接受量,指导原则建议使用低毒的溶剂,提出了一些残留溶剂毒理学上的可接受水平。
药物中的残留溶剂在此定义为在原料药或赋形剂的生产中,以及在制剂制备过程中产生或使用的有机挥发性化合物,它们在工艺中不能完全除尽。
在合成原料药中选择适当的溶剂可提高产量或决定药物的性质,如结晶型。
纯度和溶解度。
因此.有时溶剂是合成中非常关键的因素。
本指导原则所指的溶剂不是谨慎地用作赋形剂的溶剂,也不是溶剂化物,然而在这些制剂中的溶剂含量也应进行测定,并作出合理的判断。
出于残留溶剂没有疗效,故所有残留溶剂均应尽可能.去,以符合产品规范、GMP或其他基本的质量要求。
制剂所含残留溶剂的水平不能高于安全值,已知一些溶剂可导致不接受的毒性(第一类,表1),除非被证明特别合理,在原药、赋形剂及制剂生产中应避免使用。
一些溶剂毒性不太大(第二类,表2)应限制使用,以防止病人潜在的不良反应。
使用低毒溶剂(第三类,表3)较为理想。
附录1中列出了指导原则中的全部溶剂。
表中所列溶剂并非详尽无遗,其他可能使用的溶剂有待日后补充列人。
第一、二类溶剂的建议限度或溶剂的分类会随着。
新的安全性资料的获得而调整。
含有新溶剂的新药制剂、其上市申请的安全性资料应符合本指导原则或原料药指导原则(Q3A新原料药中的杂质)或新药制剂(Q3B新药制剂中的杂质)中所述的杂质控制原则,或者符合上述三者。
2. 指导原则的范围指导原则范围包括原料药、赋形剂或制剂中所含残留溶剂.因此,当生产或纯化过程中会出现这些溶剂时。
应进行残留溶剂的检验。
也只有在上述情况下,才有必要作溶剂的检查。
虽然生产商可以选择性地测定制剂,但也可以从制剂中各成分的残留溶液水平来累积计算制剂中的残留溶剂。
如果计算结果等于或低于本原则的建议水平,该制剂可考虑不检查残留溶剂,但如果计算结果高于建议水平则应页脚内容2进行检测,以确定制剂制备过程中是否降低了有关溶剂的量以达到可接受水平。
果制剂生产中用到某种溶剂,也应进行测定。
本指导原则不适用于临床研究阶段的准新原料药、准赋形剂和准制剂。
也不适用于已上市的药品。
本指导原则适用于所有剂型和给药途径。
短期(如30天或更短)使用或局部使用时,允许存在的残留溶剂水平可以较高。
应根据不同的情况评判这些溶剂水平。
有关残留溶剂的背景附加说明见附录2。
3.通则3.1 根据危害程度对残留溶剂分类“可耐受的日摄人量”(TDI)是国际化学品安全纲要(IPCS)用于描述毒性化合物接触限度的术语。
“可接受的日摄人量”(ADI)是WHO及一些国家和国际卫生组织所用的术语。
新术语“允许的日接触量”(PDE)是本指导原则中用于定义药物中可接受的有机溶剂摄人量,以避免与同一物质的ADI混淆。
本原则中残留溶剂的评价以通用名和结构列于附录1,根据它们对人体可能造成的危害分为以下三类;(1)第一类溶剂:应避免的溶剂为人体致癌物、疑为人体致癌物或环境危害物。
(2)第二类溶剂。
应限制的溶剂非遗传毒性动物致癌或可能导致其他不可逆毒性测神经毒性或致畸性)的试剂。
可能具其他严重的但可逆毒性的溶剂。
(3)第三类溶剂:低毒性溶剂页脚内容3对人体低毒的溶剂,无须制定接触限度;第三类溶剂的PDE为每天50mg或50mg以上。
3.2 建立接触限度的方法用于建立残留溶剂的PDE方法见附录3。
用于建立限度的毒理数据的总结见Pharmeuropa,Vol . 9,No . l,Suplement,April 1997.3.3 第二类溶剂限度的选择方法制定第二类溶剂的限度时有两种选择。
方法1: 使用表2中以ppm为单位的浓度限度,假定日给药量为10g,以方程(1)计算。
方程(1) C(ppm)=PDE:mg/天剂量:g/天这些限度对所有原料药、赋形剂和制剂均适用。
因此,这一方法可用于日剂量未知或未定的情况、只要在处方中所有的赋形剂和原料药都符合方法1给定的限度,就可以以任何比例用于制剂。
只要日剂量不超过10g,就无须进一步计算。
服用剂量超过10g/天,应考虑用方法2。
方法2:制剂中的每一种成分不必符合方法1的限度。
药物中允许的残留溶剂限度水平,可根据表2中PDE mg/天及已知最大日剂量,用方程(1)来计算。
只要证明已降低至实际最低水平,便可以认为这种限度是可接受的、该限度能说明分析方法的精度、生产能力和生产工艺的合理变异,并能反映当前生产的标准水平。
应用方法2时可将药物制剂的每种成分中残留溶剂叠加起来,每天的总溶剂量应低于PDE给定的值。
页脚内容4下面举例说明如何用方法l和2来考虑制剂中的乙睛限度。
乙睛的允许日接触量是4.1 mg/天,因此由方法1算出限度是410PPm;如现在日最大给药量是5.0g,制剂中含两种赋形剂,制剂中的成分和计算得到的最大残留乙睛量见下表:成分处方量乙睛量日(摄人)量原料药0.3g800ppm0.24mg辅料一0.9g 400ppm 0.36mg辅料二 3.8g 800PPm 3.04mg药物制剂 5.09 728ppm 3.64mg辅料1符合方法1限度,但原料、辅料2和药物制剂不符合方法1限度,而制剂符合方法2规定的4.1mg /天,故符合本指导原则的建议值。
乙睛作为残留溶剂的另一例子,曰最大给药量5刀g,制剂中含两种赋形剂,各组分及计算得到的最大残留的乙睛最见下表:成分处方量乙睛量日(摄人)量原料药0.3g 800ppm 0.24mg辅料1 0.9g 2000ppm 1.80mg辅料 3.8g 800ppm 3.04mg药物制剂 5.0g 1016ppm 5.08mg页脚内容5此例制剂中乙睛限度总量既不符合方法1也不符合方法2。
生产厂可先测定制剂,以确定在处方工艺中能否降低已睛水平,如果不能将乙腈水平降至允许范围,生产厂应采取措施降低制剂中的乙腈量;若所有措施均不能降低残留溶剂的水平,厂方应提供其尝试降低残留溶剂以符合指导原则所做工作的总结报告,并以利弊分析报告证明允许该制剂存在的较高水平的残留溶剂。
3.4 分析方法残留溶剂通常用色谱技术,如用GC法测定,如可能,对药典上规定要检测的残留溶剂,应采用统一了的测定方法。
生产厂也可选用更合适的、经论证的方法来测定。
若仅存在第三类溶剂;可用非专属性的方法如干燥失重来检查。
残留溶剂的方法论证应遵循ICH指导原则:“分析方法论证:定义和术语”及“分析方法论证:方法学”。
3.5 残留溶剂的报告水平制剂生产商需要了解有关赋形剂或原料药中残留溶剂量的信息,以符合本指导原则的标准。
以下阐述了赋形剂或原料药供应商应提供给制剂牛产商的信息的~些例子。
供应商应选择以下一项:·仅可能存在第三类溶剂,干燥失重小于0.5%。
·仅可能存在第M类溶剂,X、Y……全部应低于方法1的限度。
(这里供应商应将第二类溶剂用X、Y……来表示)·仅可能存在第二类溶剂X、Y……和第三类溶剂,残留的第三类溶剂低于方法1的限度,残留的第三类溶剂低于0.5%。
如果可能存在第一类溶剂,应进行鉴定并定量。
“可能存在”系指用于工艺最后一步的溶剂和用于较前几步工艺的溶剂经论证不能全部除尽。
如果第页脚内容6二类溶剂高于方法1的限度或第三类溶剂高于0.5%,应鉴定并定量。
4. 残留溶剂的限度4.1应避免的溶剂因其具有不可接受的毒性或对环境造成公害,第一类溶剂在原料药、赋形剂及制剂生产中不应该使用。
但是,为了生产一种有特殊疗效的药品而不得不使用时,除非经过其他论证,否则应按表1控制,1,1,1-三氯乙烷因会造成环境公害列人表1,其限度1500ppm是基于安全性数据而定的。
表1 药物制剂中含第一类溶剂的限度(应避免使用)溶剂浓度限度(ppm)备注苯 2 致癌物四氯化碳 4 毒性及环境公害1,2-二氯乙烷5毒性1,1-二氯乙烷8毒性1,1,1-三氯乙烷1500环境公害4.2 应限制的溶剂列于表2的溶剂,由于其具毒性,在制剂中应予限制,规定PDE约0.1mg/天,浓度约10ppm。
所列值不能反映测定所必需的分析精度,精度应为方法论证的一部分。
表2 药品中第二类溶剂溶剂PDE(mg/天)浓度限度(ppm)页脚内容7乙晴 4.1 410氯苯 3.6 360氯仿0.6 60环氧乙烷38.8 3880 1,2-二氯乙烯18.7 1870二氯甲烷 6.0 600 1,2-二甲亚砜 1.0 100 N,N-二甲乙酰胺10.9 1090 N,N-二甲基甲酰胺8.8 880 1,4-二恶烷 3.8 380 2-乙氧基乙醇 1.6 160乙二醇 6.2 620甲酰胺 2.2 220正己烷 2.9 290甲醇30.0 30002-甲氧基乙醇0.5 50甲基丁酮0.5 50页脚内容8甲基环己烷11.8 1180N-甲基吡咯烷酮48.4 4840硝基甲烷0.5 50吡啶 2.0 200二氧噻吩烷 1.6 160四氢萘 1.0 100甲苯8.9 8901,1,2-三氯乙烯0.8 80二甲苯* 21.7 2170*通常为60% m-二甲苯,14% p-二甲苯,9% o-二甲苯和17%乙基苯。
4.3低毒溶剂第三类溶剂(见表3)可能低毒,对人体危害很小。
第三类溶剂包括人们认为在药物中以一般量存在时对人体无害的溶剂,但该类溶剂中许多尚未进行长期毒性或致癌研究。
急性毒性或短期毒性试验表明这类溶剂几乎无毒、无遗传毒性。
每日50mg或更少量无须论证即可接受(用方法1计算。
即5000ppm或0.5%)。
如果能够反映生产能力和GMP的实际情况,更大的量也可接受。
表3在GMP或其他质量要求中应限制的第三类溶剂醋酸乙醇甲乙酮丙酮醋酸乙酯甲基异丁酮页脚内容9苯甲醚乙醚2-甲基-1-丙醇1-丁醇甲酸乙酯戊烷2-丁醇甲酸正丙醇醋酸丁酯正庚烷正戊醇叔丁基甲基醚醋酸异丙酯醋酸异丁酯醋酸甲酯2-丙醇异丙基苯3-甲基-1-丁醇醋酸丙酯二甲亚砜四氢呋喃4.4 没有足够毒性资料的溶剂以下溶剂(表4)在赋形剂、原料药和制剂生产中也许会被生产商采用,但尚无足够的毒理学数据,故无PDE值,生产厂在使用时应提供这些溶剂在制剂中残留水平的合理性论证报告。
表4无足够毒理学数据的溶剂1,1-二乙氧基丙烷甲基异丙酮1,1-二甲基甲烷甲基四氢呋喃2,2-二甲丙烷石油醚异辛烷三氯乙酸页脚内容10异丙醚三氟乙酸页脚内容11术语遗传毒性致癌指通过影响基因或染色体而致癌。
LOEL:lowest-observed effect level的缩写。
能观察到反应的最低量(lowest-obserued effect leuel)是在研究人体或动物接触某种物质时产生任何反应的频率或严重性在生物学上显著增加的最低剂量。
修正因子是由毒理学家评定的、由生物测定的结果转换成与人体安全性相关的系数。