最新初中常见物质化学式与元素化合价
- 格式:doc
- 大小:79.00 KB
- 文档页数:2

2024年初中化学化合价和化学式总结化合价是指元素在化合物中所具有的化学价值。
化合价可以帮助我们了解元素之间的化学反应和化合物的组成。
在初中化学课程中,学生们学习了常见元素的化合价和化学式。
下面是一个总结,列出了一些常见元素的化合价和化学式。
第一组元素:1. 氢(H):化合价为+1,最简化学式为H2;2. 铯(Cs):化合价为+1,最简化学式为CsCl。
第二组元素:1. 铍(Be):化合价为+2,最简化学式为BeO;2. 镁(Mg):化合价为+2,最简化学式为MgCl2;3. 钙(Ca):化合价为+2,最简化学式为CaO。
第三组元素:1. 钠(Na):化合价为+1,最简化学式为NaCl;2. 铝(Al):化合价为+3,最简化学式为Al2O3。
第四组元素:1. 钾(K):化合价为+1,最简化学式为KCl;2. 铬(Cr):化合价为+2或+3(六价态时),最简化学式为CrCl2或CrCl3。
第五组元素:1. 银(Ag):化合价为+1,最简化学式为AgCl;2. 锌(Zn):化合价为+2,最简化学式为ZnO。
第六组元素:1. 铜(Cu):化合价为+1或+2,最简化学式为CuCl或CuCl2;2. 镉(Cd):化合价为+2,最简化学式为CdO。
第七组元素:1. 氯(Cl):化合价为-1,最简化学式为NaCl;2. 锌(Zn):化合价为+2,最简化学式为ZnCl2。
第八组元素:1. 氩(Ar):为惰性气体,不与其他元素形成化合物。
这只是一部分常见元素的化合价和化学式。
对于其他元素,学生们可以参考化学元素周期表,并根据元素家族和化合物的性质来推测它们的化合价和化学式。
以上是____年初中化学化合价和化学式的总结,希望对您有所帮助。

初中化学化合价和化学式总结化学是一门研究物质的性质、结构、组成、变化规律以及它们之间的相互作用的科学。
化学是自然科学中一门非常重要的学科,也是理工类专业中一门基础的必修课。
在初中化学中,化合价和化学式是两个重要的概念,对于初学者来说是一个比较难以理解的部分。
下面将会对这两个概念进行总结,帮助初中化学学习者更好地理解和掌握。
一、化合价化合价是指元素与其他元素结合时所表现出的化学性质。
化合价可以帮助我们了解元素在化合物中的结合方式和元素之间的电子转移或共用情况。
化合价的大小决定了元素与其他元素形成化合物的可能性和形式。
1.单质的化合价:单质的化合价主要取决于元素所在的族别和周期。
例如,从第一周期到第七周期,元素的化合价逐渐增加。
周期表中,主族元素的化合价一般为族别数,即1A族元素的化合价为+1,2A族元素的化合价为+2、其中有一些特殊的例子,如氢原子的化合价为+1,氧原子的化合价为-2,氮原子的化合价为-32.化合物的化合价:化合物的化合价是指化合物中各元素的化合价之和。
根据化合价的大小,可以确定化合物中各元素的相对含量。
例如,氯化钠(NaCl)是一种非常常见的化合物,其中氯的化合价为-1,钠的化合价为+1、因此,氯化钠中钠的相对含量为1,氯的相对含量为13.化合价的计算:化合价的计算是基于元素与其他元素的电子转移或共用规律。
对于电子转移,如果一个非金属元素愿意捐出电子,则其化合价为正数;如果一个金属元素愿意接收电子,则其化合价为负数。
对于共用,如果两个非金属元素共用一个电子对,则它们的化合价都为正数。
二、化学式化学式是用化学符号和数字表示化合物的组成和结构。
化学式可以帮助我们了解化合物中各元素的相对含量和原子组成。
1.原子符号:化学式中使用的是元素的化学符号,如H表示氢,O表示氧,C表示碳等。
2.个数指示:化学式中通过数字表示元素的个数,如H2表示2个氢原子,O2表示2个氧原子。
3.括号使用:当化合物中含有多个相同的基团时,可以使用括号来表示。
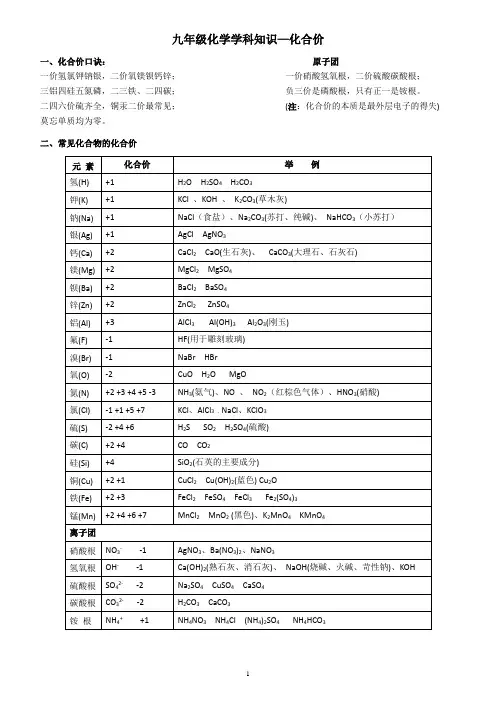
初中常见化合价、化学式及化学方程式一、初中化合价钾钠银氢正一价,氟氯溴碘负一价;正一亚铜正二铜,正二亚铁正三铁,(Cu2O、CuO;FeO、Fe2O3)钙镁钡锌正二价,铝是正三氧负二,氯是负一最常见;硫有负二正四六,(Na2S、FeS、CuS、SO2、SO3)负一硝酸氢氧根,负二硫酸碳酸根;负三记住磷酸根,正一价的是铵根,正四硅,二四碳,单质零价永不变。
其他元素有变价,先死后活来计算。
三、化合物初中化学方程式全(已配平)一、化合反应1、镁在空气中燃烧:2Mg+O2点燃2MgO2、铁在氧气中燃烧:3Fe+2O2点燃Fe3O43、铝在空气中燃烧:4Al+3O2点燃2Al2O34、氢气在空气中燃烧:2H2+O2点燃2H2O5、红磷在空气中燃烧:4P+5O2点燃2P2O56、硫粉在空气中燃烧:S+O2点燃SO27、碳在氧气中充分燃烧:C+O2点燃 CO28、碳在氧气中不充分燃烧:2C+O2点燃2CO9、二氧化碳通过灼热碳层:C+CO2高温2CO10、一氧化碳在氧气中燃烧:2CO+O2 点燃2CO211、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO2+H2O=H2CO312、生石灰溶于水:CaO+H2O=Ca(OH)213、无水硫酸铜作干燥剂:CuSO4+5H2O=CuSO4·5H2O14、钠在氯气中燃烧:2Na+Cl2点燃2NaCl二、分解反应15、实验室用双氧水制氧气:2H2O2MnO22H2O+O2↑16、加热高锰酸钾:2KMnO4△K2MnO4+MnO2+O2↑17、水在直流电的作用下分解:2H2O通电2H2↑+O2↑18、碳酸化学性质不稳定而分解:H2CO3=H2O+CO2↑19、高温煅烧石灰石(二氧化碳工业制法):CaCO3高温CaO+CO2↑20、加热氯酸钾分解:2KClO3=2KCl+3O2↑21、氧化汞加热分解:2HgO△2Hg+O2↑三、置换反应(单质+化合物→新的单质+新的合化物)22、锌和稀盐酸反应(实验室制氢气):Zn+2HCl=ZnCl2+H2↑锌和稀硫酸反应(实验室制氢气):Zn+H2SO4=ZnSO4+H2↑23、镁和稀盐酸反应:Mg+2HCl=MgCl2+H2↑镁和稀硫酸反应:Mg+H2SO4=MgSO4+H2↑24、铁和稀盐酸反应:Fe+2HCl=FeCl2+H2↑铁和稀硫酸反应:Fe+H2SO4=FeSO4+H2↑25、铝和稀盐酸反应:2Al+6HCl=2AlCl3+3H2↑铝和稀硫酸反应:2Al+3H2SO4=Al2(SO4)3+3H2↑26、铁和硫酸铜溶液反应:Fe+CuSO4 =FeSO4+Cu铝和硫酸铜溶液反应:2Al+3CuSO4=Al2(SO4)3+3Cu27、铜和硝酸银反应:Cu+2AgNO3=Cu(NO3)2+2Ag28、氢气还原氧化铜:H2+CuO△Cu+H2O29、木炭还原氧化铜:C+2CuO高温 2Cu+CO2↑30、焦炭还原氧化铁:3C+2Fe2O高温 4Fe+3CO2↑31、水蒸气通过灼热碳层:H2O+C高温 H2+CO四、复分解反应复分解反应是由两种互相交换成分,生成另外两种化合物的反应。
初中常见化合价、化学式及化学方程式一、初中化合价钾钠银氢正一价,氟氯溴碘负一价;正一亚铜正二铜,正二亚铁正三铁,(Cu2O、CuO;FeO、Fe2O3)钙镁钡锌正二价,铝是正三氧负二,氯是负一最常见;硫有负二正四六,(Na2S、FeS、CuS、SO2、SO3)负一硝酸氢氧根,负二硫酸碳酸根;负三记住磷酸根,正一价的是铵根,正四硅,二四碳,单质零价永不变。
其他元素有变价,先死后活来计算。
三、化合物初中化学方程式全(已配平)一、化合反应1、镁在空气中燃烧:2Mg+O点燃2MgO2、铁在氧气中燃烧:3Fe+2O点燃Fe3O43、铝在空气中燃烧:4Al+3O点燃2Al2O34、氢气在空气中燃烧:2H2+O点燃2H2O5、红磷在空气中燃烧:4P+5O点燃2P2O56、硫粉在空气中燃烧:S+O2点燃SO27、碳在氧气中充分燃烧:C+O点燃 CO28、碳在氧气中不充分燃烧:2C+O2点燃2CO9、二氧化碳通过灼热碳层:C+CO高温2CO10、一氧化碳在氧气中燃烧:2CO+O2 点燃2CO211、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO2+H2O=H2CO312、生石灰溶于水:CaO+H2O=Ca(OH)213、无水硫酸铜作干燥剂:CuSO4+5H2O=CuSO4·5H2O14、钠在氯气中燃烧:2Na+Cl点燃2NaCl二、分解反应15、实验室用双氧水制氧气:2H2O2MnO22H2O+O2↑16、加热高锰酸钾:2KMnO4△K2MnO4+MnO2+O2↑17、水在直流电的作用下分解:2H2O通电2H2↑+O2↑18、碳酸化学性质不稳定而分解:H2CO3=H2O+CO2↑19、高温煅烧石灰石(二氧化碳工业制法):CaCO高温CaO+CO2↑20、加热氯酸钾分解:2KClO3=2KCl+3O2↑21、氧化汞加热分解:2HgO△2Hg+O2↑三、置换反应(单质+化合物→新的单质+新的合化物)22、锌和稀盐酸反应(实验室制氢气):Zn+2HCl=ZnCl2+H2↑锌和稀硫酸反应(实验室制氢气):Zn+H2SO4=ZnSO4+H2↑23、镁和稀盐酸反应:Mg+2HCl=MgCl2+H2↑镁和稀硫酸反应:Mg+H2SO4=MgSO4+H2↑24、铁和稀盐酸反应:Fe+2HCl=FeCl2+H2↑铁和稀硫酸反应:Fe+H2SO4=FeSO4+H2↑25、铝和稀盐酸反应:2Al+6HCl=2AlCl3+3H2↑铝和稀硫酸反应:2Al+3H2SO4=Al2(SO4)3+3H2↑26、铁和硫酸铜溶液反应:Fe+CuSO4 =FeSO4+Cu铝和硫酸铜溶液反应:2Al+3CuSO4=Al2(SO4)3+3Cu27、铜和硝酸银反应:Cu+2AgNO3=Cu(NO3)2+2Ag28、氢气还原氧化铜:H2+CuO△Cu+H2O29、木炭还原氧化铜:C+2CuO高温 2Cu+CO2↑30、焦炭还原氧化铁:3C+2Fe2O高温 4Fe+3CO2↑31、水蒸气通过灼热碳层:H2O+C高温 H2+CO四、复分解反应复分解反应是由两种化合物互相交换成分,生成另外两种化合物的反应。

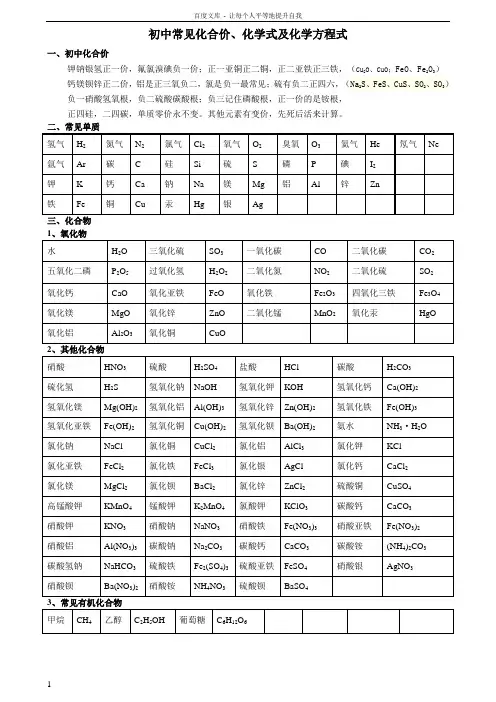
初三化学式与化合价知识点归纳初三化合价知识化合价口诀化合价一:一价氟氯溴碘氢,还有金属钾钠银。
二价氧钡钙镁锌,铝三硅四都固定。
氯氮变价要注意,一二铜汞一三金。
二四碳铅二三铁,二四六硫三五磷。
常见元素的主要化合价二:氟氯溴碘负一价;正一氢银与钾钠。
氧的.负二先记清;正二镁钙钡和锌。
正三是铝正四硅;下面再把变价归。
全部金属是正价;一二铜来二三铁。
锰正二四与六七;碳的二四要牢记。
非金属负主正不齐;氯的负一正一五七。
氮磷负三与正五;不同磷三氮二四。
硫有负二正四六;边记边用就会熟。
化合价口诀三:一价氢氯钾钠银;二价氧钙钡镁锌,三铝四硅五氮磷;二三铁二四碳,二四六硫全都齐;铜以二价最常见。
化合价口诀四:一价氢氯钾钠银二价氧钙钡镁锌三铝四硅五价磷二三铁二四碳二四六硫都齐全铜汞二价最常见负一硝酸氢氧根负二硫酸碳酸根负三记住磷酸根正一价的是铵根初三化学式知识单质:氢气H2、氮气N2、氧气O2、氯气Cl2、氦He、碳C 、钠Na、镁Mg、铝Al、硅Si、磷P、硫S、氩Ar、钾K、钙Ca、锌Zn、铁Fe、铜Cu、汞Hg、银Ag。
非金属氧化物:水H2O、二氧化碳CO2、一氧化碳CO、五氧化二磷P2O5、二氧化硫SO2、三氧化硫SO3、过氧化氢(双氧水)H2O2、二氧化氮NO2。
金属氧化物:氧化铁Fe2O3(赤铁矿,铁锈的主要成分)、四氧化三铁 Fe3O4(磁铁矿的主要成分)、氧化铝 Al2O3(铝土矿的主要成分)、氧化铜CuO、氧化钙CaO、二氧化锰MnO2、氧化镁MgO。
酸:盐酸HCl(胃酸的主要成分)、硫酸H2SO4、硝酸HNO3、碳酸H2CO3、乙酸CH3COOH(俗称醋酸)。
碱:氢氧化钠NaOH(俗称火碱、烧碱、苛性钠,易溶于水)、氢氧化钡Ba(OH)2(易溶于水)、氢氧化钙 Ca(OH)2(俗称熟石灰、消石灰。
微溶于水,水溶液俗称澄清石灰水)、氢氧化镁Mg(OH)2(不溶于水,白色沉淀)、氢氧化铁 Fe(OH)3(不溶于水,红褐色沉淀)、氢氧化铜 Cu(OH)2(不溶于水,蓝色沉淀)、一水合氨NH3•H2O(水溶液俗称氨水)。

初中化学元素化合价完整版元素的化合价是指一个元素在化合物中的电荷数。
化合价的了解对于理解元素之间的化学反应和化学反应的类型非常重要。
下面是初中化学元素化合价的完整版:一、常见元素的化合价1.碱金属元素(IA族)的化合价一般为+1,如氢(H)的化合价为+12.碱土金属元素(IIA族)的化合价一般为+2,如钙(Ca)的化合价为+23.铝(Al)作为典型的删去两个电子外壳的元素,其化合价为+34.氧(O)与许多元素形成的化合物中,氧的化合价一般为-2,如二氧化碳(CO2)中的氧的化合价为-25.氢(H)与非金属元素的化合物中,氢的化合价一般为+1,如甲烷(CH4)中的氢的化合价为+16.氯(Cl)与同族元素的化合物中,氯的化合价一般为-1,如氯化钠(NaCl)中的氯的化合价为-1二、元素的变价有些元素可以变化其化合价形成不同的化合物,这被称为变价。
例如,氮(N)在氨气(NH3)中化合价为-3,而在一氧化二氮(N2O)中化合价为+1、变价的原因是元素电子层的结构和元素与其他元素的相互作用。
三、元素的共价价电子对数共价价电子对数指一个元素与其他元素形成共价键时,共享电子的数量。
以氮(N)为例,氮的的电子组态为1s22s22p3,氮原子的最外面一层有5个电子,它需要3个电子来填满它的p轨道。
所以氮原子可以形成3个共价键,共享3对电子(或称价电子对)。
四、多价元素有些元素可以形成不同的化合价,这被称为多价元素。
例如,铁(Fe)可以形成2价和3价两种化合价。
在二价铁化合物中,铁的化合价为+2,如亚铁离子(Fe2+);而在三价铁化合物中,铁的化合价为+3,如三价铁离子(Fe3+)。
五、化合价的计算在一些情况下,我们需要根据化合物的成分计算元素的化合价。
计算化合价的方法是根据化合物的总电荷和不同元素的电荷数来确定。
对于二氧化碳(CO2),总电荷为0。
氧的化合价为-2,所以2个氧原子的电荷数为-4、因此,碳原子的电荷数必须为+4,即碳的化合价为+4化合价的计算也可以通过元素在周期表上的位置来推断。

八年级化学化合价表在人教版八年级化学中,常见元素化合价如下:一、一价元素。
1. 氢(H)- 通常显 +1价,例如在氯化氢(HCl)中,氢元素为+1价。
2. 钾(K)- 钾元素在化合物中通常显 +1价,如氯化钾(KCl)。
3. 钠(Na)- 钠元素在化合物中一般为+1价,像氯化钠(NaCl)。
4. 银(Ag)- 银元素常见化合价为 +1价,例如硝酸银(AgNO₃)。
二、二价元素。
1. 钙(Ca)- 在化合物中钙元素常显+2价,如碳酸钙(CaCO₃)。
2. 镁(Mg)- 镁元素在化合物里通常为+2价,像氧化镁(MgO)。
3. 钡(Ba)- 钡元素一般显+2价,例如硫酸钡(BaSO₄)。
4. 锌(Zn)- 锌元素常见化合价为+2价,如硫酸锌(ZnSO₄)。
5. 铜(Cu)- 铜元素有+2价,例如氧化铜(CuO);也有 +1价(亚铜离子),如氧化亚铜(Cu₂O)。
三、三价元素。
1. 铝(Al)- 铝元素在化合物中通常显+3价,如氧化铝(Al₂O₃)。
四、变价元素(铁元素)1. 铁(Fe)- 有+2价(亚铁离子),如氯化亚铁(FeCl₂);- 还有+3价(铁离子),例如氯化铁(FeCl₃)。
五、特殊元素化合价。
1. 氧(O)- 在化合物中通常显 - 2价,如二氧化碳(CO₂)。
但在过氧化物(如过氧化氢H₂O₂)中氧元素为 - 1价。
2. 氯(Cl)- 通常显 - 1价,如氯化钠(NaCl);但在氯酸钾(KClO₃)中氯元素为+5价,在高氯酸(HClO₄)中为+7价等。
3. 氮(N)- 化合价比较复杂,有 - 3价(如氨气NH₃)、+2价(一氧化氮NO)、+4价(二氧化氮NO₂)、+5价(硝酸HNO₃)等。
4. 碳(C)- 有 +2价(如一氧化碳CO)、+4价(如二氧化碳CO₂)等。

初中常见物质化学式与元素化合价物质的化学式是用元素符号表示化学元素的种类和原子数目的式子。
而元素的化合价是指元素与其他元素形成化合物时所呈现的既成规律,反映了元素在化合物中与其他元素结合的能力。
下面将介绍一些初中常见物质的化学式以及元素的化合价。
1.二氧化碳:化学式为CO2,由1个碳原子和2个氧原子组成。
其中,碳的化合价为+4,氧的化合价为-2、碳与氧原子的化合价之和为0。
2.水:化学式为H2O,由2个氢原子和1个氧原子组成。
其中,氢的化合价为+1,氧的化合价为-2、氢原子与氧原子的化合价之和为0。
3.氯化钠:化学式为NaCl,由1个钠原子和1个氯原子组成。
其中,钠的化合价为+1,氯的化合价为-1、钠原子与氯原子的化合价之和为0。
4.硝酸:化学式为HNO3,由1个氢原子、1个氮原子和3个氧原子组成。
其中,氢的化合价为+1,氮的化合价为+5,氧的化合价为-2、氢的化合价与氮、氧原子的化合价之和都为0。
5.二氧化硫:化学式为SO2,由1个硫原子和2个氧原子组成。
其中,硫的化合价为+4,氧的化合价为-2、硫原子与氧原子的化合价之和为0。
6.氨气:化学式为NH3,由1个氮原子和3个氢原子组成。
其中,氮的化合价为-3,氢的化合价为+1、氮原子与氢原子的化合价之和为0。
7.二氧化硅:化学式为SiO2,由1个硅原子和2个氧原子组成。
其中,硅的化合价为+4,氧的化合价为-2、硅原子与氧原子的化合价之和为0。
8.硫酸:化学式为H2SO4,由2个氢原子、1个硫原子和4个氧原子组成。
其中,氢的化合价为+1,硫的化合价为+6,氧的化合价为-2、氢的化合价与硫、氧原子的化合价之和都为0。
9.乙烯:化学式为C2H4,由2个碳原子和4个氢原子组成。
其中,碳的化合价为-3,氢的化合价为+1、碳原子与氢原子的化合价之和为0。
10.氯气:化学式为Cl2,由2个氯原子组成。
氯的化合价为0,因为不需要与其他元素结合。
以上是一些初中常见物质的化学式和元素的化合价。

初中化学元素及化合价1、氢化合物:
(1)氢:质子1,化合价+1
(2)氧化物:质子2,化合价-2
(3)氯化物:质子1,化合价-1
(4)硫酸盐:质子2,化合价-2
2、碱金属:
(1)钠:质子1,化合价+1
(2)钙:质子2,化合价+2
(3)铝:质子3,化合价+3
(4)锂:质子1,化合价+1
3、非金属:
(1)氟:质子1,化合价-1
(2)氖:质子0,化合价0
(3)氮:质子3,化合价-3
(4)磷:质子3,化合价-3
(5)硫:质子2,化合价-2
4、有机元素:
(1)甲烷:质子4,化合价-4
(2)乙烷:质子2,化合价-2
(3)丙烷:质子6,化合价-6
(4)烯烃:质子2,化合价-2
(5)芳香烃:质子4,化合价-4
二、常见元素的定义
1、氢:氢是一种无色、无臭、无味的无机元素,其在自然界中最多,但是在地壳中只占质量的0.14%,其原子量为1,处于无机元素周期表的
最左边。
2、氧:氧是一种常见的元素,它是地球上最常见的元素,其原子量
为16,是一种有机物,它可以与其他元素如氢、碳等进行化学反应,形
成氧化物。
3、氯:氯是一种常见的元素,原子量为35.5。

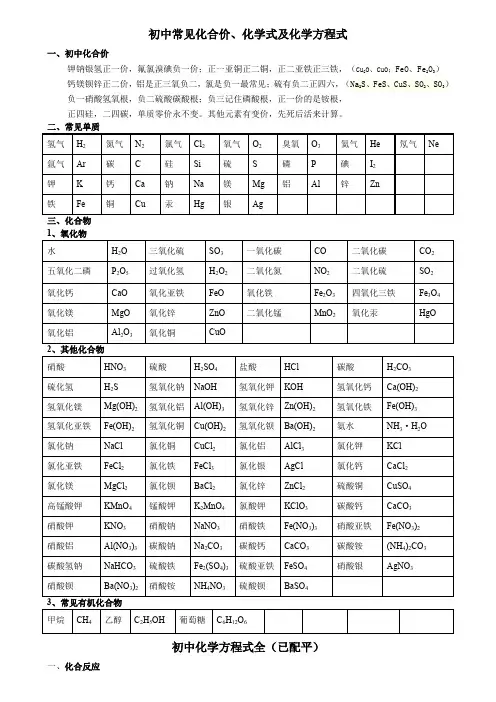
初中常见化合价化学式及化学方程式集团文件发布号:(9816-UATWW-MWUB-WUNN-INNUL-DQQTY-初中常见化合价、化学式及化学方程式一、初中化合价钾钠银氢正一价,氟氯溴碘负一价;正一亚铜正二铜,正二亚铁正三铁,(Cu 2O 、CuO ;FeO 、Fe 2O 3)钙镁钡锌正二价,铝是正三氧负二,氯是负一最常见;硫有负二正四六,(Na 2S 、FeS 、CuS 、SO 2、SO 3)负一硝酸氢氧根,负二硫酸碳酸根;负三记住磷酸根,正一价的是铵根, 正四硅,二四碳,单质零价永不变。
其他元素有变价,先死后活来计算。
二、常见单质三、化合物 1、氧化物2、其他化合物3、常见有机化合物 初中化学方程式全(已配平)一、化合反应1、镁在空气中燃烧:2Mg+O 点燃2MgO2、铁在氧气中燃烧:3Fe+2O 点燃Fe 3O 43、铝在空气中燃烧:4Al+3O 点燃2Al 2O 34、氢气在空气中燃烧:2H 2+O 点燃2H 2O5、红磷在空气中燃烧:4P+5O 点燃2P 2O 56、硫粉在空气中燃烧:S+O 点燃SO 27、碳在氧气中充分燃烧:C+O 点燃 CO 28、碳在氧气中不充分燃烧:2C+O 2 点燃2CO9、二氧化碳通过灼热碳层:C+CO 高温2CO10、一氧化碳在氧气中燃烧:2CO+O 2 点燃2CO 211、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO 2+H 2O=H 2CO 3 12、生石灰溶于水:CaO+H 2O=Ca(OH)213、无水硫酸铜作干燥剂:CuSO 4+5H 2O=CuSO 4·5H 2O 14、钠在氯气中燃烧:2Na+Cl 2点燃2NaCl 二、分解反应15、实验室用双氧水制氧气:2H 2O 2MnO 22H 2O+O 2↑ 16、加热高锰酸钾:2KMnO 4△K 2MnO4+MnO 2+O 2↑ 17、水在直流电的作用下分解:2H 2O 通电2H 2↑+O 2↑ 18、碳酸化学性质不稳定而分解:H 2CO 3=H 2O+CO 2↑19、高温煅烧石灰石(二氧化碳工业制法):CaCO 3高温CaO+CO 2↑ 20、加热氯酸钾分解:2KClO 3=2KCl+3O 2↑21、氧化汞加热分解:2HgO △2Hg+O 2↑三、置换反应(单质+化合物→新的单质+新的合化物) 22、锌和稀盐酸反应(实验室制氢气):Zn+2HCl=ZnCl 2+ H 2↑ 锌和稀硫酸反应(实验室制氢气):Zn+H 2SO 4=ZnSO 4+ H 2↑ 23、镁和稀盐酸反应:Mg+2HCl=MgCl 2+H 2↑ 镁和稀硫酸反应:Mg+H 2SO 4=MgSO 4+ H 2↑ 24、铁和稀盐酸反应:Fe+2HCl=FeCl 2+ H 2↑ 铁和稀硫酸反应:Fe+H 2SO 4=FeSO 4+ H 2↑ 25、铝和稀盐酸反应:2Al+6HCl=2AlCl 3+3H 2↑ 铝和稀硫酸反应:2Al+3H 2SO 4=Al 2(SO 4)3+3 H 2↑ 26、铁和硫酸铜溶液反应:Fe+CuSO 4 =FeSO 4+Cu 铝和硫酸铜溶液反应:2Al+3CuSO 4=Al 2(SO 4)3+3Cu 27、铜和硝酸银反应:Cu+2AgNO 3=Cu(NO 3)2+2Ag28、氢气还原氧化铜:H 2+CuO △Cu+H 2O29、木炭还原氧化铜:C+2CuO 高温 2Cu+CO 2↑ 30、焦炭还原氧化铁:3C+2Fe 2O 高温 4Fe+3CO 2↑ 31、水蒸气通过灼热碳层:H 2O+C 高温 H 2+CO 四、复分解反应复分解反应是由两种互相交换成分,生成另外两种化合物的反应。
初中化学整理一、常见元素化合价钾钠银氢+1价,钙镁钡锌+2价,一、二铜,二、三铁;氟氯溴碘-1价,氧硫通常-2价,单质化合价为零二、常见原子团化合价四、化学式的书写1、单质:(1)由原子直接构成(元素符号):a.金属:钾K、钙Ca、钠Na、镁Mg、铝Al、锌Zn、铁Fe、锡Sn、铅Pb、氢H、铜Cu、汞Hg、银Ag、铂Pt、金Au 钡Ba、钨Wb.稀有气体:氦He、氖Ne、氩Ar、氪Kr、氙Xe、氡Rnc.部分固态非金属:金刚石/石墨/碳C、硅Si、磷P、硫S(2)双原子分子:a.固体:碘I2;b.常见气体:氢气H2、氮气N2、氧气O2、氯气Cl2、氟气F2;c.液态:溴Br2(3)三原子分子:臭氧O32、化合物:按照化合价,利用化合价交叉法进行书写(1)氧化物:由两种元素组成,其中一种为氧元素的化合物a.非金属氧化物:水H2O、一氧化碳CO、二氧化碳CO2、二氧化硫SO2、三氧化硫SO3、二氧化硅SiO2、一氧化氮NO、二氧化氮NO2、五氧化二磷P2O5b.金属氧化物:氧化钾K2O、氧化钠Na2O、氧化银Ag2O、氧化亚铜Cu2O、氧化钙CaO、氧化镁MgO、氧化钡BaO、氧化锌ZnO、氧化铜CuO、氧化亚铁FeO、三氧化二铁(氧化铁)Fe2O3、四氧化三铁Fe3O4、三氧化二铝Al2O3、二氧化锰MnO2、三氧化钨WO3、氧化铅PbO(2)常见的酸(阳离子只有H+的化合物):硫酸H2SO4、盐酸HCl、硝酸HNO3、磷酸H3PO4、硫化氢H2S、碳酸H2CO3、醋酸CH3COOH(3)常见的碱(阴离子只有OH¯的化合物):氢氧化钾KOH、氢氧化钠NaOH、氢氧化钙Ca(OH)2、氢氧化镁Mg(OH)2、氢氧化钡Ba(OH)2、氢氧化锌Zn(OH) 2、氢氧化铜Cu(OH) 2、氢氧化亚铁Fe(OH) 2、氢氧化铁Fe(OH) 3、氢氧化铝Al(OH) 3(4)盐:由金属阳离子(或铵根离子)和酸根离子构成的化合物a.氯化物/盐酸盐:氯化钾KCl、氯化钠(食盐)NaCl、氯化银AgCl、氯化钙CaCl2、氯化镁MgCl2、氯化钡BaCl2、氯化锌ZnCl2、氯化铜CuCl2、氯化亚铁FeCl2、氯化铁FeCl3、氯化铝AlCl3b.硝酸盐:硝酸钾KNO3、硝酸钠NaNO3、硝酸银AgNO3、硝酸钙Ca(NO3)2、硝酸镁Mg(NO3)2、硝酸钡Ba(NO3)2、硝酸锌Zn(NO3)2、硝酸铜Cu(NO3)2、硝酸亚铁Fe(NO3)2、硝酸铁Fe(NO3)3、硝酸铝Al(NO3)3c.硫酸盐:硫酸钾K2SO4、硫酸钠Na2SO4、硫酸银Ag2SO4、硫酸钙CaSO4、硫酸镁MgSO4、硫酸钡BaSO4、硫酸锌ZnSO4、硫酸铜CuSO4、硫酸亚铁FeSO4、硫酸铁Fe2 (SO4) 3、硫酸铝Al2 (SO4) 3d.碳酸盐:碳酸钾K2CO3、碳酸钠Na2CO3、碳酸银Ag2CO3、碳酸钙CaCO3、碳酸镁MgCO3、碳酸钡BaCO3、碳酸锌ZnCO3、碳酸铜Cu CO3、碳酸亚铁Fe CO3、e.铵盐:氯化铵NH4Cl、硝酸铵NH4NO3、碳酸铵(NH4)2CO3、硫酸铵(NH4)2SO4、磷酸铵(NH4)3PO4、碳酸氢铵NH4HCO3f.其他:高锰酸钾KMnO4、锰酸钾K2MnO4、氯酸钾KClO3、氨气NH3、过氧化氢H2O2g.常见化肥:尿素CO(NH2)2(N%=46.7%)、硝酸铵NH4NO3(N%=35%)、硫酸铵(NH4)2SO4(N%=21.2%)、碳酸氢铵NH4HCO3(N%=17.7%)、硫酸钾K2SO4、氯化钾KCl(5)有机物(含碳化合物):甲烷CH4、乙炔C2H2、乙醇(酒精)C2H5OH、乙酸CH3COOH、葡萄糖C6H12O6(6)常见结晶水合物:五水硫酸铜CuSO4·H2O、明矾KAl(SO4) 2•12H2O、碳酸钠晶体Na2CO3•10H2O3、常见沉淀及其颜色:白色:CaCO3、CaSO4(微溶)、BaCO3、BaSO4、AgCO3、AgCl、AgOH、Fe(OH) 2、Mg(OH) 2红色:Cu、Fe(OH) 3(红褐色)、Fe2O3蓝色:Cu(OH)2(絮状)黑色:MnO2、CuO、Fe、C、Fe3O4、FeSO4五、溶解性表:OH¯:铵、钾、钠、钡、钙(微);NO3¯:全溶;Cl¯:AgCl(白色沉淀);SO42-:BaSO4(白色沉淀);CO32-:铵、钾、钠六、共存问题1、OH¯+H+→H2O2、OH¯+部分金属离子→碱↓3、Ba2++SO42—→BaSO44、Ag++Cl—→AgCl5、CO32—+部分金属离子→盐↓6、H++CO32—→H2O+CO2↑7、NH4++ OH¯→NH3↑+ H2O8、HCO3—+ H+→H2O+CO2↑9、无色:Fe2+(淡绿)、Fe3+(黄)、Cu2+(蓝)七、化合反应:两种或两种以上物质反应生成另一种物质。
九年级上册化学必须记住的化学式和化学方程式化合价九年级上册化学必须记住的化学式以下是必须记住的单质和化合物的化学式:一、单质的化学式:(24个)1、氧气:O22、氮气:N23、氢气:H24、氯气:Cl25、固态非金属单质:碳:C、磷:P、硫:S、硅:Si6、稀有气体单质:氦:He、氖:Ne、氩:Ar7、金属单质:铁:Fe、铜:Cu、锌:Zn、铝:Al、银:Ag、镁:Mg、钡:Ba、金:Au、汞:Hg、钾:K、钙:Ca、锰:Mn、钠:Na二、化合物的化学式:(37个)1、氧化物:水:H2O、二氧化碳:CO2、过氧化氢:H2O2、二氧化锰:MnO2、一氧化碳:CO、二氧化硫:SO2、二氧化氮:NO2、氧化铜:CuO、氧化铁:Fe2O3、四氧化三铁:Fe3O4、氧化镁:MgO、氧化钙:CaO、五氧化二磷:P2O5、氧化铝:Al2O3、二氧化硅:SiO2、氧化汞:HgO、特殊:氨气:NH32、酸:硫酸:H2SO4、碳酸:H2CO3、盐酸:HCl、硝酸:HNO33、碱:氢氧化钠:NaOH、氢氧化钙:Ca(OH)2、氢氧化钾:KOH4、盐:氯化钠:NaCl、氯化钾:KCl、硫酸铜:CuSO4、碳酸钠:Na2CO3、氯酸钾:KClO3、高锰酸钾:KMnO4、锰酸钾:K2MnO4、碳酸钙:CaCO3、硫酸亚铁:FeSO4、硫酸铁:Fe2(SO4)35、有机物:甲烷:CH4、乙醇(俗名酒精):C2H5OH九年级上册化学必须记住的化学方程式(34个)以下是必须记住的化学方程式:1、镁燃烧:2Mg+O2→2MgO2、铁燃烧:3Fe+2O2→2Fe3O43、铝燃烧:4Al+3O2→2Al2O34、氢气燃烧:2H2+O2→2H2O5、红磷燃烧:4P+5O2→2P2O56、硫粉燃烧:S+O2→SO27、碳充分燃烧:C+O2→CO28、碳不充分燃烧:2C+O2→2CO9、一氧化碳不完全燃烧:2CO+O2→2CO210、一氧化碳燃烧:2CO+O2→2CO211、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO2+H2O→H2CO3(溶液变红)12、生石灰溶于水:CaO+H2O→Ca(OH)213、无水硫酸铜作干燥剂:CuSO4+5H2O→CuSO4·5H2O14、氢氧化钠和盐酸反应:XXX→NaCl+H2O15、氢氧化钠和硫酸反应:2NaOH+H2SO4→Na2SO4+2H2O16、氢氧化钙和盐酸反应:Ca(OH)2+2HCl→CaCl2+2H2O17、氢氧化钙和硫酸反应:Ca(OH)2+H2SO4→CaSO4+2H2O18、氢氧化钾和盐酸反应:XXX→KCl+H2O19、氢氧化钾和硫酸反应:XXX→K2SO4+2H2O20、氯化铁和氢氧化钠反应:FeCl3+3NaOH→Fe(OH)3+3NaCl21、氯化铜和氢氧化钠反应:CuCl2+2NaOH→Cu(OH)2+2NaCl22、硫酸铜和氢氧化钠反应:Cu SO4+2NaOH→Cu(OH)2+Na2SO423、硫酸铁和氢氧化钠反应:XXX→Fe(OH)2+Na2SO424、氯化钠和硫酸银反应:XXXNaNO325、氢氧化钡和硫酸反应:Ba(OH)2+H2SO4→BaSO4↓+2H2O26、氯化钾和硫酸反应:2KCl+H2SO4→K2SO4+2HCl27、碳酸钠和盐酸反应:Na2CO3+2HCl→2NaCl+H2O+CO228、碳酸钠和硫酸反应:Na2CO3+H2SO4→Na2SO4+H2O+CO229、氯酸钾和硫酸反应:KClO3+H2SO4→KHSO4+HClO330、高锰酸钾和盐酸反应:XXX→KCl+MnCl2+2H2O+Cl231、高锰酸钾和氢氧化钠反应:2KMnO4+2NaOH→K2MnO4+2MnO2+2H2O+O2↑32、二氧化碳通过灼热碳层:C+CO2→2CO33、硫酸和锌反应:Zn+H2SO4→ZnSO4+H2↑34、碳酸钙和盐酸反应:XXX→CaCl2+H2O+CO2↑1.实验室使用双氧水制取氧气,反应式为2H2O2 → 2H2O + O2.2.高锰酸钾加热反应,反应式为2KMnO4 → K2MnO4 + MnO2 + O2.3.水在直流电的作用下发生分解,反应式为2H2O → 2H2 + O2.4.碳酸不稳定,分解产生水和二氧化碳,反应式为H2CO3 → H2O + CO2.5.高温煅烧石灰石可以用于制取二氧化碳,反应式为CaCO3 → CO2 + CaO。
化学式专题一、常用元素符号和化合价:氢钠钾银镁钙钡铁锌铜铝锰氯氧硫氮磷碳氢氧根铵根硝酸根硫酸根碳酸根二、化合价由来:三、化合价口诀:四、物质的化学式A单质:由同种(或一种)元素组成的纯净物。
1、金属单质(按金属活动性顺序由强至弱排列)2、非金属单质氢气氧气氮气氯气碳硅磷硫臭氧3、稀有气体氦气氖气氩气B 化合物:由不同种元素组成的纯净物。
(一)有机物:含碳元素的化合物(除CO、CO2和CO32-的化合物)甲烷乙醇甲醇乙酸尿素(二)氧化物:由两种元素组成,其中一种是氧元素的化合物。
1、非金属氧化物(大部分非金属氧化物通常是酸性氧化物,跟水化合成同价的含氧酸)水一氧化碳二氧化碳二氧化硅五氧化二磷二氧化硫三氧化硫2、金属氧化物氧化钡氧化钾氧化钙氧化钠氧化镁氧化铝氧化锌氧化铁氧化亚铁四氧化三铁氧化铜氧化亚铜氧化汞氧化银二氧化锰(三)酸:名称中最后一个字是“酸”,通常化学式的第一种元素是“H ”硫酸盐酸硝酸磷酸氢硫酸碳酸亚硫酸(四)碱:由金属离子和氢氧根离子构成,碱的名称通常有“氢氧化某”化学式的最后面是“OH”(五)盐:由金属离子和酸根离子构成氢氧化钾碳酸钾硫酸钾硝酸钾氯化钾亚硫酸钾氢氧化钠碳酸钠硫酸钠硝酸钠氯化钠亚硫酸钠氢氧化银碳酸银硫酸银硝酸银氯化银氨水碳酸铵硫酸铵硝酸铵氯化铵氢氧化钙碳酸钙硫酸钙硝酸钙氯化钙亚硫酸钙氢氧化钡碳酸钡硫酸钡硝酸钡氯化钡氢氧化镁碳酸镁硫酸镁硝酸镁氯化镁氢氧化铜碳酸铜硫酸铜硝酸铜氯化铜氢氧化锌碳酸锌硫酸锌硝酸锌氯化锌硝酸汞氯化亚铜氢氧化亚铁碳酸亚铁硫酸亚铁硝酸亚铁氯化亚铁氢氧化铁硫酸铁硝酸铁氯化铁氢氧化铝硫酸铝硝酸铝氯化铝6、酸式盐(多元酸里的氢部分被金属取代,H夹在中间)碳酸氢钠碳酸氢钙磷酸二氢钠磷酸二氢钾硫酸氢钠硫酸氢钾7、碱式盐(化学式的中间有“OH”):碱式碳酸铜8、其他盐高锰酸钾锰酸钾氯酸钾硫化钠碘酸钾亚硝酸钠硫化钾。
初中常见物质的化学式常见元素的化合价一价钾钠银氢(K Na Ag H ) 二价钙镁钡锌(Ca Mg Ba Zn ) 三铝四硅要记清氟氯溴碘负一价(F Cl Br I ) 氧硫常显负二价氢氧根、硝酸根负一价(OH - NO 3-) 碳酸根、硫酸根负二价(CO 32-SO 42-)铵根正一价(NH 4+)常见金属活动性顺序:K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au 金属活动性有强逐渐减弱酸、碱、盐的溶解性酸:一般都可溶 碱:碱溶 钾、钠、铵、钡、钙盐:钾、钠、铵盐皆可溶, 硝酸盐入水无影踪, 盐酸盐(Cl)不溶AgCl 硫酸盐(SO 4)不溶BaSO 4 碳酸盐(CO 3) 只溶 钾、钠、铵记不住就记常见的沉淀物:白色沉淀:AgCl ,CaCO 3, BaSO 4,BaCO 3,Mg(OH)2,Al(OH)3蓝色沉淀:Cu(OH)2 红褐色沉淀:Fe(OH)3复分解反应发生条件:只要生成物有水或沉淀或气体生成即可发生反应一、初中常见物质的化学式 : 1、非金属单质2、金属单质3、常见氧化物4、氯化物/盐酸盐5、常见的酸6、常见的盐7、常见的碱8、常见有机物9、常见物质10、常见化肥11、沉淀初中化学方程式汇总一、氧气的性质:1、单质与氧气的反应:(化合反应)2、化合物与氧气的反应:3、氧气的来源:二、自然界中的水:三、质量守恒定律:四、碳和碳的氧化物:1、碳的化学性质3、二氧化碳的制法与性质:4、一氧化碳的性质:5、其它反应:五、燃料及其利用:六、金属1、金属与氧气反应:2、金属单质+ 酸=盐+ 氢气(置换反应)3、金属单质+ 盐(溶液)=新金属+ 新盐4、金属铁的治炼原理:七、酸、碱、盐1、酸的化学性质⑴酸+ 金属=盐+ 氢气(见上)⑵酸+ 金属氧化物=盐+ 水⑶酸+ 碱=盐+ 水(中和反应)⑷酸+ 盐=另一种酸+ 另一种盐2、碱的化学性质⑴碱+ 非金属氧化物=盐+ 水⑵碱+ 酸=盐+ 水(中和反应,方程式见上)⑶碱+ 盐=另一种碱+ 另一种盐3、盐的化学性质⑴盐(溶液)+ 金属单质=另一种金属+ 另一种盐(置换反应)⑵盐+ 酸=另一种酸+ 另一种盐(复分解反应)⑶盐+ 碱=另一种碱+ 另一种盐(复分解反应)⑷盐+ 盐=两种新盐(复分解反应)常见物质俗名:氢氧化钠:火碱、烧碱、苛性钠氧化钙:生石灰氢氧化钙:消石灰、熟石灰氯化钠:食盐固体二氧化碳:干冰氢氧化钠与氧化钙的固体混合物:碱石灰硫:硫磺碳酸钠:苏打、纯碱碳酸氢钠:小苏打过氧化氢溶液:双氧水汞:水银常见金属活动性顺序:K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au金属活动性有强逐渐减弱酸→H+ + 酸根离子碱→金属离子+ OH- 盐→金属离子+ 酸根离子酸、碱、盐的溶解性酸:一般都可溶碱:碱溶钾、钠、铵、钡、钙盐:钾、钠、铵盐皆可溶,硝酸盐入水无影踪,盐酸盐(Cl)不溶AgCl硫酸盐(SO4)不溶BaSO4碳酸盐(CO3) 只溶钾、钠、铵沉淀:1、红褐色絮状沉淀--------Fe(OH)32、浅绿色沉淀------------Fe(OH)23、蓝色絮状沉淀----------Cu(OH)24、淡黄色沉淀(水溶液中)----S5、白色沉淀--------------CaCO3,BaCO3,AgCl,BaSO4 ,Mg(OH)2.(其中BaSO4、AgCl是不溶于 HNO3的白色沉淀,CaCO3 BaCO3是溶于HNO3的白色沉淀)固体颜色:1、红色固体:红磷、铜,氧化铁(也可说成是红棕色) 4、紫黑色固体:高锰酸钾5、淡黄色固体:硫磺 8、黑色固体:铁粉,木炭,氧化铜,二氧化锰,四氧化三铁,炭黑溶液颜色2、蓝色溶液:有Cu2+溶液3、浅绿色溶液:硫酸亚铁溶液,氯化亚铁溶液,硝酸亚铁溶液(均含有Fe2+)4、黄色溶液:硫酸铁溶液,氯化铁溶液,硝酸铁溶液,工业盐酸(均含有Fe3+)具有刺激性气体的气体为:NH3、SO2、HCl尤其考得多的化学方程式:三个制氧:水的通电:实验室制二氧化碳:澄清石灰水变浑浊的原因: CO还原CuO:炼铁原理:复分解反应(只要生成物有水或沉淀或气体生成即可发生反应)概括:金属能与氧气、酸、部分盐反应(金属不能与碱反应)酸能与金属、金属氧化物、碱、部分盐反应(酸不与非金属氧化物反应)碱能与非金属氧化物、酸、部分盐反应(碱不与金属氧化物和金属反应)盐能与酸、碱、部分金属、部分盐反应。