离子反应第二课时
- 格式:ppt
- 大小:101.00 KB
- 文档页数:26




第二节离子反应(第二课时)学习目标:了解离子反应和离子方程式的含义;了解离子反应发生的条件和离子方程式的书写方法;通过对问题的讨论培养善于思考、勇于发现问题和解决问题的能力。
学习重点、难点重点:离子反应和离子方程式的书写。
难点:离子方程式的书写方法。
学习过程[练习导入]下列物质分散到水中后主要存在形式。
(阴阳离子、分子或沉淀形式存在)H2SO4NaOH NH4Cl CH3COOH HF HCOOH AgCl BaSO4[引导学生探究]第I组实验:混合前存在的离子有,混合后存在的离子有,混合前后各种离子的数目,所以它们没有发生化学反应;第II组实验:混合前存在的离子有,混合后主要存在的离子有,和结合生成了BaSO4白色沉淀,所以混合前后有离子的数目发生了改变,所以它们发生了化学反应。
[归纳总结1]二、离子反应1、定义:[引导阅读探究]请自学离子方程式的书写步骤,用简洁的文字或语言归纳。
[归纳总结2]2、离子方程式的书写:(1);(2);(3);(4)。
[练习探究1]写出下列反应的离子方程式①HCl溶液与NaOH溶液反应:②石灰石与盐酸溶液反应:③醋酸与碳酸钠溶液反应:④氨水与硫酸溶液反应:⑤铁与硫酸铜溶液反应:[归纳总结3]书写离子方程式的四个步骤中,“写”是基础,“拆”是关健,“删”是途径,而“查”是保证。
应该拆成离子形式的物质:(1)(2)(3)不能拆成离子形式的物质:(1)(2)(3)。
[讨论]实验1~2第I组在混合前存在的离子为Na+、Cl-、Cu2+、SO42-,混合后仍存在Na+、Cl-、Cu2+、SO42-,离子没有发生变化,也就是说离子间没有发生反应,哪么离子间要发生反应,结合[练习探究1]讨论离子之间要反应应该满足什么样的条件?[归纳总结4]3、离子间发生发生反应的条件1、离子间能结合;2、离子间能结合形成;3、离子间能结合形成。
[练习巩固1]1、下列各组离子中,在碱性....的是..溶液里能大量共存,且溶液为无色透明A、K+、MnO4-、Cl-、SO42-B、Na+、Al3+、NO3-、CO32-C、Na+、H+、NO3-、SO42-D、Na+、SO42-、S2-、Cl-2、在某无色透明..溶液中,能共存的离子组是....的酸性A、NH4+、NO3-、Al3+、Cl-B、Na+、SO32-、K+、HCO3-C、Cu2+、K+、SO42-、Na+D、Ba2+、SO42-、HCO3-、Na+ [练习探究2]请写出以下反应的离子方程式。
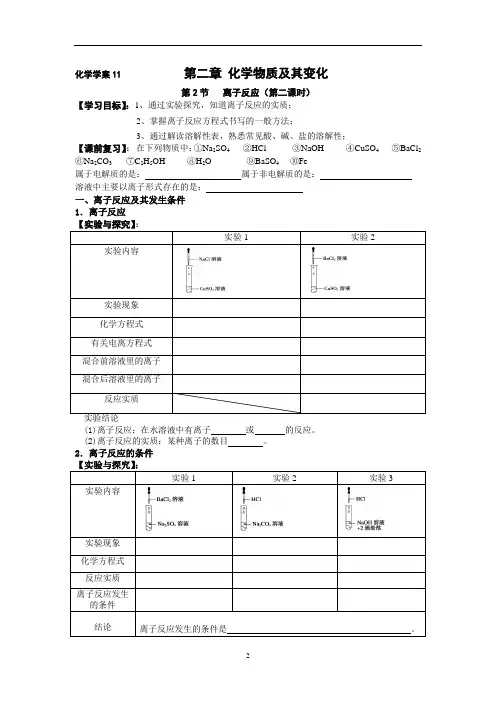
化学学案11第二章化学物质及其变化第2节离子反应(第二课时)【学习目标】:1、通过实验探究,知道离子反应的实质;2、掌握离子反应方程式书写的一般方法;3、通过解读溶解性表,熟悉常见酸、碱、盐的溶解性;【课前复习】:在下列物质中:①Na2SO4②HCl ③NaOH ④CuSO4 ⑤BaCl2⑥Na2CO3 ⑦C2H5OH⑧H2O⑨BaSO4 ⑩Fe属于电解质的是:属于非电解质的是:溶液中主要以离子形式存在的是:一、离子反应及其发生条件1.离子反应实验1 实验2 实验内容实验现象化学方程式有关电离方程式混合前溶液里的离子混合后溶液里的离子反应实质(1)离子反应:在水溶液中有离子或的反应。
(2)离子反应的实质:某种离子的数目。
2.离子反应的条件实验1实验2实验3实验内容实验现象化学方程式反应实质离子反应发生的条件结论离子反应发生的条件是。
【练习1】下列反应属于离子反应的是: ( )A.H2和O2反应生成水 B.锌片投入稀硫酸中C.KClO3加热分解制取O2D.H2还原CuOE. NaOH溶液与盐酸混和 F.盐酸与Na2CO3溶液混和G. CuSO4与NaOH溶液【小结】离子反应发生的条件是。
3、离子方程式(1)定义:用实际参加反应的表示离子反应的式子叫做离子方程式。
(2)离子方程式的书写(重要内容)步骤:四步。
(以盐酸与CaCO3反应为例)“写”:根据实验事实,写出正确的化学方程式;“拆”:反应物和生成物,以其在溶液中的主要存在形态出现。
如:的物质写成离子形式;的物质写成化学式形式。
(微溶物作反应物时,在溶液中就要拆;作生成物时就不拆。
)“删”:删去两边相同的离子,“查”:检查两边原子个数和电荷数是否相等、反应条件、沉淀符号、气体符号等。
(3)过关默写:离子形式:“易溶于水”且“易电离”:包括。
强酸:HCl、H2SO4、HNO3强碱:NaOH、KOH、Ba(OH)2、Ca(OH) 2化学式形式:单质、气体、氧化物。

离子反应第二课时教材解析本文档为《离子反应》教材第二课时的解析,旨在帮助学生更好地理解和掌握离子反应的相关知识。
1. 离子反应的基本概念离子反应是指发生在溶液中的离子之间的反应。
在溶液中,化学物质以离子的形式存在,离子之间可以进行各种反应,包括离子的结合和解离等。
离子反应的本质是离子之间的电荷转移过程。
正离子会失去电荷成为中性物质,负离子则会获得电荷成为中性物质。
这种电荷转移过程会伴随着化学反应的发生。
2. 离子反应的条件离子反应的发生需要满足一定的条件:- 存在可反应的离子:反应中必须存在能够进行反应的离子。
- 适当的溶剂:离子反应通常发生在溶液中,因此需要适当的溶剂来稀释和媒介反应。
- 适当的温度和压力:离子反应的发生通常需要控制一定的温度和压力条件。
3. 离子反应的类型离子反应可以分为以下几种类型:- 沉淀反应:当两种溶液中的离子发生相互作用时,形成的产物是不溶于溶液的固体沉淀。
这是一种常见的离子反应类型。
- 酸碱反应:当酸性物质和碱性物质发生反应时,产生水和盐。
这种反应也是离子反应的一种形式。
- 配位反应:发生在络合物中的离子反应。
络合物中的一个离子被配体取代或发生其他形式的反应。
- 氧化还原反应:涉及离子的电荷转移过程,包括氧化和还原。
这种反应常常与电子输运和能量转化有关。
4. 离子反应的实际应用离子反应在生活和科学研究中有着广泛的应用。
一些常见的实际应用包括:- 沉淀法:常用于分离和纯化化学物质中的杂质。
- 酸碱中和反应:用于调节溶液的酸碱度。
- 电解和电镀:利用离子反应的电荷转移性质进行电解和电镀。
- 金属腐蚀与防护:与离子反应相关的电化学反应可以导致金属腐蚀,而相应的防护方法也基于离子反应的原理。
5. 总结本文档对离子反应的基本概念、条件、类型和实际应用进行了解析,并介绍了常见的离子反应反应类型,供学生参考。
离子反应作为化学学科中的重要内容,对于深入理解化学反应的机理以及应用具有重要意义。


第二课时离子反应一、离子反应概念:电解质在中有离子参加或生成的反应叫离子反应。
1.离子方程式定义:用表示离子反应的式子叫做离子方程式。
2.离子方程式的书写书写离子方程式的步骤分为四步:“写、改、删、查.......”。
(1)“写”化学方程式,必须根据实验事实。
(2)“改”反应物和生成物,以其在溶液中主要存在形态出现:故将易溶易电离的物质(如强酸HC l、H2SO4、HNO3,强碱KOH、NaOH、Ba(OH)2,可溶性盐)改写成形式,难溶难电离的物质(弱酸H2CO3、HF、CH3COOH、弱碱NH3·H2O及难溶盐),单质,氧化物等仍写。
(3)“删”两边相同的离子,去除与离子反应无关的离子。
(4)“查”两边原子个数和电荷数是否相等、反应条件、沉淀符号、气体符号等。
3、离子方程式的意义(1)表示表示具体的一定物质反应(2)表示同一类型的离子反应。
如“H++OH-=H2O”练一练:1.下列反应能够发生且属于离子反应的是()A.H2和O2反应生成水B.锌片投入稀硫酸中C.KMnO4加热分解制取O2D.NH3遇HC l气体生成白烟2.能用H++OH-=H2O表示的反应是()A.氢氧化钡溶液与硫酸反应B.氢氧化铜与稀硝酸反应C.氢氧化钾与硫酸反应D.氢氧化钠与醋酸反应3.写出下列各组物质在溶液中的反应的离子方程式:(1)NaOH+ H2SO4(2)Cu(OH)2+ H2SO4(3)Ba(OH)2+ H2SO4(4)Ba(OH)2+HC l(5)NH3·H2O +HC l(6)NaOH+CH3COOH4.(1)选择适宜的物质完成反应,并写出有关反应的化学方程式。
○1CO32-+2H+=CO2↑+ H2O○2Cu2++2OH-=Cu(OH)2↓○3Zn+2H+=Zn2++ H2↑(2)完成离子反应,并改写成化学反应方程式。
○1 +2Ag+= +2Ag○2Fe2O3+ =2Fe3++○3CaCO3+ =CO2↑+ +二、离子反应发生的条件是:(1)生成难溶物质如氯化银、硫酸钡等(2)生成气体或易挥发性物质,如CO2、SO2、H2S等气体。


离子反应(第二课时)(一)指导思想与理论依据《离子反应》属于高一课本第一章第二节内容。
《离子反应》在中学阶段的基本概念基础理论知识中,占有极其重要的地位,贯穿于中学化学教材的始终,是中学化学教学的重点和难点之一。
在中学化学中要学习许多重要元素及其化合物的知识,都可能涉及离子反应及其方程式的书写。
《化学新课程标准》明确指出:学生要能通过实验认识离子反应及其发生条件,了解常见离子的检验方法。
(二)教学背景分析学习内容分析:而学生刚进高一,元素化合物知识不丰富,电离理论又没有学习,因此本节知识对学生来说具有一定的难度。
本节分三次课完成,本次课是学习离子方程式书写后的第二课时。
学好这一节内容,能揭示溶液中化学反应的本质。
既巩固了前面已学过的电离初步知识,又为后面元素化合物知识、电解质溶液的学习奠定了一定的基础,并且正确而又熟练地书写离子方程式,是学生必须掌握的一项基本技能。
学生情况分析:对于离子反应,学生基本上理解准确。
离子反应发生的条件也清楚,离子反应方程式的写法也基本掌握了。
但学生因为初中基础薄弱,溶液中发生的反应如复分解反应性质掌握不牢,常见的难溶物、易溶物记忆不清,书写时不太细心如化学符号写错等。
教学方式与教学手段说明:采用练习-错例分析-重点讲解-纠错-重写-总结-系统化,让学生感受化学用语的生成过程,巩固理解离子反应及其发生条件,并理解其重要性。
并创设问题的意境,激发学习兴趣,调动学生内在的学习动力,促使学生在意境中主动探究科学的奥妙。
通过学生对问题的探究、讨论、归纳,最终掌握离子方程式的书写方法。
技术准备:电脑、无线鼠标、多媒体投影仪前期准备:预习完成如下问题:1.将下列化学方程式改写成离子方程式2.如何判断一个离子反应方程式是否正确?3.学习离子反应发生的条件后如何帮助我们判断离子是否在溶液中大量共存。
(三)本课教学目标设计1.知识与技能(1)使学生理解并巩固离子反应的概念和离子反应发生的条件。

离子反应第二课时
1.教学目标分析
①知识与技能:
⑴让学生理解离子反应的概念,掌握复分解型离子反应发生的条件;
⑵在学生掌握复分解型离子反应发生条件的基础上,能够分析溶液中离子的共存问题;
②过程与方法:
⑴通过组织学生实验探究的方法,掌握复分解型离子反应发生的条件,并在此基础上掌握溶液中离子共存问题
⑵学会运用观察、实验等多种手段获取信息,并运用比较、分类、归纳、概括等方法对信息进行加工。
③情感态度与价值观:
⑴通过学生自主探究获得知识,让学生体验科学知识获得和形成的过程与方法,体会成功的获得知识的乐趣。
⑵通过实验激发学生学习化学的兴趣和情感,对学生进行透过现象看本质的辩证唯物主义教育;
3.教学重点、难点和关键
重点:离子反应发生的条件的探究和提出问题、解决问题的方法与能力
难点:引导学生设计离子反应发生的条件的探究方案
2.教学过程。