固态相变的热力学基础
- 格式:pdf
- 大小:896.85 KB
- 文档页数:60

固态相变By Dong大魔王固态相变:金属和陶瓷等固态材料在温度和压力改变时,其内部组织或结构会发生变化,即发生从一种状态到另一种状态的改变,这种转变称为固态相变。
按热力学分类:一级相变:相变时新旧两相的化学势相等,但化学势的一级偏微熵不等的相变称为一级相变;二级相变:相变时新旧两相的化学势相等,且化学势的一级偏微熵也相等,但化学势的二级偏微熵不相等的相变称为二级相变。
按平衡状态图分类:①平衡相变指在缓慢加热或冷却过程中所发生的能获得的符合平衡状态相图的平衡组织的相变。
主要有同素异构转变、多形性转变、平衡脱溶沉淀、共析相变、调幅分解、有序化转变。
②非平衡相变:伪共析相变、马氏体相变、贝氏体相变、非平衡脱溶相变按原子迁移情况分类:①扩散型相变:相变时,相界面的移动是通过原子近程或远程扩散而进行的相变称为扩散型相变。
基本特点是:相变过程中有原子扩散运动,相变速率受原子扩散速度所控制;新相和母相得成分往往不同;只有因新相和母相比容不同而引起的体积变化,没有宏观形状改变。
②非扩散型相变:相变过程中原子不发生扩散,参与转变的所有原子的运动是协调一致的相变称为非扩散型相变。
一般特征是:存在由于均匀切变引起的宏观形状改变,可在预先制备的抛光试样表面上出现浮突现象;相变不需要通过扩散,新相和母相的化学成分相同;新相和母相之间存在一定的晶体学位向关系;某些材料发生非扩散相变时,相界面移动速度极快,可接近声速。
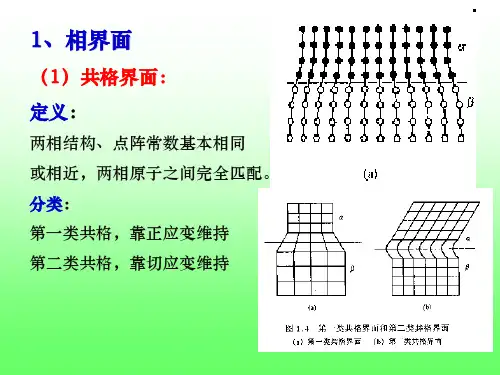
试述金属固态相变的主要特征①相界面:金属固态相变时,新相和母相的界面分为两种。
②位相关系:两相界面为共格或半共格时新相和母相之间必然有一定位相关系,两项之间没有位相关系则为非共格界面。
③惯习面:新相往往在母相一定晶面上形成,这个晶面称为惯习面。
④应变能:圆盘型粒子所导致的应变能最小,其次是针状,球状最大。
固态相变阻力包括界面能和应变能。
⑤晶体缺陷的影响:新相往往在缺陷处优先成核。
原子的扩散:收扩散控制的固态相变可以产生很大程度的过冷。
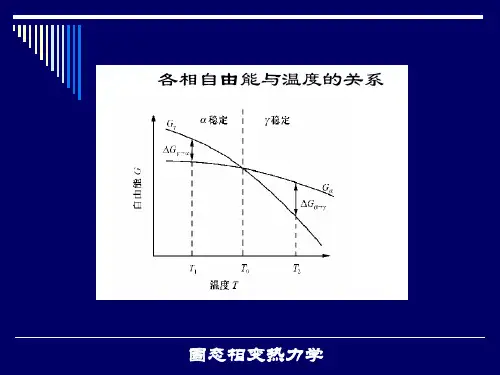




固态金属(包括纯金属和合金)在加热和冷却过程中可能发生各种相的转变,称为固态相变。
材料科学研究中的固态相变主要是指温度改变而产生的相变。
固态相变包括以下三种基本变化:①晶体结构的变化②化学成分的变化③有序程度的变化。
按相变过程中原子的运动特点分类:1)扩散型相变;2)非扩散型相变。
扩散型相变特点转变,块状转变,多形性转变,调幅分解1. 脱溶分解脱溶:从过饱和固溶体中析出新相的过程称为脱溶或沉淀。
条件:凡是有固溶度变化的相图,从单相区进入两相区时都会发生脱溶。
固溶处理工艺=淬火,不是淬火, 没有相变。
脱溶过程中由于析出了弥散分布的强化相,导致强度硬度显著升高的现象称沉淀强化(沉淀硬化),溶质原子的沉淀需要时间,随着时间的延长强化效果明显,又称为时效强化。
2)调幅分解:调幅分解(也称为增幅分解)是指过饱和固溶体在一定温度下分解成结构相同、成分不同两个相的过程。
特点:1)两个相之间没有明显的界面2)调幅分解没有形核,因此没有新的晶体结构出现3)调幅分解的成分变化通过上坡扩散来实现。
3)块状转变:新相与母相成分一样,但晶体结构不同.非扩散型相变:前后组元原子运动不超过一个原子间距的转变。
按平衡状态分类1)平衡相变2)非平衡相变三、按热力学分类1)一级相变 2)二级相变金属固态相变与液态金属结晶一样,金属固态相变与液-固相变一样,其相变驱动力来自新相与母相的自由能差,也通过形核和长大两个过程来完成。
但因相变前后均为固态,固有以下几个特点:(1).界面与界面能固态相变时,母相和新相均为固相,故其界面与固/液界面不同。
通常固/固界面可以按结构特点分为共格界面、半共格界面和非共格界面三种,其中共格界面界面能最低,半共格界面次之,非共格界面最高。
(2).惯习面和新、旧两相的位相关系惯习面的存在是为了减小两相的界面能,它的存在表面新相与母相存在一定晶体学位相关系。
(3).弹性应变能固态相变的阻力由界面能和弹性应变能构成。


第1章:奥氏体的形成1.金属固态相变的基础⑴热力学原理(自由能下降):固体中有元素扩散、自由能最低原则、降低自由能的过程⑵动力学原理(时间和温度):成份起伏,结构起伏,能量起伏→相变过程(形核、长大)发生相转变2.奥氏体的形成⑴热处理:通过加热、保温和冷却的方法,改变金属及合金的组织结构,使其获得所需要的性能的热加工工艺。
⑵奥氏体化:钢加热获得奥氏体的过程。
⑶奥氏体形成的热力学条件系统总的自由能变化ΔG:ΔG=-ΔG V+ΔG S+ΔGεΔGV——奥氏体与旧相体积自由能之差;ΔGS ——形成奥氏体时所增加的表面能;ΔGε——形成奥氏体时所增加的应变能ΔG<0,形成奥氏体。
⑷实际加热时临界点的变化加热:偏向高温,存在过热度;A C1,A C3,A CCm冷却:偏向低温,存在过冷度。
A r1,A r3,A rCm3.奥氏体的组织、结构⑴奥氏体的组织通常由多边形的等轴晶粒所组成,有时可观察到孪晶。
⑵奥氏体的结构①具有面心立方结构。
(奥氏体是C溶于γ-Fe中的固溶体。
合金钢中的奥氏体是C及合金元素溶于γ-Fe中的固溶体。
)②C是处于γ-Fe八面体的中心空隙处,即面心立方晶胞的中心或棱边的中点;③最大空隙的半径为0.052nm,与C原子半径(0.077 nm)比较接近。
C原子的存在,使奥氏体点阵常数增大④实际上奥氏体最大碳含量是2.11%(重量)4.奥氏体的性能⑴顺磁性。
用于相变点和残余奥氏体含量的测定等。
⑵比容最小。
也常利用这一性质借膨胀仪来测定奥氏体的转变情况。
⑶线膨胀系数最大。
利用奥氏体钢膨胀系数大的特性来做仪表元件。
⑷奥氏体的导热性能最差(除渗碳体外)。
奥氏体钢要慢速加热。
⑸奥氏体的塑性高,屈服强度低。
5.奥氏体的形成机制⑴奥氏体的形核①在铁素体与渗碳体的界面处依靠系统内的成分起伏、结构起伏和能量起伏形成。
②奥氏体形核于相界面处的原因:Ⅰ界面处碳浓度差大,有利于获得奥氏体晶核形成所需的碳浓度。


液相钢铁冶炼中的固相相变热力学计算随着当前社会的进步,钢铁生产成为国家发展的重要行业之一。
其中,液相钢铁冶炼技术在钢铁生产中广泛应用,而液相钢铁冶炼中的固相相变则是其中的重要环节之一。
本文将从热力学角度出发,探究液相钢铁冶炼中的固相相变热力学计算。
液相钢铁冶炼中的固相相变是指固态物质在高温高压条件下,由于自身内部的热运动而发生的发热或吸热的物理变化。
而热力学计算则是对这种物理变化反应过程的热力学性质进行系统的分析与计算。
在液相钢铁冶炼中,这种热力学计算十分重要,因为它直接关系到冶炼过程中的热量消耗、钢铁成分的变化以及金属结构、性能等方面的质量和效率问题。
液相钢铁冶炼过程中,固态物质发生相变所需的热量可以通过热力学计算获取。
具体而言,可以通过热力学分析来确定相变的平衡条件和相关的热力学参数,从而预测温度、压力、物质比例和动力学等参数,进而提高钢铁生产质量和效率。
固态相变的热力学计算涉及到的主要热力学参数包括热容、熵、焓、自由能、热化学函数等。
其中,自由能是描述化学反应热力学性质的重要参数。
它可以用来判断反应是否会自发进行,是衡量热力学体系的重要基础。
而热化学函数则是描述热化学反应能量的重要参数,包括焓变、熵变和自由能变。
在液相钢铁冶炼中,热化学函数是衡量冶炼效率的重要指标之一。
此外,固相相变热力学计算还涉及到一些传热学和热力学基础知识,例如催化剂热量测定、极大熵生产等。
在计算过程中,一定要考虑实际的操作条件和工艺要求,结合其它的核算数据和参数,以推动工艺的进一步优化和改进。
为了测定液相钢铁冶炼过程中的固相相变热力学参数,可以通过实验和模拟两种方法来获取。
实验方法是通过对钢铁材料进行加热和冷却处理,测量相变温度、吸热或放热量等参数,并通过数据分析来得出相关的热力学参数。
模拟方法则是通过建立相应的物理和化学模型,利用计算机模拟手段进行热力学计算,以获取相变过程中的各项参数和变量,并进一步发掘并优化液相钢铁冶炼工艺。
固态相变热力学条件相变是物质由一种状态转变为另一种状态的过程,固态相变是指物质由固态转变为另一种固态的过程。
在固态相变中,热力学条件起着重要的作用,它们决定了相变的发生与否以及相变过程的方向与速率。
本文将介绍固态相变热力学条件的相关内容。
1. 平衡态条件在固态相变中,平衡态条件是最基本的热力学条件之一。
平衡态条件要求相变系统达到热力学平衡状态,即系统内部各个部分的宏观性质均保持不变。
这意味着系统的温度、压力和组分等宏观性质在相变过程中保持不变。
只有在平衡态条件下,固态相变才能发生。
2. 热力学势的稳定性条件固态相变的发生与热力学势的稳定性有关。
热力学势是描述系统热力学性质的函数,如自由能、焓、熵等。
在固态相变中,相变前后的热力学势之差决定了相变的发生与否。
当相变前后的热力学势之差为负值时,相变才能发生。
这是因为系统总是倾向于降低热力学势,从而达到更稳定的状态。
3. 相变的熵变条件熵是描述系统无序程度的物理量,固态相变的熵变条件是相变前后系统的熵变值必须为正值。
当系统发生固态相变时,原子或分子的排列方式发生了改变,系统的无序程度增加,因此熵的值增加。
根据热力学第二定律,熵的增加是自然趋势,因此固态相变的熵变值必须为正。
4. Gibbs自由能的变化条件Gibbs自由能是判断系统稳定性和相变方向的重要参量。
在固态相变中,相变前后的Gibbs自由能之差决定了相变的方向。
当相变前后的Gibbs自由能之差为负值时,相变才能发生。
这是因为Gibbs 自由能是一个综合考虑了系统的能量、熵和体积等因素的物理量,其变化趋势决定了相变的方向。
5. 热力学平衡条件固态相变的发生与热力学平衡条件密切相关。
热力学平衡条件要求相变过程中系统各部分之间的温度、压力和组分等宏观性质保持一致。
这意味着相变过程中系统内部各部分之间不存在温度、压力和组分的梯度,即系统处于均匀的平衡状态。
只有在热力学平衡条件下,固态相变才能顺利进行。
总结起来,固态相变的热力学条件包括平衡态条件、热力学势的稳定性条件、相变的熵变条件、Gibbs自由能的变化条件和热力学平衡条件。