体外诊断试剂临床试验受试者筛选入选表
- 格式:doc
- 大小:52.50 KB
- 文档页数:1

国家药品试验基地临床试验前研究人员培训记录表医院药物临床试验机构34号存档文件临床试验剩余药品销毁/退回记录单___________________________临床试验文件物品交接记录研究中心:_______________________ 中心编号:□□送交人:日期:本记录一式两份,本份由(研究中心名称)保存()医院临床试验机构()期临床试验30号存档文件受试者签认代码表试验中心编号:()医院国家药品临床研究基地()期临床试验31号存档文件受试者筛选表与入选表()医院国家药品临床研究基地()期临床试验35号存档文件完成试验受试者编码目录药品名称()期临床试验12号和32号存档文件研究者履历与签名样章目录参加单位(盖章)年月日研究者履历与签名样章编号:项目分工:负责或参加编号:项目分工:负责或参加国家药品监督管理局药物临床研究批件原始编号:受理号:批件号:_________________________医学伦理委员会新药临床试验审查记录签字页我一阅读了此方案,我同意此方案的内容,并同意按此方案进行临床研究。
我将对此方案及相关内容保密。
临床研究负责单位:医院主要研究者(签字):签字日期年月日临床试验参加单位:医院主要研究者(签字):签字日期年月日医院主要研究者(签字):签字日期年月日医院主要研究者(签字):签字日期年月日医院主要研究者(签字):签字日期年月日医院主要研究者(签字):签字日期年月日统计单位:医学统计中心主要负责人(签字):签字日期年月日临床试验监察应查看的数据及标准1、知情同意书中的性别、年龄、身高、体重、姓名等项均应填写完整,最后由受试者签名。
2、试验病人的年龄应该在研究方案规定的范围内。
3、检验单的时间不能出现在随访时间之后,CRF表的时间不能出现在第一张检验单之后。
4、每位受试者在试验中的有关资料均应记录于预先按试验要求而设计的病例报告表中。
研究者应确保将任何观察与发现均正确而完整地记录于病例报告表上,记录者应在表上签名。

受试者筛选入选表
研究题目:
研究中心编号及名称:
●每个签署知情同意书的患者都需要登记;
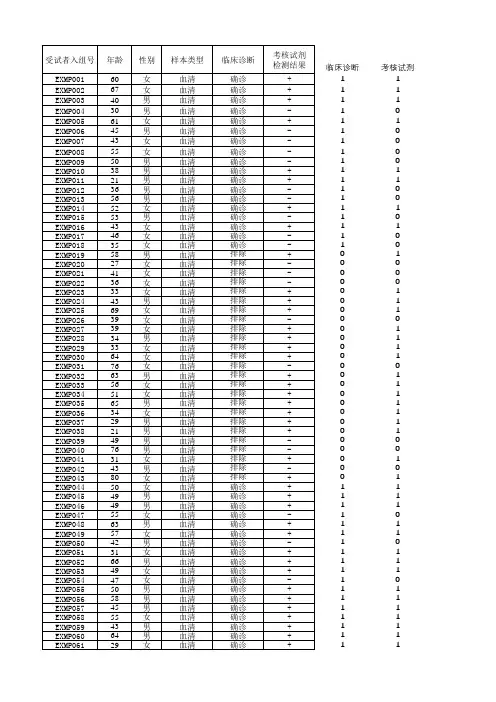
●受试者编号为中心号2位+筛选顺序号3位,根据患者签署知情同意书的先后顺序,顺序号依次从小到大;
如01中心,受试者编号为01001 、01002、01003,依次往下;
●患者姓名缩写与CRF填写要求一致;四格需填满,两字姓名填写两字拼音前两个字母;三字姓名填写三字首字母及第三字第二字母;
四字姓名填写每一个字首字母;
举例:张红
李淑明
欧阳小惠
●;
●结束日期是指患者结束试验的日期。
若患者筛选失败,则结束日期为确定筛选失败的日期,并应在“筛选失败的原因”栏予以记录;
若患者完成整个试验,则结束日期为该患者完成试验的日期;若患者提前中止研究(无论是因为失访、不可耐受的不良事件、疗效不佳等任何原因),结束日期应为该患者中止研究的日期,并应在“脱落原因”栏予以记录
受试者筛选入选表
注:受试者编号格式:中心号(2位)+筛选顺序号(3位),例如:01001 ,入组日期请记录获取随机号日期。

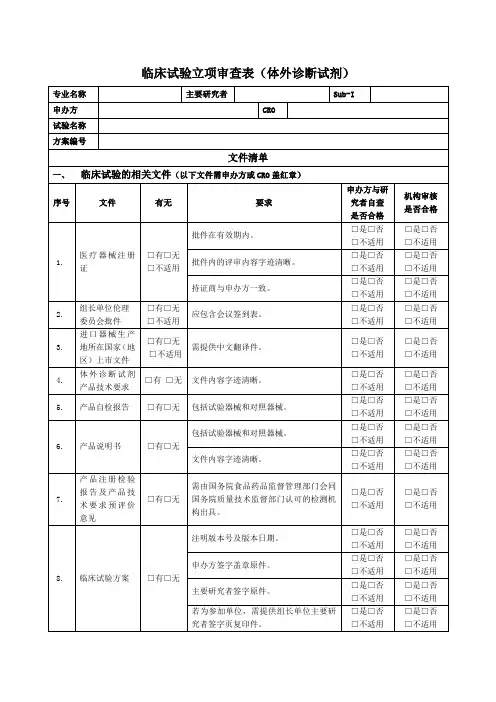
体外诊断试剂临床评价立卷审查表(临床试验)使用说明:1.本文件用于回答“体外诊断试剂注册项目立卷审查标准”和“体外诊断试剂变更注册项目立卷审查标准”中临床试验问题时使用。
2.依照注册申报资料情况对“临床评价情况”中内容进行勾选。
3.按照“临床评价情况”中勾选的情况,填写表格。
通过临床试验路径进行临床评价的,应填写《体外诊断试剂临床评价立卷审查表(临床试验)》。
根据适用审查表的填写情况,给出临床评价立卷审查结论。
4.立卷审查问题中临床试验相关问题,除有特殊说明外,均同时适用于境内、境外开展的临床试验资料。
—1—流水号:产品名称:申请人/注册人名称:临床评价情况:□免于进行临床试验路径□临床试验路径境内临床试验数据□包含□不包含境外临床试验数据□包含□不包含临床评价立卷审查结论:□通过□不通过—2——3—总体审查问题1.如果提交了相关资料则勾选“是”,如果不做要求则勾选“不适用”,如未能提供则勾选“否”。
2.对任何问题回答“否”都会导致做出“立卷审查不通过”的决定。
序号立卷审查问题是不适用否备注存在问题1是否提交了临床试验资料。
注:若未提交,临床试验部分可直接给出“不通过”的结论,不必对剩余问题进行审查。
2临床试验中各项文件均以中文形式提供,如为外文形式,提供了中文译本。
根据外文资料翻译的申报资料,同时提供了原文。
3进口产品临床试验资料如无特别说明,原文资料均应当由申请人签章,中文资料由代理人签章。
原文资料“签章”是指:申请人的法定代表人或者负责人签名,或者签名并加盖组织机构印章;中文资料“签章”是指:代理人盖公章,或者其法定代表人、负责人签名并加盖公章。
注:进口产品的临床试验资料若只以中文形式提供,则应同时由申请人、代理人签章。
4临床试验资料与注册申请表内容具有一致性。
5是否提交了临床评价综述。
1.简要总结支持产品注册申报的临床评价过程和数据,说明临床评价路径和关键内容,包括试验地点(如机构)、试验方法、受试者及样本、评价指标及可接受标准、试验结果、结论、资料位置等。


临床试验申请表306PLA-JG-T-001-01研究者履历表306PLA-JG-T-002-01项目名称: CFDA批件号:研究中心名称:研究中心代号:方案编号:参加负责项目分工:研究者声明临床试验协调会签到表306PLA-JG-T-003-01项目名称:申办单位:方案编号:_ _ 主要研究者:_ 会议时间:_ 年月日会议地点:临床试验协调会记录表306PLA-JG-T-004-01项目名称:申办单位:方案编号:_ _ 主要研究者:_ 会议时间:_ 年月日会议地点:日期:__________________ _ 主要研究者:临床试验提交伦理审议申请表306PLA-JG-T-005-01中国人民解放军第306医院国家药物临床试验机构管理文件临床试验启动会签到表306PLA-JG-T-006-01项目名称:方案编号:申办单位:_ _ 主要研究者:_ 会议时间:_ 年月日会议地点:中国人民解放军第306医院国家药物临床试验机构管理文件临床试验启动会记录表306PLA-JG-T-007-01项目名称:方案编号:申办单位:_ _ 主要研究者:_ 会议时间:_ 年月日会议地点:_________日期:主要研究者:_________ _中国人民解放军第306医院国家药物临床试验机构管理文件研究人员分工表306PLA-JG-T-008-01项目名称:方案编号:申办单位:专业科室:主要研究者:主要研究者签字:日期:中国人民解放军第306医院国家药物临床试验机构管理文件受试者筛选/入选表306PLA-JG-T-009-01页第页___共___中国人民解放军第306医院国家药物临床试验机构管理文件受试者签认代码表306PLA-JG-T-010-01 项目名称:方案编号:___第共页___页中国人民解放军第306医院国家药物临床试验机构管理文件严重不良事件报告表306PLA-JG-T-011-01项目名称:CFDA批件号:方案编号:中国人民解放军第306医院国家药物临床试验机构管理文件/ 报告者(研究医生)/报告日期:确认者(主要研究者/日期: /时间:/ / 发送者/日期者送是CFDA注册司否发伦理委员会申办至:□是□否□是□否□是□否中国人民解放军第306医院国家药物临床试验机构管理文件完成试验受试者编码目录306PLA-JG-T-012-01项目名称:方案编号:___第共页___页中国人民解放军第306医院国家药物临床试验机构管理文件临床试验总结会签到表306PLA-JG-T-013-01项目名称:申办单位:方案编号:_ _ 主要研究者:_ 会议时间:_ 年月日会议地点:中国人民解放军第306医院国家药物临床试验机构管理文件临床试验总结会记录表306PLA-JG-T-014-01项目名称:申办单位:方案编号:_ _ 主要研究者:_ 会议时间:_ 年月日会议地点:________日期:主要研究者:_________ _中国人民解放军第306医院国家药物临床试验机构管理文件临床试验用药物(物资)签收记录单306PLA-JG-T-015-01 项目名称: CFDA批件号:方案编号:研究中心名称:研究中心代号:发送单位名称:___第页___共页中国人民解放军第306医院国家药物临床试验机构管理文件试验用药物保存记录表306PLA-JG-T-016-01方案编号:项目名称:药物编号:药物名称:药物批号:药物规格:中国人民解放军第306医院国家药物临床试验机构管理文件试验用药物分发回收记录表306PLA-JG-T-017-01中国人民解放军第306医院国家药物临床试验机构管理文件临床试验剩余药物(物资)退回/销毁记录单306PLA-JG-T-018-01中国人民解放军第306医院国家药物临床试验机构管理文件文件接收、保管记录表306PLA-JG-T-019-01项目名称:方案编号:发送方:接收方:送交人:_________________ 日期:_________________注:本记录一式两份,本份由_____________(研究中心名称)保存。