土壤水溶性盐的测定
- 格式:docx
- 大小:119.84 KB
- 文档页数:7

浅谈危险废物水溶性盐测定方法摘要:在危险废物到厂时,需要对危险废物的水溶性盐含量进行快速测定,以便初步拟制废物的处置方式。
目前常用的水溶性盐含量测量的方法为行业标准法:《土壤水溶性盐总量的测定》(NY/T1121.16-2006)。
此方法,测定数据比较准确,但是缺点也显而易见,就是耗时较长。
因此,为克服测定危险废物中水溶性盐耗时长的问题,快速预测危废中水溶性盐的含量,进而选择较为科学、适用、经济的方法,以取得较好的效果,有利于高效运转。
文章就危险废物中水溶性盐常见的三种测定方法进行比较,分析阐述各自的优点和不足,指导人们在实践运用中科学掌握。
关键词:危险废物;水溶性盐;快速预测1 分析比较危险废物中水溶性盐测定方法的意义危险废物填埋污染控制标准GB18598-2019规定,满足其中一项条件可进入柔性填埋场:即水溶性盐总量小于10%的危废,测定方法按照NY/T1121.16-2006执行,待国家发布固体废物中水溶性盐总量的测定方法后执行新的监测方法标准。
且焚烧处置过程危废物料中的碱金属(六个金属元素,即锂(li)、钠(na)、钾(k)、铷(rb)、铯(cs)、钫(fr),上述碱金属化合物熔点低,能在焚烧处置系统生产过程中产生结焦结块导致系统负载、堵塞系统等现象,对焚烧处置系统影响较大导致生产过程增加维修成本及维修频次,快速预测危废物料中水溶性盐来监测其碱金属含量能指导生产,提高生产效率。
2 常见的测定方法和特点目前,采用的危险废物中水溶性盐测定的方法有三种:即行业标准法、电导法(TDS法)和盐度计法。
(1)行业标准法:《土壤水溶性盐总量的测定》(NY/T1121.16-2006)。
这种测定方法是测出除盐成分的前后质量差,为危险废物入厂提供依据。
主要有以下几个过程:将风干后土壤样品与水按一定的水土比例(1:5)混合,经过一定时间(3min)振荡后,将土壤中可溶性盐分提取到溶液中,然后将水土混合液进行过滤,滤液可作为土壤可溶盐分测定的待测液。

FHZDZTR0070 土壤 水溶性盐分全盐量的测定 质量法F-HZ-DZ-TR-0070土壤—水溶性盐分(全盐量)的测定—质量法1 范围本方法适用于土壤水溶性盐分(全盐量)的测定。
2 原理盐渍土含有的水溶性盐分主要是钾、钠、钙、镁的氯化物、硫酸盐、碳酸盐或重碳酸盐等,当其在土壤中积累到一定浓度时,就将危害作物生长,尤其是碱性钠盐的存在及其在土壤内的移动,还会造成土壤碱化。
对土壤进行水溶性盐分分析,是研究盐渍土的盐分状况及其对农业生产影响的重要方法。
土壤水溶性盐分分析包括全盐量、碳酸根、重碳酸根、氯根、硫酸根、钙、镁、钾、钠离子和离子总量。
土壤水溶性盐按一定的水土比例用水浸出,浸出液作全盐量、阴离子和阳离子含量的测定,离子总量由计算法求得,测定结果以cmol/kg 或g/kg 表示。
全盐量的测定一般采用质量法,吸取一定量土壤水浸出液,蒸干除去有机质后,烘干,称量测得全盐量。
3 试剂3.1 过氧化氢,1+1。
4 仪器4.1 振荡机。
4.2 离心机。
4.3 锥形瓶,500mL ,250mL 。
4.4 布氏漏斗和抽滤瓶。
4.5 玻璃蒸发皿,质量不超过20g 。
5 操作步骤5.1 待测液的制备:称取通过2mm 筛孔的风干土样50.000g(精确至0.001g)置于干燥的500mL 锥形瓶中,加入250.00mL 无二氧化碳的水,加塞,放在振荡机上振荡3min 。
同时做空白试验。
5.2 根据土样悬浊液能否滤清的情况,选用一种方法过滤,取得清亮的浸出液,滤液用250mL 干燥锥形瓶承接,滤完后将滤液摇匀,加塞,作全盐量、阴离子和阳离子含量测定用。
容易滤清的土样悬浊液用慢速滤纸过滤,也可用布氏漏斗慢速滤纸抽滤,过滤时漏斗上用表面皿盖好,减少溶液蒸发,最初滤液如有浑浊,必须重复过滤至清亮为止。
较难滤清的土样悬浊液用皱折的双层慢速滤纸反复过滤,也可用离心机离心分离,取得清亮的滤液。
5.3 吸取50.00mL 清亮的浸出液,置于已在105℃~110℃烘至恒量的玻璃蒸发皿中,放在水浴上蒸干。

FHZDZTR0076 土壤 水溶性盐分硫酸根的测定 容量法F-HZ-DZ-TR-0076土壤—水溶性盐分(硫酸根)的测定—容量法1 范围本方法适用于土壤中等含量水溶性盐分(硫酸根)的测定,适宜测定范围为20µg/mL~300 µg/mL 。
2 原理先用过量的氯化钡溶液使土样水浸出液中的硫酸根沉淀完全,过量的钡离子连同浸出液中原有的钙和镁离子,在pH10条件下,用EDTA 标准溶液滴定,由沉淀消耗的钡离子量计算硫酸根量。
加入一定量镁离子,可使滴定终点清晰。
3 试剂3.1 盐酸溶液,1+4。
3.2 氯化铵-氢氧化铵缓冲溶液:pH10,称取67.5g 氯化铵,溶于水中,加入570mL 新开瓶的氢氧化铵(ρ 0.90g/mL ),再加水稀释至1000mL 。
防止吸收空气中的二氧化碳,最好贮存于塑料瓶中。
3.3 EDTA 标准溶液:0.0200mol/L ,称取已在80℃烘干2h 的乙二胺四乙酸二钠7.4450g (EDTA ,Na 2H 2C 10H 12O 2N 2·2H 2O ),精确至0.0001g ,溶于1000mL 水中。
3.4 钡镁混合溶液:称取1.22g 氯化钡(BaCl 2·2H 2O)和1.02g 氯化镁(MgCl 2·6H 2O)溶于水,再加水稀释至500mL 。
此溶液钡和镁离子浓度种各为0.01mol/L ,每mL 约可沉淀1000µg 硫酸根。
3.5 酸性铬蓝K-萘酚绿B 指示剂:先将50g 烘干的氯化钠研细,再分别将0.5g 酸性铬蓝K 和1.0g 萘酚绿B 研细,然后将三者混合均匀,贮于棕色瓶中,保存于干燥器中。
3.6 氯化钡溶液:称取5g 氯化钡溶于100mL 水中。
3.7 盐酸溶液,1+1。
3.8 硫酸根标准溶液:500µg/mL ,称取0.2268g 硫酸钾(K 2SO 4),精确至0.0001g ,加水溶解,再加水稀释至250mL 。
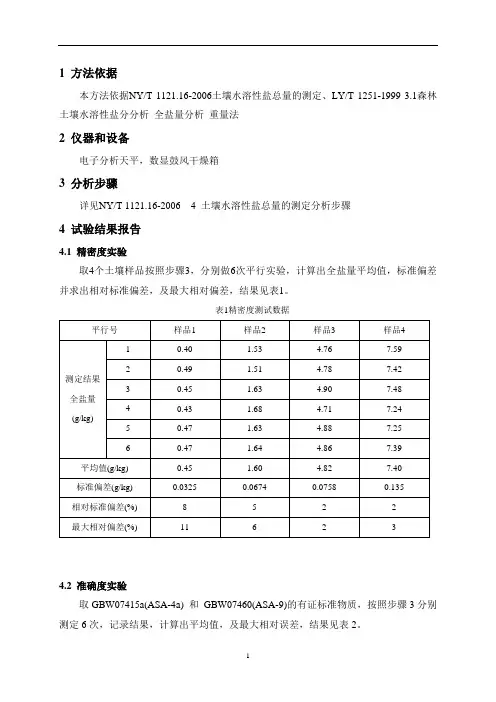
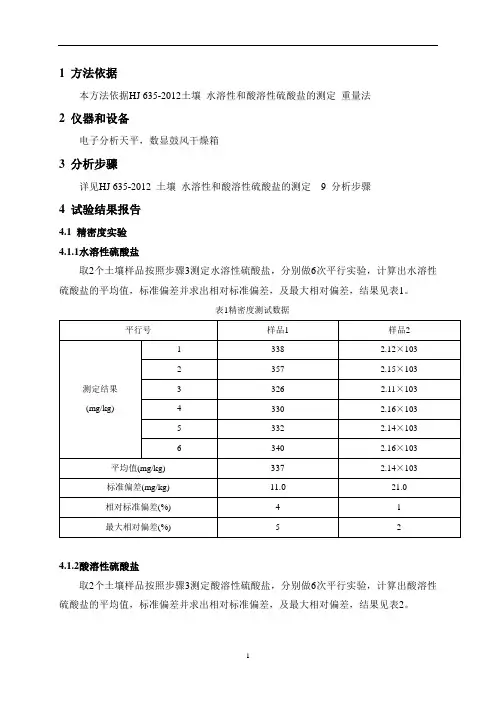
1 方法依据
本方法依据NY/T 1121.16-2006土壤水溶性盐总量的测定、LY/T 1251-1999 3.1森林土壤水溶性盐分分析全盐量分析重量法
2 仪器和设备
电子分析天平,数显鼓风干燥箱
3 分析步骤
详见NY/T 1121.16-2006 4 土壤水溶性盐总量的测定分析步骤
4 试验结果报告
4.1 精密度实验
取4个土壤样品按照步骤3,分别做6次平行实验,计算出全盐量平均值,标准偏差并求出相对标准偏差,及最大相对偏差,结果见表1。
表1精密度测试数据
4.2 准确度实验
取GBW07415a(ASA-4a) 和GBW07460(ASA-9)的有证标准物质,按照步骤3分别测定6次,记录结果,计算出平均值,及最大相对误差,结果见表2。
表2 准确度实验结果
5 结论
5.1 精密度
样品1测得平均值为0.45g/kg,最大相对偏差为11%,标准中要求测定值<0.5g/kg 时,允许相对差<20%;
样品2测得平均值为1.60g/kg,最大相对偏差为6%,标准中要求测定值为0.5~2g/kg 时,允许相对差10~15%;
样品3测得平均值为4.82g/kg,最大相对偏差为2%,标准中要求测定值为2~5g/kg 时,允许相对差5~10%;
样品4测得平均值为7.40g/kg,最大相对偏差为3%,标准中要求测定值为>5g/kg 时,允许相对差<5%;
5.2 准确度
有证标准物质GBW07415(ASA-4a)、GBW07460(ASA-9)分别测6次平行,最大相对误差分别为-7%,8%。



土壤水溶性盐的测定土壤水溶性盐的提取1 方法提要用除去二氧化碳的水浸提土壤中水溶性盐,水土比为5:1。
将水土混合液过滤,滤液作 为待测液。
2 适用范围本方法适用于各类土壤水溶性盐的提取。
3 主要仪器设备3.1 往复式或旋转式振荡器;满足180r/min ±20r/min 的振荡频率或达到相同效果; 3.2 真空泵(抽气用);3.3 巴氏滤管或布氏漏斗(平板瓷漏斗); 3.4 广 口瓶,500mL ; 3.5 具塞三角瓶,500mL 。
4 试剂4.1 去除二氧化碳的水:将蒸馏水煮沸15min ,冷却后立即使用。
5 分析步骤称取通过2mm 孔径筛的风干试样50.00g ,置于500mL 广口瓶中,加250mL 去除CO 2 的水,用橡皮塞塞紧瓶口,在振荡机上振荡3min ,立即用抽气过滤装置(见图)或布氏漏斗抽 滤于具塞三角瓶中,开始滤出的10mL 滤液弃去,以获得清亮的滤液,加塞备用。
该浸出液 可用于土壤水溶性盐总量(电导率法或重量法)、碳酸根和重碳酸根(电位滴定法或双指示 剂中和法)、氯离子(硝酸银滴定法)、硫酸根离子(硫酸钡比浊法或EDTA 间接滴定法)、水 溶性钙和镁离子(原子吸收分光光度法)、水溶性钾和钠离子(火焰光度法或原子吸收分光 光度计法)的测定。
电导、碳酸根和重碳酸根等测定应立即进行,其他离子的测定亦应在当 天完成。
6 注释二通活零巴氏丁号型管 _____ 橡声管真空泵抽气1)浸提时水土比例和浸提时间对盐分的浸出量都有一定的影响,必须统一规定,才便 于分析结果相互比较。
本方法采用国内通用的5: 1水土比例和振荡提取3min 的规定。
2)除去二氧化碳的水可以有效地减小碳酸盐(碳酸钙、碳酸镁)和硫酸钙的溶解量, 从而影响着水浸出液的盐分数量,因此,浸提时必须使用除去二氧化碳的水。
3) 待测液不可在室温下放置时间过长(一般不得超过1天),否则会影响钙、镁、 碳酸根和重碳酸根的测定,可以将滤液储存在4℃条件下备用。
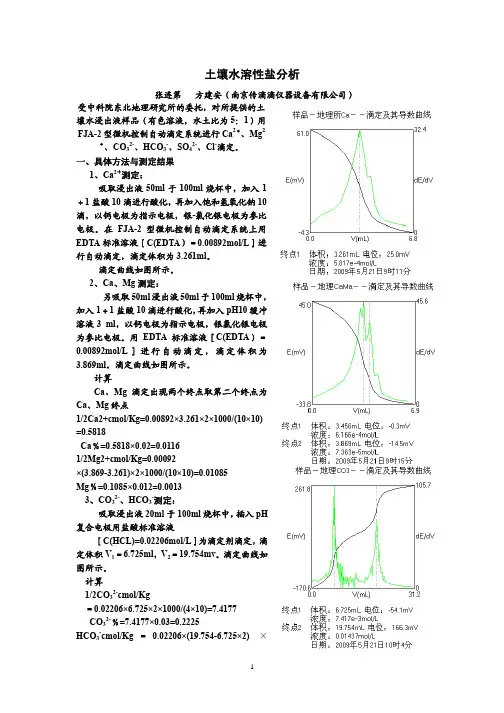
土壤水溶性盐分析张连第 方建安(南京传滴滴仪器设备有限公司)受中科院东北地理研究所的委托,对所提供的土壤水浸出液样品(有色溶液,水土比为5:1)用FJA-2型微机控制自动滴定系统进行Ca 2+、Mg 2+、CO 32-、HCO 3-、SO 42-、Cl -滴定。
一、具体方法与测定结果1、Ca 2+测定:吸取浸出液50ml 于100ml 烧杯中,加入1+1盐酸10滴进行酸化,再加入饱和氢氧化钠10滴,以钙电极为指示电极,银-氯化银电极为参比电极。
在FJA-2型微机控制自动滴定系统上用EDTA 标准溶液[C(EDTA )=0.00892mol/L ]进行自动滴定,滴定体积为3.261ml 。
滴定曲线如图所示。
2、Ca 、Mg 测定:另吸取50ml 浸出液50ml 于100ml 烧杯中,加入1+1盐酸10滴进行酸化,再加入pH10缓冲溶液3 ml ,以钙电极为指示电极,银氯化银电极为参比电极。
用EDTA 标准溶液[C(EDTA )=0.00892mol/L ]进行自动滴定,滴定体积为3.869ml 。
滴定曲线如图所示。
计算Ca 、Mg 滴定出现两个终点取第二个终点为Ca 、Mg 终点1/2Ca2+cmol/Kg=0.00892×3.261×2×1000/(10×10)=0.5818Ca %=0.5818×0.02=0.01161/2Mg2+cmol/Kg=0.00092×(3.869-3.261)×2×1000/(10×10)=0.01085Mg %=0.1085×0.012=0.00133、CO 32-、HCO 3-测定:吸取浸出液20ml 于100ml 烧杯中,插入pH复合电极用盐酸标准溶液[C(HCL)=0.02206mol/L ]为滴定剂滴定,滴定体积V 1=6.725ml ,V 2=19.754mv 。
1 方法依据本方法依据HJ 635-2012土壤水溶性和酸溶性硫酸盐的测定重量法2 仪器和设备电子分析天平,数显鼓风干燥箱3 分析步骤详见HJ 635-2012 土壤水溶性和酸溶性硫酸盐的测定9 分析步骤4 试验结果报告4.1 精密度实验4.1.1水溶性硫酸盐取2个土壤样品按照步骤3测定水溶性硫酸盐,分别做6次平行实验,计算出水溶性硫酸盐的平均值,标准偏差并求出相对标准偏差,及最大相对偏差,结果见表1。
表1精密度测试数据4.1.2酸溶性硫酸盐取2个土壤样品按照步骤3测定酸溶性硫酸盐,分别做6次平行实验,计算出酸溶性硫酸盐的平均值,标准偏差并求出相对标准偏差,及最大相对偏差,结果见表2。
表2精密度测试数据4.2 准确度实验(加标实验)4.2.1水溶性硫酸盐对样品1和2分别进行加标,按照步骤3分别测定6次,记录结果,计算出水溶性硫酸盐平均值,及加标回收率,结果见表3。
表3 加标实验结果4.2.2酸溶性硫酸盐对样品3和4分别进行加标,按照步骤3分别测定6次,记录结果,计算出酸溶性硫酸盐平均值,及加标回收率,结果见表4。
表4 加标实验结果5 结论5.1 精密度对样品1和2进行水溶性硫酸盐的测定,样品1测得平均值为337mg/kg,最大相对偏差为5%;样品2测得平均值为2.14×103mg/kg,最大相对偏差为2%;对样品3和4进行酸溶性硫酸盐的测定,样品3测得平均值为8.73×103mg/kg,最大相对偏差为2%;样品4测得平均值为1.70×104mg/kg,最大相对偏差为0.6%;标准中要求,平行样测定结果的相对偏差应在20%以内。
5.2 准确度(加标回收)分别对样品1和2进行加标测定水溶性硫酸盐,测得加标回收率分别为95.0%和101%,对样品3和4进行加标测定酸溶性硫酸盐,测得加标回收率分别为96.0%和101%。
FHZDZTR0071 土壤 水溶性盐分全盐量的测定 电导法F-HZ-DZ-TR-0071土壤—水溶性盐分(全盐量)的测定—电导法1 范围本方法适用于土壤水溶性盐分(全盐量)的测定。
2 原理土壤中的水溶性盐是强电介质,其水溶液具有导电作用,导电能力的强弱可用电导率表示。
在一定浓度范围内,溶液的含盐量与电导率呈正相关,含盐量愈高,溶液的渗透压愈大,电导率也愈大。
土壤水浸出液的电导率用电导仪测定,直接用电导率数值表示土壤的含盐量。
3 试剂3.1 氯化钾标准溶液:0.0200mol/L ,称取1.4910g (精确至0.0001g )于105℃烘4h 的氯化钾(KCl )溶于无二氧化碳的水中,并稀释至1000mL 。
4 仪器4.1 电导仪。
4.2 铂电极。
4.3 温度计。
5 操作步骤5.1 待测液的制备:称取通过2mm 筛孔的风干土样50.000g(精确至0.001g)置于干燥的500mL 锥形瓶中,加入250.00mL 无二氧化碳的水,加塞,放在振荡机上振荡3min ,然后干过滤或离心分离,取得清亮的待测浸出溶液。
也可以吸取水溶性盐分(全盐量)的测定—质量法待测液制备得到的清亮溶液测定,同时做空白试验。
5.2 将铂电极引线接到电导仪相应的接线柱上,接通电源,打开电源开关。
5.3 调节电导仪至工作状态。
5.4 将铂电极用待测液冲洗几次后插入待测液中,打开测量开关,读取电导数值。
5.5 取出铂电极,用水冲洗,用滤纸吸干,再作下一土样测定。
同时测量待测液温度。
注:电导法测定全盐量时,最好用清亮的待测液。
如用悬浊液,应先澄清,并在测定时不再搅动,以免损坏电极的铂黑层。
6 结果计算按下式计算25℃时1∶5土壤水浸出液的电导率:K f C L t ××=式中:L ——25℃时1∶5土壤水浸出液的电导率,mS/cm ;C ——测得的电导值,mS/cm ;f t ——温度校正系数;K ——电极常数(电导仪上如有补偿装置,不需乘电极常数)。
土壤—水溶性盐分(钾、钠)的测定—原子发射光谱法1 范围本方法适用于土壤水溶性盐分(钾、钠离子)的测定。
2 原理土样水浸出液中的钾、钠离子,用原子发射光度法测定,钙离子量大于20mg/L 时干扰测定,加入一定量硫酸铝溶液可以抑制钙的影响。
3 试剂3.1 钾、钠混合标准溶液:称取已在105℃烘2h 的氯化钠2.5430g(NaCl),精确至0.0001g ,溶于水,再加水稀释至1000mL 此溶液1mL 含1000µg 钠;再用水稀释5倍,得1mL 含200µg 钠标准溶液。
另称取已在105℃烘2h 的氯化钾1.9069g(KCl),精确至0.0001g ,溶于水,再加水稀释至1000mL ,此溶液1mL 含1000µg 钾;再用水稀释5倍,得1mL 含200µg 钾标准溶液。
将上述1mL 含200µg 钾和1mL 含200µg 钠标准溶液等体积混合,即得1mL 含100µg 钾和钠标准溶液,贮于塑料瓶中。
3.2 硫酸铝溶液:0.1mol/L ,称取34g 硫酸铝[Al 2(SO 4)3]或66g 硫酸铝[Al 2(SO 4)3·18H 2O]溶于水,再加水稀释至1000mL 。
4 仪器4.1 原子吸收分光光度计(发射部分)或火焰光度计。
4.2 容量瓶,25mL 。
5 操作步骤5.1 待测液的制备:称取通过2mm 筛孔的风干土样50.000g(精确至0.001g)置于干燥的500mL 锥形瓶中,加入250.00mL 无二氧化碳的水,加塞,放在振荡机上振荡3min ,然后干过滤或离心分离,取得清亮的待测浸出溶液。
也可以吸取水溶性盐分(全盐量)的测定—质量法待测液制备得到的清亮溶液测定。
同时做空白试验。
5.2 试样测定:吸取5.00mL ~10.00mL 浸出液置于25mL 容量瓶中,加入1mL 硫酸铝溶液,加水稀释至刻度,摇匀。
FHZDZTR0070 土壤 水溶性盐分全盐量的测定 质量法F-HZ-DZ-TR-0070土壤—水溶性盐分(全盐量)的测定—质量法1 范围本方法适用于土壤水溶性盐分(全盐量)的测定。
2 原理盐渍土含有的水溶性盐分主要是钾、钠、钙、镁的氯化物、硫酸盐、碳酸盐或重碳酸盐等,当其在土壤中积累到一定浓度时,就将危害作物生长,尤其是碱性钠盐的存在及其在土壤内的移动,还会造成土壤碱化。
对土壤进行水溶性盐分分析,是研究盐渍土的盐分状况及其对农业生产影响的重要方法。
土壤水溶性盐分分析包括全盐量、碳酸根、重碳酸根、氯根、硫酸根、钙、镁、钾、钠离子和离子总量。
土壤水溶性盐按一定的水土比例用水浸出,浸出液作全盐量、阴离子和阳离子含量的测定,离子总量由计算法求得,测定结果以cmol/kg 或g/kg 表示。
全盐量的测定一般采用质量法,吸取一定量土壤水浸出液,蒸干除去有机质后,烘干,称量测得全盐量。
3 试剂3.1 过氧化氢,1+1。
4 仪器4.1 振荡机。
4.2 离心机。
4.3 锥形瓶,500mL ,250mL 。
4.4 布氏漏斗和抽滤瓶。
4.5 玻璃蒸发皿,质量不超过20g 。
5 操作步骤5.1 待测液的制备:称取通过2mm 筛孔的风干土样50.000g(精确至0.001g)置于干燥的500mL 锥形瓶中,加入250.00mL 无二氧化碳的水,加塞,放在振荡机上振荡3min 。
同时做空白试验。
5.2 根据土样悬浊液能否滤清的情况,选用一种方法过滤,取得清亮的浸出液,滤液用250mL 干燥锥形瓶承接,滤完后将滤液摇匀,加塞,作全盐量、阴离子和阳离子含量测定用。
容易滤清的土样悬浊液用慢速滤纸过滤,也可用布氏漏斗慢速滤纸抽滤,过滤时漏斗上用表面皿盖好,减少溶液蒸发,最初滤液如有浑浊,必须重复过滤至清亮为止。
较难滤清的土样悬浊液用皱折的双层慢速滤纸反复过滤,也可用离心机离心分离,取得清亮的滤液。
5.3 吸取50.00mL 清亮的浸出液,置于已在105℃~110℃烘至恒量的玻璃蒸发皿中,放在水浴上蒸干。
土壤全盐量的测定方法重量法1.适用范围:《森林土壤水溶性盐分分析》LY/T 1251-19992.方法要点:准确吸取一定量的土壤水浸出液,蒸干除去有机质后,在105~110℃烘箱中烘干、称量求出全盐量(g/kg)。
3.仪器和试剂3.1过氧化氢。
3.2主要仪器分析天平(感量0. 000 2 g);水浴;烘箱;玻璃蒸发皿;干燥器;坩埚钳。
4.测定步骤4.1 吸取完全清亮的土壤浸出液50 mL(如用100 mL则分两次加,每次加50 mL),放人已知质量(mL)的玻璃蒸发皿(质量一般不超过20 g)中,在水浴上蒸干。
4.2 小心地用胶头滴管加入少量10%~15%H2O2,转动蒸发皿,使与残渣充分接触,继续蒸干。
如此重复用过氧化氢处理,至有机质氧化殆尽,残渣呈白色为止。
4.3 将蒸于残渣在105—110℃恒温箱中烘2h,在干燥器中冷却约30 min后称量。
重复烘干、称重,直至达到恒定质量(mg),即前后两次质量之差不大于1 mg。
5 .结果计算式中:m-相当于50 mL浸出液(或100 ml)的干土质量,g;m1-蒸发皿质量,g;m2-全盐量加蒸发皿质量,g。
注 1.质量法测全盐时,吸出浸出液的量应视土壤盐分含量而定,土壤舍盐量小于5.0 g/kg者,须吸取浸出液体50- 100 mL。
2 质量法中加过氯化氢除去有机质时,每次加入量只要使残渣湿润即可,以免过氯化氢分解时泡沫过多而使盐分溅失。
3 质量法测定全盐量的误差来源还有以下几方面:烘干残渣中通常含有少量硅酸盐胶体和未除尽的有机质造成正误差。
碳酸氢根(HCO3-)在加热(蒸发或烘干)时将转化为碳酸根(co3-),其质量约减轻一半,故必要时应在测得的全盐量(g/kg)上加1/2HCO3-,予以校正。
当浸出液中含有大量钙离子(ca2+)、镁离子(Mg2+)和氯离子(CI一)时,蒸发后形成吸湿性强的二氯化钙(CaCl2)和二氯化镁(MgCl2),难以烘至恒定质量;同时,二氯化镁在加热时易水解成碱式盐而失去质量,造成负误差:2MgCI2+H20 --Mg0.MgCl2+2HCI190.6 135.6遇此情况,可在浸出液中预先加入10 g/L碳酸钠溶液25.00 mL,然后在180℃下烘干,使钙和镁的氯化物(硫酸根含量高时,还有钙、镁的硫酸盐)转化为碳酸盐;在计算全盐量时,从烘干物质量中减去相当于所加入碳酸钠溶液的烘干质量。
实验五土壤可溶盐分的分析一、实验目的1.了解土壤可溶盐分的组成与全盐量的定义2.掌握土壤全盐量的测定方法及计算二、实验原理土壤可溶盐分是指在一定时间内用一定的水土比例浸提出来的土壤中所含有的水溶盐分。
分析土壤中可溶盐分的阴、阳离子组成,和由此确定的盐分和含量,可以判断土壤的盐渍状况和盐分动态。
盐分对植物的影响主要决定于可溶盐分的含量和种类组成,和不同植物的耐盐程度,就盐分组成而言,苏打盐分对植物危害最大,氯化钠次之,硫酸钠相对较轻。
因此了解土壤中可溶性盐分含量和动态对于研究盐碱土的形成,特点、变化规律;研究植物生长与土壤盐分的关系以及对盐碱地的改良的利用均有重要意义。
水溶性盐的测定一般包括全盐量,离子总量、各种离子含量等项目。
在很多情况下,也把P测定列为其中的分析项目之一。
具体测定项目应视工作需要而定。
本实验要测定的项目和所用方法如下:全盐量的测定——重量法CO32-、HCO3-离子的测定——双指示剂滴定法Cl—离子的测定——硝酸银滴定法(莫尔法)SO42—离子的测定——EDTA间接络合滴定法Ca2+、Mg2+离子的测定——EDTA络合滴定法Na+和K+离子的测定——钠电极法(一)待测液的制备1、方法原理土壤样品按一定水土比例混合,经一定时间振荡后,将土壤中可溶性盐分提取到溶液中,将此水土混合液过滤便得可作为可溶性盐分测定的待测液。
2、仪器电动振荡机:真空泵;大口塑料瓶(1000ml);巴氏滤管或平板瓷漏斗;抽气瓶(1000ml)。
3、操作步骤(1) 称取通过1mm 筛孔风干土样50克(精确到0.1克),放入500ml 大口塑料瓶中加入250ml 无CO 2蒸馏水。
(2)将塑料瓶用橡皮塞塞紧后在振荡机上振荡3分钟。
(3)振荡后立即抽气过滤,如样品不太粘重或碱化度不高,可改用平板瓷漏斗过滤,直到滤清为止。
清液存于250ml 三角瓶中,用橡皮塞盖紧备用。
(二)土壤全盐量的测定1、方法原理吸取一定量的待测液,经蒸干后,称得的重量即为烘干残查量(一般略高于或接近盐分总量)。
方法验证报告项目名称:土壤水溶性和酸溶性硫酸盐的测定重量法方法名称:《土壤水溶性和酸溶性硫酸盐的测定重量法HJ635-2012报告编写人:参加人员:审核人员:报告日期:1实验室基本情况1.1人员情况实验室检测人员已通过标准《土壤水溶性和酸溶性硫酸盐的测定重量法》HJ635-2012的培训,熟知标准内容、检测方法及样品数据采集和处理等,考核合格,得到公司技术负责人授权上岗。
1.2检测仪器/设备情况1.3检测用试剂情况1.4环境设施和条件情况实验室具有检定合格的温湿度计,环境可以控制在标准要求范围内,满足检测环境条件。
另外实验室配备了洗眼器、喷淋设施、护目镜、灭火器等的安全防护措施,符合实验室安全内务的要求。
2实验室检测技术能力2.1方法原理用去离子水或稀盐酸提取土壤中的硫酸盐,提取液经慢速定量滤纸过滤后,加入氯化钡溶液,提取液中的硫酸根离子转化为硫酸钡沉淀。
沉淀经过滤、烘干、恒重,根据硫酸钡沉淀的质量计算土壤中水溶性和酸溶性硫酸盐的含量。
2.2分析步骤2.2.1试样的制备风干后的样品过2mm筛,用四分法缩分土样制得一份约为200g的样品。
过0.25mm筛,进一步缩分约50g(用于1:2土水比水溶性硫酸盐的测定)或约10g(用于1:5土水比水溶性硫酸盐和酸溶性硫酸盐的测定)的试样。
将试样放在适合的容器中,在不超过40℃下干燥,直至试样每隔4h称重的质量差应小于0.1%(m/m),并于干燥器内冷却。
2.3试料的制备2.3.1以1:5土水比提取水溶性硫酸盐称取10.0g试样于250ml聚乙烯瓶中,加入50.0ml水,拧紧瓶盖,置于振荡器上,在20~25℃下以150~200r/min震荡提取16h。
使用慢速定量滤纸,在布氏漏斗上过滤提取液至500ml接收瓶,转移至50ml比色管中,记录提取液的体积,待测。
2.3.2以1:2土水比提取水溶性硫酸盐称取50.0g试样于250ml聚乙烯瓶中,加入100.0ml水,拧紧瓶盖,置于振荡器上,在20~25℃下以150~200r/min震荡、提取16h。
土壤水溶性盐的测定土壤水溶性盐的提取1 方法提要用除去二氧化碳的水浸提土壤中水溶性盐,水土比为5:1。
将水土混合液过滤,滤液作为待测液。
2 适用范围本方法适用于各类土壤水溶性盐的提取。
3 主要仪器设备3.1往复式或旋转式振荡器;满足180r/min±20r/min的振荡频率或达到相同效果;3.2真空泵(抽气用);3.3巴氏滤管或布氏漏斗(平板瓷漏斗);3.4广口瓶,500mL;3.5具塞三角瓶,500mL。
4 试剂4.1去除二氧化碳的水:将蒸馏水煮沸15min,冷却后立即使用。
5 分析步骤称取通过2mm孔径筛的风干试样50.00g,置于500mL广口瓶中,加250mL去除CO2的水,用橡皮塞塞紧瓶口,在振荡机上振荡3min,立即用抽气过滤装置(见图)或布氏漏斗抽滤于具塞三角瓶中,开始滤出的10mL滤液弃去,以获得清亮的滤液,加塞备用。
该浸出液可用于土壤水溶性盐总量(电导率法或重量法)、碳酸根和重碳酸根(电位滴定法或双指示剂中和法)、氯离子(硝酸银滴定法)、硫酸根离子(硫酸钡比浊法或EDTA间接滴定法)、水溶性钙和镁离子(原子吸收分光光度法)、水溶性钾和钠离子(火焰光度法或原子吸收分光光度计法)的测定。
电导、碳酸根和重碳酸根等测定应立即进行,其他离子的测定亦应在当天完成。
6 注释1)浸提时水土比例和浸提时间对盐分的浸出量都有一定的影响,必须统一规定,才便于分析结果相互比较。
本方法采用国内通用的5:1水土比例和振荡提取3min 的规定。
2) 除去二氧化碳的水可以有效地减小碳酸盐(碳酸钙、碳酸镁)和硫酸钙的溶解量,从而影响着水浸出液的盐分数量,因此,浸提时必须使用除去二氧化碳的水。
3) 待测液不可在室温下放置时间过长(一般不得超过1天),否则会影响钙、镁、碳酸根和重碳酸根的测定,可以将滤液储存在4℃条件下备用。
4) 巴氏滤管是用不同细度的陶瓷制成,其微孔大小分为6级。
号数越大,微孔越小,土壤盐分过滤可用1G 3或1G 4。
也有的巴氏滤管微孔大小分为粗、中、细三级,土壤盐分过滤可用粗号或中号。
水溶性盐总量的测定A 电导法1 方法提要土壤中水溶性盐属强电解质,其溶液导电能力的强弱称为电导度。
在一定浓度范围内,溶液的含盐量与电导率呈正相关。
因此,土壤浸出液电导率的数值能反映土壤含盐量的高低,但不能反映混合盐的组成。
如果土壤溶液中几种盐分彼此间的比值比较固定时,则用电导法测定总盐分浓度的高低是相当准确的。
将电导电极插入一定浓度的电解质溶液时,根据欧姆定律,当温度不变,电阻R 与电极极片间距离(L)成正比,与极片的截面积(A)成反比:R =ρAL式中ρ为电阻率。
当L=1cm ,A =1cm 2,则R=ρ,此时测得的电阻称为电阻率(ρ)。
溶液的电导是电阻的倒数,溶液的电导率则是电阻率的倒数。
则溶液电导(S)为:LA R S y 1==式中 y 为电导率。
对于某一电导电极A 和L 是固定的,则y 值与离子浓度及组成有关。
电导率的单位常用西门子·米-1(S ·m -1)。
土壤溶液的电导率一般小于1,因此,也常用d S ·m -1(分西门子·米-1)表示。
溶液温度将按下式对电导率产生影响:)]25(1[125℃t R ℃y -+=α式中α为温度系数。
对多数离子来说,溶液温度每升高1℃,迁移率约增加2%。
但是,各种离子的温度系数值是不同的,不同温度范围的温度系数也是不同的。
所以当条件允许时,应在恒温系统中进行测定。
待测液的电导可在电导仪上测得,经电极常数K 和温度校正值(f t )校正后即为电导率,依照盐分与电导率的关系曲线可得到可溶性盐分总量。
2 适用范围本方法适用于各类土壤水溶性盐总量的测定。
3 主要仪器设备3.1 电导仪;3.2 电导电极:铂电极和镀铂黑电导电极各1支。
4 试剂4.1 氯化钾标准溶液[c (KCl )=0.02mol ·L -1]:称取经105℃烘6h 的氯化钾(优级纯)1.4911g 溶于少量无CO 2的水,转入1L 容量瓶中,定容。
25℃时的电导率为0.2765 S ·m -1。
5 分析步骤按照所用仪器说明书,调整好电导仪,使仪器处于工作状况。
电导电极常数的测定:用标准KCl 溶液(其电导率在一定温度下是已知的)求出电极常数。
取0.02mol L -1氯化钾标准溶液30mL 于小烧杯中,用该电极测其电导度(S KCl )。
同时测量液温,按下表查得该温度下0.02mol L -1氯化钾标准溶液的电导率,计算电导电极常数。
(某些电导仪的电导电极常数已经在电极上注明,不需自行测定)。
电导电极常数,llKC KC S EC K式中:EC KCl ——标准KCl 溶液的电导率,其在不同温度下的电导率见下表。
S KCl ——同一电极在相同条件下实际测得的电导度值。
表 不同温度氯化钾标准溶液[c (KCl )=0.0200mol L -1土壤浸出液电导度的测定:取浸出液(见土壤水溶性盐的提取)30mL于50mL小烧杯中,将电极(用水冲洗后,用滤纸吸干)插入待测液,使铂片全部浸没在液面下,并尽量插在液体的中心部位,测定待测液的电导度(S t),每个试样应读取2~3次,同时测定液温。
如果测定批量样品时,应每隔10min测一次液温。
在10min内所测样品可用前后两次液温的平均值。
6 结果计算6.1土壤浸出液的电导率(EC25)=电导度(S t)×温度校正系数(f t)×电极常数(k)。
一般电导仪的电极常数值已在仪器工作时给予补偿,故只须乘温度校正系数,不再乘电极常数。
温度校正系数(f t)可查注释附表。
粗略计算时,可按下式直接算出:EC25=KS t[1-(t-25℃)×2%]6.2土壤样品水溶性盐总量的计算:溶液的电导度不仅与溶液中盐分的浓度有关,而且也受盐分组成的影响。
取30个以上所测地区盐类类型相近、盐分含量不同的有代表性的试样,用质量法或离子加合法测得水溶性盐总量,同时按上述分析步骤以电导法测得试样浸出液的电导度,换算为25℃的电导率(EC25)。
根据测得的电导率(X)和全盐量(y),建立回归方程。
按测量并校正后的试样浸出液的电导率(EC25)即可由回归方程计算出该样品的水溶性盐总量。
7 注释7.1 用于电导测量的溶液,应当清晰透明。
由于悬浮的土壤胶体颗粒吸附在电极铂黑上,会引起测量误差,因此不要用悬浊液测量。
7.2 测定电极常数时,应选择与样品溶液浓度相近的标准溶液,一般情况下,常选用c (KCl) =0.02mol·L-1的标准溶液测定电导电极常数。
7.3 测定高浓度样品时,可选择电极常数较高的铂黑电极;在测定低浓度样品时,因铂黑对电解质的吸附作用而使读数不稳定,应选用不镀铂黑的光亮铂电极。
7.4 若土壤含水溶性盐总量很高,可将浸提液稀释后再进行电导率测定,然后按稀释倍数换算水溶性盐总量。
7.5 每个样品插入电极后,测量时间应相对一致,如第一个样品在插入电极2min后读数,以后的样品也应在2min左右读数,时间不要相差太大,但一定要使指针基本稳定后记录读数。
7.6 在盐分类型比较单一的地区,可将土壤中盐分提取后,烘干,作为标准物质配成标准系列溶液,测定电导率后,求出回归方程或绘制校准曲线,进行计算。
7.7 不同地区、不同盐分类型的盐分电导曲线是不同的,必须用大量盐分与电导进行统计求得。
许多研究发现,盐分含量与溶液电导率不是简单的直线关系,若以盐分含量对应电导率的对数值作图或回归统计,可以取得更理想的线性效果。
7.8 如果样品只用电导仪测定水溶性盐总量,可称取5.0g风干试样放在25×100mm大试管中,加水25.0mL,盖紧橡皮塞,振荡3min,静置澄清后,立即将电极铂片直接浸没在上层清液中测定溶液的电导率,再由回归方程计算出水溶性盐总量。
7.9电导电极一般多用上海雷磁仪器厂生产的DJS-1C型等电导电极。
这种电极使用前后应浸在蒸馏水内,以防止铂黑的惰化。
如果发现镀铂黑的电极失灵,可浸在1:9的硝酸或盐酸中2min,然后用蒸馏水冲洗再行测量。
如果情况无改善,则更换电极。
7.10电导或电阻的温度校正系数EC=EC×ft ;R=R/ fB 质量法1 方法提要吸取一定量的水溶性盐浸出液,经蒸干并去除有机质,称重即为水溶性盐总量。
质量法一直作为测定总盐量的基准方法。
2 适用范围本方法适用于各类型土壤水溶性盐总量的测定。
3 主要仪器设备3.1水浴锅; 3.2恒温干燥箱; 3.3干燥器;3.4瓷蒸发皿:100mL 。
4 试剂4.1 1:1过氧化氢溶液。
5 分析步骤吸取清亮的浸出液(见土壤水溶性盐的提取)20.0mL ~50.0mL (视含盐量而定,所取体积中以含盐50mg ~200mg 为宜),置于已知烘干质量的瓷蒸发皿内,于水浴上蒸干。
近干时,如发现有黄褐色物质,用滴管沿皿周围加入少量1:1过氧化氢溶液,使残渣润湿,继续在水浴上加热去除有机质,反复处理至残渣发白,为完全去除有机质,蒸干。
将蒸发皿放入100℃~105℃烘箱中烘干3 h ,移至干燥器中冷却约30min 后称量,直至恒重。
6 结果计算水溶性盐总量,g ·kg -1=1000)(01⨯⋅-mDm m式中m ——称取风干试样质量,g ,本试验为50g ; m 1——蒸发皿+盐的烘干质量,g ; m 0——蒸发皿烘干质量,g ;1000——换算成每kg含量;D——分取倍数,250/20~50;平行测定结果以算术平均值表示,保留小数点后一位。
6精密度平行测定结果允许差:水溶性盐总量(g·Kg-1)允许相对相差(%)<0.5 <200.5~2 15~102~5 10~5>5 <57 注释1)残渣中当CaS04·2H2O或MgSO4·7H2O的含量较高时,其结晶水需要在180℃才能去除。
如CaCl2·6HO或MgCl2·6HO的含量高,由于其极易吸湿和潮解,可在烧杯中加入碳酸钠溶液[ (Na2CO3)=20g·L-1],使产生钙、镁的碳酸盐沉淀,然后再在105℃下烘干、称重。
减去加入的Na2CO3量。
2)加过氧化氢去除有机质时,只要达到使残渣湿润即可,这样可以避免由于过氧化氢分解时泡沫过多,使盐分溅失,因此必须少量多次反复处理,直至残渣完全变白为止。
但当盐分中有铁存在而出现黄色氧化铁时,烘干的盐分也会出现黄色,不可误认为是有机质的颜色。
3)由于盐分(特别是镁盐)在空气中容易吸水,故应在相同的时间和条件下冷却称重。