人教版高中化学必修一氯
- 格式:doc
- 大小:37.00 KB
- 文档页数:3

第二章海水中的重要元素—钠和氯二、氯气1.物理性质:黄绿色气体,有刺激性气味的有毒气体,可溶于水(1体积水大约溶解2体积的氯气),易液化,加压和降温条件下可变为液态(液氯)和固态。
2.化学性质(与强氧化性有关)(1)与金属反应①钠与氯气反应 2Na+Cl22NaCl②铁与氯气反应 2Fe+3Cl22FeCl3③铜与氯气反应 Cu + Cl2CuCl2规律:氯气与变价金属(如Fe、Cu)发生反应,把变价金属氧化成高价的金属氯化物。
(2)与非金属反应:氢气在氯气中安静燃烧,发出苍白色火焰,瓶口呈白雾状。
生成的HCl极易溶于水,与空气中的水蒸气结合形成的盐酸(氢氯酸)小液滴。
H 2 + Cl22HCl (在点燃(或光照)下氯气均能与氢气反应)实验证明,在一定条件下,Cl2还能与P、S、C等非金属直接化合。
燃烧:燃烧不一定有氧气参加,物质并不是只有在氧气中才可以燃烧。
燃烧的本质是剧烈的氧化还原反应,所有发光放热的剧烈化学反应都称为燃烧。
(3)氯气与水的反应 Cl2+H2O == HCl+HClO在该反应中,Cl2既是氧化剂于是还原剂,转移的电子数为e-。
①次氯酸HClO有强氧化性和漂泊性,次氯酸有弱酸性(酸性比碳酸还弱),作用:杀菌消毒,漂白不稳定,光照或加热分解,因此久置氯水会失效。
2HClO 2HCl+O2↑②新制氯水和久置氯水的区别?(久置氯水的酸性强于新制氯水)新制氯水:3分子:Cl2,HClO,H2O 4离子:H+,OH-,Cl-,ClO-久置氯水:分子:H2O 离子:H+,Cl-(4)氯气与碱的反应①漂白液的制取2NaOH + Cl2 = NaClO + NaCl + H2O。
主要成分是NaClO+NaCl,有效成分是NaClO②漂白粉的制取2Ca(OH)2+2Cl2==Ca(ClO)2+CaCl2+2H2O。
主要成分是Ca(ClO)2+CaCl2,有效成分是Ca(ClO)2③漂白粉的漂白原理: Ca(ClO)2 + CO2+H2O==CaCO3↓+ 2HClO④漂白粉失效原理 Ca(ClO)2 + CO2+H2O==CaCO3↓+ 2HClO , 2HClO 2HCl + O2↑(5)氯气的实验室制法MnO2+4HCl(浓) MnCl2+2H2O+Cl2(氯气在饱和食盐水里的溶解度非常小)。




最新人教版高中化学必修一第4章第2节《富集在海水中的元素——氯》(第1课时)教案整体设计从容说课氯及其化合物知识作为本章第二节教学内容,其设计意图是:1.氯是一种比较典型的、重要的非金属元素。
教科书选择氯气的性质、用途以及Cl-的检验等内容进行比较全面的学习和研究,不但可以让学生了解典型非金属单质及其化合物的性质,而且对学生全面认识化学元素,尤其是了解其他非金属元素及其化合物的性质,形成正确的观点、掌握正确的学习方法等具有重要的作用。
2.氯是富集在海水中的一种元素,资源丰富。
而且食盐、漂白粉等含氯的化合物大家都非常熟悉,与日常生活比较贴近,学习时,容易使学生产生一种亲近感,有一种似曾相识的感觉,容易产生强烈的求知欲望,有效地降低了学习的难度,较好地体现了一种人文关怀。
3.通过本节的学习,可以培养学生的归纳能力、举一反三的能力、自主学习的能力。
而自主学习的能力又是一切能力的基础,也是教学的最高境界——教是为了不教。
理论联系实际,突出知识的重要用途,是本节编排的一个特色。
重点知识判断的重要依据之一就是实用性。
氢气在氯气中的燃烧是工业上制盐酸的重要方法,氯气与水反应是氯气用于自来水消毒的原理所在,离子检验是化学实验的重要内容,也是一项重要的基本技能。
因此,这些重点知识的学习对学生知识与能力的发展有非常重要的作用。
而氯气的实验室制法,与现实联系不多,实际用途不大,而且,尾气氯气的毒性比较大,容易对环境造成污染,容易使学生产生一种不正确的认识及一种恐惧感,不利于学生以后对实验的学习及掌握。
因此,在新教材中就删去了“氯气的实验室制法”。
这样,就使学生的注意力顺着教材的顺序,自然而然地转移到用途上来,体现了编者的意图。
教材中把有关“氯气的实验室制法”放到“科学史话”中作了介绍,而且是以探究的形式让学生自己去写反应方程式,既化解了难点,又培养了学生的探究能力,真是一举两得。
另外,教材在内容上也体现了对立统一规律和辩证唯物主义观点。
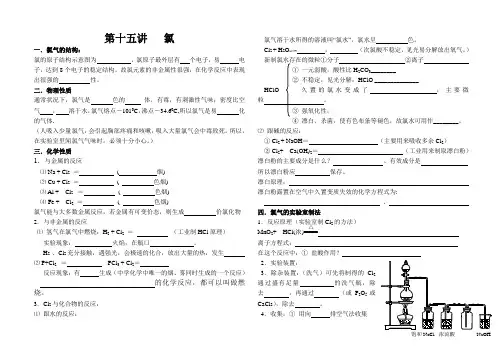
第十五讲氯一.氯气的结构:氯的原子结构示意图为,氯原子最外层有个电子,易电子,达到8个电子的稳定结构。
故氯元素的非金属性很强,在化学反应中表现出很强的性。
二.物理性质通常状况下,氯气是色的体,有毒,有刺激性气味;密度比空气,溶于水,氯气熔点-1010C,沸点-34.60C,所以氯气是易化的气体.(人吸入少量氯气,会引起胸部疼痛和咳嗽,吸入大量氯气会中毒致死。
所以,在实验室里闻氯气气味时,必须十分小心。
)三.化学性质1.与金属的反应⑴ Na + Cl2=( 烟)⑵ Cu + Cl2=( 色烟)⑶ Al + Cl2 =( 色烟)⑷ Fe + Cl2=( 色烟)氯气能与大多数金属反应,若金属有可变价态,则生成价氯化物2.与非金属的反应⑴氢气在氯气中燃烧:H2 + Cl2=(工业制HCl原理)实验现象:火焰,在瓶口。
H2 、Cl2充分接触,遇强光,会极速的化合,放出大量的热,发生⑵ P+Cl2=PCl3 + Cl2=反应现象:有生成(中学化学中唯一的烟、雾同时生成的一个反应)的化学反应,都可以叫做燃烧。
3.Cl2与化合物的反应:⑴跟水的反应:氯气溶于水所得的溶液叫“氯水”,氯水呈色。
Cl2 + H2O,(次氯酸不稳定,见光易分解放出氧气。
)新制氯水存在的微粒①分子②离子H2CO3________HClO ______________氯水变成了,主要微④漂白、杀菌,使有色布条等褪色,故氯水可用作________。
⑵跟碱的反应:① Cl2 + NaOH=(主要用来吸收多余Cl2)② Cl2+ Ca(OH)2=(工业用来制取漂白粉)漂白粉的主要成分是什么?、有效成分是所以漂白粉应保存。
漂白原理:漂白粉露置在空气中久置变质失效的化学方程式为:、四.氯气的实验室制法1.反应原理(实验室制Cl2的方法)MnO2+ HCl(浓)△离子方程式:在这个反应中:①盐酸作用?2.实验装置:3.除杂装置:(洗气)可先将制得的Cl2通过盛有足量的洗气瓶,除去,再通过(或P2O5或CaCl2),除去。



高中化学学习材料
金戈铁骑整理制作
【精品资源】临川一中新人教版化学必修1满分课堂--氯
我夯基我达标
1.下列关于HClO的说法不正确的是()
A.HClO是弱酸
B.HClO是强酸
C.HClO是强氧化性酸
D.HClO能杀菌消毒
思路解析:次氯酸是弱酸,具有强氧化性,能杀菌消毒。
答案:B
2.下列气体,被当作化学武器首次使用于战争的是()
A.氯气
B.一氧化碳
C.芥子气
D.沙林
思路解析:在第二次世界大战中被当作化学武器首次使用于战争的是氯气。
答案:A
3.欲除去Cl2中的少量HCl气体,可选用()
A.NaOH溶液
B.AgNO3溶液
C.饱和食盐水
D.石灰水
思路解析:氯化氢极易溶于水,而氯气难溶于饱和食盐水,所以可用饱和食盐水来洗气,而A、B、D三项与氯气和氯化氢都能反应,不能用于分离。
答案:C
4.下列气体,既有颜色又有毒性的是()
A.N2
B.CO
C.Cl2
D.CO2
思路解析:四项中有颜色的只有氯气,有毒的气体有CO和氯气。
答案:C
5.下列叙述能证明次氯酸是一种弱酸的是()
A.次氯酸不稳定,易分解
B.次氯酸是一种强氧化剂
C.次氯酸钙能与碳酸作用生成碳酸钙和次氯酸
D.次氯酸能使染料和有机色质褪色
思路解析:根据复分解反应规律,用强酸制弱酸,则碳酸的酸性比次氯酸强,反之,次氯酸的酸性比碳酸还要弱。
答案:C
6.下列说法正确的是()
A.用鼻子对着盛有氯气的瓶口,就可以嗅到氯气的气味
B.用排水集气法便可以收集到纯净的氯气
C.氯气有漂白性
D.自来水常用氯气来杀菌、消毒
思路解析:A项中嗅氯气等有毒气体的方法不对;氯气能溶于水,所以不能用排水法收集;氯气没有漂白性,氯气与水反应生成的次氯酸具有漂白性;自来水常用氯气杀菌、消毒。
答案:D
7.下列物质中,既含有氯分子,又含有氯离子的是( )
A.氯化钠溶液
B.新制氯水
C.漂白粉
D.液氯 思路解析:氯水中含有多种分子和离子,分子有Cl 2、HClO 、H 2O ,离子有H +、Cl -、ClO -及水分子电离出来的少量OH -。
答案:B
8.下列关于液氯和氯水的叙述正确的是( )
A.液氯是纯净物,而氯水是混合物
B.液氯无酸性,氯水有酸性
C.液氯较氯水的漂白作用更强
D.液氯无色,氯水呈黄绿色
思路解析:液氯是液态的氯气,是纯净物,而氯水是含有多种分子和离子(分子有Cl 2、HClO 、H 2O ,离子有H +、Cl -、ClO -及水分子电离出来的少量OH -)的混合物,所以它有酸性、漂白性,呈浅黄色。
答案:AB
9.下列物质能使干燥的有色布条褪色的是( )
A.氯水
B.液氯
C.氯气
D.次氯酸
思路解析:氯分子没有漂白性,只有次氯酸才有漂白性,而氯水中有次氯酸。
由此分析以上四个选项,B 、C 中只有氯气分子,只有A 、D 中含有次氯酸,能使有色布条褪色。
答案:AD
我综合 我发展
10.Cl 2可用来消灭田鼠,使用时可将Cl 2通过管子灌入洞中,这是利用Cl 2下列性质中的( )
A.黄绿色
B.密度比空气大
C.有毒
D.较易液化
思路解析:氯气能通过管子灌入洞中是因为氯气的密度比空气大,而消灭田鼠则是因为氯气具有毒性。
答案:BC
11.将一盛满Cl 2的试管倒立在水槽中,当日光照射相当一段时间后,试管中最后剩余的气体约占试管容积的( ) A.32 B.21 C.31 D.4
1 思路解析:氯气溶于水后发生反应:Cl 2+H 2O====HCl+HClO ,2HClO 光和热2HCl+O 2↑,进行到底后,每一体积氯气可生成0.5体积氧气,即气体体积减少原来的一半。
答案:B
12.有一包白色固体,它可能是KCl 、K 2CO 3、KNO 3中的一种或几种,进行下列实验: ①溶于水,得无色溶液;
②在所得溶液中滴入AgNO 3溶液,生成白色沉淀(说明:Ag 2CO 3为白色沉淀); ③再滴加稀硝酸,沉淀量减少但不完全消失,同时有气泡生成。
根据上述现象判断:
(1)白色固体一定含有的成分是_______________,可能含有的成分是_______________。
(2)请写出上述实验中有关反应的离子方程式______________________________________。
思路解析:由②产生白色沉淀知,可能含有K 2CO 3和KCl 中的一种或两种;由③沉淀量减少且有气泡生成知,一定含有K 2CO 3;又由沉淀不完全消失可知,一定含有KCl 。
答案:(1)KCl 和K 2CO 3 KNO 3
CO====Ag2CO3↓,Ag2CO3+2H+====2Ag++H2O+CO2(2)Ag++Cl-====AgCl↓,2Ag++ 2
3
↑
13.有X、Y、Z三种元素,已知①X、Y、Z的单质在常温下均为气体②X单质可在Z单质中燃烧,生成XZ,火焰为苍白色③XZ极易溶于水,电离出X+和Z-,其水溶液可使蓝色石蕊试纸变红④每2个X2分子可与1个Y2分子化合生成2个X2Y分子,X2Y在常温下为液体⑤Z单质溶于X2Y中,所得溶液具有漂白作用。
(1)推断X、Y、Z三种元素的名称为X. ____________,Y. ____________,Z. ____________。
(2)化合物的化学式XZ________________________,X2Y________________________。
(3)五个过程中涉及的化学反应的方程式为________________________、________________________、________________________。
思路解析:抓住明显特征,入手分析可得答案。
如:“火焰为苍白色”可推知是H2在Cl2中燃烧(或Cl2在H2中燃烧)。
由③可推出X+是H+、Z-是Cl-。
根据④的描述,可认为是H2和O2的反应。
根据⑤可知有HClO生成。
答案:(1)氢氧氯(2)HCl H2O
(3)H2+Cl2点燃2HCl 2H2+O2点燃2H2O Cl2+H2O====HCl+HClO
我创新我超越
14.小实验:滴水生紫烟,紫烟造蓝花
器具:铁架台、铁夹、蒸发皿、滴管
药品:锌粉、碘片、浆糊、蒸馏水
方法:取一只蒸发皿放入2 g锌粉和2 g碎碘片,混合均匀,在蒸发皿的正上方悬挂一朵白纸花,白纸花上涂沫上浆糊。
用胶头滴管加入两滴水于混合粉末上,立刻有紫烟和白雾升起,一齐接触白纸花,白纸花立刻被染成蓝色,蓝色鲜艳、逼真。
说明:由于碘蒸气有毒,为防止吸入,实验最好在通风橱内完成。
联系所学知识发挥你的想象力揭示其中的奥妙。
解答:固态锌粉与碘片在常温下不易反应,加入少量水,起到催化剂的作用,同时反应放出大量的热量,使碘升华呈现紫烟,水汽在空气中冷凝产生白雾。
碘遇到白纸花上浆糊(淀粉)变成了蓝色,于是产生了如上现象。