《无机及分析化学》部分作业答案
- 格式:doc
- 大小:120.00 KB
- 文档页数:5

第一章物质的聚集状态(部分)1-3.用作消毒剂的过氧化氢溶液中过氧化氢的质量分数为0.030,这种水溶液的密度为1.0g⋅mL-1,请计算这种水溶液中过氧化氢的质量摩尔浓度、物质的量浓度和摩尔分数。
解:1L溶液中,m( H2O2) = 1000mL⨯1.0g⋅mL-1⨯0.030 = 30gm( H2O) = 1000mL⨯1.0g⋅mL-1⨯(1-0.030) = 9.7⨯102gn( H2O2) = 30g/34g⋅moL-1=0.88moln( H2O) = 970g/18g.⋅mol-1=54molb( H2O2)= 0.88mol /0.97kg = 0.91mol⋅kg-1c( H2O2)= 0.88mol/1L = 0.88mol⋅L-1x( H2O2) = 0.88/(0.88.+54) = 0.0161-4.计算5.0%的蔗糖(C12H22O11)水溶液与5.0%的葡萄糖(C6H12O6)水溶液的沸点。
解:b(C12H22O11)=5.0g/(342g.⋅mol-1⨯0.095kg)=0.15mol⋅kg-1b(C6H12O6)=5.0g/(180g.⋅mol-1⨯0.095kg)=0.29mol⋅kg-1蔗糖溶液沸点上升∆T b=K b⋅b(C12H22O11)= 0.52K⋅kg⋅mol-1⨯0.15mol⋅kg-1=0.078K蔗糖溶液沸点为:373.15K+0.078K=373.23K葡萄糖溶液沸点上升∆T b=K b⋅b(C6H12O6)= 0.52K⋅kg⋅mol-1⨯0.29mol⋅kg-1=0.15K葡萄糖溶液沸点为:373.15K + 0.15K = 373.30K1-5.比较下列各水溶液的指定性质的高低(或大小)次序。
(l)凝固点: 0.1mol⋅kg-1 C12H22O11溶液,0.1mol⋅kg-1 CH3COOH溶液,0.1mol⋅kg-1 KCl溶液。

无机及分析化学作业及答案第一章 物质的聚集状态(一) 是非题1.液体的沸点就是其蒸发和凝聚的速度相等时的温度。
( × )2.质量相等的甲苯和二甲苯均匀混合时,溶液中甲苯和二甲苯的物质的量分数都为0.5 。
( × )3.电解质的聚沉值越大,其聚沉能力也越大。
( × )4.土壤中的水分能传递到植物体中是因为土壤溶液的渗透压比植物细胞液的渗透压大的缘故。
( × )(二) 选择题1.将0.001mol .L -1NaI 和0.002mol .L -1AgNO 3等体积混合制成溶胶,分别用下列电解质使其聚沉,聚沉能力最大的为 ( A )A. Na 3PO 4B. NaClC. MgSO 4D. Na 2SO 42.下列物质的水溶液,浓度均为0.01mol .L -1,沸点最高的是 ( D )A. C 12H 22O 11B. C 6H 12O 6C. KClD. Mg(NO 3)23.下列物质各10g ,分别溶于1000g 苯中,配成四种溶液,它们的凝固点最低的是 ( A )A.CH 3ClB. CH 2Cl 2C. CHCl 3D.都一样4.下列溶液浓度相同,沸点最高的是 ( D )A. C 6H 12O 6B. H 3BO 3C. KClD. BaCl 25.称取同样质量的两种难挥发的电解质A 和B ,分别溶解在1升水中,测得A 溶液的凝固点比B 溶液的凝固点低,则 (C )A. B 的分子量小于A 的分子量B. A 的分子量和B 的分子量相同C. B 的分子量大于A 的分子量6.0.58%的NaCl 溶液产生的渗透压接近于 ( C )A. 0.58%的C 12H 22O 11溶液B. 0.58%的C 6H 12O 6溶液C. 0.2mol .L -1的C 12H 22O 11溶液D. 0.1mol .L -1的C 6H 12O 6溶液7.溶胶发生电泳时,向某一方向定向移动的是 ( D )A. 胶核B. 吸附层C. 胶团D. 胶粒(三) 填空题1.KCl 溶液滴入过量AgNO 3中制得AgCl 溶胶,胶团结构为___{(AgCl)m .nAg +. (n-x)NO 3-}x+.x NO 3-___,其中胶核是__ (AgCl)m __,胶粒是___{(AgCl)m .nAg +. (n-x)NO 3-}x+__,电位离子是__ Ag +__。

无机及分析化学课后习题答案Document serial number【NL89WT-NY98YT-NC8CB-NNUUT-NUT108】一、选择题1.等压下加热5%的下列水溶液,最先沸腾的是()A. 蔗糖(C12H22O11)溶液 B. 葡萄糖(C6H12O6)溶液C. 丙三醇(C3H8O3)溶液 D. 尿素( (NH2)2CO)溶液解:选A。
在等压下,最先沸腾就是指溶液的蒸气压最低。
根据难挥发非电解质稀溶液的依数性变化规律,溶液质量摩尔浓度增大,溶液的蒸气压下降。
这里,相同质量分数下,溶质的摩尔质量越小,质量摩尔浓度越大。
选项D中非电解质尿素的摩尔质量最小,尿素溶液的质量摩尔浓度最大,蒸气压最低,在等压下最先沸腾。
2.0.1mol·kg-1下列水溶液中凝固点最低的是()A. NaCl溶液B. C12H22O11溶液 C. HAc溶液 D. H2SO4溶液解:选D。
电解质溶液的依数性虽然不能用拉乌尔定律进行统一的定量计算,但仍然可以参照难挥发非电解质稀溶液的依数性进行定性描述。
即溶质的粒子数目增大,会引起溶液的蒸气压降低,沸点升高,凝固点下降和溶液的渗透压增大。
此题中,在相同质量摩尔浓度下,溶液中的粒子数目估算出来是H2SO4溶液最多,所以其凝固点最低。
3.胶体溶液中,决定溶胶电性的物质是()A. 胶团B. 电位离子C. 反离子D. 胶粒解:选D。
根据胶团结构,胶核和吸附层的整体称为胶粒,胶粒中反离子数比电位离子数少,故胶粒所带电荷与电位离子符号相同。
即胶粒带电,溶胶电性由胶粒决定。
4.溶胶具有聚结不稳定性,但经纯化后的Fe(OH)3溶胶可以存放数年而不聚沉,其原因是()A. 胶体的布朗运动B. 胶体的丁铎尔效应C. 胶团有溶剂化膜D. 胶粒带电和胶团有溶剂化膜解:选D。
溶胶具有动力学稳定性和聚结稳定性,而聚结稳定性是溶胶稳定的根本原因,它包含两个方面,胶粒带有相同电性的电荷,当靠近时会产生静电排斥,阻止胶粒聚结合并;而电位离子和反离子形成的溶剂化膜,也会阻隔胶粒的聚结合并。

第二章 习题解答2-10解:(1)×;(2)×;(3)√;(4)×;(5)×;(6)×;(7)×;(8)×;(9);(10)×;(11)×2-11解:(1)敞开体系;(2)孤立体系;(3)敞开体系;2-12解:(1) Q =100kJ W=-500 kJ △U = Q + W=-400 kJ(2)Q =-100kJ W=500 kJ △U = Q + W=400 k2-13解:因为此过程为可逆相变过程,所以Q p =△H= 40.6kJ ·mol -1W=-p 外△V ≈-n R T =-8.314×373.15=-3.10 kJ ·mol -1 △U = Q + W= 40.6+(-3.10)=37.5 kJ ·mol -12-14解:(1)r m B f m Bf m 2f m f m f m 231B)3CO g Fe,s 3CO,g Fe O ,s 3393.51203(110.52)(822.2)26.77kJ mol H H H H H H -∆=ν∆=∆∆-∆+∆=⨯-⨯-⨯---=-⋅∑((,)+2()()()()+ΘΘΘΘΘΘ(2)r m B f m Bf m 2f m 2f m f m 21B)CO g H ,g CO,g H O,g 393.510(110.52)(241.82)41.17kJ mol H H H H H H -∆=ν∆=∆∆-∆+∆=-----=-⋅∑((,)+()()()()+ΘΘΘΘΘΘ(3)r m B f m Bf m 2f m f m 2f m 31B)6H O l NO,g 5O ,g 4NH ,g 6285.834(90.25)504(46.11)1169.54kJ mol H H H H H H -∆=ν∆=∆∆-∆+∆=⨯-⨯-⨯-⨯-=-⋅∑((,)+4()()()()+ΘΘΘΘΘΘ2-15解:乙醇的Θm f H ∆反应r m H ∆Θ为:(4) 2C (s ,石墨)+3H 2(g )+1/2O 2(g )= C 2H 5OH (l ),所以:反应(4)=反应(2)×2+反应(3)×3-反应(1)r m r m r m r m -1(4)2(2)3(3)(1)2(393.5)3(571.6)(1366.7)1135.1kJ mol H H H H ∆=∆+∆-∆=⨯-+⨯---=-⋅ΘΘΘΘ对反应2C (s ,石墨)+ 2H 2(g )+ H 2O (l )= C 2H 5OH (l )r m f m f m 2f m 2f m 1()(H O,l)2(H ,g)2(C,s)1135.1(285.83)2020849.27kJ mol H H H H H -∆=∆-∆-∆-∆=----⨯-⨯=-⋅乙醇ΘΘΘΘΘ虽然,该反应的r m H ∆Θ<0(能量下降有利),但不能由r m H ∆Θ单一确定反应的方向,实际反应中还须考虑其他因素,如:混乱度、反应速率等。

第一章物质的聚集状态(部分)1-3.用作消毒剂的过氧化氢溶液中过氧化氢的质量分数为0.030,这种水溶液的密度为1.0g⋅mL-1,请计算这种水溶液中过氧化氢的质量摩尔浓度、物质的量浓度和摩尔分数。
解:1L溶液中,m( H2O2) = 1000mL⨯1.0g⋅mL-1⨯0.030 = 30gm( H2O) = 1000mL⨯1.0g⋅mL-1⨯(1-0.030) = 9.7⨯102gn( H2O2) = 30g/34g⋅moL-1=0.88moln( H2O) = 970g/18g.⋅mol-1=54molb( H2O2)= 0.88mol /0.97kg = 0.91mol⋅kg-1c( H2O2)= 0.88mol/1L = 0.88mol⋅L-1x( H2O2) = 0.88/(0.88.+54) = 0.0161-4.计算5.0%的蔗糖(C12H22O11)水溶液与5.0%的葡萄糖(C6H12O6)水溶液的沸点。
解:b(C12H22O11)=5.0g/(342g.⋅mol-1⨯0.095kg)=0.15mol⋅kg-1b(C6H12O6)=5.0g/(180g.⋅mol-1⨯0.095kg)=0.29mol⋅kg-1蔗糖溶液沸点上升∆T b=K b⋅b(C12H22O11)= 0.52K⋅kg⋅mol-1⨯0.15mol⋅kg-1=0.078K蔗糖溶液沸点为:373.15K+0.078K=373.23K葡萄糖溶液沸点上升∆T b=K b⋅b(C6H12O6)= 0.52K⋅kg⋅mol-1⨯0.29mol⋅kg-1=0.15K葡萄糖溶液沸点为:373.15K + 0.15K = 373.30K1-5.比较下列各水溶液的指定性质的高低(或大小)次序。
(l)凝固点: 0.1mol⋅kg-1 C12H22O11溶液,0.1mol⋅kg-1 CH3COOH溶液,0.1mol⋅kg-1 KCl溶液。

无机及分析化学练习册答案无机及分析化学是一门研究无机物质的化学性质、结构、反应及其分析方法的学科。
以下是一份无机及分析化学练习册的答案,供参考:练习一:配位化合物的命名1. 给定化合物[Co(NH3)5Cl]Cl2,其名称是五氨氯化钴(II)氯化物。
2. 化合物[Fe(CN)6]3-的名称是六氰合铁(III)酸根离子。
3. 化合物[Cu(en)2(H2O)2]SO4的名称是乙二胺二水合铜(II)硫酸盐。
练习二:酸碱滴定1. 已知某酸的浓度为0.1M,若用0.05M的NaOH溶液滴定,滴定终点时消耗NaOH溶液的体积为20mL,则该酸的浓度为0.1M。
2. 假设滴定某碱溶液,使用0.1M的HCl溶液,滴定终点时消耗HCl溶液的体积为25mL,若碱溶液的体积为50mL,则碱的浓度为0.05M。
练习三:氧化还原反应1. 给定反应式Zn + CuSO4 → ZnSO4 + Cu,Zn的氧化态从0变为+2,Cu的氧化态从+2变为0。
2. 反应式2H2 + O2 → 2H2O中,H的氧化态从0变为+1,O的氧化态从0变为-2。
练习四:沉淀反应1. 已知Ba2+和SO42-反应生成BaSO4沉淀,若溶液中Ba2+的浓度为0.01M,SO42-的浓度为0.005M,则生成的BaSO4沉淀的量为0.005摩尔。
2. 如果溶液中Ag+的浓度为0.02M,Cl-的浓度为0.01M,则生成的AgCl沉淀的量为0.01摩尔。
练习五:配位化学1. 配位体是含有孤对电子的分子或离子,能够与中心金属离子形成配位键。
2. 配位数是指一个中心金属离子周围配位体的数量,例如在[Fe(CN)6]3-中,Fe3+的配位数是6。
结束语:以上是无机及分析化学练习册的部分答案,希望能够帮助同学们更好地理解和掌握无机化学的基本概念和计算方法。
在实际学习过程中,还应结合具体题目和实验操作,深入理解无机化学的原理和应用。


无机及分析化学习题及答案精选xxx科技大学第十四章分析化学基础1.对某组分的含量进行测定时,若被分析样品的质量大于100mg,则该分析方法属于( )A. 常量分析B. 半微量分析C. 微量分析D. 超微量分析2.对某溶液中的铝进行测定时,若取分析试液25ml进行分析测定,则该分析方法属于( )A. 常量分析B. 半微量分析C. 微量分析D. 超微量分析3.由精密度好就可断定分析结果可靠的前提是( )A. 偶然误差小B. 系统误差小C. 标准偏差小D. 相对偏差小4.下列各种分析纯的化学试剂,其中不能用直接配制法配制标准溶液的是A. KHCO3B. KMnO4C. K2CrO7D. KCl5.下列各种措施中,可以减小偶然误差的是( )A. 进行空白试验B. 进行对照试验C. 进行仪器校准D. 增加平行测定次数6.下述情况引起的误差中,不属于系统误差的是( )A. 移液管转移溶液之后残留时稍有不同B. 称量时使用的砝码锈蚀C. 滴定管刻度未经校正D. 天平的两臂不等长7.下列叙述中错误的是()A.系统误差呈正态分布 B. 系统误差又称可测误差C. 方法误差属于系统误差D. 系统误差具有单向性8. 分析测定中出现下列情况,何者属于系统误差( )A. 滴定时有溶液溅出B. 试样未经充分混匀C. 滴定管未经校正D. 读错法码9. 下列计算式的计算结果(X)应有几位有效数字?( )X= [0.3120⨯48.12⨯(21.65-16.10)]÷(1.2845⨯1000)A. 二位B. 三位C. 四位D. 五位第 1 页10. 欲测某组分含量,由四人分别进行测定,试样称取量皆为2.2g,问下列结果中哪一个是合理的?( )A. 2.085%B. 2.08%C. 2.09%D. 2.1%11. 称取一定质量的邻苯二甲酸氢钾基准物质以标定NaOH溶液的浓度,下列何者将引起正误差( )A. 称取基准物重量时用的一只10mg法码,事后发现其较正后的值为9 .7mgB.滴定时滴定终点在等量点后到达。

1.根据下列酸碱的解离常数,选取适当的酸度是共轭碱来配置PH=4.50和PH=10.00的缓冲溶液,其共轭酸,碱的浓度比应是多少?HAC,NH3·H2O,H2C2O4 ,NaHCO3 ,H3PO4,NaAC,NaHPO4,C6H5NH2,NH4cl解:选择HAC和NaAC来配置PH=4.50的缓冲液,共轭酸碱的浓度比可由以下来计算检表得:K aΘ(HAC)=1.8×10-5 Kbθ(AC-)=Kw/ K aΘ=10-14/(1.85×10-5)=5.6×10-10由PH=14-Pk bθ+lg((C(AC-))/(C(HAC)))可得4.50=14-lg(5.6×10-10)+lg((C(AC-))/(C(HAC))) 解得:(C(AC-))/(C(HAC))=4/7=1.74选择NH3·H2O和NH4cl来配制PH=10.00的缓冲液,共轭酸碱的浓度比如下K bθ(NH3·H2O)=1.8×10-5PH=14- Kbθ(NH3·H2O)+lg(C(NH3·H2O)/C(NH4cl))10=14-lg(1.8×10-5)+ lg(C(NH3·H2O)/C(NH4cl))解得:C(NH3·H2O)/C(NH4cl)=5:12.欲配制250mlPH=5.00的缓冲液,问在125ml,1.0mol·L-1NaAC溶液中应加入多少毫升6.0 mol·L-1溶液?解:由题意得可设还应加入xml,6.0 mol·L-1的HAC溶液检表得KaΘ(HAC)=1.8×10-5PH=Pk aθ(HAC)+lg((C(AC-))/(C(HAC)))5=-lg(1.8×10-5)+ lg((C(AC-))/(C(HAC)))解得:(C(AC-))/(C(HAC))=1.82n(AC-)=0.125×1mol·L-1=0.125mol;n(HAC)=6x×10-3mol0.125/(0.125+x×10-3)/(6x×10-3/(0.125+x×10-3))=0.125/(6x×10-3)解得:x=11.6ml3.计算下列各溶液的PH:(3)20.0ml 0.10 mol·L-1NaOH和20.0ml 0.20 mol·L-1 NH4cl溶液混合解:由题意的检表可得Kb(NH3)θ= 1.8×10-5 ; K aθ(NH4+)=Kw/ Kb(NH3)θ=10-14/(1.8×10-5 )=5.56×10-10n(OH-)=0.002mol n(NH4+)=0.004molC(NH3·H2O)=0.002/(0.02+0.02)=0.05 mol·L-1 C(NH4+)=0.02/(0.02+0.02)=0.05 mol·L-1 PH=Pk aθ(NH4+)+lg(C(NH3·H2O)/C(NH4cl))=-lg(5.56×10-10)+0=9.26(5)20.0ml 0.10 mol·L-1Hcl和20.0ml0.20 mo l·L-1NaAC溶液混合混合前:n(H+)=0.002mol n(AC-)=0.0004mo l混合后:C(HAC)=0.002/(0.02+0.02)mol·L-1=0.05 mol·L-1C(AC-)=0.002/(0.02+0.02)mol·L-1=0.05 mol·L-1PH=Pkaθ(HAC)+lg((C(AC-))/(C(HAC)))检表得:Pk a θ(HAC)=1.8×10-5=-lg(1.8×10-5)+lg(0.05/0.05)=4.74(9)300.0ml 0.5mol·L-1 H3PO4与400.0ml1.00 mol·L-1NaOH的混合液n(H3PO4)=0.3×0.5=0.15mol C(OH-)=0.4×1mol=0.4molK aθ(HPO42-)=4.5×10-13混合后:n(Na3PO4)=0.1moln(Na2HPO4)=0.05mol则:n(Na3PO4)/ n(Na2HPO4)=2PH= K aθ(HPO42-)+lg2=-lg(4.5×10-13)+lg2=12.651.今有2.00L的0.5001.00 mol·L-1NH3(aq)和2.0L的0.500mol·L-1Hcl溶液,若配制PH=9.00的缓冲溶液,不允许再加水,最多能配制多少升缓冲溶液,其中C(NH3),C(NH4+)各为多少?解:由表可知: Kb(NH3)θ= 1.8×10-5则PH=14- K bθ(NH3·H2O)+ lg(C(NH3·H2O)/C(NH4cl))=9即:PH=14-4.74+ lg(C(NH3·H2O)/C(NH4cl))=9得lg(C(NH3·H2O)/C(NH4cl))=-0.26解得C(NH3·H2O)/C(NH4cl)=0.55设 xL NH3·H2O yL HCl则有 C(NH3·H2O )=n(NH3·H2O )/V总=0.5(x-y)/(x+y) mol·L-1C(NH4+)=n(Hcl)/ V总=0.5y/(x+y)mol·L-1即C(NH3·H2O)/ C(NH4+)=0.55解得x/y=1.55若要溶液最多,只需令x=2.00L,则y=1.3L此时 C(NH3·H2O )=0.5(x-y)/(x+y) mol·L-1=0.11 mol·L-1C(NH4+)=n(Hcl)/ V总=0.5y/(x+y) mol·L-1 =0.2 mol·L-12.列表指出下列配合物的形成体、配体、配位原子和形成体的配位数;确定配离子和形成体的配位数;确定配离子和形成体的电荷数,并给出他们的命名。

第1章思考题与习题参考答案一、选择题1.等压下加热5%的下列水溶液,最先沸腾的是()A. 蔗糖(C12H22O11)溶液B. 葡萄糖(C6H12O6)溶液C. 丙三醇(C 3H8O3)溶液D. 尿素((NH2)2 CO)溶液解:选D。
在等压下,最先沸腾就是指溶液的蒸气压最低。
根据难挥发非电解质稀溶液的依数性变化规律,溶液质量摩尔浓度增大,溶液的蒸气压下降。
这里,相同质量分数下,溶质的摩尔质量越小,质量摩尔浓度越大。
选项D中非电解质尿素的摩尔质量最小,尿素溶液的质量摩尔浓度最大,蒸气压最低,在等压下最先沸腾。
2.0.1mol·kg-1下列水溶液中凝固点最低的是()A. NaCl溶液B. C12H22O11溶液C. HAc溶液D. H2SO4溶液解:选D。
电解质溶液的依数性虽然不能用拉乌尔定律进行统一的定量计算,但仍然可以参照难挥发非电解质稀溶液的依数性进行定性描述。
即溶质的粒子数目增大,会引起溶液的蒸气压降低,沸点升高,凝固点下降和溶液的渗透压增大。
此题中,在相同质量摩尔浓度下,溶液中的粒子数目估算出来是H2SO4溶液最多,所以其凝固点最低。
3.胶体溶液中,决定溶胶电性的物质是()A. 胶团B. 电位离子C. 反离子D. 胶粒解:选D。
根据胶团结构,胶核和吸附层的整体称为胶粒,胶粒中反离子数比电位离子数少,故胶粒所带电荷与电位离子符号相同。
即胶粒带电,溶胶电性由胶粒决定。
4.溶胶具有聚结不稳定性,但经纯化后的Fe(OH)3溶胶可以存放数年而不聚沉,其原因是()A. 胶体的布朗运动B. 胶体的丁铎尔效应C. 胶团有溶剂化膜D. 胶粒带电和胶团有溶剂化膜解:选D。
溶胶具有动力学稳定性和聚结稳定性,而聚结稳定性是溶胶稳定的根本原因,它包含两个方面,胶粒带有相同电性的电荷,当靠近时会产生静电排斥,阻止胶粒聚结合并;而电位离子和反离子形成的溶剂化膜,也会阻隔胶粒的聚结合并。
由于纯化的Fe(OH)3溶胶具有这种聚结稳定性,从而可以存放数年而不聚沉。
《无机及分析化学》习题答案一、单选题(小四号宋体)1.下列四个量子数正确的组合正确的是( B )A: n=3, l=-3, m=0, ms=0; B: n=4, l=3, m=-1, ms=+1/2;C: n=2, l=0, m=-1, ms=-1/2; D: n=3, l=2, m=2, ms=+1/2;2.对钠,铝,磷,氯四种元素,随原子序数增加元素性质变化叙述正确的有( B )A: 第一电离能依次增加;B: 最高氧化值依次增大;C: 原子半径依次增大;D: 电负性依次增大;3.下列粒子的空间构型正确的有( C )A: SF4(平面四边形)B: [Fe(CN)6]3-(正八面体形)C: Ag(NH3)2+(角形)D: ClO4-(正四面体)4.下列分子中偶极矩不为零的是( B )A. CCl4B. NH3C. SF6D. BeCl25.选出核外电子排布正确的粒子( D )A: (Cu1+(Z=29)) [Ar]3d10;B: (Fe3+(Z=26)) [Ar]3d5;C: (Ba(Z=56)) 1s22s22p63s23p64s23d104p65s24d105p66s2;D: (Zr(Z=40)) [Ar]4d25s2;6.在具有下列价层电子组态的基态原子中,金属性最强的是( A )A. 4s1B. 3s23p5C. 4s24p4D. 2s22p17.邻苯二甲酸分子间存在的分子间力有( C )1.:色散力B:取向力C:诱导力D:氢键8.下列哪一组n、l、m量子数错误的是( B )1.. 3,2,-2 B. 3,0,1 C. 3,3,1 D. 5,4,-49.基态13Al原子最外层电子的四个量子数应是( A )A. 3,1,+1,12+ B. 4,1,0,12+C. 3,2,1,12+ D. 3,2,2,12+10.下列判断中正确的是( A )A CO2为非极性分子,而SO2为极性分子B.[Ag(NH3)2]+配离子中的中心离子Ag+采取的是SP2杂化方式C HI分子比HBr分子的共价成分多一些D O2+不具有顺磁性11.下列四个量子数组合正确的是( C )A. n=3, l=-3, m=0, ms=0B. n=4, l=3, m=-1, ms=+1/2C. n=2, l=0, m=-1, ms=-1/2D. n=3, l=2, m=2, ms=+1/212. 下列说法中错误的是 ( D )A. 只要n,l 相同,径向波函数R(r)就相同B. 波函数的角度分布图形与主量子数无关C. 只要l,m 相同,角度波函数Y(θ,φ)就相同D. s 轨道的角度分布波函数Ys(θ,φ)也与角度θ,φ有关13. 在电子云示意图中的小黑点 ( D )A. 表示电子B. 表示电子在该处出现C 其疏密表示电子出现的几率大小D 其疏密表示电子出现的几率密度大小14. 下列哪一组数值是原子序数19的元素的价电子的四个量子数(依次为n,l,m ,ms ) D) A. 1,0,0,+1/2 B. 2,1,0,+1/2C. 3,2,1,+1/2D. 4,0,0,+1/215. 原子核外电子排布主要应遵循 ( A )A. 统计规律B. 能量最低原理C. 泡利不相容原理D. 洪特规则16. 若将氮原子的电子排布式写成1s 22s 22px 22py 1,它违背 ( D) A.能量守恒原理 B.泡利不相容原理C.能量最低原理D.洪特规则17. 在l=3的亚层中,最多能容纳的电子数是 ( B )A. 2B. 6C. 10D. 1418. 某元素原子的外层电子构型为3d54s2,它的原子中未成对电子数为 ( A )A. 0B. 1C. 3D. 519. 原子序数为33的元素,其原子在n=4,l=1,m=0的轨道中的电子数为 ( D) A. 1 B. 2 C. 3 D. 4 E. 520. 下列函数均为状态函数的是 ( C )A. H ,G ,UB. U ,S ,QC. G ,W ,UD. G ,S ,W21. 下列反应中,r m H θ∆与产物的f m H θ∆相同的是 ( D )A. 2()2()2()22g g g H O H O +→B. 2()2()()12g g g NO O NO +→C. C C →))(金刚石(石墨D. 2()2()2()12g g g H O H O +→22. 下列结论正确的是 ( B )A. 当△H>0,△S<0时,反应自发进行B. 当△H<0,△S>0时,反应自发进行C.当△H<0,△S<0时,任何温度下均不自发进行D.当△H>0,△S>0时,任何温度下均不自发进行23.标定KMnO4溶液浓度时,应使用的基准物质是( D )A. K2Cr2O7B. Na2CO3C. Na2S2O3D. Na2C2O424.下列物质中,常用作基准物质来标定NaOH溶液浓度的是( B )A. H2CO3B. 邻苯二甲酸氢钾C. 苯酚D. H2C2O4 ·2H2O25.下列分子或离子中,键角最小的是( B )A. HgCl2B. H2OC. NH3D. PH326.下列说法正确的是( C )A.凡中心原子采取sp3杂化轨道成键的分子其几何构型都是正四面体;B.CH4分子中的sp3杂化轨道是由4个H原子的1s轨道和C原子的2p轨道混合起来而形成的;C.sp3杂化轨道是由同一原子中能量相近的s轨道和p轨道混合起来形成的一组能量相等的新轨道;D.凡AB3型的共价化合物,其中心原子A均采用sp3杂化轨道成键。
无机及分析化学考试题及参考答案一、选择题1. 下列哪个元素具有最高的电负性?a) 碳b) 氮c) 氧d) 硫2. 氯化钠是由正离子和负离子组成的化合物,其晶体结构属于下列哪种类型?a) 离子晶体b) 共价晶体c) 金属晶体d) 非晶体3. 下列哪种化合物在水中能够电离产生氢氧根离子(OH-)?a) 硝酸铵b) 硫酸铵c) 氯化钠d) 氢氧化铵4. 下列哪个元素具有最大的原子半径?a) 锂b) 钠c) 铷d) 钾5. 气体状态下的金属铝具有什么形式的结构?a) 单原子结构b) 双原子结构c) 多原子结构d) 多面体结构二、填空题1. 银的原子序数为47,电子结构为2,8,18,19,1。
请写出银的化学符号。
2. 铜的相对原子质量为63.55,其一个原子的质量为____________。
3. 锌离子的化学式为Zn2+,请写出其原子核中的质子数和中子数。
4. 硝酸是一种强酸,其化学式为____________。
5. 溴氯乙烷(C2H4BrCl)的结构式中,碳原子与溴原子之间的连线应_________。
1. 请解释下列术语的含义并举例说明:a) 酸性溶液b) 碱性溶液c) 中性溶液2. 简要描述下列实验的操作步骤以及结果:添加氯化银溶液于盐酸溶液中观察现象。
3. 请说明以下气体之间的关系:氧气(O2),一氧化氮(NO),二氧化氮(NO2),三氧化二氮(N2O3)。
四、计算题1. NaCl 在水中的溶解度为36g/100mL。
如果加入45g NaCl 到200mL 的水中,请计算是否形成饱和溶液。
2. 从化合物的摩尔质量(g/mol)计算化合物的质量百分比:C2H5OH (乙醇)3. 一段高炉内,熔化的铁经过冷却形成固态铁。
在这个过程中,铁发生了化学变化还是物理变化?请说明原因。
参考答案:1. c) 氧2. a) 离子晶体3. d) 氢氧化铵4. d) 钾5. b) 双原子结构二、填空题1. Ag2. 63.553. 质子数为30,中子数为354. HNO35. 直线三、简答题1.a) 酸性溶液:指溶液中氢离子(H+)浓度较高的溶液。
第六章 酸碱平衡和酸碱滴定法习题1.是非判断题1-1在水溶液中解离度大的物质,其溶解度也大。
1-2由于乙酸的解离平衡常数)()()(HAc c Ac c H c K a -+=θ,所以只要改变乙酸的起始浓度即c(HAc),a K θ必随之改变。
1-3在浓度均为0.01 mol ·L -1的HCl ,H 2SO 4,NaOH 和NH 4Ac 四种水溶液中,H + 和OH -离子浓度的乘积均相等。
1-4弱碱溶液越稀,其解离度越大,因而酸度也越大。
1-5将10mL 0.1 mol ·L -1NH 3·H 2O 溶液稀释至100mL ,则NH 3·H 2O 的解离度增大,OH -离子浓度也增大。
1-6在一定温度时,稀释溶液,解离常数不变而解离度增大。
1-7将氨水的浓度稀释一倍,溶液中OH - 离子浓度就减小到原来的一半。
1-8弱酸浓度越小,解离度越大,因此溶液中H + 离子浓度也就增大。
1-9根据稀释定律,弱碱溶液越稀,其解离度就越大,故溶液中(OH -)越大,溶液pH 值越大。
1-10 NaHCO 3中含有氢,故其水溶液呈酸性。
1-11 pH 值小于7的溶液一定是酸。
1-12水的离子积在18℃时为6.4×10-15,25℃时为1.00×10-14,即在18℃时水的pH 值大于25℃时的pH 值。
1-13浓度为1.0×10-7 mol ·L -1的盐酸溶液的pH 值=7.0。
1-14稀释10mL 0.1 mol ·L -1HAc 溶液至100mL ,则HAc 的解离度增大,平衡向HAc 解离方向移动,H +离子浓度增大。
1-15两种酸溶液HX 和HY ,其pH 值相同,则这两种酸溶液浓度也相同。
1-16在0.1 mol ·L -1 H 2C 2O 4溶液中,c(H +)=2c(C 2O 42-)。
1-17凡是多元弱酸,其酸根的浓度近似等于其最后一级的解离常数。
无机及分析化学习题解答严新徐茂蓉葛成艳编第一章绪论1.1判断下列误差属于何种误差?①在分析过程中,读取滴定管读数时,最后一位数字n次读数不一致,对分析结果引起的误差。
②标定HCl溶液用的NaOH标准溶液中吸收了CO2 ,对分析结果所引起的误差。
③移液管、容量瓶相对体积未校准,由此对分析结果引起的误差.④在称量试样时,吸收了少量水分,对结果引起的误差。
答: ①偶然误差;②系统误差中的试剂误差;③系统误差中的仪器误差;④过失误差1.2测得Cu百分含量为41。
64%、41.66%、41。
58%、41。
60%、41.62%、41。
63%,计算测定结果的平均值、平均偏差、相对平均偏差。
(无须舍去数据)解:41.64%41.66%41.58%41.60%41.62%41.63%41.62%6x+++++==1id x xn=-∑=2.2×10—4 100%rddx=⨯=0.053%1.3测定某样品中铁的百分含量,结果如下:30。
12%、30。
05%、30。
07%、30.05%、30。
06%、30.03%、30。
02%、30.03%根据Q检验法,置信度为90%时是否有可疑数要舍去,计算分析结果的平均值、标准偏差、变异系数和对应的置信区间。
解:排序:30。
02%、30.03%、30。
03%、30。
05%、30.05%、30。
06%、30。
07%、30。
12%先检验最大值30。
12%:30.12%30.07%0.530.12%30.02%Q-==-Q0.9=0.47 < 0.5,所以舍去30.12%继续检验最大值30。
07%,30.07%30.06%0.230.07%30.02%Q-==-,Q0.9=0.51〉0.2,不应舍去,30。
07%应该保留.检验最小值30.02%,30.03%30.02%0.230.07%30.02%Q -==-Q 0.9=0。
51>0。
2,不应舍去,30.02%应该保留.30.02%30.03%30.03%30.05%30.05%30.06%30.07%30.04%7X +==+++++、S =1.8×10—4100%sCV x=⨯=6×10-4()430.04%30.040.01%μ-==±1.4下列数据分别有几位有效数字? ①18。
无机及分析化学课后习题答案Document serial number【NL89WT-NY98YT-NC8CB-NNUUT-NUT108】一、选择题1.等压下加热5%的下列水溶液,最先沸腾的是()A. 蔗糖(C12H22O11)溶液 B. 葡萄糖(C6H12O6)溶液C. 丙三醇(C3H8O3)溶液 D. 尿素( (NH2)2CO)溶液解:选A。
在等压下,最先沸腾就是指溶液的蒸气压最低。
根据难挥发非电解质稀溶液的依数性变化规律,溶液质量摩尔浓度增大,溶液的蒸气压下降。
这里,相同质量分数下,溶质的摩尔质量越小,质量摩尔浓度越大。
选项D中非电解质尿素的摩尔质量最小,尿素溶液的质量摩尔浓度最大,蒸气压最低,在等压下最先沸腾。
2.0.1mol·kg-1下列水溶液中凝固点最低的是()A. NaCl溶液B. C12H22O11溶液 C. HAc溶液 D. H2SO4溶液解:选D。
电解质溶液的依数性虽然不能用拉乌尔定律进行统一的定量计算,但仍然可以参照难挥发非电解质稀溶液的依数性进行定性描述。
即溶质的粒子数目增大,会引起溶液的蒸气压降低,沸点升高,凝固点下降和溶液的渗透压增大。
此题中,在相同质量摩尔浓度下,溶液中的粒子数目估算出来是H2SO4溶液最多,所以其凝固点最低。
3.胶体溶液中,决定溶胶电性的物质是()A. 胶团B. 电位离子C. 反离子D. 胶粒解:选D。
根据胶团结构,胶核和吸附层的整体称为胶粒,胶粒中反离子数比电位离子数少,故胶粒所带电荷与电位离子符号相同。
即胶粒带电,溶胶电性由胶粒决定。
4.溶胶具有聚结不稳定性,但经纯化后的Fe(OH)3溶胶可以存放数年而不聚沉,其原因是()A. 胶体的布朗运动B. 胶体的丁铎尔效应C. 胶团有溶剂化膜D. 胶粒带电和胶团有溶剂化膜解:选D。
溶胶具有动力学稳定性和聚结稳定性,而聚结稳定性是溶胶稳定的根本原因,它包含两个方面,胶粒带有相同电性的电荷,当靠近时会产生静电排斥,阻止胶粒聚结合并;而电位离子和反离子形成的溶剂化膜,也会阻隔胶粒的聚结合并。
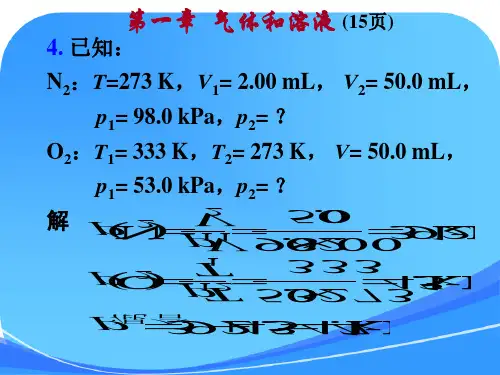
第一章 物质的聚集状态一.选择题( D ) 1、今有0.4000mol ·L -1HCl 溶液1L ,欲将其配制成浓度为0.6000mol ·L -1溶液,需加入1.0000mol ·L -1HCl 多少毫升?A 、200.00mlB 、300.00mlC 、400.00mlD 、500.00ml( B ) 2、5.0 g 某聚合物溶于400 cm 3水中,20℃时的渗透压为100 Pa ,则该聚合物的分子量为A. 4.0 × 106B. 3.0 × 105C. 2.1 × 104D. 3.0 × 102( D ) 3、理想气体状态方程用于真实气体的条件是A. 低温、高压B. 高温、高压C. 低温、低压D. 高温、低压( D ) 4、下列稀溶液,渗透压最小的是A. 0.02 mol ⋅L -1NaCl ;B. 0.02mol ⋅L -1CaCl 2;C . 0.02 mol ⋅L -1HAc ;D. 0.02 mol ⋅L -1葡萄糖。
二.填空题:1、渗透现象所必备的条件是(1) ;(2) 。
半透膜,膜两边存在浓度差2、临床实践中,对患者输液的原则为 ,如常用的生理盐水浓度为 。
等渗溶液、0.9%(W/V) 或0.154 mol/L三.是非判断题(对的打“√ ”错的打“×”)( × )1、盐碱地中的植物不容易存活,甚至枯萎,这主要是土壤溶液的渗透压太小所引起的。
( × )2、可以将低温低压下的真实气体,看成理想气体来处理。
( × )3、在一定的温度下,将相同质量的葡萄糖和蔗糖溶于相同体积的水中,则两溶液的沸点升高和凝固点下降值相同。
四.简答题1、农田施化肥时,化肥的浓度不能过高。
答:化肥浓度过高时,就会造成土壤溶液的浓度大于作物根毛细胞液的浓度.根据渗透压原理,使根毛细胞液中的水分渗透到土壤溶液中去,这样根毛细胞不但吸收不到水分,反而还要失去水分,从而使植物萎蔫,即俗话说的“烧苗”。
《无机及分析化学》作业答案第一章(P25)1—8 (1)26.44% (2) 6.14mol·Kg -1; (3) 5.42 mol·L -1; (4) x(NaCl)=0.0995, x(H 2O)=0.9005 1—9 ⊿t b =K b ·b B 相同则b B 相等,1.5g/(60g·mol -1×200g)=42.8g/(M x ×1000g)M x =342 g·mol -11—11 ⊿t f =K f ·b B =1.86℃·kg·mol -1×19g/(M x ×100×10-3Kg) M x =1606 g·mol -1 1—13 П=c B RT≈b B RT R=8.314kPa·L·mol -1·K -1 ≈8.314kPa·kg·mol -1·K -1(ρ≈1.0 kg·L -1稀溶液) ⊿t f ==0.56℃=K f ·b B =1.86℃·kg·mol -1×b BП=8.314kPa·kg ·mol -1·K -1×309.65K×0.56℃/1.86℃·kg·mol -1=775.09 kPa 1—14 过量AgNO 3过量 胶团结构式:[(AgI)m ·n Ag +·(n-x) NO 3-]x+·xNO 3- 正溶胶,负极移动 1—15 三硫化二砷溶胶胶团结构式:[ (As 2S 3) m ·nHS -·(n-x) H +]x-·x H +, 负溶胶, 聚沉能力:NaCl ﹤Mg Cl 2﹤AlCl 3,第二章(P57)2—17 ∆r H m θ=3∆f H m θ(N 2,g)+4∆f H m θ(H 2O,g)- ∆f H m θ(N 2O 4,g)- 2∆f H m θ(N 2H 4,l)=3×0+ 4×(-241.84kJ·mol -1)-(9.661kJ·mol -1)- 2×(50.63kJ·mol -1)= -1078.28 kJ·mol -11078.28×103 J=mgh=100kg×9.8×h h=1100m2—18 ∆r G m θ=∆f G m θ(C 6H 12O 6,s)+6∆f G m θ(O 2,g)- 6∆f G m θ(H 2O,l)- 6∆f G m θ(CO 2,g)=(-910.5kJ·mol -1)+6×0 -6×(-237.14kJ·mol -1)- 6×(-394.38kJ·mol -1)= 2878.62 kJ·mol -1 >0 即298K 及标态下不能自发进行第三章(P89)3—13题 解: 2SO 2(g) + O 2(g) 2SO 3(g)起始分压P 0(kPa) 0.4RT 1.0RT 0平衡分压P(kPa) 0.08RT 0.84RT 0.32 K θ={[p(SO 3)/p θ]2/{[p(SO 2)/p θ] 2[p(O 2)/p θ]}=0.286,其中p θ=100kPa ,Kc θ=19.053—14题 解: PCl 5(g) PCl 3(g) + Cl 2(g)起始分压P 0(kPa) 0.35RT 0 0平衡分压P(kPa) 0.10RT 0.25RT 0.25RT K θ={[p(PCl 3)/p θ][p(Cl 2)/p θ]/[p(PCl 5)/p θ]=27.18, 其中p θ=100kPa ,Kc θ=0.6253—15题 解:(1)理论计算∆r H m θ(T)≈∆r H m θ(298.15K)= ∑ ∆f H m θ(B,298.15K)=172.43 kJ ·mol -1,∆r S m θ(T)≈∆r S m θ(298.15K)= ∑ S m θ(B,298.15K)=182.23 J ·mol -1·K -1,∆r G m θ(298.15K )=∑ ∆f G m θ(B,298.15K)=119.78 kJ ·mol -1,∆r G m θ(1773K)=∆r H m θ(298.15K)-1773×∆r S m θ(298.15K)=-150.66 kJ ·mol -1,∆r G m θ(298.15K)与∆r G m θ(1773K)完全不同(2)实验值计算 lg(K 2θ/K 1θ)= ∆r H m θ/2.303R ×[(T 2-T 1)/ T 2 T 1]——范特霍夫公式 得∆r H m θ=96.65 kJ ·mol -1,∆r G m θ(T)=-RTln K θ=-2.303RTlg K θ,得∆r G m θ(1773K)=-112.8 kJ ·mol -1,∆r G m θ(1773K)=∆r H m θ-1773×∆r S m θ= -112.8 kJ ·mol -1,得∆r S m θ=0.1181 kJ ·mol -1·K -1=118.1 J ·mol -1·K -1,B νB νB ν可见理论计算值和实验计算值相差较大,如何计算看题意。
3—18题K1θ= Kθ 1/2 = 7.07;K2θ= 1/Kθ= 0.02第六章(P218)6—11过程:Fe2O3+ HCl→Fe3+→Fe2+→Fe3+Fe→Fe2+→Fe3+n(Fe)=n(1/5 KMnO4) =5n(KMnO4), n(Fe2O3)= 1/2 n(Fe)T Fe/KMnO4 =m(Fe)/V(KMnO4)= 5n(KMnO4)M(Fe)/V(KMnO4)=5c(KMnO4)M(Fe)=5.613g·L -1=5.613×10-3 g·mL -1T Fe2O3/KMnO4 =m(Fe2O3)/V(KMnO4)= 5/2 n(KMnO4)M(Fe2O3)/V(KMnO4)=5/2 c(KMnO4)M(Fe2O3)=8.025g·L -1=8.025×10-3 g·mL -16—12n(Al3+)+n(Zn2+)=n(EDTA) n(Al2O3)=n(Al3+)w(Al2O3)=m(Al2O3)/m s= n(Al2O3)M(Al2O3)/m s=12.37%6—13n(1/6 K2Cr2O7)=n(Na2S2O3)=6 n(K2Cr2O7)c(Na2S2O3)V(Na2S2O3)=6×m(K2Cr2O7)/M(K2Cr2O7)c(Na2S2O3)=0.1189 mol·L-1第七章(P218)7—9(12.5mL改成125mL):c a=V(HAc)×6.00 mol·L-1/250mL,V b=125mL×1.00 mol·L-1/250mL pH=5.00=p K aθ-logc a/c b;p K aθ=4.74,V(HAc)=11mL, V(H2O)=250-125-11=114mL 7—12P262算式c(HCl)=2m(Na2B407·10H2O)/[M(Na2B407·10H2O)V(HCl)]=0.1323 mol·L-1 7—14 P265算式w(N)= [c(HCl)V (HCl)- c(NaOH)V(NaOH)]M(N)/m(s) =4.37%7—16P264~265算式w(Na2CO3)=c(HCl)V1(HCl)M(Na2CO3)/m s=72.17%w(NaHCO3)=c(HCl)(V2-V1) (HCl)M(NaHCO3)/m s=6.05%7—17P266算式w(N)= c(NaOH)V(NaOH)M(N)/m(s)=19.24%第八章(P298)K( BaSO4)]1/2=1.05×10-5 mol·L-18—8 S (BaSO4)=[θSPK[Mg(OH)2]}1/3=1.12×10-4 mol·L-1S [(Mg(OH)2)]={1/4θSPK(AgI)]1/2=9.2×10-9 mol·L-18—9S (AgI)=[θSPK(AgI)/0.01=8.5×10-15 mol·L-1S’ (AgI)=θSP8—12 Zn2+ + HS(aq) ZnS(s) + 2H+开始沉淀的平衡浓度( mol·L-1) 0.1 0.1 c1(H+)沉淀完全的平衡浓度( mol·L-1) 1.0×10-50.1 c2(H+)K(ZnS)= 9.2×10-22/ 2.5×10-22=[c(H+)/cθ]2/{[c(Zn2+)/cθ]×[c(H2S)/cθ]}Kθ= K a1θK a2θ/θSP开始沉淀(平衡时)c(H+)=0.19 mol·L-1 pH=0.72沉淀完全(平衡时)c(H+)=0.19×10-2 mol·L-1 pH=2.728—16 ρ(NaCl)=c(AgNO3)V(AgNO3)M(NaCl)/V s=8.887×10-3 g·mL-18—17w(Cl )={[ c(AgNO3)V(AgNO3)-c(NH4SCN)V(NH4SCN)]M(Cl)}/m s=0.4098—20w(Cr2O3)=m(Cr2O3)/ m s =n(Cr2O3) M(Cr2O3)/ m s =1/2 ×n(BaCrO4) M(Cr2O3)/ m s=1/2 ×m(BaCrO4)M(Cr2O3)/ [M(BaCrO4)m s]=15.38%第九章(P338)9—1 略9—13 Ag(NH3)2++Cl-=AgCl(s)+2NH3Kθ=1/{K spθ(AgCl)×K fθ[Ag(NH3)2+]}=1/[1.77×10-10×1.12×107]= 5.04×102Kθ=[c(NH3)/cθ]2/{c[Ag(NH3)2+]/cθ×[c(Cl-)/cθ]}Ag(NH3)2++Cl-=AgCl(s)+2NH3起始浓度(mol·L-1) 0.1 0.1 5.0 无沉淀加HNO3减小NH3浓度至刚有沉淀平衡浓度(mol·L-1) 0.1 0.1 xKθ=x2/0.12=5.04×102x=2.2mol·L-1c b=c(NH3)=x=2.2mol·L-1c a=c(NH4+)=2.8mol·L-1pH=pKa-log c a/c b =9.26-0.10=9.16)2++Cl-AgCl(s)+2NH39—15 Ag(NHKθ=1/{K spθ(AgCl)×K fθ[Ag(NH3)2+]}=1/[1.77×10-10×1.12×107]=5.04×102Kθ=[c(NH3)/cθ]2/{c[Ag(NH3)2+]/cθ×[c(Cl-)/cθ]}c(Ag(NH3)2+)=10/11×0.05mol·L-1,c(Cl-)=1/10×0.1mol·L-1,代入计算得c(NH3)=0.46 mol·L-1. NH3浓度大于0.46 mol·L-1时才能防止AgCl沉淀生成9—18(本教材有问题)第一版教材: 分析铜锌镁合金,称取0.5000g试样,溶解后,用容量瓶配成100ml试液。