膜片钳实验与技术
- 格式:ppt
- 大小:17.46 MB
- 文档页数:46


膜片钳记录钠电流实验结果膜片钳是一种用于记录细胞膜上离子通道电流的实验技术。
在钠电流实验中,膜片钳被广泛应用于研究神经元细胞膜上的钠离子通道的活动。
本文将详细介绍如何使用膜片钳记录钠电流实验结果。
一、实验目的通过使用膜片钳记录钠电流,我们可以了解神经元细胞膜上钠离子通道的特性和功能。
具体而言,我们可以研究钠离子通道的开放概率、电流大小和动力学特性等。
二、实验材料和设备1. 膜片钳:包括一个玻璃微电极和一个放大器。
2. 玻璃微电极:用于穿刺神经元细胞膜,并记录离子通道电流。
3. 放大器:用于放大微弱的离子通道电流信号。
4. 实验室常规设备:显微镜、注射器、培养皿等。
三、实验步骤1. 准备工作:a. 准备好玻璃微电极。
将一根玻璃毛细管拉制成细微的一端,并用火烧熔封,形成一个小孔。
b. 准备好实验室常规设备,确保实验环境安全和卫生。
2. 细胞准备:a. 选择合适的细胞进行实验。
可以使用培养的原代神经元细胞或转染表达特定蛋白质的细胞系。
b. 将培养皿中的细胞置于显微镜下,选择一个健康、完整的细胞。
3. 穿刺膜片:a. 将玻璃微电极连接到放大器上,并调整放大器参数,使其适应记录离子通道电流信号。
b. 控制玻璃微电极接近选定的细胞,并轻轻穿刺膜片,使其与玻璃微电极相连。
c. 在穿刺过程中,需要注意保持薄膜完整性和稳定性。
4. 录制钠电流:a. 穿刺成功后,将放大器参数调整到合适的范围。
通常需要设置合适的增益、滤波和采样频率等参数。
b. 开始记录钠电流。
通过施加一系列不同电压的脉冲,可以激活和测量钠离子通道的电流。
c. 记录一段时间内的电流数据,并保存以备后续分析。
5. 数据分析:a. 使用适当的软件对记录的数据进行分析。
可以计算钠离子通道的开放概率、电流大小和动力学特性等。
b. 可以绘制电流-电压曲线(I-V曲线)来描述钠离子通道的特性。
c. 进一步分析和比较不同条件下钠离子通道活动的差异。
四、实验注意事项1. 实验环境应保持安静和稳定,以避免噪音干扰。



常州细胞生物学脑定位膜片钳原理及步骤
常州细胞生物学脑定位膜片钳是一种用于记录神经元电活动的实验技术。
其原理为利用微型电极穿透细胞膜,直接记录细胞内外电位的变化,并通过程序控制电极的移动,定位到特定的神经元细胞上进行电生理实验分析。
具体步骤如下:
1. 制备膜片钳:制作玻璃微电极,并用火炬加热封闭一端,使其呈现一个微小的孔。
将另一端连接到电极放大器上。
2. 切取小鼠或大鼠脑组织:将小鼠或大鼠的脑组织切成薄片,并将其置于离心管中。
加入缓冲液处理,使脑片柔软并不断吸除液,去除脑组织中的血液和细胞间液。
3. 将片段放在实验器皿中:将制备好的膜片钳放入实验器皿中,将离心管中的脑片放在显微镜下,观察和定位神经元的位置。
4. 穿透细胞膜:通过微调玻璃微电极的位置,将其穿透神经元细胞膜,并记录细胞内外的电位变化。
5. 进行电生理实验:利用程序控制电极的移动,将膜片钳定位到具体的神经元细胞上进行离子通道电流和电势信号的测量。
6. 分析细胞电生理数据:通过数据分析软件对实验结果进行分析,了解神经元细胞的电生理特性和响应情况。
7. 记录实验结果:将数据记录下来,并用图表等方式展示实验结果,以便后续研究或发表论文。

宁波全自动膜片钳实验原理及步骤简介宁波全自动膜片钳是一种实现自动化操作的技术设备,广泛应用于生物医学、材料科学等领域。
本文将详细介绍宁波全自动膜片钳实验的原理及步骤,帮助读者更好地了解和应用这一实验技术。
一、原理膜片钳是一种将膜片牢固固定在实验设备上的工具,常用于观察和研究小样品的性质和行为。
宁波全自动膜片钳利用机械力学和电子技术的原理,实现对膜片的自动夹持和控制,并配备了各种传感器和数据采集系统,可以进行实时监测和记录。
二、步骤在使用宁波全自动膜片钳进行实验前,需要按照以下步骤准备好实验样品和设备,以及设置实验条件:1. 准备实验样品和膜片钳•选择合适的实验样品,并将其制备成薄膜片的形式。
•选择符合实验要求的膜片钳,并确保其工作正常。
2. 连接仪器设备•将膜片钳连接到实验设备的电源和控制系统。
•连接膜片钳的传感器和数据采集系统,以便进行实时监测和数据记录。
3. 设置实验参数•根据实验的要求,设置膜片钳的夹持力、温度、湿度等参数。
•针对不同的实验目的,设置合适的实验时长和采样频率。
4. 夹持膜片•将预先制备好的膜片放置在膜片钳上,并确保其牢固和平整。
•调节膜片钳的夹持力,使膜片稳定且不会发生移位。
5. 启动实验•在实验控制系统中点击启动按钮,开始实验过程。
•实验过程中,膜片钳会根据预设的参数进行相应的控制和调节。
6. 实验数据记录•实验过程中,膜片钳的传感器会实时采集膜片的力学性能、形状变化等数据。
•这些数据会被传输到数据采集系统中并进行记录,供后续分析和研究使用。
7. 实验结束•实验时间达到设定值或实验过程结束后,点击停止按钮结束实验。
•仔细取下实验样品,并检查膜片的完整性和形状是否发生变化。
三、实验注意事项在进行宁波全自动膜片钳实验时,需要注意以下事项,以确保实验的可靠性和安全性:1. 校准仪器在进行实验前,需要检查和校准膜片钳的各项参数和传感器,确保仪器工作正常,并与实验室的标准设备进行对比。

膜片钳记录法(Patch Clamp Recording)是一种生理学实验技术,用于测量细胞膜离子通道或受体的电生理特性和活动。
该技术的基本原理是使用微型玻璃电极将一个非常小的玻璃管(称为膜片)贴附到单个细胞的表面上,从而形成一个微小的、高阻抗的突触点。
然后在膜片和细胞膜之间形成一个密封,并使用微电极或电极芯片记录跨越这个突触点的电位变化。
这种技术可以测量非常小的电流变化(尤其是亚毫安级别),因此非常适合研究离子通道和受体的活动。
通过控制细胞环境的情况,例如改变温度、pH值或添加化学物质,可以进一步调节离子通道和受体的电生理属性及其响应模式。
这种方法还可以用于研究各种细胞类型的电生理特性,包括神经元和心肌细胞等。
膜片钳记录法是一种十分精密的技术,在操作过程中需要非常小心谨慎,以避免损坏细胞或膜片。
同时,该技术需要一定的专业知识和设备支持,因此通常由有经验的生理学家和技术人员来执行。
总之,膜片钳记录法是一种重要的电生理技术,已经成为研究离子通道和受体的电生理学特性的关键工具之一,对于揭示神经、心血管等多种疾病的发病机制和治疗方法也具有重要意义。
膜片钳技术1、膜片钳技术原理膜片钳技术是用玻璃微电极吸管把只含1-3个离子通道、面积为几个平方微米的细胞膜通过负压吸引封接起来,由于电极尖端与细胞膜的高阻封接,在电极尖端笼罩下的那片膜事实上与膜的其他部分从电学上隔离,因此,此片膜内开放所产生的电流流进玻璃吸管,用一个极为敏感的电流监视器(膜片钳放大器)测量此电流强度,就代表单一离子通道电流。
膜片钳的基本原理则是利用负反馈电子线路,将微电极尖端所吸附的一个至几个平方微米的细胞膜的电位固定在一定水平上,对通过通道的微小离子电流作动态或静态观察,从而研究其功能。
膜片钳技术实现膜电流固定的关键步骤是在玻璃微电极尖端边缘与细胞膜之间形成高阻密封,其阻抗数值可达10~100 GΩ(此密封电阻是指微电极内与细胞外液之间的电阻)。
由于此阻值如此之高,故基本上可看成绝缘,其上之电流可看成零,形成高阻密封的力主要有氢健、范德华力、盐键等。
此密封不仅电学上近乎绝缘,在机械上也是较牢固的。
又由于玻璃微电极尖端管径很小,其下膜面积仅约1 μm2,在这么小的面积上离子通道数量很少,一般只有一个或几个通道,经这一个或几个通道流出的离子数量相对于整个细胞来讲很少,可以忽略,也就是说电极下的离子电流对整个细胞的静息电位的影响可以忽略,那么,只要保持电极内电位不变,则电极下的一小片细胞膜两侧的电位差就不变,从而实现电位固定。
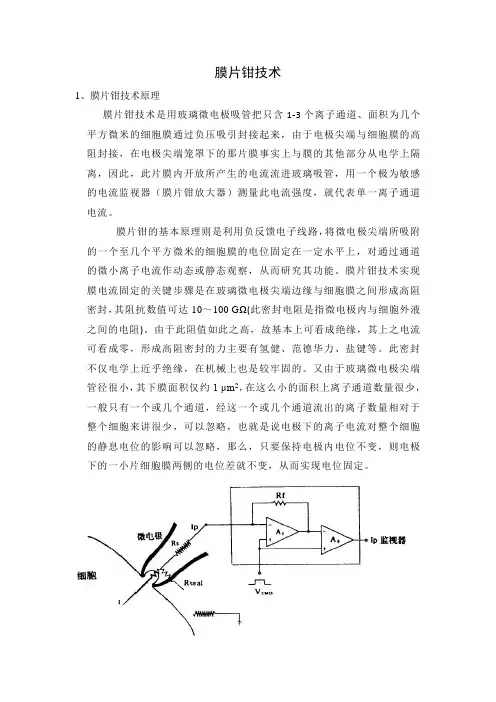
膜片钳技术的原理图[51]Rs是与膜片抗阻串联的局部串联电阻(或称入路阻抗),Rseal是封接阻抗。
RS通常为1~5MΩ,如果Rseal高达10GΩ以上是成为Ip/I=Rseal/(Rs+Rseal)-1。
此Ip可作为I~V转换器(点线)内的高阻抗负反馈电阻(Rf)的电压下降而被检测出。
实际上这是场效应管运算放大器(A1)的输出中包括着膜电阻成分,这部分将在通过第二级场效应管运算放大器(A2)时被减掉。
本实验采用的是全细胞记录模式。
全细胞记录构型(whole-cell recording)高阻封接形成后,继续以负压抽吸使电极管内细胞膜破裂,电极胞内液直接相通,而与浴槽液绝缘,这种形式称为“全细胞”记录。

郭静1611210748 北大深圳医院一.概念:膜片钳技术是一种通过微电极与细胞膜之间形成紧密接触的方法,采用电压钳或电流钳技术对生物膜上离子通道的电活动(尤其是可对单通道电流)进行记录的微电极技术。
二.应用:在一个细胞上检测多种离子通道用于离子通道电生理特性的研究研究受体及第二信使对通道活性的作用生理、药理机制研究中的应用三.常用的记录形式:(1) 细胞贴附式:高阻封接后的状态即为细胞贴附式模式,是在细胞内成分保持不变的情况下研究离子通道的活动,进行单通道电流记录。
即使改变细胞外液对电极膜片也没有影响。
(2) 膜内面向外式:在细胞贴附式状态下将电极向上提,电极尖端的膜片被撕下与细胞分离,形成细胞膜内面向外模式。
此时膜片内面直接接触浴槽液,灌流液成分的改变则相当于细胞内液的改变。
可进行单通道电流记录。
此模式下细胞质容易渗漏,影响通道电流的变化,如Ca2+ 通道的run-down 现象。
(3) 全细胞式记录:在细胞贴附式状态下增加负压吸引或者给予电压脉冲刺激,使电极尖端膜片在管口内破裂,即形成全细胞记录模式。
此时电极内液与细胞内液相通成为和细胞内电极记录同样的状态,不仅能记录一个整体细胞产生的电活动,并且通过电极进行膜电位固定,也可记录到全细胞膜离子电流。
这种方式可研究直径小于20μm 以下的小细胞的电活动;也可在电流钳制下测定细胞内电位。
(4) 膜外面向外式(outside-out mode):在全细胞模式状态下将电极向上提,使电极尖端的膜片与细胞分离后又粘合在一起,此时膜内面对电极内液,膜外接触的是灌流液。
可在改变细胞外液的情况下记录单通道电流。
四.全细胞膜片钳的记录过程:1.DRG神经元的急性分离2.玻璃微电极的制备3.计算机操作(1)打开膜片钳放大器(2)打开计算机,进入Patchmaster操作界面。
(3)单击“store”,选择好文件名和保存路径,单击“save”(4)单击“current clamp”,编辑所需的刺激模式。


合肥细胞生物学电生理膜片钳原理及步骤
合肥细胞生物学电生理膜片钳是一种实验技术,用于研究细胞膜的离子转运和通道功能。
具体原理及步骤如下:
原理:
膜片钳分为两种:内破式和外破式。
内破式膜片钳是使用吸管吸引细胞,通过内破细胞膜来接触细胞内部,外破式膜片钳则是通过压力控制膜片和细胞膜的接触。
步骤:
1. 实验者需要制备一些玻璃膜片,并涂上一层细胞贴壁剂,使其变得亲水。
2. 首先,需要生长细胞并将其放入培养皿中,保证其在适当的环境下生长。
3. 实验者使用一个钳子将一块膜片夹在微调杆上,并将其移动以接近细胞膜。
4. 然后,使用一个微小的吸孔将膜片吸附在细胞上,使其吸附在膜片上。
5. 实验者会给膜片和细胞提供一些膜平衡液,帮助膜片更容易地接触到细胞膜。
6. 接下来,实验者会通过调节电路并施加微小电压来观察膜片和细胞膜的交互
作用。
7. 在观察的过程中,实验者可以通过一个耳机来听到来自膜片上的信号。
8. 最后,实验者便可以分析信号并弄清楚细胞膜中的离子转运和通道功能。
膜片钳技术及应用膜片钳技术及应用是一种常见的力学装置,由薄膜片、夹持手柄和支撑结构组成。
膜片钳可用于夹持和固定物体,并且在广泛的领域中有着重要的应用。
下面将对膜片钳的技术原理和应用领域进行详细介绍。
膜片钳的技术原理主要基于材料的力学性质。
一般情况下,膜片钳采用弹性薄膜片作为夹持物体的夹持部分。
当施加外力使薄膜片发生形变时,薄膜片会产生力与形变量成正比的特性,这种力被称为弹性力。
通过调整薄膜片的形变程度和位置,可以达到对不同物体的夹持和固定的目的。
膜片钳的应用领域非常广泛。
以下是一些常见的应用领域:1. 医疗行业:膜片钳被广泛用于医疗器械的设计和制造。
例如,在手术中,膜片钳可以用于夹持和固定组织、血管和器官,以便医生进行手术操作。
膜片钳的特点是夹持力均匀,不会损伤组织和血管。
2. 实验室研究:膜片钳在实验室研究中也有广泛的应用。
例如,在细胞学研究中,膜片钳可以用于夹持、拉伸和操纵细胞,以研究细胞的力学特性和细胞间的相互作用。
此外,膜片钳还可以用于微流体实验中的液滴操纵和胶体粒子的固定。
3. 微机电系统(MEMS):膜片钳是制作微机电系统中常用的工具。
在MEMS 器件制造过程中,需要对微米级物体进行精确操纵和固定。
膜片钳结构简单,加工工艺成熟,可以实现对微米级物体的夹持和固定。
4. 机械制造:膜片钳在机械制造过程中也有重要的应用。
例如,在精密加工中,膜片钳可以用于夹持和固定零件,以确保加工精度。
另外,膜片钳还可以用于装配过程中的夹持和定位。
总的来说,膜片钳技术及其应用在医疗、实验室研究、微机电系统和机械制造等领域起到了重要的作用。
膜片钳具有结构简单、操作方便、夹持力均匀等特点,使其成为一种广泛使用的力学装置。
随着科技的不断发展,膜片钳的应用领域还将不断扩大,为各个领域的科研和应用带来更多的便利和可能性。
膜片钳技术原理与基本操作1976 年Neher 和Sakmann 建立了膜片钳技术(Patch clamp technique),这是一种以记录通过离子通道旳离子电流来反映细胞膜上单一旳或多数旳离子通道分子活动旳技术。
1981 年Hamill, Neher 等人又对膜片钳实验措施和电子线路进行了改善,形成了当今广泛应用旳膜片钳实验技术。
该技术可应用于许多细胞系旳研究,也是目前唯一可记录一种蛋白分子电活动旳措施,膜片钳技术和克隆技术并驾齐驱给生命科学研究带来了巨大旳迈进动力,这一伟大旳奉献,使Neher 和Sakmann 获得1991 年诺贝尔医学与生理学奖。
一、膜片钳技术旳基本原理用一种尖端直径在1.5~3.0μm 旳玻璃微电极接触细胞膜表面,通过负压吸引使电极尖端与细胞膜之间形成千兆欧姆以上旳阻抗封接,此时电极尖端下旳细胞膜社区域(膜片,patch)与其周边在电学上分隔,在此基本上固定(钳制,Clamp)电位,对此膜片上旳离子通道旳离子电流进行监测及记录。
基本旳仪器设备有膜片钳放大器、计算机、倒置显微镜、示波器、双步电极拉制器、三轴液压显微操纵器、屏蔽防震实验台、恒温标本灌流槽、玻璃微电极研磨器。
膜片钳放大器是离子单通道测定和全细胞记录旳核心设备,具有高敏捷度、高增益、低噪音及高输入阻抗。
膜片钳放大器是通过单根电极对细胞或膜片进行钳制旳同步记录离子流经通道所产生旳电流。
膜片钳放大器旳核心部分是以运算放大器和反馈电阻构成旳电流-电压(I-V)转换器,运算放大器作为电压控制器自动控制,使钳制电位稳定在一定旳水平上。
二、操作环节1.膜片钳微电极制作(1) 玻璃毛细管旳选择:有二种玻璃类型,一是软质旳苏打玻璃,另一是硬质旳硼硅酸盐玻璃。
软质玻璃在拉制和抛光成弹头形尖端时锥度陡直,可减少电极旳串联电阻,对膜片钳旳全细胞记录模式很有利;硬质玻璃旳噪声低,在单通道记录时多选用。
玻璃毛细管旳直径应符合电极支架旳规格,一般外部直径在1.1~1.2mm。
膜片钳实验技术入门------基本原理与操作关兵才 李国华 刘理望按:本文乃于2003年根据较旧型号的仪器写成,后被《机能实验科学》 (郑先科主编,北大医学版,2006)收入。
因新旧仪器基本原理和操作步骤大同小异,现对原文略作修改和标注,供同学们参考。
【实验目的】1. 了解膜片钳技术的基本原理和操作。
2. 初步学习电压依赖性离子通道电流的基本记录方法。
【实验原理】一、膜片钳技术原理简介膜片钳(patch clamp)是一种主要用于检测细胞膜离子通道活动的电生理技术,按工作方式可区分为电压钳(voltage clamp)和电流钳是最基本的工作方式,即对细胞膜电位进行人为控制,如将膜电位钳制于某一固定水平,或在此基础上再施以阶跃(step)式或斜坡式(ramp)电压刺激,同时记录跨膜电流,从而分析细胞膜通道的活动。
电流钳即人为控制经微电极对细胞进行注射的电流(等于离子通道电流与细胞膜电容电流之和),同时记录膜电位及其变化。
若注射电流为零即常用的零位钳流,用于测量细胞膜静息电位,若注射方波脉冲刺激电流,用于诱发、观测动作电位。
另外,膜片钳技术还常用于观测细胞膜电容, 从而推测分泌细胞的活动情况。
下面主要介绍其电压钳工作方式的基本原理。
(注:在电生理资料中,因通常将细胞外液和记录系统的“地”点相连作为参考点即零电位点,所以电位和电压两个概念经常混用。
)根据膜片钳实验中受检细胞膜的型式(configuration)不同,又可将膜片钳分为全细胞式(whole-cell)、细胞贴附式(cell-attached 或on-cell)、内面朝外式(inside-out)、外面朝外式(outside-out)等四种模式。
(一)全细胞式1.电压钳制和电流记录的实现图9-9为全细胞式膜片钳工作原理示意图。
图9-9 全细胞膜片钳实验原理示意图A1:运算放大器;A2:单倍增益差动放大器;R f:反馈电阻;V p:电极电位(A1反向输入端电位);V c:A1同向输入端电位;C in:输入端杂散电容;C p:电极电容;Rs:串联电阻;C m:细胞膜电容;R m:细胞膜电阻;E m:细胞膜内在电位(指钳压时的细胞膜诸通道状态决定的内在Goldman-Hodgkin-Katz平衡电位);V o:A2输出端电位;V-offset:偏移电位补偿电位;C c:用于电容补偿的电容;V c(app):表观钳制电压即欲施加于受试膜片的电压;图中⊕和表示求和电路将充有电解质溶液的玻璃微电极(glass microelectrode或 recording pipette)利用负压紧密吸附于细胞表面,形成吉欧即千兆欧(109Ω)级高阻封接,进一步对微电极内施加负压、将放大器(以下简称运放)A1在深度负反馈工作状态下的“虚短路(virtual short circuit)”原理实现,即只要A1工作于线性范围内,其反向输入端的电位V p总是等于同向输入端的电位V c,这两个输入端之间虽非短路却类似于短路。
黄山细胞生物学膜片钳原理及步骤
黄山细胞生物学膜片钳原理:
膜片钳是一种实验工具,用于测量单个细胞膜上离子通道的电流。
它由一个超细的玻璃吸管和一个镊子组成。
首先,将吸管拉长,熔化并拉成一支钳,然后将其用火焰加热并细化端部。
使用显微镜将钳端定位到待研究细胞的表面,并轻轻将其吸附到膜上。
钳端的电极与试管中的参比电极相连,并通过增大或缩小电压的方式控制外部离子流动,以测量细胞膜上的离子通道电流。
黄山细胞生物学膜片钳步骤:
1. 准备细胞:首先需要通过化学或机械方法分离细胞。
随后,在培养基中对细胞进行孵育,并在实验前将其转移到导电性基板上。
2. 准备膜片钳:使用玻璃吸管通过拉伸和定位的方法制作成超细的膜片钳,并根据需要在其上装备好电极。
3. 将膜片钳轻轻吸附到细胞膜上。
4. 控制钳端与参比电极之间的电压差,以便测量细胞膜上的离子通道电流。
5. 通过调整钳端与膜的接触点,使钳端内的电压从而能够控制细胞膜上的离子
通道的状态。
6. 记录测量数据并进行分析。
需要注意的是,实验中需要保持细胞的完整性和稳定性,避免对其造成损伤。
此外,需要对实验环境进行精确控制以保证实验结果的准确性和可靠性。
细胞膜片钳实验实验技术:一种以记录通过离子通道的离子电流来反映细胞膜单一的或多个的离子通道分子活动的技术。
膜片钳技术是用微玻管电极(膜片电极或膜片吸管)接触细胞膜,以千兆欧姆以上的阻抗使之封接,使与电极尖开口处相接的细胞膜的小区域(膜片)与其周围在电学上分隔,在此基础上固定点位,对此膜片上的离子通道的离子电流(pA级)进行监测记录的方法。
实验技术原理:膜片钳技术是用玻璃微电极吸管把只含1-3个离子通道、面积为几个平方微米的细胞膜通过负压吸引封接起来,由于电极尖端与细胞膜的高阻封接,在电极尖端笼罩下的那片膜事实上与膜的其他部分从电学上隔离,因此,此片膜内开放所产生的电流流进玻璃吸管,用一个极为敏感的电流监视器(膜片钳放大器)测量此电流强度,就代表单一离子通道电流。
实验操作流程:1、标本制备:根据研究目的的不同,可采用不同的细胞组织,如心肌细胞、平滑肌细胞、肿瘤细胞等,现在几乎可对各种细胞进行膜片钳的研究。
对所采用的细胞,必须满足实验要求,一般多采用酶解分离法,也可采用细胞培养法;另外,由于与分子生物学技术的结合,现在也运用分子克隆技术表达不同的离子通道,如利用非洲爪蟾卵母细胞表达外源性基因等。
2、电极制备:合格的膜片微电极是成功封接细胞膜的基本条件。
要成功的封接细胞膜需要两方面的因素保证,一是设法造成干净的细胞膜表面,二是制成合格的电极。
首先要选择适当的玻璃毛细管,其材料可使用软质玻璃(苏打玻璃、电石玻璃)或硬质玻璃(硼硅玻璃、铝硅玻璃、石英玻璃)。
软玻璃电极常用于作全细胞记录,硬质玻璃因导电率低、噪声小而常用于离子单通道记录。
3、膜片钳实验系统:根据不同的电生理实验要求,可以组建不同的实验系统。
4、进行实验,记录和分析数据。
[晶莱生物]实验注意事项:客户提供:1、培养细胞:通过细胞计数取不少于2×106个细胞于EP管,加入0.5ml生理盐水或蛋白保护剂,混匀后保存于冰箱(-80℃,避免反复冻融);2、实验信息:离子通道名称及亚型。