第一章 复习 化学反应与能量旋冰讲义
- 格式:doc
- 大小:249.50 KB
- 文档页数:10







第六章化学反应与能量第一节化学反应与能量变化第1课时化学反应与热能课程标准解读核心素养解读1.认识物质具有能量,认识吸热反应与放热反应,了解化学反应体系能量改变与化学键的断裂和形成有关。
2.知道化学反应可以实现化学能与其他能量形式的转化。
1.通过实验和已有知识、经验感受化学反应中的能量变化,知道常见的吸热反应和放热反应,树立物质变化中伴随能量变化的观念。
2.能从反应物与生成物所具有的能量、化学键的断裂与形成两个角度理解化学反应中能量变化的主要原因,提升证据推理能力。
3.通过多种渠道了解人类对化学反应中能量的利用情况,了解节能的意义和方法,感受化学学科的社会价值,培养科学态度与社会责任。
一、吸热反应和放热反应1.实验探究实验操作实验现象有气泡产生;用温度计测量,温度升高闻到刺激性气味;烧杯壁发凉;玻璃片和烧杯黏结在一起,混合物呈糊状实验结论该反应产生气体,放出热量该反应产生NH3和H2O,吸收热量放出热量,有的吸收热量。
2.放热反应和吸热反应(1)概念①放热反应:释放热量的化学反应。
②吸热反应:吸收热量的化学反应。
(2)常见的放热反应和吸热反应二、化学反应与能量变化的关系1.化学反应的实质和特征(1)实质:旧化学键断裂和新化学键形成(2)特征:①物质变化:生成新物质→遵循质量守恒定律②能量变化:释放能量或吸收能量→遵循能量守恒定律物质的化学反应与体系的能量变化同时发生。
2.化学反应中能量变化的主要原因和决定因素(1)主要原因(微观角度)反应物旧化学键断裂吸收能量与生成物新化学键形成释放能量,两者不相等,引起能量变化。
(2)决定因素①一个确定的化学反应是吸收能量还是放出能量取决于反应物总能量与生成物总能量的相对大小。
当反应物的总能量大于生成物的总能量时,化学反应放出能量; 当反应物的总能量小于生成物的总能量时,化学反应吸收能量。
类型比较放热反应吸热反应图示②化学反应过程中的能量变化取决于化学键断裂吸收的能量与化学键形成释放的能量的相对大小。



2017-2018学年高中化学第一章化学反应与能量章末复习讲座新人教版选修4编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(2017-2018学年高中化学第一章化学反应与能量章末复习讲座新人教版选修4)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为2017-2018学年高中化学第一章化学反应与能量章末复习讲座新人教版选修4的全部内容。
第一章化学反应与能量1.[2014·课标全国卷Ⅱ]室温下,将1 mol的CuSO4·5H2O(s)溶于水会使溶液温度降低,热效应为ΔH1,将1 mol的CuSO4(s)溶于水会使溶液温度升高,热效应为ΔH2;CuSO4·5H2O 受热分解的化学方程式为CuSO4·5H2O(s)错误!CuSO4(s)+5H2O(l),热效应为ΔH3.则下列判断正确的是()A.ΔH2>ΔH3B.ΔH1<ΔH3C.ΔH1+ΔH3=ΔH2D.ΔH1+ΔH2>ΔH3解析:由题给条件可知:①CuSO4·5H2O(s)===Cu2+(aq)+SO错误!(aq)+5H2O(l) ΔH1>0,②CuSO4(s)===Cu2+(aq)+SO2-,4(aq) ΔH2<0,则①-②可得CuSO4·5H2O(s)===CuSO4(s)+5H2O(l) ΔH3=ΔH1-ΔH2>0,选B。
答案:B2.[2014·重庆高考]已知:C(s)+H2O(g)===CO(g)+H2(g) ΔH=a kJ·mol-12C(s)+O2(g)===2CO(g) ΔH=-220 kJ·mol-1H-H、O===O和O—H键的键能分别为436、496和462 kJ·mol-1,则a为( )A.-332 B.-118C.+350 D.+130解析:按顺序将题中两个热化学方程式编号为①和②,依据盖斯定律,②-①×2得2H2(g)+O2(g)===2H2O(g)ΔH=-(220+2a) kJ·mol-1,代入相关数据得(2×436+496)-4×462=-(220+2a),解得a=+130,D项正确。
第一章化学反应与能量【目标】1.了解化学反应中的能量变化,并了解放热反应和吸热反应2.介绍燃料充分燃烧的条件,培养节约能源和环境保护的意识。
3.了解焓、焓变、反应热的定义及相互关系。
理解反应热的涵义,能用盖斯定律进行有关反应热的计算。
4.掌握热化学方程式的书写方法和应用。
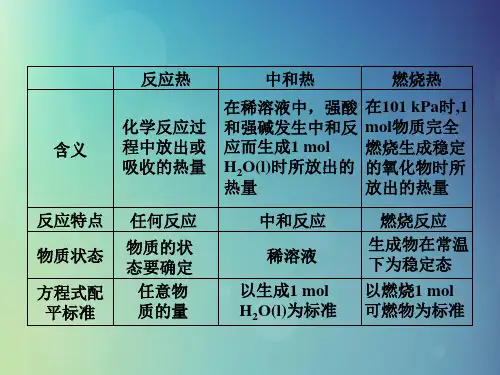
5.理解燃烧热并掌握有关燃烧热的计算。
6.理解中和热。
{知识结构}知识点一:反应能量变化与反应热1.化学反应与能量变化的关系任何一个化学反应中,反应物所具有的总能量与生成物所具有的总能量是不相等的,在产生新物质的同时总是伴随着能量的变化。
2、化学反应中能量变化形式形式较多,通常表现为热量的变化3、(1)放热反应:即有热量放出的化学反应,其反应物的总能量高于生成物的总能量。
如:燃料的燃烧、中和反应、生石灰与水化合、金属和酸的反应、铝热反应等都是放热反应。
(2)吸热反应:即吸收热量的化学反应,其反应物的总能量小于生成物的总能量。
如:H2还原CuO的反应,灼热的碳与二氧化碳反应,H2和I2、S、P等不活泼的非金属化合,CaCO3分解等大多数分解反应,Ba(OH)2·8H2O与NH4Cl的反应都是吸热反应。
说明:吸热反应特征是大多数反应过程需要持续加热,但有的不需要加热如:Ba(OH)2·8H2O和NH4Cl固体反应,放热反应有的开始时需要加热以使反应启动。
即反应的吸、放热与反应条件无关。
4.化学键与化学反应中能量变化的关系 (1)化学键的断裂是化学反应中能量变化的主要原因。
①当物质发生化学反应时,断开反应物中的化学键要 能量;而形成生成物中的化学键要 能量。
所以一个化学反应是否为放热还是吸热取决于所有断键吸收的总能量与所有形成新键放出的总能量的相对大小。
(2)一个确定的化学反应在发生过程中是吸收能量还是放出能量,决定于反应物和生成物中能量的相对大小。
(图示)∑E (反应物)>∑E (生成物)——化学反应放出能量;∑E (反应物)<∑E (生成物)——化学反应吸收能量。
化学反应的过程,可以看成是能量的“贮存”或“释放”的过程小结:能量公式化 E (反应物)=E (生成物)+Q (能量守恒定律)Q>0为放热反应;Q<0为吸热反应知识点二:反应热(焓变)(1)概念:化学反应过程中所释放或吸收的 热量 。
(2)表示符号: Q 。
(3)单位: (或 )。
(4)计算方法:∆H =E (反应物的键能)- E (生成物的键能)∆H =E (生成物的总能量)- E (反应物的总能量)△H<0, 为放热反应; △H>0,为吸热反应。
化学研究表明,对于在等压条件下进行的化学反应,如果反应中物质的能量变化全部转化为热能(同时可能伴随着反应体系体积的改变),而没有转化为电能、光能等其他形式的反应物总能量 反应物总能量 生成物总能量 生成物总能量 生成物总能量 放热反应吸热 反应 放热 反应物总能量 生成物总能量吸热 能 量能,则该反应的反应热就等于反应前后物质的焓的变化。
[对位专练]:1.下列说法正确的是( C )A.焓是一个物理量,符号为H,单位为mol·L可以测量B.焓变就是反应热,二者没有区别C.公式△H--T△S中的△H是反应的焓变D.焓变△H只有大小,没有正负之分2.下列变化中属于吸热反应的是:①液态水汽化②将胆矾加热变为白色粉末③浓硫酸稀释④氯酸钾分解制氧气⑤生石灰跟水反应生成熟石灰( D )A.①② B.②③ C.①④⑤ D.②④3.知化学反应2C(s)+O2(g)点燃2CO(g)、2CO(g)+O2点燃 2 CO2(g )都是放热反应。
据此判断,下列说法中不正确的是 ( A )A.12gC所具有的能量一定高于28g CO所具有的能量B.56g CO和32g O2所具有的总能量大于88g CO2所具有的总能量C.12gC和32g O2所具有的总能量大于44g CO2所具有的总能量D.将一定质量的C燃烧,生成CO2比生成C0时放出的热量多4. 下列反应属于吸热反应的是: DA. 铜与硫蒸气反应B. Mg粉与水反应C. 干冰升华为气体D.硫酸钙高温锻烧5. 下列说法正确的是 CA. 需要加热方能发生的反应一定是吸热反应;B. 放热的反应在常温下一定很易发生;C.一个反应是放热反应还是吸热反应主要由反应物、生成物所具有的总能量的相对大小决定,而不是由反应是否需要加热而决定;D. 吸热反应发生过程中要不断从外界获得能量、放热反应发生过程中不再需要外界能量。
6.已知反应A+B=C+D为放热反应,对该反应的下列说法中正确的是(C)A. A的能量一定高于CB. B的能量一定高于DC. A和B的总能量一定高于C和D的总能量D. 该反应为放热反应,故不必加热就一定能发生7.氢气在氧气中燃烧产生蓝色火焰,在反应中,破坏1molH-H键消耗的能量为Q1kJ,破坏1molO = O键消耗的能量为Q2kJ,形成1molH-O键释放的能量为Q3kJ。
下列关系式中正确的是(B)A.2Q1 + Q2 > 4Q3B. 2Q1 + Q2 < 4Q3C. Q1 + Q2 < Q3D. Q1 + Q2 = Q38.反应C(石墨) → C(金刚石)是吸热反应,由此可知(AB)A、石墨比金刚石更稳定B、金刚石和石墨可以相互转化C、金刚石比石墨稳定D、金刚石和石墨不能相互转化10.下列变化过程中会放出热量的是()①硝酸铵溶于水②物质的燃烧③苛性钠溶于水④醋酸的电离⑤ Ba(OH)2·8H2O与NH4Cl的反应⑥灼热的碳与二氧化碳的反应⑦氯化钠溶于水(C)A.仅①⑤ B.仅②③⑦C.仅②③ D.②③④11、下列变化属于吸热反应的是①液态水汽化②将胆矾加热变为白色粉末③浓硫酸稀释④氯酸钾分解⑤生石灰跟水反应(A)A.②④ B.①④ C.②③ D.①④⑤12.1molC与1molH2O(g)反应失成lmol CO(g)和1mol H2(g),需要吸收131.5kJ的热量,该反应的反应热为△H= +131.5 kJ/mol13.拆开 lmol H—H键、lmol N-H键、lmolN≡N键分别需要的能量是436kJ、391kJ、946kj,则1mol N2生成NH3的反应热为 -92KJ/mol,1mol H2生成NH3的反应热为-30.7KJ/mol解:N2+3H2===2NH3 ∆H=E(反应物的键能)- E(生成物的键能)①△H =(946kj/mol +3X436kJ/mol)-- 2X3X391 ==-92KJ/mol②△H =-92KJ/mol÷3==-30.7 KJ/mol知识点三:热化学方程式1.概念:表示参加反应物质的量和放应热的关系化学方程式。
2.表示意义:2H2(g)+02(g)===2H20(1) △H ===一571.6 kJ·mol—1 表示在一定条件下。
1mol气态H2和1mol气态 02完全反应生成2 mol液态2H20时要放出14.9kJ的热量。
3、热化学方程式的书写与判断正误规则:(1)一看化学原理是否正确(2)二看状态是否表明(3)三看△H符号和单位是否正确(4)四看反应热的数值与化学计量数是否对应即时巩固依据事实,写出下列反应的热化学方程式。
(1)在25 ℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ。
则表示甲醇燃烧热的热化学方程式CH3OH(l)+ 3/2O2(g)=CO2(g)+ 2H2O(l) ΔH=-725.76 kJ·mol-1 。
(2)若适量的N2和O2完全反应,每生成23 g NO2需要吸收16.95 kJ热量,写热化学方程式N2(g)+2O2(g)=2NO2(g)ΔH=+67.8kJ·mol-1 。
(3)已知拆开1 mol H—H键,1 mol N—H键,1 mol N≡N键分别需要的能量是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式为_N2(g)+3H2(g)=2NH3(g) ΔH=-92 kJ·mol-1[对位专练]1. 含NaOH 20.0g的稀溶液与足量稀盐酸反应,放出28.7kJ的热量,表示该反应中和热的热化学方程式正确的是: DA. NaOH(aq)+HCl(aq) = NaCl(aq)+H2O(1) ∆H=+28.7kJ/molB. NaOH(aq)+HCL(aq) = NaCl(aq)+H2O(1) ∆H=-28.7kJ/molC. NaOH(aq)+HCl(aq) = NaCl(aq)+H2O(1) ∆H=+57.4kJ/molD. NaOH(aq)+HCl(aq) = NaCl(aq)+H2O(1) ∆H=-57.4kJ/mol2. 分析下面的能量变化示意图,下列热化学方程式正确的是: BA. 2A(g)+B(g)=2C(g); ∆H=a(a>0)B. 2A(g)+B(g)=2C(g); ∆H=a(a<0)C. 2A+B=2C;∆H=a(a<0)D. 2C=2A+B;∆H=a(a>0)3.已知在发射卫星时可用肼(N2H4)作燃料和N02作氧化剂,两者反应生成N2和水蒸气。
又知:①N2(g) + 202(g)====2N02(g) △H ==+67.47 kJ·mol-1②N2H4(g)+02(g)====N2(g)+2H20(g)△H===--534 kJ·mol-1写出肼与N02反应的热化学方程式:N2H4(g)+N02(g)====3/2N2(g)+2H20(g)△H===--567.85 kJ·mol-14.用CH4催化还原NOx,可以消除氮氧化物的污染。
例如:CH4(g)+4N02(g)====4N0(g)+C02((g)+2H20(g) △H==--574 kJ·mol-1CH4(g)+4N0(g)=====2N2(g)+C02(g)+2H20(g) △H==一1160 kJ·mol-1若用标准状况下4.48 L CH4还原N02至N2,整个过程中转移的电子总数为 (阿伏加德罗常数的值用N A表示),放出的热量为 kJ (1.6N A 173.4)5、阿伏加德罗常数值记为NA,则关于C2H2(气)+ O2(气)=2CO2(气) +H2O(液);∆H=-1300kJ/mol的下列说法中,正确的是: BA. 有10NA个电子转移时,吸收1300kJ的能量B.有8NA个碳氧共用电子对生成时,放出1300kJ能量C. 有NA个水分子生成且为液体时,吸收1300kJ能量D. 有2NA个碳氧双键生成时, 放出1300kJ能量4、应用——反应热大小的比较:(1) 同一反应生成物状态不同时如:2H2(g)+O2(g) = 2H2O(1);∆H12H2(g)+O2(g) = 2H2O(g);∆H2因为气体变液体会放热,故:∆H1< ∆H2(2) 同一反应反应物状态不同时点燃如:S(g)+O2(g) = SO2(g); ∆H1S(s)+O2(g) = SO2(g);∆H2因为固体变气体会吸热,故: ∆H1< ∆H2(3) 两个相联系的不同反应比较如: C(s)+O2(g) = CO2(g);∆H1C(s)+1/2O2(g) = CO(g);∆H2可以设计成:C(s) —— CO(g)———CO2(g) 故∆H1< ∆H2知识点四:燃烧热和中和热1、燃烧热的定义:在101kPa时,1mol纯物质燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热。