2021年人教版中考化学专题复习训练:有关氢氧化钠和氢氧化钙变质的探究
- 格式:docx
- 大小:585.08 KB
- 文档页数:8


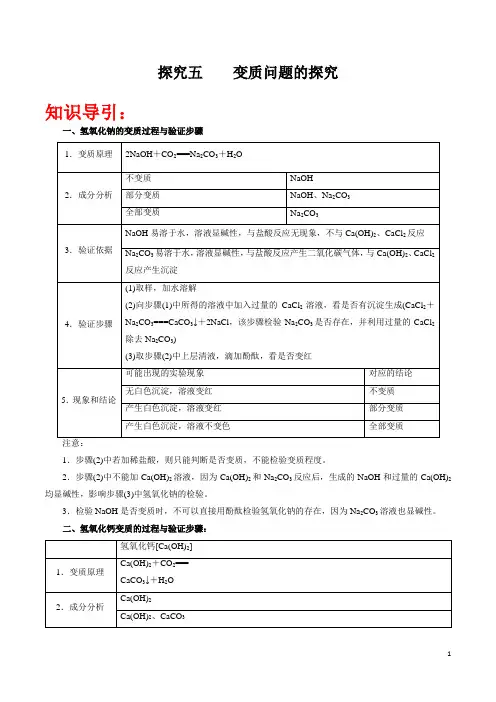
初三化学专题复习— NaOH、Ca(OH)2变责问题【研究 1: NaOH变责问题】氢氧化钠没密封保留会因汲取空气中的二氧化碳,生成碳酸钠而变质。
2NaOH+CO===Na2CO3+H2O.一、氢氧化钠的变质存在这样三种状况(猜想):(1)没有变质:(成分NaOH)(2)部分变质:(成分NaOH和 Na2CO3)(3)完整变质:(成分Na2CO3)二、证明变质:(取样 ----加试剂---说操作---描现象 --- 下结论)查验能否有碳酸钠有三种不一样的方法:(1)加入盐酸有气泡冒出:2HCl + Na2CO3=2NaCl+ H2O+CO2↑(2)加入石灰水有积淀产生:Ca(OH)2 + Na2CO3 = CaCO3↓ +2NaOH(3)加入氯化钙有积淀产生:Na2CO3 +CaCl2= CaCO 3↓ +2NaCl取少量固体物质溶于水,配成溶液与试管中;可分别向此中滴加酸、碱、盐溶液中的一种。
【方法( 1)】:取少量固体物质溶于水,配成溶液与试管中,向此中滴加稀盐酸或稀硫酸,假如产生气泡,说明已经变质。
原理:碳酸钠会与酸反响生成二氧化碳气体,而氢氧化钠与酸反响没有明展现象。
Na2CO3+2HCl=== 2NaCl+H2O+ CO2↑〖 NaOH+HCl== NaCl+H2O〗【方法( 2)】:取少量固体物质溶于水,配成溶液与试管中,向此中滴加氢氧化钡溶液或氢氧化钙溶液,假如产生白色积淀,说明已经变质。
原理:碳酸钠会与氢氧化钡或氢氧化钙反响生成白色积淀,而氢氧化钠与氢氧化钡或氢氧化钙不反响,没有明展现象。
v1.0可编写可改正Na2CO3+Ba(OH)2== BaCO3↓+ 2NaOH;NaOH+ Ba(OH)2≠【方法( 3)】:取少量固体物质溶于水,配成溶液与试管中,向此中滴加氯化钡溶液或氯化钙溶液(或硝酸钡等其余可溶性钙盐、钡盐溶液),假如产生白色积淀,说明已经变质。
原理:碳酸钠会与氯化钡或氯化钙反响生成白色积淀,而氢氧化钠与氯化钡或氯化钙不反响,没有明展现象。

初三化学专题复习一NaOH、Ca(OH):变质问【探究1: NaOH变质问题】氢氣化钠没密封保存会因吸收空气中的二氧化碳,生成碳酸钠而变质o 2NaOH+CO2===Na2CO3+H2O.一、氢氧化钠的变质存在这样三种情况(猜想〉:(1)没冇变质:(成分NaOH)(2)部分变质:(成分NaOH和Na2CO3)(3)完全变质:(成分Na2CO3)二、证明变质:(取样——-加试剂——说操作一- 描现象一-I、•结论)检验是否有碳酸钠有三种不同的方法:(1)加入盐酸冇气泡冒出:2HC1 + Na2CO3=2NaCl+ H20+C02 t(2)加入石灰水有沉淀产生:Ca(OH)2 + Na2CO3 = CaCO3 I +2NaOH(3)加入氯化钙有沉淀产生:Na2CO3 +CaC12= CaCO3 I +2NaCl取少许固体物质溶于水,配成溶液与试管中:可分别向其中滴加酸、碱、盐溶液中的一种。
【方法(1)]:取少许固体物质溶于水,配成溶液与试管中,向英中滴加稀盐酸或稀硫酸,如果产生气泡,说明己经变质。
原理:礁酸钠会与酸反应生成二氣化碳气体,而氯氧化钠与酸反应没冇明显现象。
Na2CO3+2HCl== 2NaCl+H2O+ C02 t ENaOH+HCl== NaCl+H2O3【方法(2)]:取少许固体物质溶于水,配成溶液与试管中,向英中滴加氢氧化做溶液或氢氧化钙溶液•如果产生白色沉淀,说明已经变质。
原理:碳酸钠会与氢氣化领或氢氣化钙反应生成白色沉淀,而氢氟化钠与氢氧化领或氢氣化钙不反应,没有明显现象。
Na2C03+Ba(0H)2== BaCO3 I + 2NaOH: NaOH+ Ba (OH)2【方法(3)]:取少许固体物质溶于水,配成溶液与试行中,向其中滴加氯化锁溶液或氯化钙溶液(或硝酸领等英他可溶性钙盐、顿盐溶液),如果产生白色沉淀,说明已经变质。
原理:碳酸钠会与氯化领或氯化钙反应生成白色沉淀,而氢氧化钠与氯化做或氯化钙不反应,没有明眾现象。


有关氢氧化钠变质的探究一、氢氧化钠变质的原因:1.氢氧化钠的吸水潮解现象属于物理变化,而与二氧化碳反响生成碳酸钠才是化学变化。
反响化学方程式为:2NaOH+CO2=Na2CO3+H2O。
所以氢氧化钠固体必须保存。
2.实验室盛放氢氧化钠溶液的试剂瓶不能用玻璃塞,而是用橡皮塞。
其原因是在常温下,氢氧化钠能与玻璃中的二氧化硅缓慢地发生反响,产物使瓶口与瓶塞黏合在一起,其反响化学方程式为:SiO2 + 2NaOH=X + H2O,试推断X的化学式为。
【常见陷阱】①氢氧化钠溶液敞口放置,溶液质量会减小。
注意:露置的氢氧化钠溶液既吸收空气中的水分,又吸收空气中的二氧化碳,造成溶液质量增加。
②盛放氢氧化钠溶液的试剂瓶用玻璃塞。
注意:常温下NaOH能与玻璃中的SiO2发生反响,使瓶口与瓶塞黏合在一起。
二、如何检验氢氧化钠变质:【分析】我们只要验证固体中是否含有碳酸钠就能知道氢氧化钠的变质情况。
但由于氢氧化钠和碳酸钠都是白色固体且都易溶于水,一般不通过物理方法进展鉴别。
【方法】1.加酸,如稀盐酸现象:有气泡产生。
Na2CO3+2HCl=2NaCl+H2O+CO2↑2.加碱,如Ca〔OH〕2溶液或者Ba〔OH〕2溶液现象:有白色沉淀产生。
Ca〔OH〕2+ Na2CO3=CaCO3↓+2NaOH; Ba〔OH〕2+ Na2CO3=BaCO3↓+2NaOH。
3.加盐,如CaCl2或者Ca〔NO3〕2溶液、BaCl2或者Ba〔NO3〕2溶液。
现象:有白色沉淀产生。
Na2CO3+ CaCl2 =CaCO3↓+2NaCl或者Na2CO3+ Ca〔NO3〕2 =CaCO3↓+2NaNO3;Na2CO3+ BaCl2 =BaCO3↓+2NaCl或者Na2CO3+ Ba〔NO3〕2 =BaCO3↓+2NaNO3。
【常见陷阱】①直接参加无色酚酞,观察到无色酚酞变红,就说氢氧化钠变质。
注意:碳酸钠溶液也是碱性的,也能使无色酚酞变红②滴加几滴稀盐酸,没有看到气泡,就说氢氧化钠没有变质注意:盐酸先与氢氧化钠反响,后与碳酸钠反响,少量的稀盐酸可能先与氢氧化钠反响了,所以看不到气泡。





人教版初中化学专题复习:氢氧化钠和氢氧化钙的变质探究说课稿一、教学背景和目标现在,我们将要进行一堂关于氢氧化钠和氢氧化钙的变质探究的化学课。
本节课我们的教学目标是:1.理解氢氧化钠和氢氧化钙的基本性质和化学结构;2.探究氢氧化钠和氢氧化钙的变质过程及其影响因素;3.提高学生的实验观察能力和实验设计能力。
二、教学内容和重点本节课的教学内容主要包括:1.氢氧化钠和氢氧化钙的基本性质和化学结构的介绍;2.氢氧化钠和氢氧化钙的变质过程;3.影响氢氧化钠和氢氧化钙变质的因素。
本节课的重点是氢氧化钠和氢氧化钙的变质过程及其影响因素。
三、教学准备和教学过程安排1. 教学准备为了进行本节课的教学,我们需要准备如下物品和设备:•实验室:–氢氧化钠溶液;–氢氧化钙溶液;–PH试纸;–温度计;–反应容器;–实验报告单等。
•教室:–讲台;–投影仪。
2. 教学过程安排本节课的教学过程安排如下:1.导入:通过提问引导学生回顾并讨论氢氧化钠和氢氧化钙的基本性质和化学结构。
2.知识讲解:通过投影仪展示图表和实验步骤,介绍氢氧化钠和氢氧化钙的变质过程。
3.实验操作:将实验装置搭建好,并把氢氧化钠溶液和氢氧化钙溶液倒入反应容器中,观察并记录变质过程中的变化。
4.实验数据分析:让学生根据实验结果进行数据分析,并讨论影响氢氧化钠和氢氧化钙变质的因素。
5.实验总结:引导学生总结实验过程中的经验和教训,并理解变质现象的原因。
6.作业布置:布置相关课后习题,以巩固学生的学习成果。
四、教学评价和反思本节课的教学评价主要包括以下方面:•学生对氢氧化钠和氢氧化钙的基本性质和化学结构的理解情况;•学生观察实验变质过程和数据分析的准确性;•学生实验能力和实验设计能力的提高。
通过对本节课的教学评价和反思,我们可以进一步完善和改进本单元的教学内容和教学方法,提高教学效果。
附:课程参考资料1.人教版初中化学教材;2.相关实验手册;3.相关网络资源。
有关氢氧化钠和氢氧化钙变质的探究
1.为了证明长期露置在空气中的氢氧化钠浓溶液已变质,某同学先取2 mL试样于试管中,然后进行如下实验,其中不能达到目的的是()
A.加入过量盐酸,观察现象
B.加入澄清石灰水,观察现象
C.加入氯化钡溶液,观察现象
D.通入适量CO2气体,观察现象
2.对一瓶已变质的NaOH溶液进行如下实验,其中实验方案能达到实验目的的是()
选项实验目的实验方案
A证明溶液中存在Na2CO3取样,滴加无色酚酞溶液
B除去溶液中的Na2CO3加入一定量的CaCl2溶液,然后过滤
C证明溶液部分变质取样,加入过量呈中性的BaCl2溶液,振荡后滴加无色酚酞溶液
D测溶液的pH用玻璃棒蘸取少许溶液涂在湿润的pH试纸上,与标准比色卡对比3.实验室有一瓶久置的氢氧化钠固体,实验员猜测该固体已变质,为验证其猜测,取少量该固体样品进行如图1所示实验。
图1
(1)上述实验中,A操作的名称是。
(2)“无色溶液”中溶质成分为(填化学式)。
(3)根据上述实验,推断固体样品中一定含有(填化学式)。
4.[2020·齐齐哈尔]某同学发现,上个月做实验用的氢氧化钠溶液忘记了盖瓶盖。
对于该溶液是否变质,同学们进行了以下探究:
提出问题
氢氧化钠溶液是否变质?变质程度如何?
作出猜想猜想一:氢氧化钠溶液未变质;
猜想二:氢氧化钠溶液完全变质;
猜想三:。
设计实验请完成实验报告。
实验步骤实验现象实验结论
①取少量溶液于试管中,加入,充分反应
猜想二成立②将步骤①试管中的物质过滤,向滤液中加入无明显现象
反思拓展
(1)氢氧化钠溶液变质的原因是(用化学方程式表示),氢氧化钠溶液应保存。
(2)分别取两份完全变质的氢氧化钠溶液样品于试管中,向其中一份加入盐酸后有气泡产生,另一份加入氢氧化钙溶液后有白色沉淀产生,然后将两支试管中所有物质一起倒入废液缸中,得到无色澄清溶液,所得溶液中溶质一定有。
图2
5.实验室中一瓶久置的氢氧化钠溶液可能发生了变质(若发生变质,变质的结果是生成了Na2CO3),现在对该瓶氢氧化钠溶液进行分析检测。
猜测溶质
猜测一:溶液中溶质只有NaOH;
猜测二:溶液中溶质只有Na2CO3;
猜测三:溶液中溶质。
查阅资料
①某溶液能使无色酚酞变红,则该溶液可能是碱溶液或其他碱性溶液。
②Na2CO3溶液能使pH试纸变蓝,BaCl2溶液不能使pH试纸变色。
实验设计
实验方案一:
待检测溶液变红白色沉淀
实验方案二:
实验结论
根据实验方案一,你得出的结论是:溶液中的溶质一定有,可排除猜测。
根据实验方案二,你认为该瓶溶液中的溶质是。
讨论
(1)实验方案一不能准确确定溶质中一定含有NaOH的原因是。
(2)实验室为防止NaOH溶液变质,你的措施是(答一点即可)。
6.小娟同学发现,上次做化学实验用的氢氧化钠溶液忘记了盖瓶塞。
为确定该溶液是否变质,小娟和同学进行了如下探究活动。
提出问题
该瓶氢氧化钠溶液是否变质及变质的程度?
查阅资料氯化钡溶液呈中性。
猜想
①该溶液没有变质;
②该溶液全部变质;
③该溶液部分变质。
进行实验
小娟和同学按如图3所示方案进行了实验。
图3
问题讨论
(1)操作Ⅰ的名称是。
(2)写出产生白色沉淀的反应的化学方程式:。
由此现象可得出:猜想(填序号)错误。
(3)结合操作Ⅰ和Ⅰ,若“现象X”是溶液不变色,则猜想(填序号)正确;若“现象X”是,则猜想③正确。
拓展应用
(1)小娟和同学通过以上实验探究得出,实验室保存氢氧化钠溶液的方法是。
(2)如果氢氧化钠溶液中混有少量碳酸钠杂质,常加入适量(填“BaCl2”或“Ba(OH)2”)除去。
7.化学兴趣小组的同学在帮助老师整理实验室时,意外地发现实验桌上有一瓶敞口放置的氢氧化钙粉末,于是对该粉末进行了如下探究。
提出问题该瓶粉末的成分是什么?
猜想与假设猜想一:该瓶粉末的成分可能为氢氧化钙;
猜想二:该瓶粉末的成分可能为氢氧化钙和碳酸钙;
猜想三:该瓶粉末的成分可能为。
作出猜想三的理由是。
实验验证请你参与探究,完成下面的实验报告。
实验步骤实验现象实验结论
(1)取少量样品于小烧杯中,加入适量水,充分搅
拌,过滤,取少量滤渣于试管中,加入有大量气泡产生说明含有
猜想二正确
(2)取步骤(1)中的于试管中,滴加无色
酚酞溶液
说明含有
联想与启示
氢氧化钙露置在空气中会发生变质的原因是
(用化学方程式表示),因此,必须保存。
8.在化学兴趣小组活动中,小山把一个标有“生石灰干燥剂”的小纸袋带到学校进行实验。
(1)干燥剂是否变质?小山设计并进行了如下实验,请你帮他完成实验报告。
实验步骤实验现象结论
①
干燥剂中含有CaO ②取少量用样品制得的
溶液于试管中,滴入几滴酚酞溶液
干燥剂中含有Ca(OH)2,干燥剂部分变质
(2)既然干燥剂中已有CaO和Ca(OH)2,小山又猜想还可能有另一种物质生成,原因是(用化学方程式表示)。
请你设计实验证明小山的猜想(简要写出实验步骤、现象及结论):,其化学方程式为。
(3)小西认为步骤②不严谨,理由是。
答案
1.D
2.C
3.(1)过滤
(2)NaOH、NaCl、CaCl2
(3)NaOH、Na2CO3
4.作出猜想氢氧化钠溶液部分变质
设计实验①足量(或过量)氯化钙溶液(或氯化钡等,合理即可)产生白色沉淀(或产生白色浑浊)②酚酞溶液(或可溶性铜盐、铁盐溶液等,合理即可)
反思拓展(1)2NaOH+CO2Na2CO3+H2O密封
(2)氯化钙、氯化钠(或CaCl2、NaCl)
5.猜测溶质既有NaOH,又有Na2CO3
实验结论Na2CO3一NaOH和Na2CO3
讨论(1)Na2CO3溶液显碱性,也能使无色酚酞变红(2)密封保存(或现配现用)
6.问题讨论(1)过滤
(2)Na2CO3+BaCl2BaCO3↓+2NaCl①
(3)②溶液变红
拓展应用(1)密封保存(2)Ba(OH)2
7.猜想与假设碳酸钙氢氧化钙可能完全变质
实验验证(1)稀盐酸碳酸钙(2)滤液溶液变红氢氧化钙
联想与启示Ca(OH)2+CO2CaCO3↓+H2O密封
8.(1)①取少量样品于试管中,加水,用手触摸试管外壁试管外壁发热
②溶液变红
(2)Ca(OH)2+CO2CaCO3↓+H2O取少量样品于试管中,滴加足量稀盐酸,若有气泡产生,则有碳酸钙CaCO3+2HCl CaCl2+H2O+CO2↑
(3)Ca(OH)2也可能是未变质的CaO和水反应生成的。