福林酚法测蛋白浓度
- 格式:pdf
- 大小:108.90 KB
- 文档页数:1

folin酚法测定蛋白质含量Folin-酚法是一种测定蛋白质含量的经典方法,其历史可以追溯到1948年。
此方法的基本原理是酚类物质在碱性条件下与蛋白质反应,生成一种深蓝色的复合物,该复合物在760nm处的吸光度与蛋白质浓度成正比,因此可以通过测定吸光度来计算蛋白质浓度。
以下是Folin-酚法测定蛋白质含量的详细步骤:一、实验准备1.实验材料:o待测样品(蛋白质溶液)o Na2CO3o NaHCO3o硫酸铜o酒石酸钾钠o氯仿o无水乙醇o磷酸二氢钾o氢氧化钠2.实验设备:o分光光度计o研钵或电动搅拌器o漏斗和滤纸o玻璃试管和试管架o移液管o搅拌棒二、实验步骤3.准备Folin-酚试剂:将10g的酒石酸钾钠与50g的Na2CO3、NaHCO3混合在研钵中,充分研磨后转移至烧杯中,加入80ml的蒸馏水,搅拌至溶解。
将溶液煮沸并保持1分钟,然后冷却至室温。
将混合物转移至1L容量瓶中,用蒸馏水定容至1L。
4.取1ml待测蛋白质溶液(约0.01-1mg蛋白质)加入到试管中。
5.向试管中加入5ml Folin-酚试剂,混匀。
6.将混合物在室温下保持30分钟,期间不时搅拌。
7.在760nm波长下,用分光光度计测定混合物的吸光度。
为了获得更准确的结果,可以以蒸馏水为空白对照调零。
8.根据标准曲线计算蛋白质浓度。
可以通过绘制已知蛋白质浓度与其对应的吸光度的曲线图来制作标准曲线。
根据待测样品的吸光度,可以在曲线上找到对应的蛋白质浓度。
9.根据需要,可以进一步计算蛋白质的含量(mg/mL或mg/g)。
三、注意事项和局限性1.Folin-酚法对碱性环境非常敏感,如果在试剂准备和混合过程中出现不慎或操作不当,可能会影响到最终的测定结果。
因此,操作者需要熟练和准确的掌握该方法的操作步骤。
2.本方法不适用于测定含有大量酚类物质或还原性物质的样品,这些物质可能会干扰蛋白质与Folin-酚试剂的反应,导致结果偏差。
3.一些蛋白质的氨基酸序列中含有酪氨酸或色氨酸残基,这些残基可以与Folin-酚试剂反应生成蓝色化合物,导致吸光度偏高,最终结果可能偏高也可能偏低。

蛋白质含量测定方法——Folin—酚试剂法Folin—酚试剂法是一种常用的蛋白质定量方法,其原理是蛋白质分子中酪氨酸和半胱氨酸残基在Folin试剂存在下氧化成碘,与酚试剂结合形成一种蓝色复合物。
由于蛋白质的量与Folin 试剂呈正比,因此可以通过比色法测定蛋白质含量。
步骤:1. 准备一系列浓度的标准蛋白质溶液(从低到高),并设置空白对照。
2. 取一定量的Folin试剂和样品混合,充分摇匀后静置2-3分钟。
3. 用酚试剂对样品进行稀释,制备出一系列浓度的标准样品。
4. 对比观察各标准样品的颜色变化,找到蛋白质浓度和颜色的对应关系。
5. 绘制标准曲线,再用于样品蛋白质的测定。
6. 根据样品中剩余的Folin试剂颜色,求出样品中的蛋白质含量。
注意事项:1. 必须严格控制反应温度和时间,以免影响测定的准确度。
2. 在加入Folin试剂后,需要摇动几次以确保充分反应。
3. 如果要测定的样品含有维生素C或其他具有抗氧化性质的物质,需要事先进行去除或中和。
4. 对于浓度过高的样品,建议先进行稀释再进行测定。
在实践中,除了遵循以上步骤,还可以参考以下技巧和经验:* 使用干净的玻璃器具来操作,避免使用塑料器具导致的颜色干扰。
* 在加入Folin试剂后,可以加入少量无水乙醇来稳定颜色反应。
* 在绘制标准曲线时,可以使用不同浓度的标准蛋白质溶液制备一系列梯度样品,这样可以更准确地找到蛋白质浓度和颜色的对应关系。
* 对于未知样品,可以先进行预实验,大致确定蛋白质浓度范围,以便更好地控制实验进程。
总之,Folin—酚试剂法是一种简便、灵敏的蛋白质定量方法,通过遵循正确的步骤和注意事项,可以获得较为准确的测定结果。




生化实验报告福林-酚试剂法测定蛋白质的浓度实验目的:利用福林-酚试剂法测定蛋白质的浓度。
实验原理:福林-酚试剂法是一种常用的蛋白质定量方法。
该方法利用在碱性条件下,蛋白质和福林-酚试剂在高温下反应生成可溶性淡红色复合物,其最大吸收峰位于560 nm。
该复合物的吸光度与蛋白质的浓度呈线性关系,可以通过比较不同浓度蛋白质标准溶液的吸光度来测定待测蛋白质的浓度。
实验步骤:1. 准备蛋白质标准溶液:称取不同浓度的蛋白质标准溶液(如1 mg/mL、2 mg/mL、4 mg/mL等)分别加入福林-酚试剂,使得最终浓度为0.2 mg/mL,并用称重瓶搅拌均匀。
2. 制备待测蛋白质样品:将待测蛋白质样品溶解在适量的缓冲液中,使其浓度在标准曲线的线性范围内。
3. 加入福林-酚试剂:取相同体积的蛋白质标准溶液和待测蛋白质样品分别加入福林-酚试剂,并用试管架将其放入预热至60°C的水浴中反应15分钟。
4. 冷却:将试管从水浴中取出,放置到冰水中冷却至室温。
5. 测定吸光度:使用分光光度计将各个标准溶液和待测样品的吸光度分别置于560 nm处测量。
6. 建立标准曲线:依次将标准溶液的吸光度值绘制于纵轴,浓度值绘制于横轴,得到标准曲线。
7. 测定样品浓度:根据待测样品的吸光度值和标准曲线,确定其蛋白质浓度。
实验注意事项:1. 确保福林-酚试剂无色,否则应更换新的试剂。
2. 需要在60°C的水浴或恒温器中对试剂进行反应,确保反应温度稳定。
3. 温度过高或过低都会影响测定的准确性,应控制好试管在水浴中的时间。
4. 标准曲线的制备需要使用不同浓度的标准溶液,并且至少应包含一组空白对照组。
5. 测定待测样品时,应确保其在线性范围内,并尽量重复测定。
实验结果:根据实验步骤中的吸光度测定值和标准曲线的关系,可以得到样品中蛋白质的浓度。
实验结论:利用福林-酚试剂法可以测定蛋白质的浓度。
该方法简单、快速、灵敏度高,适用于常规蛋白质浓度的测定。

蛋白质浓度测定——Folin-酚测定一)实验目的:熟悉并掌握福林-酚法测定蛋白质浓度的原理和方法。
二)实验原理:蛋白质(或多肽)分子中含有酪氨酸或色氨酸,能与Folin-酚试剂起氧化还原反应,生成蓝色化合物,蓝色的深浅与蛋白质浓度成正比,可用比色法测定蛋白质浓度。
三)实验器材试剂:1、标准酪蛋白:200ug/ml2、Folin-酚乙试剂:乙液:原液:水=1:1:13、Folin-酚甲液:4%Na2CO3:0.2mol/lNaOH=1:1 A1%CuSO4:2%酒石酸钾钠=1:1 BA:B=50:1 混匀4、血清:稀释200倍5、分光光度计试管(9支)吸管0.5ml(1支)、1ml(3支)四)实验操作:1、标准曲线的绘制将9支干净的试管编号,按下表所示顺序加入试剂并操作。
表1 Folin-酚法测定酪氨酸浓度试剂管号 1 2 3 4 5 6 A B C酪氨酸0 0.2 0.4 0.6 0.8 1.0 0 0 0 血清0 0 0 0 0 0 0.2 0.2 0.2 蒸馏水 1.0 0.8 0.6 0.4 0.2 0 0.8 0.8 0.8 分别加入5ml,混匀后放入30℃水中水浴10minFolin-甲Folin-分别加入0.5ml,混匀后放入30℃水中水浴30min乙640nm 0 0.085 0.163 0.223 0.287 0.349 0.216 0.224 0.2122、样液测定将9支试管分别放于分光光度计中测定其吸光度,对照标准曲线求出样液蛋白质浓度。
五)实验结果:1、不同浓度酪氨酸与样液的吸光度表2 不同浓度酪氨酸与样液的吸光度管号 1 2 3 4 5 6 A B C0 0.085 0.163 0.223 0.287 0.349 0.216 0.224 0.212吸光度2、标准蛋白分度曲线:六)结果分析:1、数据分析:最终所得数据与酪氨酸浓度大致呈一正比的关系,血清的吸光度有着一定的波动,但波动不大,些许误差可能是因系统存在误差。


蛋白质的定量测定――福林酚法(Folin―酚试剂法)实验原理Folin—酚试剂法最早是由Lowry确定的测定蛋白质浓度的基本方法。
以后在生物化学领域得到广泛的应用。
此法的显色原理与双缩脲方法是相同的,只是加入了第二种试剂,即Folin—酚试剂,以增加显色量,从而提高了检测蛋白质的灵敏度。
这个方法的优点是灵敏度高,比双缩脲法灵敏得多,缺点是费时较长,要严格控制操作时间,标准曲线也不是严格的直线形式,且专一性较差,干扰物质较多。
凡干扰双缩脲反应的基团,如 -CO-NH2, -CH2-NH2, CS-NH2以及Tris缓冲液、蔗糖、硫酸铵、巯基化合物均可干扰Folin—酚反应,而且对后者的影响还要大得多。
此外,酚类、柠檬酸对此反应也有干扰作用。
Folin—酚试剂由甲试剂和乙试剂组成。
甲试剂由碳酸钠,氢氧化钠,硫酸铜及酒石酸钾钠组成。
蛋白质中的肽键在碱性条件下,与酒石酸钾钠铜盐溶液起作用,生成紫红色络合物。
乙试剂是由磷钼酸和磷钨酸、硫酸、溴等组成。
此试剂在碱性条件下,易被蛋白质中酪氨酸的酚基还原呈蓝色反应,其色泽深浅与蛋白质含量成正比。
此法也适用于测定酪氨酸和色氨酸的含量。
本法可测定范围是25—250μg蛋白质。
试剂和器材一、试剂Folin—酚试剂:试剂甲:1) 4%碳酸钠溶液2) 0.2mol/L氢氧化钠溶液3) 1%硫酸铜溶液4) 2%酒石酸钾钠溶液。
临用前将(1)与(2)等体积配制碳酸钠—氢氧化钠溶液。
(3)与(4)等体积配制成硫酸铜—酒石酸钾钠溶液。
然后这两种试剂按50:1的比例配合,即成Folin—酚试剂甲。
此试剂临用前配制,一天内有效。
试剂乙:称钨酸钠(Na2WO2?2H2O)100g,钼酸钠(Na2MoO4?2H2O)25g置2000mL磨口回流装置内,加蒸馏水700mL,85%磷酸50mL和浓硫酸100mL。
充分混匀,使其溶解。
小火加热,回流10h(烧瓶内加小玻璃珠数颗,以防溶液溢出),再加入硫酸锂(LiSO4)150g,蒸馏水50mL及液溴数滴。

实验三:福林(Folin)-酚试剂法测定蛋白质的浓度一、实验目的1.学会制备无蛋白血滤液。
2.掌握Folin-Wu法测定血糖含量的原理和方法。
3.掌握7200型可见分光光度计的使用方法。
二,实验原理蛋白质或多肽分子中有带酚基酪氨酸或色氨酸,在碱性条件下,可使酚试剂中的磷钼酸化合物还原成蓝色(生成钼蓝和钨蓝化合物)。
蓝色的深浅与蛋白质的含量成正比,可用比色法测定。
三.实验仪器1.试管2.移液管3.卵清蛋白片4.7220分光光度计四.实验试剂1、碱性硫酸铜溶液A液:无水碳酸钠35g,酒石酸钠13g及碳酸氢钠11g溶于蒸馏水,稀释定容至1000ml.B液:硫酸铜晶体5g,溶于蒸馏水并定容至100ml。
临用时,A液:B液=9:1混合(体积比),混合液于冰箱中保存(4℃)。
2、标准葡萄糖溶液(0.1mg/ml)(1)1%葡萄糖母液:称取1.000g葡萄糖,溶于蒸馏水,稀释并定容至100ml。
(2)葡萄糖标准液:取1.0ml葡萄糖母液于100ml容量瓶中,加蒸馏水定容。
3、10%钨酸钠溶液:称取钨酸钠10g,溶于蒸馏水并定容至100毫升。
4、0.33mol/LH2SO4溶液:于53ml蒸馏水中加入1ml的浓硫酸。
五.实验步骤1、无蛋白血滤液的制备:用奥氏吸管吸取全血(已加抗凝剂)1ml,缓缓放入100ml锥形瓶中,加蒸馏水7ml,摇匀,溶血后(血液变为红色透明)加10%钨酸钠1ml,摇匀.。
再加0.33mol/L H2SO41ml,边加边摇,加毕充分摇匀,放置5~15分钟,至沉淀变为暗棕色(如不变色可再加0.33mol/L H2SO41-2滴)。
用干滤纸过滤。
先倾入少许,待滤纸湿润后在全部倒入,如滤液不清需重新过滤。
每毫升无蛋白血滤液相当于1/10ml全血。
2、血糖的定量测定:取25ml的血糖管3支,编号。
第一支血糖管中加入2ml蒸馏水(空白管);第二支血糖管中加2ml标准葡萄糖液;用吸管吸取无蛋白血滤液2ml,放入第三支血糖管中。
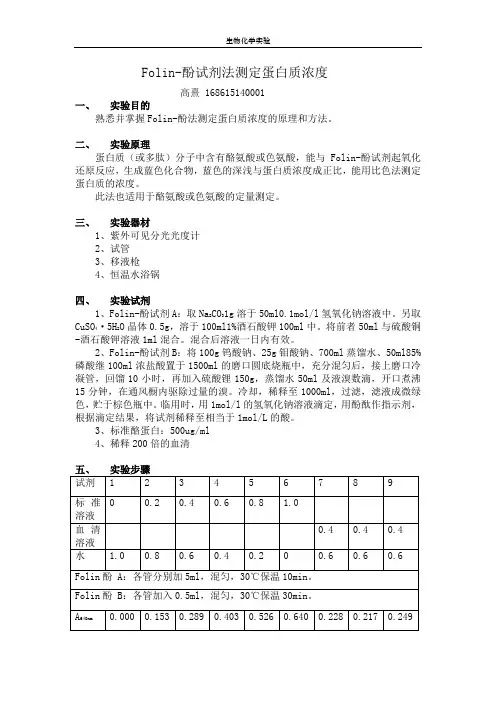
Folin-酚试剂法测定蛋白质浓度高熹 168615140001一、实验目的熟悉并掌握Folin-酚法测定蛋白质浓度的原理和方法。
二、实验原理蛋白质(或多肽)分子中含有酪氨酸或色氨酸,能与Folin-酚试剂起氧化还原反应,生成蓝色化合物,蓝色的深浅与蛋白质浓度成正比,能用比色法测定蛋白质的浓度。
此法也适用于酪氨酸或色氨酸的定量测定。
三、实验器材1、紫外可见分光光度计2、试管3、移液枪4、恒温水浴锅四、实验试剂1、Folin-酚试剂A:取Na2CO31g溶于50ml0.1mol/l氢氧化钠溶液中。
另取CuSO4·5H2O晶体0.5g,溶于100ml1%酒石酸钾100ml中。
将前者50ml与硫酸铜-酒石酸钾溶液1ml混合。
混合后溶液一日内有效。
2、Folin-酚试剂B:将100g钨酸钠、25g钼酸钠、700ml蒸馏水、50ml85%磷酸继100ml浓盐酸置于1500ml的磨口圆底烧瓶中,充分混匀后,接上磨口冷凝管,回馏10小时,再加入硫酸锂150g,蒸馏水50ml及液溴数滴,开口煮沸15分钟,在通风橱内驱除过量的溴。
冷却,稀释至1000ml,过滤,滤液成微绿色,贮于棕色瓶中。
临用时,用1mol/l的氢氧化钠溶液滴定,用酚酞作指示剂,根据滴定结果,将试剂稀释至相当于1mol/L的酸。
3、标准酪蛋白:500ug/ml4、稀释200倍的血清六、结果分析对1-6号进行线性回归分析,作图如下:三组样品的测量值分别为0.228、0.217和0.249,由于0.249偏差过大,则取0.228与0.217的平均0.223,则y=0.223时,x=0.323,即0.4ml稀释200倍的血清溶液中蛋白含量与0.323ml的500ug/ml标准酪蛋白相等。
则血清中蛋白含量为:500*0.323/0.4*200ug/ml=80750ug/ml。
七、实验反思第三组样品测量值偏差过大,考虑为未完全摇匀,以后实验要注意操作步骤及操作规范。
蛋白质浓度测定(Folin-酚法)
实验目的:
熟悉并掌握福林-酚法测定蛋白质浓度的原理和方法。
实验原理:
蛋白质(或多肽)分子中含有酪氨酸或色氨酸,能与Folin-酚试剂起氧化还原反应,生成蓝色化合物,蓝色的深浅与蛋白质浓度成正比,可用比色法测定蛋白质浓度。
实验器材:
样品血清(稀释200倍)
标准酪蛋白溶液(200ug/ml)
Folin-酚甲液:
A 4%Na2CO3:0.2mol/lNaOH=1:1
B 1%CuSO4:2%酒石酸钾钠=1:1
A:B=50:1 混匀
Folin-酚乙液
可见分光光度计、试管(9支)、移液枪、移液管、烧杯、希尔球。
实验步骤:
1、将九支试管洗净晾干并标号,按照下表内容依次按顺序加入试剂。
2、用可见分光光度计以1号试管溶液为空白测量九个试管溶液在640nm处的吸
光度。
3、以蛋白浓度为横坐标,吸光度为纵坐标绘制标准曲线。
4、由样品吸光度在标准曲线中找出样品浓度。
实验结果:
标准曲线:
样品平均吸光度=0.286
由标准曲线得酪蛋白样品浓度为107.04ug/ml
总结分析:
从实验结果数据分析,本次实验结果并不理想,主要问题为标准曲线线性关系不好,部分数据偏离较大,血清样品的三组平行也存在较大方差。
由实验结果可以看出,应该是溶液配制出现问题导致标准曲线线性关系较差。
经分析应该为添加试剂时移液枪操作不当导致配得溶液浓度不准,移液枪活塞有卡顿现象,添加试剂时可能会未按到底导致试剂添加量不准。
福林-酚法的原理该方法是双缩脲法的发展,包括两步反应:(1)在碱性条件下,蛋白质与铜作用生成蛋白质—铜络合物。
(2)此络合物将试剂磷钼酸—磷钨酸(FolIn试剂)还原,混合物深蓝色(磷钼蓝和磷钨蓝混合物),颜色深浅与蛋白质含量成正比。
此方法操作简便,灵敏度比双缩脲法高100倍,定量范围为5~100μg蛋白质。
FolIn试剂显色反应由酪氨酸、色氨酸、半胱氨酸引起,因此样品中若含有酚类、柠檬酸和巯基化合物,均有干扰作用。
此方法的缺点是有蛋白质的特异性影响,即不同蛋白质因络氨酸、色氨酸含量的不同而使显色强度稍有不同,标准曲线也不是严格的直线形式。
【仪器与用具】试管若干;刻度移液管05Ml 1支,1Ml 1支,10Ml 1支;定量加样器;圆底烧瓶;冷凝管1套(带橡胶管);微量滴定管;小烧杯;微量进样器50μl 1支;721分光光度计;恒温水浴器;研钵;玻棒;离心机;离心管。
【试剂】NA2WO4·2H2O;NA2MoO4·2H2O;85%H3PO4;浓HCl;LI2SO4·H2O;溴水;酚酞指示剂;NA2CO3;NAOH;CuSO4·5H2O;酒石酸钾钠;牛血清白蛋白。
所用试剂均为化学纯或分析纯。
【方法】1试剂的配制(1)碱性铜试剂(相当于双缩脲试剂)的制备首先配制A液:4%碳酸钠(NA2CO3)溶液与0.2Mol/L氢氧化钠(NAOH)溶液等比例混合(2%NA2CO3,01Mol NAOH);B液:1%硫酸铜(CuSO4·5H2O)溶液与2%酒石酸钾钠溶液等比例混合(0.5%CuSO4·5H2O,0.1%酒石酸钾钠)。
在使用前将A液与B液按50∶1的比例混合即成。
此为FolIn—酚试剂甲液,此试剂只能使用1天。
酚试剂(相当于FolIn试剂)的配备:称取钨酸钠(NA2WO4·2H2O)100g、钼酸钠(NA2MoO4·2H2O)25g,加蒸馏水700Ml溶解于1500Ml 的圆底烧瓶中。
1. 理解福林酚法测定蛋白质浓度的原理。
2. 掌握福林酚试剂的配制方法。
3. 学习使用分光光度计进行蛋白质定量分析。
4. 通过实验,提高实验操作技能和数据分析能力。
二、实验原理福林酚法是一种常用的蛋白质定量分析方法。
其原理基于蛋白质中的酪氨酸和色氨酸在碱性条件下与福林酚试剂反应,生成蓝色的复合物。
该复合物的颜色深浅与蛋白质的浓度成正比,通过比色法可以测定蛋白质的浓度。
三、实验材料1. 标准蛋白质溶液(已知浓度)2. 待测蛋白质溶液3. 福林酚试剂4. 碱性铜试剂5. 0.1mol/L NaOH溶液6. 0.85mol/L H2SO4溶液7. 10% TCA溶液8. 1%牛血清白蛋白溶液9. 7200型可见分光光度计10. 移液器11. 试管12. 烧杯13. 移液管14. 实验记录表格1. 福林酚试剂的配制a. 称取10g钨酸钠、2.5g钼酸钠,加入70ml蒸馏水。
b. 加入5ml 85%磷酸和10ml浓盐酸,充分混匀。
c. 将混合溶液转移至150ml磨口圆底烧瓶中,接上磨口冷凝管,回馏1小时。
d. 加入15g硫酸锂和5ml蒸馏水,混匀。
2. 蛋白质样品的处理a. 取0.1ml标准蛋白质溶液,加入1.9ml 0.1mol/L NaOH溶液,混匀。
b. 取0.1ml待测蛋白质溶液,加入1.9ml 0.1mol/L NaOH溶液,混匀。
c. 将混合溶液转移至试管中,加入0.5ml福林酚试剂,混匀。
d. 室温下放置5分钟。
3. 碱性铜试剂的加入a. 取0.5ml碱性铜试剂,加入上述混合溶液中,混匀。
b. 室温下放置10分钟。
4. 比色测定a. 使用7200型可见分光光度计,在660nm波长下,测定样品的吸光度。
b. 以1%牛血清白蛋白溶液为空白对照,进行校正。
5. 结果计算a. 根据标准蛋白质溶液的吸光度,绘制标准曲线。
b. 根据待测蛋白质溶液的吸光度,从标准曲线上查得蛋白质浓度。
五、实验结果与分析1. 标准曲线的绘制:以标准蛋白质溶液的浓度为横坐标,吸光度为纵坐标,绘制标准曲线。
folin酚试剂法测定蛋白浓度实验报告一、实验目的蛋白质是生命活动的主要承担者,其含量的测定在生物化学、临床医学、食品科学等领域具有重要意义。
本实验旨在掌握 Folin 酚试剂法测定蛋白质浓度的原理和操作方法,并通过实验数据计算样品中的蛋白质浓度。
二、实验原理Folin 酚试剂法是利用蛋白质中的酪氨酸和色氨酸残基能还原 Folin 酚试剂(磷钼酸磷钨酸),生成蓝色化合物的原理来测定蛋白质的浓度。
该蓝色化合物在一定条件下的吸光度与蛋白质浓度成正比,通过测定吸光度并绘制标准曲线,即可计算出样品中蛋白质的浓度。
三、实验材料与仪器1、实验材料(1)标准蛋白质溶液:牛血清白蛋白(BSA),浓度为 1mg/mL。
(2)样品溶液:待测定蛋白质浓度的溶液。
(3)Folin 酚试剂甲液:由碳酸钠、氢氧化钠、硫酸铜和酒石酸钾钠组成。
(4)Folin 酚试剂乙液:由磷钼酸、磷钨酸和蒸馏水组成。
2、实验仪器(1)分光光度计(2)移液器(3)容量瓶(4)试管(5)恒温水浴锅四、实验步骤1、标准曲线的绘制(1)取 6 支干净的试管,分别编号为 0、1、2、3、4、5。
(2)按表 1 向各试管中加入标准蛋白质溶液和蒸馏水。
表 1 标准曲线绘制的加样量|试管编号| 0 | 1 | 2 | 3 | 4 | 5 ||||||||||标准蛋白质溶液(mL)| 0 | 02 | 04 | 06 | 08 | 10 ||蒸馏水(mL)| 10 | 08 | 06 | 04 | 02 | 0 |(3)向各试管中加入 5mL Folin 酚试剂甲液,摇匀,于室温下放置10 分钟。
(4)再向各试管中加入 05mL Folin 酚试剂乙液,立即摇匀,于 50℃恒温水浴锅中保温 30 分钟。
(5)以 0 号试管为空白对照,在分光光度计上于 650nm 波长处测定各试管溶液的吸光度(A)。
(6)以蛋白质浓度(μg/mL)为横坐标,吸光度(A)为纵坐标,绘制标准曲线。
YYSWDB0090 蛋白质含量测定福林酚法
YY-SW-DB-0090 蛋白质福林-酚法
1. 范围 本方法采用蛋白质与福林 本方法适用于各类蛋白质2.0毫克的氮酚试剂phenol reagent铜复合物磷钨酸还原成蓝色复合物蓝色强度与蛋白质量成正比250mL-1但其缺点也很明显
干扰物质多蔗糖巯基化物柠檬酸等标准曲线的直线关系不特别严格
3.试剂 碳酸钠,氢氧化钠,酒石酸钾钠,硫酸铜5H2ONa2W04,钼酸钠(Na2Mo04
4.仪器 72型分光光度计
1OgNa
2CO3或钠盐或钾盐
0.5gCuSO4每次使用前将两溶液以A:B此为试剂甲
在1.5升的磨口回流瓶中加入10Og钨酸钠2H2O25g钼酸钠(Na2Mo04
再加5OmL 85l00mL浓盐酸接上回流冷凝管以小火回流
10小时50mL蒸馏水及数滴液体溴
冷却后溶液呈黄色须再重复滴加液体溴的步骤将溶液稀
稀至1升滤液置棕色瓶中保存以酚酞为指示剂
约加1倍水使最终的酸浓度为1mol 5.3 标准蛋白质溶液浓度为250mL-1取动物血清
6.操作步骤 6.1 按下表顺序加入各试剂 试管编号 1 2 3 4 5 6 7 8 9 蛋白质含量gmLmLmL室温下放置10分钟
试剂乙L-1
立即混匀
然后利用未知样品的光密度值
8.说明
8.1 比色测定时的波长可选65Onm或660nm100可选用75Onm
若在125
9.参考文献
1 李如亮 主编. 生物化学实验. 武汉1998. 37-58
2 张龙翔等 主编. 生化实验方法和技术. 北京1997. 136-144
3 李建武等 合编. 生物化学实验原理和方法. 北京1994. 150-174 。
87...“It is flattering to be ‘most cited author,’but I am afraid it does not signify great scientific accomplishment. The truth is that I have written a fair number of methods papers, or at least papers with new methods included. Although method development is usually a pretty pedestrian affair, others doing more creative work have to use methods and feel constrained to give credit for same 1.... Nevertheless, although I really know it is not a great paper (I am much better pleased with a lot of others from our lab), I secretly get a kick out of the response....“Perhaps you would be interested in a little about the history of the method. Back in 1922, Wu, who worked with Folin,applied the reagent to proteins, without CU 2+, so it was based on the tyrosine and tryptophane contents of the protein. This procedure was used sporadically for some time and had a reputation for erratic results,probably because traces of contaminating CU 2+ would increase the readings. Herriot, in a 1935 footnote to another paper,mentioned that CU 2+ enhanced readings with protein, and in 1941 published a short communication describing the CU 2+enhancing effect for 7 proteins, and giving convincing evidence that the enhancement was attributable to reaction with peptide bonds.“Before I came to St. Louis we had need of a micro method for protein, studied thereaction some more, and came up with a revised procedure which we felt was an improvement, particularly in regard toapplication to a variety of situations.Actually, however, we had made few fundamental changes from the method of Herriot, and had never really intended to publish it.“When I came to St. Louis in 1947 EarlSutherland, who was here then, adopted our procedure, but for several years complained that he had to cite it as ‘personal communication,’ and, he inquired, why didn’t we write it up? So we finally went to work and did the necessary things: studied the reaction more thoroughly, tested it a lot of ways,described its virtues and disadvantages,compared the results with a Kjeldahl procedure, investigated what interfered, etc.“This was a lot of work and the three co-authors helped in various ways. The greatest help was from Miss Nira Rosebrough (now Mrs. Nira R. Roberts) who became one of the best technicians I have ever had. She left us in 1957, worked for awhile with Dr. Rosen in Buffalo, and then quit science to raise a family. Dr. A. Lewis Farr (M.D.) was a post-doctoral student who had an outstanding record in medical school but decided after a year or so to go into private practice in his hometown in Greenville, Mississippi. Mrs.Randall was a technician who stayed at most a year, then left with her husband, and I don’t believe has been in science since, but I have lost track of her.“I...am puzzled why the paper is so often cited, and cited as such. I would like to think it is partly because we studied it pretty thoroughly and it is still applicable in most cases without modification, whereas the original Kjeldahl method, for example, has had innumerable major modifications and microfications, and people cite the particular modification they use. Another reason why our method isn’t simply referred to by name is that it’s quite a mouthful to say ‘Lowry,Rosebrough, Farr, and Randall.’ The method apparently filled a need in the beginning—and a lot of people measure proteins in their work.Once it became established by people like Sutherland and Kornberg, other people may have thought it was the method to use, or at least checked the procedure they were using against it.”21.Lowry O H. Personal communication to D.J.D. Price, November 11, 1969.2.Lowry O H. Personal communication to E. Garfield, August 5, 1976....The authors assert that the use of the Folin phenol reagent for the measurement of proteins “has not found great favor for general biochemical purposes.” This study is concerned with modifying the Folin phenol reagent procedure by treating protein solutions “with copper in alkali.” By recording the color change after the copper treatment, and measuring the quantity of protein present with a Beckman spectrophotometer, the authors determined that “measurement of protein with copper and the Folin reagent” is more sensitive and simpler than other procedures.Professor Oliver H. Lowry:Number 1January 3, 1977Citation ClassicsLowry O H, Rosebrough N J, Farr A L & Randall R J. Protein measurement with the Folin phenol reagent. J. Biol. Chem. 193:265, 1951.。