参考区间确定资料
- 格式:docx
- 大小:31.82 KB
- 文档页数:6

临床实验室检验项目参考区间的制定.
临床实验室检验项目参考区间是评价检测结果是否正常的重要指标,是确保检验结果准确性和临床诊断正确性的基础。
参考区间的制定是指确定一个特定检验项目的正常值范围,使得该数值在区间内的个体被认为是正常的。
参考区间的制定需要涉及到多个因素,包括年龄、性别、种族、地区和生理状态的影响等。
因此,参考区间制定需要根据人群特征进行分类,以便比较各组间的结果。
一般情况下,参考区间是根据健康个体群体值的统计分布来确定的。
一个典型的方法是选择一定数量的健康个体,然后测量特定指标的值并进行统计分析,以确定参考区间。
健康人群的选择在很大程度上影响参考区间的准确性。
因此,为了确保参考区间的准确性和可信度,应该选择相对健康、代表性和随机的人群,排除有疾病和其他潜在干扰因素的人群。
参考区间还受到实验室技术和仪器的影响。
为确保准确的参考区间,实验室应该执行规范化的方法,使用标准的检测设备,并严格遵守质量管理要求。
另外,参考区间对于不同的仪器和技术也有所不同,因此在更换设备或改变检测方法时需要重新确定参考区间。
参考区间在现代医学中具有重要的意义。
临床医生常常将检验结果与参考区间进行比较,以确定某项检测结果是否异常或者需要进一步的检测或治疗。
因此,确保参考区间的准确性和可靠性,对于提高公共健康水平和各种疾病的及时发现和治疗具有重要的意义。
总之,参考区间的制定需要考虑多种因素,包括年龄、性别、种族和技术等因素的影响。
科学严谨的制定方法可以增强参考区间的准确性和可信度,进而提高各种疾病的及时发现和治疗水平,对人类健康具有深远的影响。


孕酮检测试剂注册技术审查指导原则本指导原则旨在指导注册申请人对孕酮检测试剂注册申报资料的准备及撰写,同时也为技术审评部门审评注册申报资料提供参考。
本指导原则是对孕酮检测试剂的一般要求,申请人应依据产品的具体特性确定其中内容是否适用,若不适用,需具体阐述理由及相应的科学依据,并依据产品的具体特性对注册申报资料的内容进行充实和细化。
本指导原则是供申请人和审查人员使用的指导文件,不涉及注册审批等行政事项,亦不作为法规强制执行,如有能够满足法规要求的其他方法,也可以采用,但应提供详细的研究资料和验证资料。
应在遵循相关法规的前提下使用本指导原则。
本指导原则是在现行法规、标准体系及当前认知水平下制定的,随着法规、标准体系的不断完善和科学技术的不断发展,本指导原则相关内容也将适时进行调整。
一、适用范围从方法学考虑,在本文中孕酮检测试剂是指采用化学发光免疫分析技术,以竞争法为基本原理,利用全自动、半自动化学发光免疫分析仪,在医学实验室对人体样本中孕酮的含量进行体外定量分析的试剂。
依据《体外诊断试剂注册管理办法》(国家食品药品监督管理总局令第5号)、《体外诊断试剂注册管理办法修正案》(国家食品药品监督管理总局令第30号)和《食品药品监管总局关于印发体外诊断试剂分类子目录的通知》(食药监械管〔2013〕242号),孕酮检测试剂管理类别为Ⅱ类医疗器械,分类编码为6840。
本指导原则不适用于:(一)单独申请注册的孕酮校准品和质控品。
(二)化学发光免疫分析法原理之外的其他孕酮检测试剂。
二、注册申报材料要求(一)综述资料孕酮是一种重要的孕激素,属于类固醇激素,相对分子量314.5,主要由卵巢黄体和妊娠期胎盘生成,是睾酮、雌激素及肾上腺皮质激素的前体。
正常男性和女性卵泡期产生的孕酮水平很低,分泌入血后主要结合于白蛋白和性激素结合蛋白在体内进行循环。
孕酮水平与黄体的发育和萎缩有关。
孕酮的主要功能是使子宫为受精卵的着床做好准备,并维持妊娠。

第二类体外诊断试剂产品注册资料白蛋白测定试剂盒(溴甲酚绿法)参考区间确定资料XXXXXX有限公司一、参考依据依据NCCLS C28-A2 如何确定临床检验的参考区间:批准指南(2000)文件。
该文件是确定定量临床检验项目的参考区间的指南。
二、材料与方法1.标本来源按健康人群要求选择XXXXXXXXX医院健康体检者,收取该医院检验科检测已完成的临床样本。
样本采集/检验时间:XXXX.XX。
对象:在XX地区居住的性别不限、年龄不限的健康人。
健康人的要求:(1)一月内无急性感染史;(2)发育正常,无心血管、肺、肾和肝、胆、胰等器质性疾患;(3)半年内无输血和大手术史;(4)3月内未服用影响凝血功能的药物,2周内无中毒史,未接触毒物及其他有害物质;(5)妇女不在妊娠或哺乳期。
2.使用仪器HITACHI 7020全自动生化仪。
3.检测试剂XXXXXX有限公司生产的白蛋白测定试剂盒(溴甲酚绿法)。
规格:XXmL;批号:XXXXXX;生产日期:XXXXXXXX;有效期XXXXXXXX。
4. 质量控制按照技术要求3.1、3.3~3.6.1、3.7进行产品性能的测定,结果应符合要求。
5. 参考值确定根据项目制定双侧界限或单测界限,采用95%参考区间范围。
6.统计方法应用SPSS20进行数据统计分析。
正态性检验采用Kolmogorov–Smirnov(K-S) 检验。
结果属于正态分布的,用正态分布法计算参考区间范围,其95%参考区间范围分别用下式计算:双侧:SD.1X96单测下限:SD.1+X64-单测上限:SD.1X64结果属于偏态分布的,用百分位法计算参考区间范围,其95%参考区间范围分别用下式计算:双侧:P2.5~P97.5单测下限:P5单侧上限:P95三、试验结果用白蛋白测定试剂盒(溴甲酚绿法)对收集到的标本进行测定,测定结果呈正态分布(见图1)。
95%参考区间用公式求出,得出了本试剂盒测定ALB的参考值范围上下限,见表1。

wst 402-2012临床实验室检验项目参考区间的制定临床实验室检验项目参考区间是指人群中,在特定实验室检测条件下,正常人群中某检验项目的结果值的范围,通常用于指导医生判断检验结果的偏离程度,从而作出病情的诊断和治疗决策。
临床实验室检验项目参考区间的制定,是重要的医学质量控制环节之一,对于提高临床实验室检验结果的准确性和可靠性,保障患者的健康治疗具有重要作用。
临床实验室检验项目参考区间的制定,通常需要了解受检样本的来源、人群结构、生理特性、营养状况等多种因素,同时考虑实验室检验方法、仪器设备和标准参照物的制定等。
具体来说,可以按照以下步骤进行。
第一步,确定要制定参考区间的具体项目和检测方法。
在选择特定的检测项目和方法时,需要考虑相关文献、国家规范和临床实验室的实际情况,以确保检测结果的准确性和可靠性。
第二步,收集样本以确定正常参考值。
在收集样本之前,需要确定样本来源和受检人群的特征。
通常,这些数据可以通过文献分析、实地调查、采用标准问卷等方式获得。
此外,要求参与样本收集的受检人员不患有疾病,不服用相关药物,不受病毒感染等。
第三步,定义正常参考值的具体范围。
待样本收集结束后,需要进行数据分析、统计分布等统计学方法,确定正常参考值的上限和下限。
第四步,审核并修改参考值。
确定参考值后,需要进行内部和外部质量控制,确保参考值的准确性和可靠性。
如果发现误差或不合理性,需要进行修改和审核。
总之,临床实验室检验项目参考区间的制定是一个系统性、综合性的过程,需要考虑多个因素。
参考区间的制定要根据不同的实验室和人群的特点来调整,以确保其对临床实验室检验结果的评价具有准确性和可靠性,同时也能够帮助临床医生更好地了解患者的情况,为患者的治疗提供更科学的依据和指导。

医院实验室参考范围的确定与调整程序1.目的:规范各检测项目生物参考区间的建立。
2.范围:实验室开展的检测项目。
3.定义3.1参考个体:依据临床对某检验项目的使用要求确定选择原则,以此选择的检测参考值的个体。
所有参考个体的集合为参考总体。
3.2参考抽样组:从统计意义上,一定数量的参考个体是对参考总体的一个抽样。
在现今的参考值建立中,都是对参考抽样组作具体研究,在一定的可信限条件下,成为某项目的参考值和参考区间。
3.3参考值:对一个参考个体进行某项目检测得到的值为该个体的参考值,所有参考抽样组的各个参考值合起来即为参考值范围。
3.4参考区间和参考限:依据所有参考值的分布特性以及临床使用要求,选择合适的统计方法进行归纳分析后,确定参考值范围中的一部分为参考区间,区间的两端为参考区间的限值,分为低参考限和高参考限。
4.权责4.1各专业组组长负责评审本组检验项目的生物参考区间。
4.2技术负责人批准评审后的生物参考区间。
5.制度内容5.1检验科在下列情况下应重新评审生物参考区间。
5.1.1开展新的检验项目。
5.1.2改变当的检测系统。
5.1.3实验室有理由可以相信某一特定参考区间对参考人群不再适用时。
5.2工作程序5.2.1各专业组应为所运行的检验项目确定可靠的生物参考值区间。
5.2.2生物参考区间的设立可直接采用由国家权威机构发布或权威刊物出版的适合实验室的生物参考区间;还可直接引用试剂供应商提供的对应的生物参考区间;也可自行建立生物参考区间。
5.2.3自行建立参考值范围和参考区间计划。
5.2.3.1根据文献和实验研究,总结对该项目检测结果产生的生物变异和分析下扰的因素,供选择参考个体时用。
5,2.3.2确定参考个体的选择原则(或排除非参考个体的原则),编写与之对应调查表。
5.2.3.3依据调查表和其他有关记录,挑选候选的参考个体。
5.2.3.4依据排除原则,剔去不符合要求的候选对象。
5.2.3.5将采集标本前和采集时对受检查的要求,告诉各个受检参考个体,做好准备。

c28-a2医学实验室参考区间的定义和确定医学实验室参考区间是指在正常人群中,某项生理指标的测量结果在某一范围内的概率分布。
其确定的目的是为了将正常值与异常值区分开来,从而对疾病进行诊断和监测。
下面将详细介绍医学实验室参考区间的定义和确定。
医学实验室参考区间的定义:医学实验室参考区间又称正常范围,是指某项生理指标的测量结果在正常人群中观察到的分布范围。
它由下限和上限所组成,表示了该指标测量结果在正常人群中所占的百分比。
一般使用95%的置信区间来确定参考区间,即该指标测量结果有95%的概率分布在该范围内。
医学实验室参考区间的确定:确定医学实验室参考区间需要考虑多个因素,包括样本来源、样本数量、性别、年龄、种族等。
下面将逐一介绍这些因素的影响。
1.样本来源:医学实验室参考区间的确定需要选择来自正常人群的样本。
这些样本应该是没有明显疾病症状,且无明显影响该指标的因素,如未使用药物、未患有慢性疾病等。
选择样本时需要考虑性别、年龄、种族等因素,以保证参考区间的准确性。
2.样本数量:样本数量是确定参考区间的重要因素之一。
较少的样本数量容易导致偏差,不准确地估计参考区间。
一般来说,样本数量越多,结果越可靠。
根据统计学原理,当样本数量达到一定程度时,参考区间的计算结果将更加可靠。
3.性别、年龄和种族:某些生理指标的参考区间可能会因性别、年龄和种族的不同而有差异。
因此,在确定参考区间时需要对这些因素进行分层分析,以准确划定不同人群的参考区间。
4.统计方法:确定参考区间常用的统计方法有光谱法和非参数法。
光谱法是根据正态分布的假设来估计参考区间,适用于样本数量充足且近似正态分布的情况。
非参数法是基于分位数回归方法来估计参考区间,适用于样本数量较少、分布非正态的情况。
在确定参考区间时,也需要考虑参考区间的可靠性和灵敏度。
参考区间的可靠性指的是该区间的结果在不同实验室、不同设备、不同测量者之间能够重复,能够给出一致的结果。

百分位数法(非参数法)确定参考区间的方法说实话百分位数法(非参数法)确定参考区间这事儿,我一开始也是瞎摸索。
我最早想确定一个数据的参考区间的时候,都不知道从哪下手。
我就先把收集到的所有数据都堆在一起,然后就开始在那瞎琢磨。
我试着找特殊值,比如最大值、最小值,觉得说不定这就和参考区间有点关系呢,结果发现这简直太幼稚了,这根本就不是百分位数法的思路嘛。
后来我就开始看书查资料,才大概知道点皮毛。
百分位数法呢,简单说就是要看不同百分位的数值。
打个比方,就好像你要给一个班级的同学身高确定参考区间,你不能只看最高最矮的几个人,得看看从最矮到最高排好队之后,中间不同位置的人的身高情况。
比如说第5百分位的身高和第95百分位的身高,那中间这一大部分人的身高范围就可能是比较正常的参考区间。
那具体怎么做呢?首先你得把数据按照从小到大的顺序排列好。
这一步可不能乱,我之前就有一次数据排得乱七八糟的,结果算出来的百分位数都不对。
排好序之后,就开始确定你要的百分位数。
比如说100个数据里,第5个最小的数据就是第5百分位。
但这里面有个问题我不太确定,就是如果数据的数量不是这种正好是100 、1000这样好计算的怎么办?我试过按比例去估算,但是总觉得不太靠谱。
比如说有一次我研究某个人群的血糖数值参考区间,最开始我以为只要挑出几个我觉得像是边缘的数值就好了,大错特错啊。
后来我老老实实把几百个血糖数据排序,再依照找第百分位和第百分位的数据,最后得出的数值范围才有点像个参考区间的样子。
要是想做准确呢,数据量也要多一些。
要是只有很少的数据就去用这个方法,就好比用很少的砖头去砌一堵墙,根本就不牢固,得出来的参考区间肯定也不怎么可靠。
我在确定一个新指标的参考区间的时候,就因为数据太少,结果得到的结果和后来数据足够多的时候差别老大了。
总之呢,用百分位数法确定参考区间虽然不难,但是细节得特别注意,不然就容易出岔子。
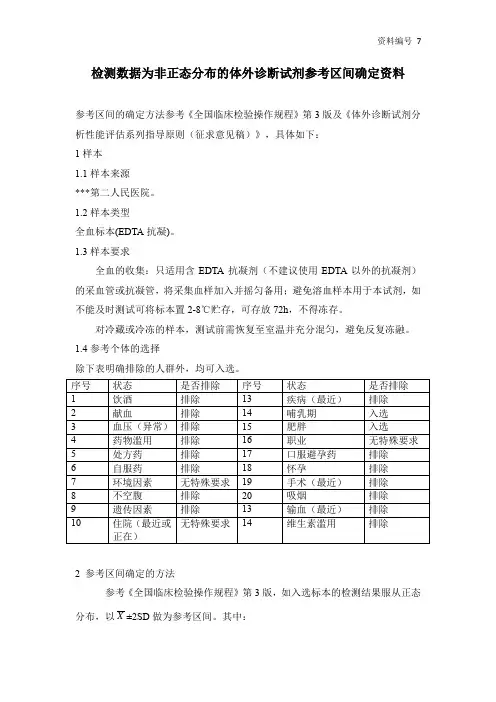
检测数据为非正态分布的体外诊断试剂参考区间确定资料参考区间的确定方法参考《全国临床检验操作规程》第3版及《体外诊断试剂分析性能评估系列指导原则(征求意见稿)》,具体如下:1样本1.1样本来源***第二人民医院。
1.2样本类型全血标本(EDTA抗凝)。
1.3样本要求全血的收集:只适用含EDTA抗凝剂(不建议使用EDTA以外的抗凝剂)的采血管或抗凝管,将采集血样加入并摇匀备用;避免溶血样本用于本试剂,如不能及时测试可将标本置2-8℃贮存,可存放72h,不得冻存。
对冷藏或冷冻的样本,测试前需恢复至室温并充分混匀,避免反复冻融。
1.4参考个体的选择除下表明确排除的人群外,均可入选。
2 参考区间确定的方法参考《全国临床检验操作规程》第3版,如入选标本的检测结果服从正态分布,以X±2SD做为参考区间。
其中:X = 检测结果的算术平均数SD=()12--∑n X Xn=120如入选标本的检测结果不服从正态分布,则采用95%分位法计算参考区间。
3 参考区间确定试验步骤:使用前请仔细阅读本说明书及干式荧光免疫分析仪操作手册,测试应在室温下进行。
取20ul 样本加入缓冲液中,混匀;解离15分钟后混匀;取40ul 稀释过后的样本加入到卡条的加样窗口,层析15分钟,按照仪器操作方法的详细说明读取检测结果。
质量控制:当测试出现异常值时,建议进行校准和质控测试。
校准:在加样检测前,请将检测卡放于仪器卡槽中,扫描检测卡背面的二维码,进行仪器校准,不同批次的检测卡,缓冲液及二维码不能混用。
质控:用质控品(选购品,非试剂盒标配品)进行测试,测试结果应在靶值范围内。
45离群值检查经分析,各组数据D<1/3R,无离群值,均纳入后续的统计分析。
4.1.3性别及年龄差异比较(n=200)男女组、<=30岁及>30岁样本数量均为100,则Z*=3(200/240)1/2=2.739,如果z值超过了对应的Z*值,两组之间即存在显著性差别,应分别报告参考区间。

精选文档临床实验室怎样确立和成立生物参照区间(赞同指南――第二版)1内容简介此指南是专为指导临床诊断实验室、诊断仪器试剂制造商和临床检验工作者在定量实验检测中确立参照值和参照区间而拟订的。
它包括在临床医学实验室中成立可靠的参照区间所用的方法步骤和介绍程序。
而该介绍程序的主要内容是怎样用最简单和最务实的方法去成立一个能保证足够可靠性和适用性的参照区间的草案。
此文件不能够能每一种状况都左右逢源,所以有些内容需要经过指南外来充足。
但在特定的地域内,额外的步骤或努力能够提高参照区间的可信度和精确度。
当前的现状是,临床实验室科研人员和仪器试剂制造商缺乏一致的收集数据及操作方法去成立参照区间,故小组委员会希望此文件能为成立可靠的参照区间供应最基本的、一致的实验草案,并为进一步的研究夯实基础。
该程序指南的要点在于决定“相对健康” 集体参照值或参照区间时所选择的样品组可否本源于健康优异的人群,这也是此文件的议论的要点。
自然,关于其他种类诸如生理或病理状况下的参照值的成立,也应该采用相似的方法。
此程序大纲适用于任何种类的参照区间确实定,由于它充足考虑了合适的参照个体的选择及各种剖析方法影响因素等状况。
但是,这份文件没有特意地谈到怎样成立诊断域值(如紧急值或各种医学决定值)。
这些值的决定方法各异,部分还经常要在特定医学条件下由诊断方法的敏感性和特异性来决定。
不同样状况下的参照值研究的各种需求本指南也将涉及,包括:新剖析物的测量用新的或不同样的剖析方法测量开初已明确知道的剖析物或已标准化测定的生理学的数据和参照值。
用同样也许有可比性的方法去测量同一剖析物,并利用其他实验室或试剂生产商供应的参照值作比较研究(参照值的调用)。
被称为“参照值调用”的最后一项议题是比较复杂的。
由于今后所有的临床诊断实验室将会不断地碰到调用参照值的考据和随后的采用它这个问题,而试剂生产商和其他实验室所供应的参照值是不能够够直接应用的。
这一问题的解决方法到此刻依旧不是特别严格。

β-羟丁酸检测试剂注册审查指导原则(征求意见稿)本指导原则旨在指导注册申请人对β-羟丁酸检测试剂注册申报资料的准备及撰写,同时也为技术审评部门审评注册申报资料提供参考。
本指导原则是针对β-羟丁酸检测试剂的一般要求,申请人应依据产品的具体特性确定其中内容是否适用,若不适用,需具体阐述理由及相应的科学依据,并依据产品的具体特性对注册申报资料的内容进行充实和细化。
本指导原则是供注册申请人和技术审评人员使用的指导性文件,但不包括审评审批所涉及的行政事项,亦不作为法规强制执行,应在遵循相关法规的前提下使用本指导原则。
如果有能够满足相关法规要求的其他方法,也可以采用,但是需要提供详细的研究资料和验证资料。
本指导原则是在现行法规和标准体系以及当前认知水平下制定的,随着法规和标准的不断完善,以及科学技术的不断发展,相关内容也将适时进行调整。
一、适用范围本指导原则适用于采用β-羟丁酸脱氢酶法,利用全自动、半自动生化分析仪或分光光度计,在医学实验室进行β-羟丁酸定量测定所使用的临床化学体外诊断试剂。
基于其他方法的β-羟丁酸检测试剂盒可参照本指导原则,但应根据产品的具体特性确定其中的内容是否适用,若不适用,应另外选择适合自身方法学特性的研究步骤及方法。
二、注册审查要点注册申报资料的撰写应符合《体外诊断试剂注册申报资料要求及说明》的相关要求。
(一)监管信息1.产品名称产品名称由三部分组成。
第一部分:被测物质的名称,如β-羟丁酸;第二部分:用途,如测定试剂盒;第三部分:方法或者原理,如β-羟丁酸脱氢酶法等,本部分应当在括号中列出。
2.分类依据根据2013版《体外诊断试剂分类子目录》,β-羟丁酸检测试剂产品类别为:Ⅱ-2 用于糖类检测的试剂,管理类别为第二类,分类编码为6840。
3.注册单元划分按照《医疗器械注册单元划分指导原则》对注册单元划分。
如包含不同的包装规格,不同规格间仅试剂组分装量或检测数有差异,原则上划分为同一注册单元;如包含不同的包装规格,不同规格间除试剂装量或检测数的差异外,适用于不同的仪器机型,原则上划分为同一注册单元。
附件 3 C反应蛋白测定试剂盒注册技术审查指导原则(2016年修订版)需规要求的其他方法,也可以采用,但应提供详细的研究资料和验证资料。
应在遵循相关法规的前提下使用本指导原则。
本指导原则是在现行法规、标准体系及当前认知水平下制定的,随着法规、标准体系的不断完善和科学技术的不断发展,本指导原则相关内容也将适时进行调整。
一、适用范围本指导原则适用于基于分光光度法原理,利用手工和半自动、全自动生化分析仪,在医学实验室进行对人血清或血浆中的C-反应蛋白进行定量检测所使用的临床化学体外诊断试剂(盒)。
本指导原则不适用于:是白(常规CRP)和超敏C反应蛋白(超敏CRP)。
一次性检测常规CRP和超敏CRP,这种方法被称为全程C反应蛋白检测。
常规CRP和超敏CRP在化学本质上无区别,是同一种物质,只是检测方法的定量下限不同。
常规CRP测定包括定性、半定量和定量分析,可用于评价感染,组织损伤和炎症性疾病。
对于常规的CRP测定,参考值通常被认为是临床上含量高于10毫克/升。
在健康人群血液中CRP水平低于5毫克/升,而在各种条件下,急性炎症4—8小时内,CRP值达到约20至500毫克/升。
常规CRP作为急性炎症评估指标比红细胞沉降率(ESR)和白细胞计数更敏感、更可靠。
超敏C反应蛋白线性范围低端低于常规CRP,这种较低的范围可扩大使用适应症,C反应蛋白是非特异性的,必须结合临床症状综合评估,不能作为特定的疾病或疾病的风险的确诊依据。
图1 超敏CRP与常规CRP的区别超敏C反应蛋白常见的用途可作为心血管疾病风险识别的辅助手段。
配合传统的急性冠脉综合征临床诊断使用,可作为冠状动脉疾病或急性冠脉综合征复发的预警指示物。
图2 超敏CRP的临床意义表1 各种CRP的区别及性能要求常规CRP 超敏CRP用途感染,组织损伤和炎症性疾病的评价。
提供炎症性疾病的诊断,治疗和监控的信息是区分低水平炎症状态的灵敏指标, 血清hs-CRP 水平与动脉粥样硬化及急性脑梗死( ACI) 等心脑血管疾病的发生、严重程度及预后密切相关参考值范围参考值范围: 约10mg/ L健康人群:≤ 5mg / L急性范围: 20—500 mg/L参考值范围: 1mg/L推荐线性范围≥ 5mg/L到上限0.5 mg/L 到≤ 10.0mg/L灵敏度明确在线性范围低端的性能确定定量限(功能灵敏度)综述资料主要包括CRP的代谢、产品预期用途、产品描述、参考品的详细溯源性、有关生物安全性的说明、研究结果的总结评价以及同类产品上市情况介绍等内容,其中同类产品上市情况介绍部分应着重从方法学、临床应用情况、性能指标等方面写明拟申报产品与目前市场上已获批准的同类产品之间的异同。
胃蛋白酶原I/II检测试剂注册审查指导原则本指导原则旨在指导注册申请人对胃蛋白酶原I/II检测试剂注册申报资料的准备及撰写,同时也为技术审评部门对注册申报资料的技术审评提供参考。
本指导原则是对胃蛋白酶原I/II检测试剂的一般要求,申请人应依据产品的具体特性确定其中内容是否适用,若不适用,需具体阐述理由及相应的科学依据,并依据产品的具体特性对注册申报资料的内容进行充实和细化。
本指导原则是供注册申请人和技术审评人员使用的指导性文件,但不包括审评审批所涉及的行政事项,亦不作为法规强制执行,应在遵循相关法规的前提下使用本指导原则。
如有能够满足法规要求的其他方法,也可以采用,但应提供详细的研究资料和验证资料。
本指导原则是在现行法规、标准体系及当前认知水平下制定的,随着法规、标准体系的不断完善和科学技术的不断发展,本指导原则相关内容也将适时进行调整。
一、适用范围胃蛋白酶原I/II检测试剂用于体外定量测定人血清或血浆样本中胃蛋白酶原I/II(PepsinogenⅠ/Ⅱ,PGⅠ/Ⅱ)的浓度。
本指导原则适用于胃蛋白酶原I/II检测试剂,包括以酶标记、化学发光标记等标记方法免疫分析试剂,不适用于胶体金标记或其他方法标记的半定量胃蛋白酶原I/II检测试剂(如:试纸条等)和用125I等放射性同位素标记的各类放射免疫或免疫放射试剂。
二、注册审查要点(一)监管信息1.产品名称试剂(盒)名称由三部分组成:被测物名称、用途、方法或原理。
例如:例如:胃蛋白酶原Ⅰ检测试剂盒(化学发光法)。
2.分类编码根据《体外诊断试剂分类规则》,胃蛋白酶原I/II检测试剂管理类别为Ⅱ类,分类编码为6840。
3.包装规格注明可测试的样本数或装量,如××测试/盒、××人份/盒、××mL,除国际通用计量单位外,其余内容均应采用中文进行表述。
4.主要组成成分说明产品包含试剂组分的名称、数量、每个组成成分在反应体系中的比例或浓度、其生物学来源、活性及其他特性。
在临床实验室检验过程中,参考区间的确定是非常重要的。
参考区间可以帮助医生评估患者的健康状况,诊断疾病,并监控治疗效果。
本文将从临床实验室检验项目参考区间的确定方法、意义、影响因素以及现状和未来趋势进行深入探讨。
**1. 什么是参考区间?**在临床实验室检验中,参考区间是指在一定人群中,同一检验项目在健康人群中的正常值范围。
参考区间通常分为一般参考区间和专家参考区间两种。
一般参考区间是通过对一定人群进行检测,统计分析来确定的,而专家参考区间是由专家根据临床医学经验和文献资料来确定的。
**2. 参考区间的确定方法**参考区间的确定需要经过严格的统计分析和临床验证。
一般参考区间的确定方法通常包括横断面调查和纵向追踪两种。
横断面调查是指在某一时间点对一定人群进行检测,然后根据统计学原理确定参考区间;而纵向追踪则是在一段时间内对同一人群进行多次检测,再根据统计学方法确定参考区间。
而专家参考区间则是通过专家讨论、文献综述和临床验证来确定的。
**3. 参考区间的意义**参考区间的确定对于准确评估患者的健康状况、诊断疾病和监控治疗效果具有重要意义。
参考区间可以帮助医生判断患者是否存在异常情况,及时调整诊疗方案,提高诊断的准确性和治疗的有效性。
**4. 参考区间的影响因素**参考区间的确定受到许多因素的影响,包括人种、性别、芳龄、地域、环境等因素。
不同人群的生理和生活环境都可能导致参考区间的差异,因此在确定参考区间时需要考虑这些因素的影响。
**5. 参考区间的现状和未来趋势**目前,随着临床医学的发展和技术的进步,参考区间的确定方法也在不断完善。
未来,基于大数据和人工智能的参考区间确定方法将会得到更广泛的应用,这将进一步提高参考区间的准确性和可靠性,有助于更好地指导临床诊疗工作。
**总结与回顾**通过本文的探讨,我们了解了临床实验室检验项目参考区间的确定方法、意义、影响因素以及现状和未来趋势。
参考区间的准确性和可靠性对于临床工作具有重要意义,希望通过不断的研究和实践,可以进一步完善参考区间的确定方法,为临床医生提供更可靠的参考依据。
检测数据呈正态分布的体外诊断试剂参考区间确定资料参考区间的确定方法参考《全国临床检验操作规程》第3版及《体外诊断试剂分析性能评估系列指导原则(征求意见稿)》,具体如下:1样本1.1样本来源****附属第五医院。
1.2样本类型血清、血浆标本。
1.3样本要求血清/血浆的收集:只适用含EDTA抗凝剂(不建议使用EDTA以外的抗凝剂)的采血管或抗凝管,将采集血样加入并摇匀备用;避免溶血样本用于本试剂,如不能及时测试可将标本置4℃贮存,可存放72h,超过3天应置-20℃冷冻保存,可存放6个月。
对冷藏或冷冻的样本,测试前需恢复至室温并充分混匀,避免反复冻融。
1.4参考个体的选择除下表明确排除的人群外,均可入选。
2 参考区间确定的方法参考《全国临床检验操作规程》第3版,如入选标本的检测结果服从正态分布,以X±1.96SD做为参考区间。
其中:X = 检测结果的算术平均数SD=()12--∑n X Xn=120如入选标本的检测结果不服从正态分布,则采用95%分位法计算参考区间。
3 参考区间确定试验步骤:使用前请仔细阅读本说明书及***分析仪操作手册,测试应在室温下进行。
取70ul 样本加入到缓冲液中,混匀;取40ul 稀释过后的样本加入到卡条的加样窗口,层析15分钟,按照仪器操作方法的详细说明读取检验结果。
质量控制:当测试出现异常值时,建议进行校准和质控测试。
校准:在加样检测前,请将检测卡放于仪器卡槽中,扫描检测卡背面的二维码,进行仪器校准,不同批次的检测卡,缓冲液及二维码不能混用。
质控:用质控品(选购品,非试剂盒标配品)进行测试,测试结果应在靶值范围内。
5离群值检查经分析,各组数据D<1/3R,无离群值,均纳入后续的统计分析。
6两组之间差异比较(n=120)男女组数量均为60,则Z*=3(120/240)1/2=2.12,如果z值超过了对应的Z*值,两组之间即存在显著性差别,应分别报告参考区间。
另外,应检查标准偏差较大者,如S2,是否大于1.5S1。
第二类体外诊断试剂产品注册资料
白蛋白测定试剂盒
(溴甲酚绿法)
参考区间确定资料
XXXXXX有限公司
一、参考依据
依据NCCLS C28-A2 如何确定临床检验的参考区间:批准指南(2000)文件。
该文件是确定定量临床检验项目的参考区间的指南。
二、材料与方法
1.标本来源
按健康人群要求选择XXXXXXXXX医院健康体检者,收取该医院检验科检测已完成的临床样本。
样本采集/检验时间:XXXX.XX。
对象:在XX地区居住的性别不限、年龄不限的健康人。
健康人的要求:(1)一月内无急性感染史;(2)发育正常,无心血管、肺、肾和肝、胆、胰等器质性疾患;(3)半年内无输血和大手术史;(4)3月内未服用影响凝血功能的药物,2周内无中毒史,未接触毒物及其他有害物质;(5)妇女不在妊娠或哺乳期。
2.使用仪器
HITACHI 7020全自动生化仪。
3.检测试剂
XXXXXX有限公司生产的白蛋白测定试剂盒(溴甲酚绿法)。
规格:XXmL;批号:XXXXXX;生产日期:XXXXXXXX;有效期XXXXXXXX。
4. 质量控制
按照技术要求3.1、3.3~3.6.1、3.7进行产品性能的测定,结果应符合要求。
5. 参考值确定
根据项目制定双侧界限或单测界限,采用95%参考区间范围。
6.统计方法
应用SPSS20进行数据统计分析。
正态性检验采用Kolmogorov–Smirnov(K-S) 检验。
结果属于正态分布的,用正态分布法计算参考区间范围,其95%参考区间范围分别用下式计算:
双侧:SD
.1
X96
单测下限:SD
.1
X64
+
X64
-单测上限:SD
.1
结果属于偏态分布的,用百分位法计算参考区间范围,其95%参考区间范围分别用下式计算:
双侧:P2.5~P97.5
单测下限:P5单侧上限:P95
三、试验结果
用白蛋白测定试剂盒(溴甲酚绿法)对收集到的标本进行测定,测定结果呈正态分布(见图1)。
95%参考区间用公式求出,得出了本试剂盒测定ALB的参考值范围上下限,见表1。
确定白蛋白试剂盒(溴甲酚绿法)参考值范围为:38-44g/L。
图1 200例总胆汁酸测定结果的K-S检验
表1 白蛋白测定试剂盒(溴甲酚绿法)参考值范围确定
例数X SD X-1.96SD X+1.96SD
200 40.97 1.513 38 44 备注:详细实验数据资料(质量控制数据、参考值样本测定数据)见附件1
四、讨论
1.某项目的临床参考值是指在特定条件用特定方法所得到的生理生化参数,不同的条件(如地区,时间,性别,年龄,生活水平,测定方法等)测出的参考值范围可能有所差异,建议用户建立自己实验室内的参考值范围。
2.不能盲目地把参考值范围作为正常与异常的分界点,因参考值通常采用95%可信区间,此范围仅覆盖研究人群的95%,有5%的健康人群落在参考值范围之外。
3.参考值在作为诊断与监测疾病时的判断依据时,还应考虑年龄、性别、饮食、锻炼、个人喜好等多种因素的影响,综合评价,仔细判定。
附件1:
质量控制数据
参考值样本测定数据。