2023届高考化学一轮专题训练—工业流程题及参考答案
- 格式:docx
- 大小:2.83 MB
- 文档页数:24

2023届高考化学一轮强化练习题:工业流程题1.(2022·四川省绵阳南山中学高三开学考试)海洋是一个巨大的资源宝库。
海水资源综合利用的部分途径如下图:已知:粗盐中的杂质有泥沙、2MgCl 、2CaCl ,流程中部分操作及试剂已省略。
(1)“操作I”中玻璃棒的作用是_______。
(2)滤渣中除泥沙外还有_______(填化学式)。
(3)反应①和①的化学反应方程式分别为_______;_______。
(4)海水中本身就有氯化镁,请分析反应①、①转化过程的目的_______。
(5)根据图中KNO 3、NaCl 的溶解度曲线,下列说法不正确的是_______(填字母)。
A .t①时,将45g KNO 3固体放入50g 水中充分溶解,所得溶液的质量为95gB .NaCl 溶液中含有少量KNO 3,可以采用蒸发结晶的方法提纯NaClC .40①时,将KNO 3的饱和溶液降温至20①,溶液的溶质质量分数减小(不考虑水分损失)(6)同学们查阅NaCl 的溶解度曲线后,欲配制20①时100g 溶质质量分数为10%的NaCl 溶液。
已知配制溶液的步骤有:①溶解 ①计算 ①装瓶存放 ①称量。
上述步骤的正确顺序为_______(填序号)。
2.(2022·河北·高三阶段练习)以锌焙砂(主要成分为ZnO ,还含有23Fe O 、24ZnFe O 和少量Pb 、Ag 、Cu 、Cd )为原料,制备黄铁矾和42ZnSO 7H O 的工艺流程如下:已知:①24ZnFe O 的成分可看做23ZnO Fe O ⋅,只在高温高酸环境下溶解;①25①下,浸出液中2Zn +和3Fe +开始沉淀和完全沉淀(5110mol L c --⋅)时的pH 如下表: 金属离子pH开始沉淀 完全沉淀2Zn + 6.28.2 3Fe +1.5 3.2 回答下列问题:(1)基态锌原子的电子排布式为_______,欲提高“浸出”速率,可采用的方法是_______(任写一条)。

试卷第1页,共10页 2023届高考化学一轮系统复习卷--氧化还原反应 学校:___________姓名:___________班级:___________考号:___________一、单选题1.为防止废弃的硒单质(Se)造成环境污染,通常用浓硫酸将其转化成二氧化硒(SeO 2),再用KI 溶液处理后回收Se .发生的反应为:①Se+2H 2SO 4(浓)=2SO 2+SeO 2+2H 2O 、①SeO 2+4KI+4HNO 3=4KNO 3+Se+2I 2+2H 2O ,下列说法错误的是A .①中SO 2是还原产物,SeO 2是氧化产物B .①中KI 是还原剂,HNO 3是氧化剂C .回收Se 过程中每生成0.4mol I 2共转移1.6mol 电子D .氧化性由强到弱的顺序是:H 2SO 4(浓)>SeO 2>HNO 32.下列关于铁单质的说法中不正确的是A .3 mol 单质Fe 完全转变为Fe 3O 4,失去8N A 个电子B .装月饼的袋子里常放有干燥剂和铁粉,这是利用了铁粉的还原性C .常温下,Fe 与H 2O 不反应,但在空气中O 2、H 2O 的共同作用下能发生氧化反应D .56 g 铁和71 g 氯气完全反应,转移的电子数为3N A3.某工业废水中含有大量的Mn 2+和Cr 3+,常经以下过程进行氧化处理,再进行一系列操作,回收锰和铬,以达到回收利用且降低污染的目的。
下列说法正确的是( )A .在氧化处理过程中用H 2O 2代替NaClO 会更环保,效果更好B .反应①中,氧化剂与还原剂的物质的量之比为1①1C .反应①离子方程式为2Cr 3++3ClO -+5H 2O=2CrO 2-4+3Cl -+10H +D .生成的CrO 2-4在酸性条件下易转化为Cr 2O 2-7,该反应为氧化还原反应4.(CN)2、(OCN)2、(SCN)2等化合物的性质与卤素单质相似,称为“类卤素”。
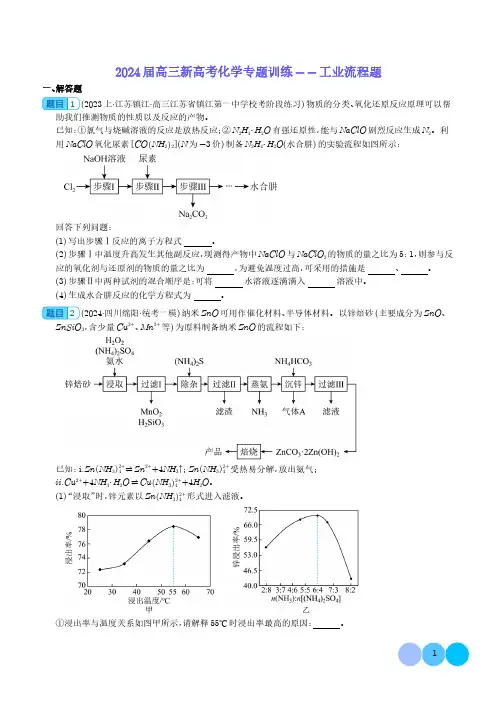
2024届高三新高考化学专题训练--工业流程题一、解答题1(2023上·江苏镇江·高三江苏省镇江第一中学校考阶段练习)物质的分类、氧化还原反应原理可以帮助我们推测物质的性质以及反应的产物。
已知:①氯气与烧碱溶液的反应是放热反应;②N2H4⋅H2O有强还原性,能与NaClO剧烈反应生成N2。
利用NaClO氧化尿素CO NH22(N为-3价)制备N2H4⋅H2O(水合肼)的实验流程如图所示:回答下列问题:(1)写出步骤Ⅰ反应的离子方程式。
(2)步骤Ⅰ中温度升高发生其他副反应,现测得产物中NaClO与NaClO3的物质的量之比为5:1,则参与反应的氧化剂与还原剂的物质的量之比为,为避免温度过高,可采用的措施是、。
(3)步骤Ⅱ中两种试剂的混合顺序是:可将水溶液逐滴滴入溶液中。
(4)生成水合肼反应的化学方程式为。
2(2024·四川绵阳·统考一模)纳米ZnO可用作催化材料、半导体材料。
以锌焙砂(主要成分为ZnO、ZnSiO3,含少量Cu2+、Mn2+等)为原料制备纳米ZnO的流程如下:已知:i.Zn NH32+4受热易分解,放出氨气;2+4⇌Zn2++4NH3↑;Zn NH3ii.Cu2++4NH3⋅H2O⇌Cu NH32+4+4H2O。
(1)“浸取”时,锌元素以Zn NH32+4形式进入滤液。
①浸出率与温度关系如图甲所示,请解释55℃时浸出率最高的原因:。
②浸出率与n NH 3 :n NH 4 2SO 4 的关系如图乙所示,n NH 3 :n NH 4 2SO 4 >6:4之后浸出率下降,说明(填序号)的浸出主要依赖硫酸铵浓度的大小。
A.ZnO 和ZnSiO 3B.ZnOC.ZnSiO 3③浸取过程加入H 2O 2的目的是。
(2)写出流程中生成“滤渣”的离子方程式:。
(3)适量S 2-能将Cu 2+等离子转化为硫化物沉淀而除去,若选择ZnS 进行除杂,是否可行?(填“是”或“否”),[已知:K sp (ZnS )=1.6×10-24,K sp (CuS )=1.3×10-36;K >105化学反应完全,K <10-5化学反应不发生],用计算说明原因。

广东省各地市2023届高考化学一模试题分类汇编-02工业流程题一、工业流程题1.(广东省惠州市2023届高三下学期第一次调研考试化学试题)利用硫酸烧渣(主要含23Fe O 、FeO ,还含有2SiO 和CuO 等)来制取4FeSO 溶液。
(1)①将硫酸烧渣进行粉碎,其目的是_______。
②“酸浸”时,23Fe O 发生反应的离子方程式是_______。
(2)“还原”时,铁粉将3Fe +、2Cu +还原为2Fe +和Cu 。
检验3Fe +是否已全部被还原,所选用试剂的化学式是_______。
(3)将得到的4FeSO 溶液进行下列操作,测定其物质的量浓度:步骤一:取410.00mLFeSO 溶液,将其稀释成100.00mL 溶液。
步骤二:取25.00mL 稀释后的溶液,向其中加入10.100mol L -⋅酸性4KMnO 溶液。
恰好反应时,记下消耗4KMnO 溶液的体积。
步骤三:重复上述实验3次,平均消耗4KMnO 溶液20.00mL 。
已知:22342___MnO ___Fe ___H ___Mn ___Fe ___H O +-++++++=+(未配平)①配平上述方程式_______。
②“步骤一”中稀释时所用的水需先进行加热煮沸,其目的是_______。
③试通过计算,求原4FeSO 溶液的物质的量浓度是多少?(写出计算过程)_______2.(广东省江门市2023届高三下学期第一次模拟考试化学试题)(氧化铬(Cr 2O 3)可用作着色剂、分析试剂、催化剂等。
以含铬废料(含FeCr 2O 4、MgO 、SiO 2、Al 2O 3等)为原料制备氧化铬的一种流程如图所示。
已知:烧渣的成分为Na 2CrO 4、NaAlO 2、Na 2SiO 3、Fe 2O 3、MgO ;25℃时,K sp [Fe(OH)3]=4×10-38、K sp [Al(OH)3]=1×l0-33、K sp [Mg(OH)2]=2×10-11,溶液中离子浓度≤10-5mol·L -1时,认为该离子沉淀完全。

2023届高考化学一轮专题强化训练——工业流程题1.(2022·广东·普宁市华侨中学二模)2—甲氧基—2—甲基丁烷(TAME)常用作汽油原添加剂。
在催化剂作用下,可通过甲醇与烯烃的液相反应制得,体系中同时存在如图反应: 反应I :+CH 3OH △H 1反应II :+CH 3OH △H 2反应III:△H 3回答下列问题: (1)反应I 、II 、III 以物质的量分数表示的平衡常数K x (即用物质的量分数代替浓度表示平衡常数)与温度T 变化关系如图所示。
据图判断,A 和B 中相对稳定的是____(用系统命名法命名);12ΔH ΔH 的数值范围是_____(填标号)。
A .<-1 B .-1~0 C .0~1 D .>1(2)为研究上述反应体系的平衡关系,向某反应容器中加入1.0molTAME ,控制温度为353K ,测得TAME 的平衡转化率为α。
已知反应III 的平衡常数K x3=9.0,则平衡体系中B 的物质的量为_______mol ,反应I 的平衡常数K x1=_______。
同温同压下,再向该容器中注入惰性溶剂四氢呋喃稀释,反应I 的化学平衡将_______(填“正向移动”“逆向移动”或“不移动”)平衡时,A 与CH 3OH 物质的量浓度之比c (A)△c (CH 3OH)=_______。
(3)为研究反应体系的动力学行为,向盛有四氢呋喃的另一容器中加入一定量A 、B 和CH 3OH 。
控制温度为353K ,A 、B 物质的量浓度c 随反应时间t 的变化如图所示。
曲线X 代表B 的变化,则t =100s 时,反应III 的正反应速率v 正_______逆反应速率v 逆(填“>”“<”或“=)。
2.(2022·天津·二模)回答下列问题:(1)利用水煤气合成二甲醚的反应如下:△2H2(g)+CO(g)CH3OH(g) ΔH=-90.8kJ/mol△2CH3OH(g)CH3OCH3(g)+H2O(g) ΔH=-23.5kJ/mol△CO(g)+H2O(g)CO2(g)+H2(g) ΔH=-41.3kJ/mol总反应:3H2(g)+3CO(g)CH3OCH3(g)+CO2(g)的ΔH=____kJ/mol;一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是____(多选)。
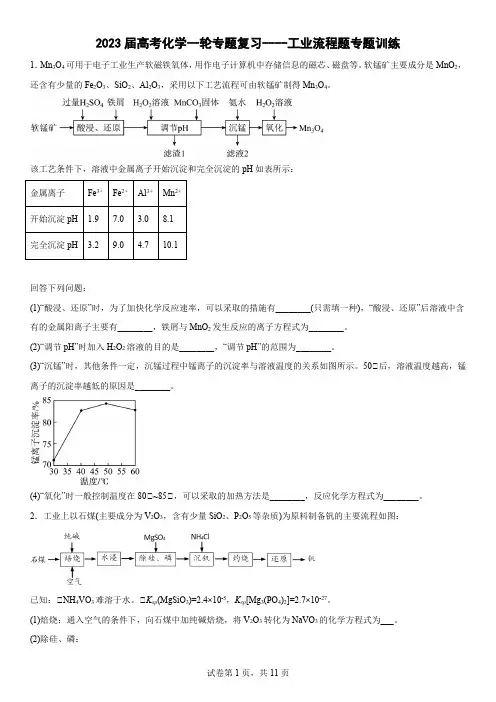
2023届高考化学一轮专题复习----工业流程题专题训练1.Mn3O4可用于电子工业生产软磁铁氧体,用作电子计算机中存储信息的磁芯、磁盘等。
软锰矿主要成分是MnO2,还含有少量的Fe2O3、SiO2、Al2O3,采用以下工艺流程可由软锰矿制得Mn3O4。
该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如表所示:金属离子Fe3+Fe2+Al3+Mn2+开始沉淀pH 1.97.0 3.08.1完全沉淀pH 3.29.0 4.710.1回答下列问题:(1)“酸浸、还原”时,为了加快化学反应速率,可以采取的措施有________(只需填一种),“酸浸、还原”后溶液中含有的金属阳离子主要有________,铁屑与MnO2发生反应的离子方程式为________。
(2)“调节pH”时加入H2O2溶液的目的是________,“调节pH”的范围为________。
(3)“沉锰”时,其他条件一定,沉锰过程中锰离子的沉淀率与溶液温度的关系如图所示。
50℃后,溶液温度越高,锰离子的沉淀率越低的原因是________。
(4)“氧化”时一般控制温度在80℃~85℃,可以采取的加热方法是________,反应化学方程式为________。
2.工业上以石煤(主要成分为V2O3,含有少量SiO2、P2O5等杂质)为原料制备钒的主要流程如图:已知:℃NH4VO3难溶于水。
℃K sp(MgSiO3)=2.4×10-5,K sp[Mg3(PO4)2]=2.7×10-27。
(1)焙烧:通入空气的条件下,向石煤中加纯碱焙烧,将V2O3转化为NaVO3的化学方程式为___。
(2)除硅、磷:℃用MgSO4溶液除硅、磷时,Si、P会形成Mg3(PO4)2、MgSiO3沉淀。
若沉淀后溶液中c(PO34-)=1.0×10-8mol•L-1,则c(SiO23-)=___mol•L-1。
℃如图所示,随着温度升高,除磷率下降,其原因是Mg3(PO4)2溶解度增大、___;随着温度升高,除硅率升高,其原因是___。

2023届高考化学一轮强化训练——工业流程题 1.(2022·辽宁沈阳·高三专题练习)三氯化六氨合钴()336Co NH Cl ⎡⎤⎣⎦是橙黄色、微溶于水的配合物,是合成其它一些含钴配合物的原料。
下图是某科研小组以含钴废料(含少量Fe Al 、等杂质)制取()336Co NH Cl ⎡⎤⎣⎦的工艺流程:己知:2Co(OH)和3Co(OH)均难溶于水,且3Co +较2Co +更易结合OH - 回答下列问题:(1)写出加“适量3NaClO ”发生反应的离子方程式___________。
(2)“加23Na CO 调pH 至a”会生成两种沉淀,分别为___________、___________(填化学式)。
(3)操作I 的步骤包括___________、冷却结晶、减压过滤。
(4)流程中4NH Cl 除作反应物外,还可防止加氨水时()-c OH 过大,其原理是___________。
(5)写出“氧化”步骤的化学方程式:___________。
甲同学认为应先加入氨水再加入22H O ,乙同学认为试剂添加顺序对产物无影响。
你认为___________(填“甲”或“乙”)同学观点正确,理由是___________。
(6)通过碘量法可测定产品中钴的含量。
将()336Co NH Cl ⎡⎤⎣⎦转化成3Co +后,加入过量KI 溶液,再用223Na S O 标准液滴定(淀粉溶液做指示剂),反应原理:3+-2+2--2-2223462Co +2I =2Co +I I +2S O =2I +S O ,,实验过程中,下列操作会导致所测钴含量数值偏高的是___________。
A .用久置于空气中的KI 固体配制溶液B .盛装223Na S O 标准液的碱式滴定管未润洗C .滴定结束后,发现滴定管内有气泡D .溶液蓝色退去,立即读数2.(2022·广西南宁·高三开学考试)金属及其化合物在生产生活中占有极其重要的地位,请结合金属及其化合物的相关知识回答下列问题:(1)目前使用量最大的合金是_______。
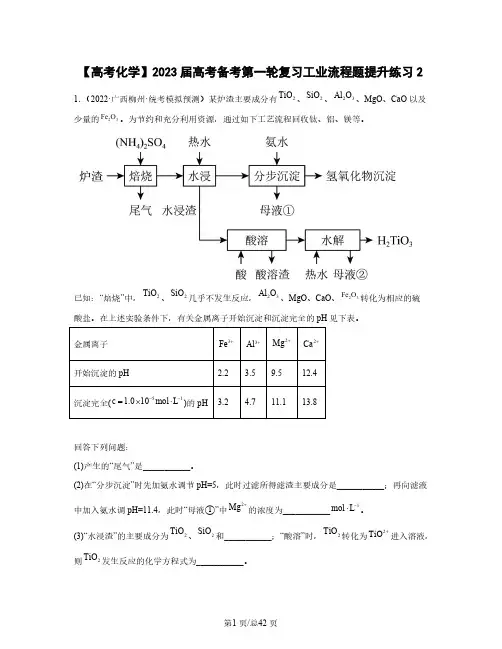
【高考化学】2023届高考备考第一轮复习工业流程题提升练习21.(2022·广西柳州·统考模拟预测)某炉渣主要成分有、、、MgO 、CaO 以及2TiO 2SiO 23Al O 少量的。
为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。
23Fe O已知:“焙烧”中,、几乎不发生反应,、MgO 、CaO 、转化为相应的硫2TiO 2SiO 23Al O 23Fe O 酸盐。
在上述实验条件下,有关金属离子开始沉淀和沉淀完全的pH 见下表。
金属离子3Fe +3Al +2Mg +2Ca +开始沉淀的pH2.23.59.512.4沉淀完全()的pH51c 1.010mol L --=⨯⋅ 3.24.711.113.8回答下列问题:(1)产生的“尾气”是___________。
(2)在“分步沉淀”时先加氨水调节pH=5,此时过滤所得滤渣主要成分是___________;再向滤液中加入氨水调pH=11.4,此时“母液①”中的浓度为___________。
2Mg +1mol L -⋅(3)“水浸渣”的主要成分为、和___________;“酸溶”时,转化为进入溶液,2TiO 2SiO 2TiO 2TiO +则发生反应的化学方程式为___________。
2TiO(4)“酸溶”后,将溶液适当稀释并加热,“水解”生成沉淀,该反应的离子方程式是23H TiO ___________。
2.(2022秋·福建宁德·高三统考期末)从烟气脱硝催化剂(SCR)中回收金属元素可实现资源的循环利用。
一种从废弃SCR(主要含、、、、)中回收金属钒和钨的2TiO 25V O 3WO 2SiO 23Al O 流程如下:请回答下列问题:(1)为了加快“碱浸”的速率,可采取的措施有_______(任填一种)。
“碱浸”时,滤液中的阴子除、、外还有_______。
OH -24WO -3VO -(2)操作ⅰ的名称为_______;滤渣1的主要成分为_______(填化学式)。

2023届高考化学一轮训练题——工业流程题1.(2022·江苏南京·金陵中学校联考模拟预测)硼氢化钠(NaBH4,硼为+3价)为白色粉末,在干燥空气中稳定,在潮湿空气中分解,是常用的还原剂。
偏硼酸钠(NaBO2)易溶于水,不溶于乙醇,易水解。
目前有多种工艺可制备NaBH4。
(1)用硼精矿(含有一定量B2O3,及Al2O3、SiO2、Fe2O3等杂质)制取NaBH4的流程如下:① “溶解”时,B2O3与NaOH反应生成了NaBO2,反应离子方程式为________。
① “除硅铝”步骤加入CaO,而不加入CaCl2的原因有:能将硅、铝以沉淀除去;尽量不带入杂质离子;________。
① “操作2”是将滤液蒸发、结晶、洗涤,其中洗涤选用的试剂最好是________。
① “反应1”是MgH2与NaBO2混合得到NaBH4和MgO,其化学方程式为________。
(2)我国孙彦平采用耐腐蚀电极材料,以阳离子交换膜为隔离膜,电解偏硼酸钠的碱溶液,也可以高效制备NaBH4。
该工艺阳极产物为________,阴极电极方程式为________。
2.(2022·天津河西·统考一模)氯及其化合物在生产、生活中有广泛的应用。
请按照要求回答下列问题。
I.化合物A在一定条件下通过电解所得产品及其之间的反应如下图所示(1)写出反应①离子方程式___________________。
(2)溶液G中还应有的溶质化学式为___________________。
II.以氯酸钠(NaClO3)为原料制备亚氯酸钠(NaClO2)粗品的工艺流程如下图所示:已知:i.纯ClO2易分解爆炸,空气中ClO2的体积分数在10%以下比较安全;ii.NaClO2在碱性溶液中稳定存在,在酸性溶液中迅速分解;iii.NaClO2饱和溶液在温度低于38①时析出NaClO2∙3H2O,等于或高于38①时析出NaClO2晶体,高于60①时分解成NaClO3和NaCl。
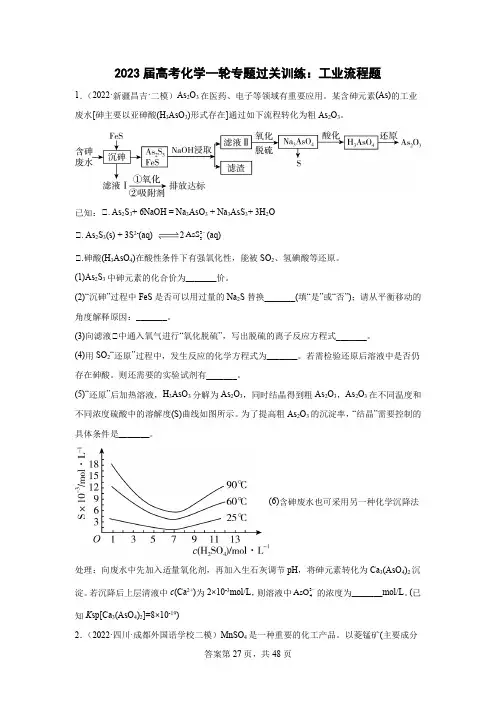
2023届高考化学一轮专题过关训练:工业流程题1.(2022·新疆昌吉·二模)As2O3在医药、电子等领域有重要应用。
某含砷元素(As)的工业废水[砷主要以亚砷酸(H3AsO3)形式存在]通过如下流程转化为粗As2O3。
已知:Ⅰ. As2S3+ 6NaOH = Na3AsO3 + Na3AsS3+ 3H2OAsS-(aq)Ⅰ. As2S3(s) + 3S2-(aq) 233Ⅰ.砷酸(H3AsO4)在酸性条件下有强氧化性,能被SO2、氢碘酸等还原。
(1)As2S3中砷元素的化合价为_______价。
(2)“沉砷”过程中FeS是否可以用过量的Na2S替换_______(填“是”或“否”);请从平衡移动的角度解释原因:_______。
(3)向滤液Ⅰ中通入氧气进行“氧化脱硫”,写出脱硫的离子反应方程式_______。
(4)用SO2“还原”过程中,发生反应的化学方程式为_______。
若需检验还原后溶液中是否仍存在砷酸。
则还需要的实验试剂有_______。
(5)“还原”后加热溶液,H3AsO3分解为As2O3,同时结晶得到粗As2O3,As2O3在不同温度和不同浓度硫酸中的溶解度(S)曲线如图所示。
为了提高粗As2O3的沉淀率,“结晶”需要控制的具体条件是_______。
(6)含砷废水也可采用另一种化学沉降法处理:向废水中先加入适量氧化剂,再加入生石灰调节pH,将砷元素转化为Ca3(AsO4)2沉AsO-的浓度为_______mol/L。
(已淀。
若沉降后上层清液中c(Ca2+)为2×10-3mol/L,则溶液中34知K sp[Ca3(AsO4)2]=8×10-19)2.(2022·四川·成都外国语学校二模)MnSO4是一种重要的化工产品。
以菱锰矿(主要成分为MnCO3,还含有Fe3O4、FeO、CoO等)为原料制备MnSO4的工艺流程如图。
资料:金属离子沉淀的pH(1)写出酸浸前将菱锰矿石粉碎的目的是____。

2023届高考化学第一轮专题复习真题试卷模拟——工业流程题(1)6LiPF 中基态Li +的电子排布式为___________,6PF -中P 原子上的孤电子对数为___________。
(2)反应釜1中生成的3LiHCO 在反应釜2中转化为LiF 沉淀,其反应的离子方程式为___________。
本工艺未采用23Li CO (工业级)与氢氟酸直接反应制备LiF 的原因是___________。
已知:TiO 2难溶于盐酸;K sp [Fe(OH)3]=1.0×10−38。
回答下列问题:(1)为提高“酸浸”速率,对“赤泥”的处理方式为___________;滤渣I 的主要成分是___________(填化学式)。
(2)“氧化”时加入足量H 2O 2的目的是___________;氧化后溶液中Fe 3+浓度为0.001mol∙L −1,常温下“调pH”时,若控制pH =3,则Fe 3+的去除率为___________(忽略调pH 前后溶液的体积变化)。
(3)已知25℃时,K h1(C 2O 24-)=a ,K h2(C 2O 24-)=b ,K sp [Sc 2(C 2O 4)3]=c 。
“沉钪”时,发生反应:2Sc 3++3H 2C 2O 4 Sc 2(C 2O 4)3↓+6H +,该反应的平衡常数K =___________(用含a 、b 、c 的代数式表示)。
(4)Sc 2(C 2O 4)3·6H 2O 在空气中加热至550℃时生成Sc 2O 3、CO 2和H 2O ,写出反应的化学方程式___________。
3.(2023·山东潍坊·统考模拟预测)氧化铈(2CeO )是一种应用非常广泛的稀土氧化物。
现以氟碳铈矿(含3CeFCO 、2SiO 等)为原料制备氧化铈,其工艺流程如图所示:已知:①3Ce +在空气中易被氧化,易与24SO -形成复盐沉淀;②硫脲()具有还原性,酸性条件下易被氧化为()232SCN H ;③4Ce +在硫酸体系中能被萃取剂[()2HA ]萃取,而3Ce +不能。
2023届高考化学一轮专题训练——工业流程题1.(2022·四川巴中·模拟预测)我国稀土资源丰富,其中二氧化铈(CeO2) 是一种重要的稀土氧化物,具有吸收强紫外光线的能力,可以用于光催化降解有机污染物,利用氟碳铈矿(主要成分为CeCO3F)制备CeO2的工艺流程如下:(1)CeCO3F其中Ce元素的化合价为_______。
(2)“焙烧”过程中可以加快反应速率,提高焙烧效率的方法有_______ ( 写出一种即可)。
(3)操作①所需的玻璃实验仪器有烧杯、________、________。
(4)上述流程中盐酸可用硫酸和H2O2替换,避免产生污染性气体Cl2,由此可知氧化性: CeO2_____ H2O2 (填“>”或“<”)。
(5)写出“沉铈”过程中的离子反应方程式______________。
若“沉铈”中,Ce3+恰好沉淀完全[c(Ce3+)为1.0×10-5mol·L-1,此时溶液的pH为5,则溶液中HCO)=______ mol·L-1 (保留2位有效数字)。
c(-3已知常温下:(6)Ce4+溶液可以吸收大气中的污染物NO x,减少空气污染,其转化过程如图所示(以NO2为例)。
①该反应中的催化剂为_____________(写离子符号);①该转化过程中还原剂与氧化剂物质的量之比为_____。
2.(2022·广东深圳·一模)钾离子电池以其优异的性能成为替代理离子电池的一种选择,该电池的负极是由钾嵌入石墨中构成,正极主要含24K NiFeO 、铝箔、醚类有机物等。
从某废旧钾离子电池中回收部分材料的流程如下:已知:I.放电时负极的电极反应式为-+x 66K C -xe =C +xK ;II .常温下,()38sp 3K Fe OH 410-⎡⎤=⨯⎣⎦,当溶液中某离子浓度低于51110mol L --⨯⋅时,认为该离子已沉淀完全。
2023届高考化学一轮训练—工业流程题1.(2022·北京·101中学高三期中)某粗铜精炼得到的阳极泥主要成分为Cu 、Se 、Ag 2Se 等,从中提取Se 的工艺流程如下:已知: 化学式 Ag 2Se AgClK sp (常温) 642.010-⨯ 101.810-⨯(1)“酸浸”过程中,加入稀硫酸并通入空气的目的是_______。
(2)“氯化”过程中发生如下转化:①Se 转化为H 2SeO 3,反应方程式为_______。
①Ag 2Se 转化为AgCl ,结合化学用语从化学平衡的角度解释原因_______。
(3)“还原”过程中发生反应的化学方程式为_______。
(4)滴定法测定“酸浸”过程所得CuSO 4溶液的浓度,其基本原理为:第一步:222Cu 4I 2CuI I +-+=↓+第二步:22232462S O () I S O () 2I ---+=+无色无色①由反应原理可知滴定所用的指示剂为_______。
①若CuSO 4溶液体积为25mL ,滴定至终点时消耗c mol/L Na 2S 2O 3溶液V mL ,则CuSO 4溶液的物质的量浓度为_______mo/L 。
①若第一步使用的KI 溶液过量,对滴定结果的影响是_______ (填“偏大”或“偏小”或“不影响”)。
2.(2022·黑龙江·建三江分局第一中学高三期中)已知氮元素及其化合物的转化关系如下图所示,回答下列问题。
(1)①~ ①各步转化中,属于氮的固定的是_______(填序号)。
(2)实验室常用加热氯化铵和氢氧化钙固体混合物的方法制取氨气。
①化学方程式是_______。
①干燥氨气不可选用的试剂是_______(填字母)。
a.浓硫酸b.NaOH固体c.碱石灰(3)工业上用氨气制备NO的化学方程式是_______。
(4)工业制硝酸时尾气中含有NO、NO2,可用以下方法吸收:①NaOH溶液吸收法。
高考化学一轮强化训练:工业流程题学校:___________姓名:___________班级:___________考号:___________1.(·辽宁·大连二十四中三模)从铝土矿废料“赤泥”(主要成分为Al2O3、Fe2O3、TiO2、Sc2O3)中提钪与TiO2的一种工艺流程如图:己知:①钪离子可以在不同pH下生成[Sc(OH)n]3-n(n=1~6)。
①该工艺条件下,溶液中相关离子开始沉淀和完全沉淀的pH值如表:离子Fe2+Fe3+Al3+TiO2+开始沉淀pH7.0 1.9 3.00.3完全沉淀pH9.0 3.2 4.7 2.0请回答以下问题:(1)Sc元素在元素周期表中的位置:____。
(2)试计算“反萃取”时,使Sc3+恰好完全沉淀(浓度为1.0×10-6)的pH=____(已知:K sp[Sc(OH)3]=8.00×10-30,lg2=0.30,计算结果保留3位有效数字)。
(3)“反萃取”时若加入的NaOH过量则Sc(OH)3沉淀会溶解。
写出Sc(OH)3与过量NaOH溶液反应生成n=6的含钪产物的化学方程式____。
(4)常温下,三价Sc的几种存在形式与F-浓度的对数[1gc(F-)]、pH的关系如图所示。
若溶液中c(F-)=5×10-6,“调pH”过程中控制pH=4.0,则调pH后三价Sc的存在形式为____(填化学式)(已知:lg5=0.7)。
(5)钪的萃取率(E%)与O/A值[萃取剂体积(O)和酸液体积(A)之比]的关系如图,应.选择的合适O/A值为____。
(6)向“水相”中加入铁粉的目的是____。
(7)“水解”过程中,加水稀释后,TiOSO4水解为TiO2·xH2O的离子方程式为____。
2.(·内蒙古呼和浩特·一模)铬系和非铬系铜镍电镀污泥均含有Cu(①)、Ni(①)、Fe(①)、Al(①)的氢氧化物,前者还含有Cr(①)的氢氧化物,一种综合回收铜、镍的新工艺流程如下:已知:Cr及其化合物的性质与铝类似。
2023届高考化学一轮专题训练—工业流程题1.(2022·广东茂名·模拟预测)钼酸铵[(NH 4)2MoO 4]是生产高纯度钼制品、钼催化剂、钼颜料等的基本原料。
一种以钼精矿(主要含MoS 2,还含有少量SiO 2、As 、Sn 、P 、Cu 、Pb 、CaO)为原料制备钼酸铵的工艺流程如图所示:已知:钼盐溶液中含钼物种之间的平衡关系为:()()()10-2-2-pH=6.5pH=5pH=3.5pH=1.22-41241310413242MoO Mo O Mo O Mo O H MoO xH O ⋅回答下列问题:(1)(NH 4)2MoO 4中Mo 元素的化合价为_______价。
(2)“氧化焙烧”时MoS 2转化为MoO 3,该反应中氧化剂与还原剂的物质的量之比为_______;气体A 对环境的主要危害是_______。
(3)“除铜”时选择在60~80℃的条件下进行的原因为_______。
(4)“沉淀”过程中加入H 2SO 4调节溶液pH=2.1,则所得沉淀的化学式为_______,加入氨水后生成(NH 4)2MoO 4的化学方程式为_______。
(5)(NH 4)6Mo 7O 24·4H 2O 的热重曲线如图所示:已知A 点失重的原因是生成H 2O ,则1 mol (NH 4)6Mo 7O 24·4H 2O 在A 点失去H 2O 的物质的量为_______,B 点所得的物质为_______(填化学式)。
2.(2022·四川成都·模拟预测)铅和砷的化合物大多数有毒,易对环境造成污染。
从高砷烟尘中回收制备砷酸钠晶体的工艺流程如图所示。
已知:℃.高砷烟尘的成分为()543Pb AsO OH 、23As O 、25As O 和58Pb O ,且23As O 、25As O 均为酸性氧化物。
℃.亚砷酸钠()2NaAsO 是灰白色的固体,易溶于水,具有还原性。
砷酸钠()34Na AsO 是灰白色粉末,溶于水、甘油。
回答下列问题:(1)本流程中多次涉及固液分离,实验室中通过普通过滤实现固液分离用到的玻璃仪器有___________ (填仪器名称)。
(2)58Pb O 中2Pb +与4Pb +的数目之比为___________。
“碱浸”时,58Pb O 与2Na S 反应生成NaOH 等产物的化学方程式为___________(用离子方程式表示)。
(3)流程中,“氧化”操作的目的是___________(用离子方程式表示)。
(4)“系列操作”为___________。
“滤液”可循环使用,应将其导入___________(填操作单元的名称)操作中。
(5)砷酸钠()34Na AsO 可用于可逆电池,装置如图甲所示,其反应原理为34AsO 4H -+++2222I AsO I 2H O --++。
探究pH 对34AsO -氧化性的影响,测得输出电压与pH 的关系如图乙所示。
则a 点时,盐桥中K +___________(填“向左”“向右”或“不”)移动,c 点时,负极的电极反应为___________。
3.(2022·广东广州·模拟预测)高锰酸钾生产过程中产生的废锰渣(主要成分为MnO 2、KOH 、MgO 和Fe 2O 3)可用于制备MnSO 4晶体,工艺流程如图所示:该工艺条件下金属离子开始沉淀和完全沉淀的pH如下表所示:回答以下问题:(1)滤渣B的成分是单质S,反应II的化学方程式是___________;(2)反应III加入MnO2的作用是___________;(3)加入CaCO3的作用是调节溶液的pH除去铁元素。
调节溶液pH的范围是___________;用离子方程式___________和简要文字说明碳酸钙除去铁元素的原因是___________。
(4)滤渣C的成分是___________。
(5)如图所示,将精制MnSO4溶液送入电解槽,电解制得二氧化锰(EMD)。
生成EMD的是电极是_____ (填“a”或“b”),生成EMD的电极反应式是___________。
4.(2022·安徽六安·模拟预测)硫酸锰是一种重要的化工中问体。
一种以高硫锰矿(主要成分为含锰化合物及FeS)为原料制备硫酸锰的工艺流程如下:已知:℃“混合焙烧”后烧渣含MnSO4、Fe2O3及少量FeO、Al2O3、MgO。
℃金属离子在水溶液中沉淀的pH范围如下表所示(25°C):℃离子浓度 10-5mol·L-1时,离子沉淀完全。
请回答:(1)“混合焙烧”主要目的是_______(2)若试剂a为MnO2,则氧化步骤发生反应的离子方程式为_______,若省略“氧化”步骤,造成的影响是_______。
(3)“中和除杂”时,应控制溶液的pH范围是_______。
(4)“氟化除杂”后,溶液中c(F- )浓度为0.05mol/L。
则溶液中c(Mg2+)和c (Ca2+)的比值=_______(已知:K sp(MgF2)= 6.4×10-10;K sp(CaF2)=3.6×10-12)(5)“碳化结晶”时选择NH4HCO3,NH4HCO3溶液中各离子浓度大小顺序为_______,(已知CH3COONH4溶液呈中性)“碳化结晶”时发生反应的离子方程式为_______,“碳化结晶”时不选择Na2CO3溶液的原因是_______。
5.(2022·四川成都·模拟预测)镍及其化合物在工业上有广泛用途,以某地红土镍矿(主要成分NiO、MgO、Al2O3、SiO2和铁的氧化物为原料,采用酸溶法制取硫酸镍和MgSO4●7H2O,工业流程如图所示。
已知:℃常温下,NiSO4易溶于水,Ni(OH)2和NiOOH不溶于水,已知K sp[Ni(OH)2]=1.0×10-15。
℃在上述流程中,某些金属离子开始沉淀和沉淀完全时的pH如下:回答下列问题:(1)“浸取”时需将矿样研磨的目的是___________,“滤渣1”的成分___________(填化学式)。
(2)滤液1中加入H2O2的作用___________(用反应离子方程式表示)。
(3)操作II为达到实验目的,由表中的数据判断通入NH3调节溶液pH的范围是___________(4)“滤液1”中是否存在Fe3+,可用___________ (填试剂名称) 检验,检验存在Fe3+的实验方法是___________。
(5)“沉镍”中pH调为8.5,则滤液中Ni2+的浓度为___________mol·L-1(6)操作V是___________、过滤、洗涤。
(7)NiSO4在碱性溶液中用NaClO氧化,可制得碱性镍镉电池电极材料NiOOH,该反应的离子方程式___________。
6.(2022·安徽马鞍山·一模)钪(Sc)是一种稀土金属。
从钛白酸性废水(主要含Ti、Fe2+,微量Sc)中富集钪,并制备氧化钪(Sc2O3)的工艺流程如下。
回答下列问题:(1)“有机相”中主要含有Ti4+、Fe2+、Sc3+,酸洗时加入H2O2的目的是___________;(2)在实验室中,“操作1”需要的玻璃仪器有烧杯、___________,“滤渣1”的主要成分是Ti(OH)4、___________(3)调pH的目的是___________;检验“含Sc3+“滤液”中是否含Fe3+的操作为___________。
(4)写出草酸钪焙烧时反应的化学方程式___________(5)钛白酸性废水中Sc3+含量10.0~20.0mg·L-1,该工艺日处理钛白酸性废水50.0m3,理论上能生产含85%氧化钪的产品最多___________kg。
7.(2022·甘肃·武威第六中学模拟预测)钒铬还原渣是钠化提钒过程的固体废弃物,其主要成分为VO2∙xH2O、Cr(OH)3及少量的SiO2.一种初步分离钒铬还原渣中钒铬并获得Na2Cr2O7的工艺流程如图。
已知:℃“酸浸”后VO2▪xH2O转化为VO2+;℃1g2=0.3;℃Cr(OH)3的K sp近似为1×10-30;℃有关物质的溶解度(g/100gH2O)如表所示:回答下列问题:(1)写出“滤渣”的一种用途___________,“氧化”生成VO2 ,反应中氧化剂与还原剂的物质的量之比为___________。
(2)若“含Cr3+净化液”中c(Cr3+)=0.125mol·L-1,则“水解沉钒”调pH的范围是2.5~___________。
(结果保留1位小数)(3)“溶液1”中含CrO2 ,加入H2O2后发生的化学反应方程式为___________。
(4)“溶液2调pH”,所发生反应的离子方程式___________。
(5)“多步操作”包括蒸发浓缩、___________、冷却结晶、过滤、洗涤等步骤。
(6)研究温度对Na2S2O8与H2O2的氧化-水解沉钒率的影响,得到如图所示结果。
钒铬还原渣酸浸液初始温度在80℃左右,降低温度能耗增加。
由图可知,分别采用Na2S2O8、H2O2进行“氧化”时,应选择的适宜温度是___________、___________,在“氧化”工艺中不采用H2O2氧化的原因是___________(写出两点)。
8.(2022·广东肇庆·二模)菱镁矿的主要成分为MgCO3还含少量SiO2、Fe2O3和Al2O3。
工业上利用菱镁矿冶炼镁的路径有两种,具体工业流程如下图。
回答下列问题:(1)“煅烧”时,需将菱镁矿破碎,并将热空气从底部吹入,这两种操作的优点为___________。
(2)工艺I中所得“废渣”中含钙成分有___________(填化学式)。
(3)工艺II中“浸出”操作中溶解氧化镁的离子方程式为___________。
(4)“沉镁”操作中温度不宜过高,原因为___________。
(5)“沉镁”过程中当镁离子沉淀完全时,溶液中c(NH 4+):c(NH 3·H 2O)至少为___________(填计算结果)。
(已知K b (NH 3·H 2O)=1.6×10-5;K sp [Mg(OH)2]=1.0×10-11;当溶液中离子浓度小于1.0×10-5×mol·L -1时,认为该离子沉淀完全。
) (6)“操作”具体是指___________。
(7)“熔融电解”时阳极的电极反应式为___________。
9.(2022·山西吕梁·一模)3CoCO 可用作选矿剂、催化剂及涂料的颜料。