单效蒸发及计算
- 格式:docx
- 大小:53.00 KB
- 文档页数:15

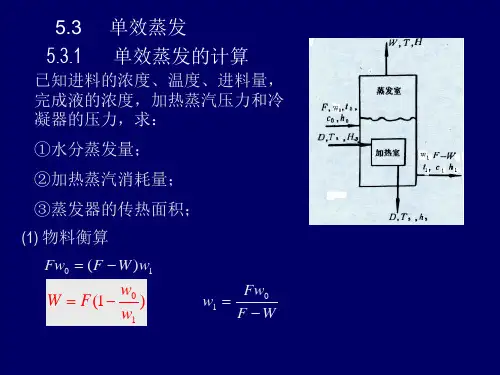



单效蒸发器计算公式输入原始数据即可自动计算单效蒸发器计算一、蒸发水量(W)计算计算值根据溶质的物料衡算,得:F?X0=(F-W)?X1=L?X1则水的蒸发量为:W=F?(1-X0/X1)=450完成液的浓度为:X1=F?X0/(F-W)=0.2二、加热蒸汽消耗量(D)计算:做热量衡算,得:D?H+F?h0=W?h′+L?h1+D?h c+Q L或:Q=D?(H-h c)=W?h′+L?h1-F?h0+Q L=1183217若考虑溶液浓缩热不大,并将H取t1下饱和整齐的焓。
则:D=[F?c0?(t1-t0)+W?r′+Q L]/r=124.04式中r、r′分别为加热蒸汽和二次蒸汽的气化潜热,kJ/Kg。
由于蒸汽的气化潜热随压力变化不大,故r≈r′。
三、传热面积(A)计算:A=Q/(K?ΔTm)=9.63若忽略热损失,则Q为加热蒸汽冷凝放出的热量:Q=D?(H-h?c)=D?r=280320算各组分的值F——原料液量,kg/h;500W——蒸发水量,kg/h;450L——完成液量,kg/h;50X0——原料液中溶质的浓度,质量分数;0.02X1——完成液中溶质的浓度,质量分数;0.2t0——原料液的温度,℃;20t1——完成液的温度,℃;100H ——加热蒸汽的焓,kJ/kg;2733.9 h′——二次蒸汽的焓,kJ/kg;2676.1h0——原料液的焓,kJ/kg;83.96h1——完成液的焓,kJ/kg;419.04h c ——加热室排出冷凝液的焓,kJ/kg;2691.5 Q ——蒸发器的热负荷或传热速率,kJ/h;Q L ——热损失,可取Q的某一百分数,kJ/h;c0——原料液的比热,kJ/(kg·℃); 4.183c1——完成液的比热,kJ/(kg·℃); 4.212r ——加热蒸汽的气化潜热,kJ/Kg;2260 r′——二次蒸汽的气化潜热,kJ/Kg。
2260 K——总传热系数,w/(m2/℃);2410ΔTm——平均传热温差,℃。

单效蒸发及计算范文单效蒸发是一种常见的蒸发操作过程,用于从溶液中分离溶剂和溶质。
在单效蒸发中,溶液在一个蒸发器中加热,使溶剂蒸发,然后凝结和收集。
单效蒸发的基本原理是根据溶剂和溶质之间的汽液平衡关系。
在溶液中,溶剂的蒸汽压与溶质的蒸汽压不同,溶剂的蒸汽压较高,因此在加热的过程中,溶剂会先蒸发,而溶质则会留在液相中。
通过控制加热温度和压力,可以实现溶剂和溶质的分离。
单效蒸发的计算涉及一些基本参数,如溶液的初始浓度、蒸发温度、蒸汽压、蒸发器的流量和效率等。
以下是一个简单的单效蒸发计算实例:假设我们有一种溶液,初始浓度为10%(质量分数),总体积为1000升。
我们希望通过单效蒸发把溶剂蒸发掉,从而得到更高浓度的溶液。
蒸发器的进料流量为100升/小时,效率为90%。
首先,我们需要确定溶液中的溶剂和溶质的组分和浓度。
假设这是一个水和盐的溶液,溶剂为水,溶质为盐。
根据溶液的初始浓度,我们可以得到溶液中的溶剂和溶质的质量。
溶液的初始质量为1000升*10%=100千克,其中溶剂的质量为100千克*(1-10%)=90千克,溶质的质量为100千克-90千克=10千克。
接下来,我们需要根据溶液的成分和性质确定溶剂和溶质的蒸汽压。
水的蒸汽压可以通过查找蒸汽压表得到,假设此温度下水的蒸汽压为5千帕。
盐的蒸汽压可以忽略不计,因为溶剂和溶质的蒸汽压差异较大。
然后,我们可以计算蒸发器中的蒸汽流量。
蒸汽流量等于进料流量乘以效率,即100升/小时*90%=90升/小时。
最后,我们可以计算蒸发的速率。
蒸发速率等于溶剂的质量除以溶剂的密度,再除以流量,即90千克/(90升/小时)=1千克/升。
通过这个例子,我们可以看到单效蒸发的计算包括了溶液的成分和浓度、蒸发温度、蒸汽压、流量和效率等参数的考虑。
根据实际情况,还可以进一步考虑热损失、传热系数等因素来优化蒸发过程。

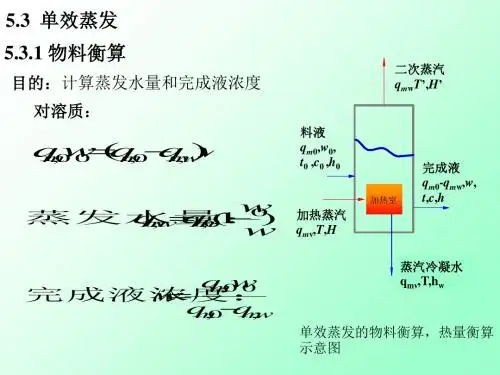
一.物料衡算二.能量衡算1.可忽略溶液稀释热的情况2.溶液稀释热不可忽略的情况三.传热设备的计算1.传热的平均温度差2.蒸发器的传热系数3.传热面积计算四.蒸发强度与加热蒸汽的经济性1.蒸发器的生产能力和蒸发强度2.加热蒸汽的经济性单效蒸发及计算一.物料衡算(materialbalance)对图片5-13所示的单效蒸发器进行溶质的质量衡算,可得由上式可得水的蒸发量及完成液的浓度分别为(5-1)(5-2)式中F———原料液量,kg/h;W———水的蒸发量,kg/h;L———完成液量,kg/h;x0———料液中溶质的浓度,质量分率;x1———完成液中溶质的浓度,质量分率。
二.能量衡算(energybalance)仍参见图片(5-13),设加热蒸汽的冷凝液在饱和温度下排出,则由蒸发器的热量衡算得(5-3)或(5-3a)式中D———加热蒸汽耗量,kg/h;H———加热蒸汽的焓,kJ/kg;h0———原料液的焓,kJ/kg;H'———二次蒸汽的焓,kJ/kg;h1———完成液的焓,kJ/kg;hc———冷凝水的焓,kJ/kg;QL———蒸发器的热损失,kJ/h;Q———蒸发器的热负荷或传热速率,kJ/h。
由式5-3或5-3a可知,如果各物流的焓值已知及热损失给定,即可求出加热蒸汽用量D以及蒸发器的热负荷Q。
溶液的焓值是其浓度和温度的函数。
对于不同种类的溶液,其焓值与浓度和温度的这种函数关系有很大的差异。
因此,在应用式5-3或5-3a求算D时,按两种情况分别讨论:溶液的稀释热可以忽略的情形和稀释热较大的情形。
1.可忽略溶液稀释热的情况大多数溶液属于此种情况。
例如许多无机盐的水溶液在中等浓度时,其稀释的热效应均较小。
对于这种溶液,其焓值可由比热容近似计算。
若以0℃的溶液为基准,则(5-4)(5-4a)将上二式代入式5-3a得(5-3b)式中t0———原料液的温度,℃;t1———完成液的温度,℃;C0———原料液的比热容,℃;C1———完成液的比热容,℃;当溶液溶解的热效应不大时,其比热容可近似按线性加合原则,由水的比热容和溶质的比热容加合计算,即(5-5)(5-5a)式中CW———水的比热容,℃;CB———溶质的比热容,℃。
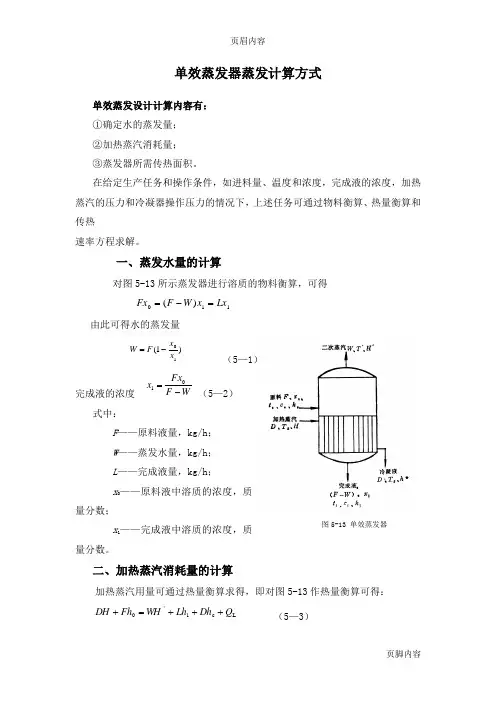
页眉内容单效蒸发器蒸发计算方式单效蒸发设计计算内容有: ①确定水的蒸发量; ②加热蒸汽消耗量; ③蒸发器所需传热面积。
在给定生产任务和操作条件,如进料量、温度和浓度,完成液的浓度,加热蒸汽的压力和冷凝器操作压力的情况下,上述任务可通过物料衡算、热量衡算和传热速率方程求解。
一、蒸发水量的计算对图5-13所示蒸发器进行溶质的物料衡算,可得由此可得水的蒸发量(5—1)完成液的浓度(5—2)式中:F ——原料液量,kg/h ; W ——蒸发水量,kg/h ; L ——完成液量,kg/h ; x 0——原料液中溶质的浓度,质量分数;x 1——完成液中溶质的浓度,质量分数。
二、加热蒸汽消耗量的计算加热蒸汽用量可通过热量衡算求得,即对图5-13作热量衡算可得:(5—3)110)(Lx x W F Fx =-=)1(1x x F W -=W F Fx x -=1Lc 10Q Dh Lh WH Fh DH +++=+‘图5-13 单效蒸发器或(5—3a )式中:H ——加热蒸汽的焓,kJ/kg ; H ´——二次蒸汽的焓,kJ/kg ; h 0 ——原料液的焓,kJ/kg ; h 1 ——完成液的焓,kJ/kg ;h c ——加热室排出冷凝液的焓,kJ/h ; Q ——蒸发器的热负荷或传热速率,kJ/h ; Q L ——热损失,可取Q 的某一百分数,kJ/kg ; c 0、c 1——为原料、完成液的比热,kJ/(kg ·℃) 。
考虑溶液浓缩热不大,并将H ´取t 1下饱和蒸汽的焓,则(9—3a )式可写成:(5—4)式中: r 、r ´——分别为加热蒸汽和二次蒸汽的汽化潜热,kJ/kg 。
若原料由预热器加热至沸点后进料(沸点进料),即t 0=t 1,并不计热损失,则(4—5)式可写为:(5—5)或(5—5a ) 式中:D /W 称为单位蒸汽消耗量,它表示加热蒸汽的利用程度,也称蒸汽的经济性。

单效蒸发及计算 Prepared on 22 November 2020单效蒸发及计算一.物料衡算(materialbalance)对图片5-13所示的单效蒸发器进行溶质的质量衡算,可得由上式可得水的蒸发量及完成液的浓度分别为(5-1)(5-2)式中F———原料液量,kg/h;W———水的蒸发量,kg/h;L———完成液量,kg/h;x0———料液中溶质的浓度,质量分率;x1———完成液中溶质的浓度,质量分率。
二.能量衡算(energybalance)仍参见图片(5-13),设加热蒸汽的冷凝液在饱和温度下排出,则由蒸发器的热量衡算得(5-3)或(5-3a)式中D———加热蒸汽耗量,kg/h;H———加热蒸汽的焓,kJ/kg;h0———原料液的焓,kJ/kg;H'———二次蒸汽的焓,kJ/kg;h1———完成液的焓,kJ/kg;hc———冷凝水的焓,kJ/kg;QL———蒸发器的热损失,kJ/h;Q———蒸发器的热负荷或传热速率,kJ/h。
由式5-3或5-3a可知,如果各物流的焓值已知及热损失给定,即可求出加热蒸汽用量D以及蒸发器的热负荷Q。
溶液的焓值是其浓度和温度的函数。
对于不同种类的溶液,其焓值与浓度和温度的这种函数关系有很大的差异。
因此,在应用式5-3或5-3a求算D时,按两种情况分别讨论:溶液的稀释热可以忽略的情形和稀释热较大的情形。
1.可忽略溶液稀释热的情况大多数溶液属于此种情况。
例如许多无机盐的水溶液在中等浓度时,其稀释的热效应均较小。
对于这种溶液,其焓值可由比热容近似计算。
若以0℃的溶液为基准,则(5-4)(5-4a)将上二式代入式5-3a得(5-3b)式中t0———原料液的温度,℃;t1———完成液的温度,℃;C0———原料液的比热容,℃;C1———完成液的比热容,℃;当溶液溶解的热效应不大时,其比热容可近似按线性加合原则,由水的比热容和溶质的比热容加合计算,即(5-5)(5-5a)式中CW———水的比热容,℃;CB———溶质的比热容,℃。
单效蒸馏器蒸发计算方式
单效蒸馏器是一种常见的蒸馏设备,常用于分离液体的混合物。
蒸发计算是在设计和操作蒸馏器时必不可少的环节。
蒸发计算的基本原理是根据物料的物理化学性质和热力学原理,确定蒸馏器的操作条件和设计参数。
下面是一个简单的蒸发计算方式,供参考:
1. 确定进料物料的质量流率和组成,包括液相和气相组分的含量。
2. 确定蒸发器的进料温度和出料温度,这涉及到蒸发器的设计
要求和操作目标。
3. 根据物料的蒸发热和热平衡原理,计算出所需的蒸发热量。
4. 根据蒸发热量和进料温度,计算出蒸发器所需的加热功率或
蒸汽流量。
5. 根据蒸发器的传热性能和热平衡原理,计算出所需的换热面积。
6. 根据蒸发器的传热性能和操作要求,选择合适的传热介质和
传热方式。
7. 根据蒸发器的操作要求,选择适当的操作参数,如进料质量流率、汽液比、蒸发温度等。
8. 进行蒸发器的设计和优化,包括确定设备的尺寸、材料、结构等。
在进行蒸发计算时,需要考虑多种因素,如物料的性质、操作条件、设备的性能等。
因此,蒸发计算是一个复杂的过程,需要综合考虑多种因素才能得到准确的结果。
以上是单效蒸馏器蒸发计算方式的简要介绍,希望对您有所帮助。
单效蒸发及计算一.物料衡算二.能量衡算1.可忽略溶液稀释热的情况2.溶液稀释热不可忽略的情况三.传热设备的计算1.传热的平均温度差2.蒸发器的传热系数3.传热面积计算四.蒸发强度与加热蒸汽的经济性1.蒸发器的生产能力和蒸发强度2.加热蒸汽的经济性一.物料衡算(materialbalance)对图片5-13所示的单效蒸发器进行溶质的质量衡算,可得由上式可得水的蒸发量及完成液的浓度分别为(5-1)(5-2)式中F———原料液量,kg/h;W———水的蒸发量,kg/h;L———完成液量,kg/h;x0———料液中溶质的浓度,质量分率;x1———完成液中溶质的浓度,质量分率。
二.能量衡算(energybalance)仍参见图片(5-13),设加热蒸汽的冷凝液在饱和温度下排出,则由蒸发器的热量衡算得(5-3)或(5-3a)式中D———加热蒸汽耗量,kg/h;H———加热蒸汽的焓,kJ/kg;h0———原料液的焓,kJ/kg;H'———二次蒸汽的焓,kJ/kg;h1———完成液的焓,kJ/kg;hc———冷凝水的焓,kJ/kg;QL———蒸发器的热损失,kJ/h;Q———蒸发器的热负荷或传热速率,kJ/h。
由式5-3或5-3a可知,如果各物流的焓值已知及热损失给定,即可求出加热蒸汽用量D以及蒸发器的热负荷Q。
溶液的焓值是其浓度和温度的函数。
对于不同种类的溶液,其焓值与浓度和温度的这种函数关系有很大的差异。
因此,在应用式5-3或5-3a求算D时,按两种情况分别讨论:溶液的稀释热可以忽略的情形和稀释热较大的情形。
1.可忽略溶液稀释热的情况大多数溶液属于此种情况。
例如许多无机盐的水溶液在中等浓度时,其稀释的热效应均较小。
对于这种溶液,其焓值可由比热容近似计算。
若以0℃的溶液为基准,则(5-4)(5-4a)将上二式代入式5-3a得(5-3b)式中t0———原料液的温度,℃;t1———完成液的温度,℃;C0———原料液的比热容,℃;C1———完成液的比热容,℃;当溶液溶解的热效应不大时,其比热容可近似按线性加合原则,由水的比热容和溶质的比热容加合计算,即(5-5)(5-5a)式中CW———水的比热容,℃;CB———溶质的比热容,℃。
7.2 单效蒸发7.2.1 单效蒸发的计算对于单效蒸发,在给定的生产任务和确定了操作条件以后,通常需要计算以下的这些内容:① 分的蒸发量;② 热蒸汽消耗量;③ 发器的传热面积。
要解决以上问题,我们可应用物料衡算方程,热量衡算方程和传热速率方程来解决。
(1)物料衡算溶质在蒸发过程中不挥发,且蒸发过程是个定态过程,单位时间进入和离开蒸发器的量相等,即w W F Fw )(0-=水分蒸发量: )1(0w w F W -= (1) 完成液的浓度: WF Fw w -=0 (2) (2)热量衡算对蒸发器作热量衡算,当加热蒸汽在饱和温度下排出时,损Q Di WI i W F Fi DI s +++-=+)(0s (3)或 损Q i I W i i F i I D s s +-+-=-)()()(0 (4) 式中 D ——加热蒸汽消耗量,kg/s ;0t ,t ——加料液与完成液的温度,℃;0i ,i ,s i ——加料液,完成液和冷凝水的热焓,kJ/kg ;I ,s I ——二次蒸汽和加热蒸汽的热焓,kJ/kg 。
式中热损失损Q 可视具体条件来取加热蒸汽放热量(0Dr )的某一百分数。
用以上两个式子进行计算时,必须预知溶液在一定浓度和温度下的焓。
对于大多数物料的蒸发,可以不计溶液的浓缩热,而由比热求得其焓。
习惯上取0℃为基准,即0℃时的焓为零,则有0*T c i s =000000t c t c i =-=ct ct i =-=00c 、c ——料液和完成液的比热,kJ/kg ·K 。
代入前面的两式得损Q ct I W t c c F i I D t s s +-+-=-)()()(00为了避免使用不同溶液浓度下的比热,可以近似认为溶液的比热容和所含溶质的浓度呈加和关系,即0B 0*0)1(w c w c c +-=w c w c c B *)1(+-=式中 *c ——水的比热,kJ/kg ; B c ——溶质的比热,kJ/kg 。
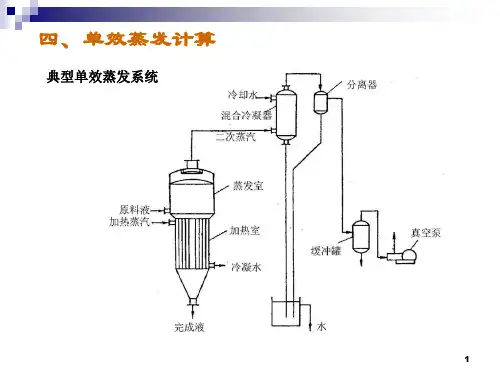
单效蒸发器篇(一):单效蒸发器蒸发计算方式最详细总结,还有案例分析哦在蒸发结晶系统操作过程中,时常也伴随着许多的数值和计算,今天小七详细为您说明单效蒸发器蒸发过程中,在给定生产任务和操作条件要完成的计算。
蒸发水量的计算对图5-13所示蒸发器进行溶质的物料衡算,可得Fx0=(F-W)x1=Lx1由此可得水的蒸发量完成液的浓度式中F——原料液量,kg/h;W——蒸发水量,kg/h;L——完成液量,kg/h;x0——原料液中溶质的浓度,质量分数;x1——完成液中溶质的浓度,质量分数。
加热蒸汽消耗量的计算加热蒸汽用量可通过热量衡算求得,即对图5-13作热量衡算可得DH Fh0=WH Dhc QL (5—3)或Q=D(H-hc)=WH’ Lh1-Fh0 QL(5—3a)式中H——加热蒸汽的焓,kJ/kg ;H′——二次蒸汽的焓,kJ/kg ;h0——原料液的焓,kJ/kg ;h1——完成液的焓,kJ/kg ;hc——加热室排出冷凝液的焓,kJ/h ;Q——蒸发器的热负荷或传热速率,kJ/h ;QL——热损失,可取Q的某一百分数,kJ/kg ;c0、c1——为原料、完成液的比热,kJ/(kg·℃) 。
考虑溶液浓缩热不大,并将H′取t1下饱和蒸汽的焓,则(9—3a)式可写成(5—4)式中r 、r′——分别为加热蒸汽和二次蒸汽的汽化潜热,kJ/kg。
若原料由预热器加热至沸点后进料(沸点进料),即t0=t1,并不计热损失,则(4—5)式可写为(5—5)或(5—5a)式中D/W称为单位蒸汽消耗量,它表示加热蒸汽的利用程度,也称蒸汽的经济性。
由于蒸汽的汽化潜热随压力变化不大,故r=r′。
对单效蒸发而言,D/W=1,即蒸发一千克水需要约一千克加热蒸汽,实际操作中由于存在热损失等原因,D/W ≈1。
可见单效蒸发的能耗很大,是很不经济的。
传热面积的计算蒸发器的传热面积可通过传热速率方程求得,即(5—6)或(5—6a)式中A ——蒸发器的传热面积,m2;K——蒸发器的总传热系数,W/(m2·K);Δtm——传热平均温度差,℃;Q——蒸发器的热负荷,W或kJ/kg。
页眉内容单效蒸发器蒸发计算方式单效蒸发设计计算内容有:①确定水的蒸发量;②加热蒸汽消耗量;③蒸发器所需传热面积。
在给定生产任务和操作条件,如进料量、温度和浓度,完成液的浓度,加热蒸汽的压力和冷凝器操作压力的情况下,上述任务可通过物料衡算、热量衡算和传热速率方程求解。
一、蒸发水量的计算对图5-13所示蒸发器进行溶质的物料衡算,可得Fx o =(F -W)x i =Lx i由此可得水的蒸发量W=F(1 --)xi(5—1)Fx o x i ———完成减的浓度. F-W (5- 2)式中:F--- 原料液量,kg/h ;W-―蒸发水量,kg/h ;L -- 完成液量,kg/h ;x0——原料液中溶质的浓度,质量分数;x i——完成液中溶质的浓度,质量分数。
二、加热蒸汽消耗量的计算图5-13单效蒸发器加热蒸汽用量可通过热量衡算求得,即对图5-13作热量衡算可得:DH Fh0 =WH Lh1 Dh c Q L(5—3)式中:D/W 称为单位蒸汽消耗量,它表示加热蒸汽的利用程度,也称蒸汽的经济 性。
由于蒸汽的汽化潜热随压力变化不大,故r=r' Q 对单效蒸发而言,D/W=1, 即蒸发一千克水需要约一千克加热蒸汽,实际操作中由于存在热损失等原因,D/ W -K 可见单效蒸发的能耗很大,是很不经济的。
三、传热面积的计算蒸发器的传热面积可通过传热速率方程求得,即:(5- 6)AQ A 二K ;:t m式中:A ——蒸发器的传热面积,m ;或 Q=D(H —h c )=WH Lh i —Fh o Q L(5—3a)式中:H ——加热蒸汽的始,kJ/kg ; H' h o 二次蒸汽的始,kJ/kg ;kJ/kg ;h i h c完成液的始,kJ/kg ;-加热室排出冷凝液的始,kJ/h ; 蒸发器的热负荷或传热速率,kJ/h ; C o 、 C i 热损失,可取Q 的某一百分数,kJ/kg ;-一为原料、完成液的比热,kJ/(kg ・℃)。
单效蒸发及计算一.物料衡算(materialbalance)对图片5-13所示的单效蒸发器进行溶质的质量衡算,可得由上式可得水的蒸发量及完成液的浓度分别为(5-1)(5-2)式中F———原料液量,kg/h;W———水的蒸发量,kg/h;L———完成液量,kg/h;x0———料液中溶质的浓度,质量分率;x1———完成液中溶质的浓度,质量分率。
二.能量衡算(energybalance)仍参见图片(5-13),设加热蒸汽的冷凝液在饱和温度下排出,则由蒸发器的热量衡算得(5-3)或(5-3a)式中D———加热蒸汽耗量,kg/h;H———加热蒸汽的焓,kJ/kg;h0———原料液的焓,kJ/kg;H'———二次蒸汽的焓,kJ/kg;h1———完成液的焓,kJ/kg;hc———冷凝水的焓,kJ/kg;QL———蒸发器的热损失,kJ/h;Q———蒸发器的热负荷或传热速率,kJ/h。
由式5-3或5-3a可知,如果各物流的焓值已知及热损失给定,即可求出加热蒸汽用量D以及蒸发器的热负荷Q。
溶液的焓值是其浓度和温度的函数。
对于不同种类的溶液,其焓值与浓度和温度的这种函数关系有很大的差异。
因此,在应用式5-3或5-3a求算D时,按两种情况分别讨论:溶液的稀释热可以忽略的情形和稀释热较大的情形。
1.可忽略溶液稀释热的情况大多数溶液属于此种情况。
例如许多无机盐的水溶液在中等浓度时,其稀释的热效应均较小。
对于这种溶液,其焓值可由比热容近似计算。
若以0℃的溶液为基准,则(5-4)(5-4a)将上二式代入式5-3a得(5-3b)式中t0———原料液的温度,℃;t1———完成液的温度,℃;C0———原料液的比热容,℃;C1———完成液的比热容,℃;当溶液溶解的热效应不大时,其比热容可近似按线性加合原则,由水的比热容和溶质的比热容加合计算,即(5-5)(5-5a)式中CW———水的比热容,℃;CB———溶质的比热容,℃。
将式5-5与5-5a联立消去CB并代入式5-2中,可得,再将上式代入式5-3b中,并整理得(5-6)由于已假定加热蒸汽的冷凝水在饱和温度下排出,则上式中的即为加热蒸汽的冷凝潜热,即(5-7)但由于溶液的沸点升高,二次蒸汽的温度与溶液温度t1并不相同(下面还要详细讨论)。
但作为近似,可以认为(5-8)式中r——加热蒸汽的冷凝潜热,kJ/kg;r'——二次蒸汽的冷凝潜热,kJ/kg。
将式5-7及式5-8代入式5-6中,可得o(5-9)上式表示加热蒸汽放出的热量用于:(1)原料液由t0升温到沸点t1;(2)使水在t1下汽化成二次蒸汽以及(3)热损失。
若原料液在沸点下进入蒸发器并同时忽略热损失,则由式5-9可得单位蒸汽消耗量e为(5-10)一般水的汽化潜热随压力变化不大,即,则或。
换言之,采用单效蒸发,理论上每蒸发1kg水约需1kg加热蒸汽。
但实际上,由于溶液的热效应和热损失等因素,e值约为或更大。
2.溶液稀释热不可忽略的情况.有些溶液,如CaCl2、NaOH的水溶液,在稀释时其放热效应非常显着。
因而在蒸发时,作为溶液稀释的逆过程,除了提供水分蒸发所需的汽化潜热之外,还需要提供和稀释热效应相等的浓缩热。
溶液浓度越大,这种影响越加显着。
对于这类溶液,其焓值不能按上述简单的比热容加合方法计算,需由专门的焓浓图查得。
通常溶液的焓浓图需由实验测定。
图片(5-14)为以0℃为基准温度的NaOH水溶液的焓浓图。
由图可见,当有明显的稀释热时,溶液的焓是浓度的高度非线性函数。
对于这类稀释热不能忽略的溶液,加热蒸汽的消耗量可直接按式5-3a计算,即(5-3b)三.传热设备的计算蒸发器的传热速率方程与通常的热交换器相同,即(5-11)式中S----蒸发器的传热面积,m2;K----蒸发器的总传热系数,W/;----传热的平均温度差,℃;Q----蒸发器的热负荷,W。
式5-11中的热负荷Q可通过对加热器作热量衡算求得。
当忽略加热器的热损失,则Q为加热蒸汽冷凝放出的热量,即(5-12)但在确定蒸发器的和K时,与普通的热交换器有着一定的差别。
下面分别予以讨论。
1.传热的平均温度差(meantemperaturedifference)蒸发器加热室的一侧为蒸汽冷凝,另一侧为溶液沸腾,其温度为溶液的沸点。
因此,传热的平均温度差为(5-13)式中式中T----加热蒸汽的温度,℃;t1----操作条件下溶液的沸点,℃。
亦称为蒸发的有效温度差,是传热过程的推动力。
但是,在蒸发过程的计算中,一般给定的条件是加热蒸汽的压力(或温度T)和冷凝内的操作压力。
由给定的冷凝器内的压力,可以定出进入冷凝器的二次蒸汽的温度tc。
一般地,将蒸发器的总温度差定义为(5-14)式中tc----进入冷凝器的二次蒸汽的温度,℃。
那么,如何从已知的求得传热的有效温差,或者说,如何将tc转化为t1呢让我们先讨论一种简化的情况。
设蒸发器蒸发的是纯水而非含溶质的溶液。
采用T=150℃的蒸汽加热,冷凝器在常压()下操作,因此进入冷凝器的二次蒸汽的温度为100℃。
如果忽略二次蒸汽从蒸发室流到冷凝器的摩擦阻力损失,则蒸发室内操作压力亦为。
又由于蒸发的是纯水,因此蒸发室内的二次蒸汽及沸腾的水均为100℃。
此时传热的有效温差应等于总温度差℃。
如果仍采用如上操作条件(即加热蒸汽的温度为150℃,冷凝器的操作压力为),蒸发%的NH4NO3水溶液,则实验表明,在相同的压力下(),该水溶液在120℃下沸腾。
然而该溶液上方形成的二次蒸汽却与纯水沸腾时产生的蒸汽有着相同的温度,即100℃。
也就是说,二次蒸汽的温度低于溶液的沸点温度。
亦忽略二次蒸汽从蒸发室流到冷凝器的阻力损失,则进入冷凝器的二次蒸汽温度为100℃,此时传热的有效温度差变为℃=30℃与纯水蒸发相比,其温度差损失为℃。
蒸发计算中,通常将总温度差与有效温度差的差值称为温度差损失,即(5-15)式中----温度差损失,℃。
亦称为溶液的沸点升高。
对于上面NH4NO3溶液的蒸发,沸点升高仅仅是由于水中含有不挥发的溶质引起的。
如果在上面的讨论中,考虑了二次蒸汽从蒸发器流到冷凝器的阻力损失,则蒸发器内的操作压力必高于冷凝器内压力,还会使溶液的沸点升高。
此外,多数蒸发器的操作需维持一定的液面(膜式蒸发器除外),液面下部的压力高于液面上的压力(即蒸发器分离室中的压力),故蒸发器内底部液体的沸点还进一步升高。
综上所述,蒸发器内溶液的沸点升高(或温度差损失),应由如下三部分组成,即(5-16)式中----由于溶质的存在引起的沸点升高,℃;----由于液柱压力引起的沸点升高,℃;----由于管路流动阻力引起的沸点升高,℃。
(1).由于溶液中溶质存在引起的沸点升高由于溶液中含有不挥发性溶质,阻碍了溶剂的汽化,因而溶液的沸点永远高于纯水在相同压力下的沸点。
如前面的例子中,在下,水的沸点为100℃,而%的NH4NO3(质量分率)的水溶液的沸点则为120℃。
但二者在相同压力下()沸腾时产生的饱和蒸汽(二次蒸汽)有相同的温度(100℃)。
与溶剂相比,在相同压力下,由于溶液中溶质存在引起的沸点升高可定义为(5-17)式中tB----溶液的沸点,℃。
----与溶液压力相等时水的沸点,即二次蒸汽的饱和温度,℃;溶液的沸点tB主要与溶液的种类、浓度及压力有关。
一般需由实验测定。
常压下某些常见溶液的沸点可参见附录。
蒸发操作常常在加压或减压下进行。
但从手册中很难直接查到非常压下溶液的沸点。
当缺乏实验数据时,可以用下式近似估算溶液的沸点升高。
(5-18)式中----常压下()由于溶质存在引起的沸点升高,℃;----操作压力下由于溶质存在引起的沸点升高,℃;f----校正系数,其值为(5-19)式中----操作压力下二次蒸汽的温度,℃;----操作压力下二次蒸汽的汽化热,kJ/kg。
溶液的沸点亦可用杜林规则(Duhring'srule)估算。
杜林规则表明:一定浓度的某种溶液的沸点与相同压力下标准液体的沸点呈线性关系。
由于不同压力下的水的沸点可以从水蒸气表中查得,故一般以纯水作为标准液体。
根据杜林规则,以某种溶液的沸点为纵坐标,以同压力下水的沸点为横坐标作图,可得一直线,即(5-20)或写成(5-21)式中、tB----分别为压力和p下溶液的沸点,℃;、----分别为和p下水的沸点,℃;k----杜林直线的斜率。
由式5-21可知,只要已知溶液在两个压力下的沸点,即可求出杜林直线的斜率,进而可以求出任何压力下溶液的沸点。
图片(5-15)为NaOH水溶液的杜林线图。
图中每一条直线代表某一浓度下该溶液在不同压力下的沸点与对应压力下水的沸点间的关系。
由图片(5-15)可知,当溶液的浓度较低时,各浓度下杜林直线的斜率几乎平行,这表明在任何压力下,NaOH溶液的沸点升高基本上是相同的。
2.由于液柱静压头引起的沸点升高由于液层内部的压力大于液面上的压力,故相应的溶液内部的沸点高于液面上的沸点tB,二者之差即为液柱静压头引起的沸点升高。
为简便计,以液层中部点处的压力和沸点代表整个液层的平均压力和平均温度,则根据流体静力学方程,液层的平均压力为(5-22)式中pav----液层的平均压力,Pa;----液面处的压力,即二次蒸汽的压力,Pa;----溶液的平均密度,kg/m3;L----液层高度,m;g----重力加速度,m/s2.溶液的沸点升高为(5-23)式中----平均压力下溶液的沸点,℃;----液面处压力(即二次蒸汽压力)下溶液的沸点,℃。
作为近似计算,式5-23中的和可分别用相应压力下水的沸点代替。
应当指出,由于溶液沸腾时形成气液混合物,其密度大为减小,因此按上述公式求得的值比实际值略大。
3.由于流动阻力引起的沸点升高前已述及,二次蒸汽从蒸发室流入冷凝器的过程中,由于管路阻力,其压力下降,故蒸发器内的压力高于冷凝器内的压力。
换言之,蒸发器内的二次蒸汽的饱和温度高于冷凝器内的温度,由此造成的沸点升高以表示。
与二次蒸汽在管道中的流速、物性以及管道尺寸有关,但很难定量分析,一般取经验值,约为1~℃。
对于多效蒸发,效间的沸点升高一般取1℃。
2.蒸发器的传热系数(coefficientofheattransfer)蒸发器的总传热系数的表达式原则上与普通换热器相同,即(5-24)式中——对流传热系数,W/(m2.℃);d----管径,m;Rs----垢层热阻,(m2.℃)/W;b----管壁厚度,m;k----管材的导热系数,W/(m2.℃);下标i表示管内侧,o表示外侧,m表示平均。
式5-24中,管外蒸汽冷凝的传热系数可按膜式冷凝的传热系数公式计算,垢层热阻值Rs可按经验值估计。
但管内溶液沸腾传热系数则受较多因素的影响,例如溶液的性质、蒸发器的型式、沸腾传热的形式以及蒸发操作的条件等等。