《医疗器械生产许可证现场审查》评分标准
- 格式:doc
- 大小:51.55 KB
- 文档页数:3

医疗器械生产许可证现场审查标准一、审查准备工作在进行医疗器械生产许可证现场审查之前,审查人员应当做好以下准备工作:1. 完成对申请材料的初步审查,确认是否符合相关法规和要求。
2. 准备好相关的法规、标准和技术文件,以供参考。
3. 确定审查的时间和地点,通知申请人并确认其配合。
4. 准备好必要的检查工具和设备。
二、审查对象范围医疗器械生产许可证现场审查主要对象为医疗器械生产企业和其生产现场。
审查的内容主要包括以下几个方面:1. 生产设备的合理性和完整性。
2. 生产车间的卫生环境和设施设备。
3. 生产过程的规范性和可追溯性。
4. 原材料的质量控制和供应商管理。
5. 产品质量检测与控制。
6. 生产记录和档案管理。
三、审查流程医疗器械生产许可证现场审查一般按照以下流程进行:1. 初步考察:审查人员对生产企业及其场地进行初步考察,了解基本情况,并与企业负责人进行沟通。
2. 资料审核:对企业所提交的相关资料进行审核,核实是否符合相关法规和要求。
3. 现场检查:对生产设备、生产车间、生产过程等进行现场检查,核实是否符合相关要求。
4. 数据验证:对产品质量检测数据和生产记录进行验证,确保产品质量可控。
5. 结果反馈:将审查结果反馈给申请人,包括审查意见和改进建议。
6. 审查报告:根据现场审查结果,撰写审查报告,提出是否通过审查的决定。
四、审查要求医疗器械生产许可证现场审查的要求如下:1. 生产设备应当符合相关技术标准和规定,设备维护保养应及时有效。
2. 生产车间应具备卫生、通风、防尘、防潮等条件,并符合相关法规和要求。
3. 生产过程应有规范的操作程序和控制措施,并能够追溯产品的生产过程。
4. 原材料供应商应符合相关资质要求,并有相应的质量控制措施。
5. 产品质量检测应按照相关标准和规定进行,结果准确可靠。
6. 生产记录和档案管理应行之有效,确保数据的完整性和可靠性。
五、审查结果根据医疗器械生产许可证现场审查的结果,审查人员将给予不同的判定:1. 通过审查:对于符合要求的企业,将予以通过审查的,并准备相关的证明文件。
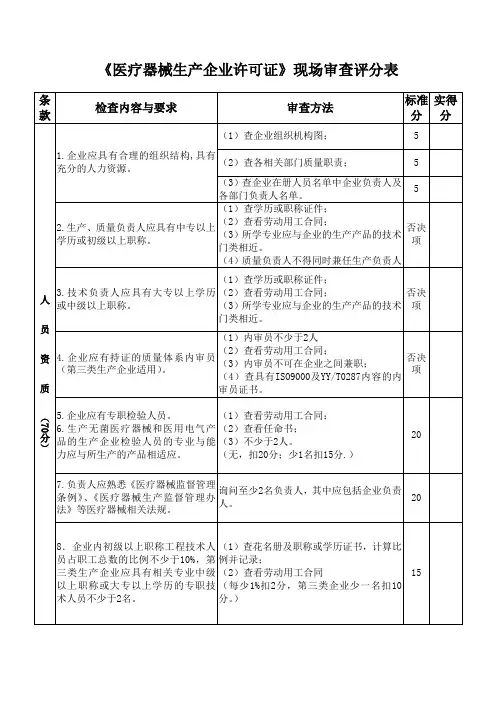


体外诊疗试剂生产公司现场查核评定表条款 查核内容与要求 不切合事实描绘5. 1※ 公司应成立生产管理和质量管理机构。
5. 2公司应明确有关部门和人员的质量管理职责。
一机 5. 3公司应装备必定数目的与产品生产和质量管理相适应的专业管理人员。
构 、5.4人 公司应有起码二名质量管理系统内审员。
员 与管6.1 公司最高管理者应付公司的质量管理负责。
理 职 责6. 2公司最高管理者应明确质量管理系统的管理者代表。
公司最高管理者和管理者代表应熟习医疗器材有关法例并认识有关标 6. 3准。
生产和质量的负责人应拥有医学检验、临床医学或药学等有关专业知 7.1识,有有关产品生产和质量管理的实践经验。
7.2 ※ 生产负责人和质量负责人不得相互兼任。
8.1 从事生产操作和检验的人员应经过岗前特意培训。
8.2应装备专职成品检验员,合格后方可上岗。
拥有专业知识背景或有关从业经验,而且查核对从事高生物活性、 高毒性、 强传染性、 强致敏性等有特别要求的产品9生产和质量检验的人员应进行登记,并保存有关培训记录。
10从事体外诊疗试剂生产的各级人员应按本实行细则进行培训和查核, 合格后方可上岗。
制产设二公司的厂房、环境、设备、设备应与体外诊疗试剂产品生产相适应。
环 备 11※设境 与 施厂区内生产环境应整齐、 厂区周边环境不该付生产过程和产质量量造成12.1影响;生产、行政、生活和协助区布局合理。
控 生 、12.2生产、研发、检验等地区应相互分开。
13.1仓储区要与生产规模相适应,各个地区应区分清楚。
13.2所有物料的名称、批号、有效期和检验状态等表记一定明确。
13.3台帐应清楚明确,帐、卡、物应一致。
仓储地区应保持洁净、14.1入的举措。
干燥和通风,并具备防昆虫、其余动物和异物混对各种物料的仓储环境及控制应切合规定的储藏要求,14.2藏条件应切合生产要求并按期监测。
并按期监测。
冷易燃、易爆、有毒、有害、拥有污染性或传染性、拥有生物活性或根源15.1 ※于生物体的物料的寄存应切合国家有关规定。


医疗器械经营许可现场
检查评分表
西安市食品药品监督管理局制
填表说明
1、该表共三部分、40项,其中关键项16项、一般项24项。
适用于第三类医疗器械经营企业许可(含变更和延续)现场核查。
2、检查要求:现场检查时,要求检查员对照内容进行全面检查,对不符合事实做出客观描述。
3、结果判定:共分三种情况:
“通过检查”——项目全部符合要求的为“通过检查”。
“限期整改”——关键项目全部符合要求,一般项目中不符合要求的项目数≤10%为“限期整改”。
企业应当在现场检查结束后30天内完成整改并向原审查部门一次性提交整改报告。
经复查后,整改项目全部符合要求的,食品药品监管部门作出准予许可的书面决定;在30天内未能提交整改报告或复查仍存在不符合要求项目的,食品药品监管部门作出不予许可的书面决定。
“未通过检查”——关键项目不符合要求或者一般项目中不符合要求的项目数>10%的为“未通过检查”。
4、一般项目中不符合要求的项目数比例=一般项目中不符合要求的项目数/(一般项目数总数-一般项目中确认的合理缺项项目数)*100%。
5、※号项为关键项目,其他为一般项目。
企业名称:
检查人员(签字):企业法定代表人
或负责人(签字):时间:年月日时间:年月日
10。

山东省《医疗器械生产企业许可证》现场审查规定及评分表一、山东省《医疗器械生产企业许可证》现场审查规定㈠总则1. 依据《医疗器械监督管理条例》、《医疗器械生产企业监督管理办法》及《山东省〈医疗器械生产企业监督管理办法〉实施细则》,特制定本规定。
2. 本标准适用于对山东省境内新开办企业申办《医疗器械生产企业许可证》、年度验证、换证及《医疗器械生产企业许可证》有关事项变更的现场审查。
3. 生产企业现场审查按《山东省<医疗器械生产企业许可证>现场审查评分表》进行,审查评分表分为5个部分,其中否决项2项,总分为300 分,各部分内容和分值为:1)人员资质80分2)场地80分3)法规资料30分4)生产设备40分5)检验能力70分4. 合格标准:“否决项”合格且各部分的得分率均达到80%及以上为合格;“否决项”一项及以上不合格,或者“否决项”合格而各部分的得分率不是全部达到80%及以上,即为本次审查不合格,要求企业进行整改。
㈡评分方法1. 按审核评分表中审核方法评分;扣分时,最多至本条分数扣完为止。
2. 按评分通则评分:评分不宜量化的条款,按评分通则打分。
实得分等于每条规定满分乘以得分系数。
得分系数及含义:1.0 全面达到规定要求;0.8 执行较好,但仍需改进;0.5 基本达到要求,部分执行较好;0.3 已执行,但尚有一定差距;0 未开展工作。
3. 缺项的处理: 缺项指由于产品管理类别等原因而出现的合理缺项。
缺项不记分,计算得分率时,从该项标准总分中减去缺项应得分。
计算公式为:得分率=实得分/(该部分总和-缺项分)×100%4、现场审查评分表中未说明评分标准的项目均按通则评分。
㈢审查结论现场审查时,审查人员应如实记录现场审查情况。
审查结束后,填写《山东省医疗器械生产企业现场审查报告》,审查人员、企业负责人均应在现场审查报告上签字并加盖企业公章(如有)和组织审查的药品监督管理部门公章。
㈣其它1.对新开办企业现场审查时,可豁免审查1.4项。
《医疗器械生产企业许可证》现场审查标准一、总则(一)根据《医疗器械监督管理条例》(国务院令第276号)、《医疗器械生产监督管理办法》(国家食品药品监督管理局令第12号),结合现场审查的实际情况,特制定本标准。
(二)本标准适用于对新开办企业申办《医疗器械生产企业许可证》、《医疗器械生产企业许可证》生产地址和生产范围变更以及《医疗器械生产企业许可证》换证的现场审查。
(三)生产企业现场审查按《<医疗器械生产企业许可证>现场审查评分表》进行,审查评分表分为5个部分,其中否决条款5项,总分为300 分,各部分内容和分值为:1.人员资质70分2.场地80分3.法规资料40分4.生产能力40分5.检验能力70分(四)合格标准:“否决项”一项不合格,即为本次审查不合格;“否决项”合格且各部分的得分率均达到80%以上为合格;“否决条”合格且各部分的得分率均达到60%以上,其中,一部分(或几部分)不足80%的,要求企业整改并进行复查,复查仍不合格,即为本次审查不合格;“否决条”合格而一部分(或几部分)的得分率不足60%,即为本次审查不合格。
二、评分方法(一)按审查评分表中审查方法评分;扣分时,最多至本条分数扣完为止。
(二)按评分通则评分:评分不宜量化的条款,按评分通则打分。
实得分等于每条规定满分乘以得分系数。
得分系数及含义:1.0 全面达到规定要求;0.8 执行较好,但仍需改进;0.7 基本达到要求,部分执行较好;0.6 基本达到要求0.5 已执行,但尚有一定差距;0 未开展工作。
(三)缺项(条)的处理: 缺项(条)指由于产品管理类别而出现的合理缺项(条)。
缺项(条)不记分,计算得分率时,从该项(条)标准总分中减去缺项(条)应得分。
计算公式为:得分率=实得分/(该部分总和-缺项分)X100%(四)现场审查记录中的“合计”应包括总实得分及总得分率。
总实得分为各部分实得分和,总得分率=总实得分/总分三、审查结论现场审查后,及时填写现场审查记录。
《医疗器械生产企业许可证》现场审查标准说明一、一般要求(一)根据《医疗器械监督管理条例》、《医疗器械生产监督管理办法》,结合现场审查的实际情况,特制定本标准。
(二)本标准适用于对新开办企业申办《医疗器械生产企业许可证》、《医疗器械生产企业许可证》生产地址和生产范围变更以及《医疗器械生产企业许可证》换证的现场审查。
医疗器械生产企业日常监督管理可参照执行本标准。
(三)生产企业现场审查按《〈医疗器械生产企业许可证〉现场审查评分表》进行,审查评分表分为5个部分,其中否决条款5项。
评分条款总分为300分,各部分内容和分值为:1.人员资质70分2.场地80分3.法规及质量管理文件40分4.生产能力40分5.检验能力70分(四)合格标准:“否决条款”一项不合格,即为本次审查不合格;“否决条款”全部合格且各部分的得分率均达到80%以上为合格;“否决条款”全部合格且各部分的得分率均达到60%以上,但其中一部分或几部分的得分率不足80%的,要求企业整改并对整改情况进行复查,复查仍不合格的,即为本次审查不合格;“否决条款”全部合格但有一部分或几部分的得分率不足60%的,即为本次审查不合格。
二、评分方法(一)按审查评分表中审查方法评分。
扣分时,最多至本项分数扣完为止。
(二)按评分通则评分。
评分不宜量化的条款,按评分通则打分。
实得分等于每项规定满分乘以得分系数。
得分系数及含义:1.0全面达到规定要求;0.8执行较好,但仍需改进;0.7基本达到要求,部分执行较好;0.6基本达到要求;0.5已执行,但尚有一定差距;0.0未开展工作。
(三)缺项(条)的处理:缺项(条)指由于产品管理类别而出现的合理缺项(条)。
缺项(条)不记分,计算得分率时,从该项(条)标准总分中减去缺项(条)应得分。
计算公式为:得分率=实得分/(该部分总和-缺项分)×100%(四)现场审查记录中的“合计”应包括总实得分及总得分率。
总实得分为各部分实得分和,总得分率=总实得分/总分三、审查结论现场审查后,应及时填写现场审查记录。
《医疗器械生产企业许可证》现场审查标准说明一、一般要求(一)根据《医疗器械监督管理条例》、《医疗器械生产监督管理办法》,结合现场审查的实际情况,特制定本标准。
(二)本标准适用于对新开办企业申办《医疗器械生产企业许可证》、《医疗器械生产企业许可证》生产地址和生产范围变更以及《医疗器械生产企业许可证》换证的现场审查。
医疗器械生产企业日常监督管理可参照执行本标准。
(三)生产企业现场审查按《〈医疗器械生产企业许可证〉现场审查评分表》进行,审查评分表分为5个部分,其中否决条款5项。
评分条款总分为300分,各部分内容和分值为:1.人员资质70分2.场地80分3.法规及质量管理文件40分4.生产能力40分5.检验能力70分(四)合格标准:“否决条款”一项不合格,即为本次审查不合格;“否决条款”全部合格且各部分的得分率均达到80%以上为合格;“否决条款”全部合格且各部分的得分率均达到60%以上,但其中一部分或几部分的得分率不足80%的,要求企业整改并对整改情况进行复查,复查仍不合格的,即为本次审查不合格;“否决条款”全部合格但有一部分或几部分的得分率不足60%的,即为本次审查不合格。
二、评分方法(一)按审查评分表中审查方法评分。
扣分时,最多至本项分数扣完为止。
(二)按评分通则评分。
评分不宜量化的条款,按评分通则打分。
实得分等于每项规定满分乘以得分系数。
得分系数及含义:1.0 全面达到规定要求;0.8 执行较好,但仍需改进;0.7 基本达到要求,部分执行较好;0.6 基本达到要求;0.5 已执行,但尚有一定差距;0.0 未开展工作。
(三)缺项(条)的处理:缺项(条)指由于产品管理类别而出现的合理缺项(条)。
缺项(条)不记分,计算得分率时,从该项(条)标准总分中减去缺项(条)应得分。
计算公式为:得分率=实得分/(该部分总和-缺项分)×100%(四)现场审查记录中的“合计”应包括总实得分及总得分率。
总实得分为各部分实得分和,总得分率=总实得分/总分三、审查结论现场审查后,应及时填写现场审查记录。
审查结论:审查人员:企业对审查结论的意见:企业负责人1。
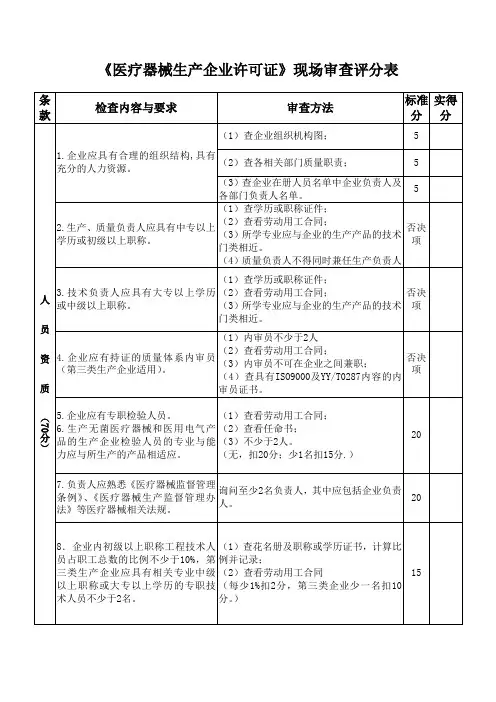
企业应具有合理的组织结构,具有充分的人力资源。
(1)查企业组织机构图;(2)查各相关部门质量职责;(3)查企业在册人员名单中企业负责人及各部门负责人名单.555年月日(企业公章)年月日职务、、2.生产、质量负责人应具有中专以上 学历或者初级以上职称.3.技术负责人应具有大专以上学历或者 中级以上职称。
4。
企业应有持证的质量体系内审员(第三类生产企业合用).5。
企业应有专职检验人员。
6.生产无菌医疗器械和医用电气产 品的生产企业检验人员的专业与能 力应与所生产的产品相适应。
7.负责人应熟悉《医疗器械监督管理条例》、《医疗器械生产监督管理办 法》等医疗器械相关法规。
(1)查学历或者职称证件; (2)查看劳动用工合同;(3) 所学专业应与企业的生产产品的技术门类相近。
(4) 质量负责人不得同时兼任生产负责人(1)查学历或者职称证件;(2)查看劳动用工合同; (3) 所学专业应与企业的生产产品的技术 门类相近。
(1)内审员不少于2人 (2)查看劳动用工合同;(3)内审员不可在企业之间兼职; (4)查具有ISO9000及YY/T0287内容的内 审员证书。
(1)查看劳动用工合同; (2)查看任命书; (3)不少于2人.(无, 扣20分;少1名扣15 分. )问询至少2名负责人, 其中应包括企业负责 人。
否决项否决项否决 项20208.企业内初级以上职称工程技术人员占职工总数的比例不少于10%,第三类生产企业应具有相关专业中级以上职称或者大专以上学历的专职技 术人员不少于2名。
立1.设企置业的。
管理、仓储和生产场地应独 (1)查花名册及职称或者学历证书 ,计算比 例并记录;(2)查看劳动用工合同(每少1%扣2 分, 第三类企业少一位扣10 分。
)(1)查三方面场地是否独立; (2)核查生产场地与生产场地证明文件的符合性。
(每项不符合扣20 分)1520,(1)观察生产场地环境及照明情况;(2)观察生产面积是否拥挤。