化学与材料的发展知识点
- 格式:pdf
- 大小:164.12 KB
- 文档页数:4

文科化学知识点总结导言化学是自然科学的一个分支领域,涉及物质的组成、结构、性质、变化规律等内容。
文科化学作为学科的一部分,注重对化学知识的理论分析、历史考据以及化学与其他学科的交叉融合。
本文将从文科角度出发,对化学的相关知识点进行总结,帮助学生更好地理解化学知识。
一、化学的历史及发展1. 古代化学的起源化学的起源可追溯至古代,古代人类通过冶炼金属、使用草药等实践活动,开始对物质的性质有了一定的认识。
例如,古埃及人在制作青铜器具时,就已经掌握了一些金属冶炼的技术。
2. 古代化学思想古希腊的质子学派和原子说、印度的自然哲学、中国的阴阳五行等古代化学思想,为后来现代化学理论的形成奠定了基础。
3. 化学的现代发展17世纪以来, 化学发展迅速。
阿尔凡斯、拉瓦锡、达尔顿、门捷列夫等化学家的研究,为原子论、元素周期表等现代化学理论的建立提供了理论基础。
二、基础化学知识1. 元素与周期表元素是构成物质的基本单位,而周期表则是将元素按照其物理性质和化学性质分类排列。
通过周期表的学习,我们可以了解元素的周期规律、元素周期律等核心概念。
2. 化学键化学键是原子为了达到化学稳定性而进行的结合,常见的化学键有共价键、离子键和金属键等。
学生需要理解不同化学键形成的原理及其在化学反应中的作用。
3. 化学方程式化学方程式是用化学符号来表示物质间相互作用的公式。
学生需要理解化学方程式的平衡、热力学等相关知识。
4. 化学反应化学反应是物质之间的转化过程,学生需要掌握化学反应的类型、速率、平衡等概念。
5. 酸碱中和反应酸碱中和反应是酸和碱之间的化学反应,学生需要了解酸碱的性质、酸碱中和反应的条件及其在生活中的应用。
6. 氧化还原反应氧化还原反应是指氧化剂和还原剂之间的电子转移过程,学生需要了解氧化还原反应的特征及其在化学生产和生活中的应用。
三、化学与其他学科的交叉1. 化学与生物学的关系生物学研究生命的组成和转化过程,而生命的组成和转化都离不开化学。

有机化学基础知识点有机化学的发展历程有机化学基础知识点:有机化学的发展历程有机化学是研究碳元素及其化合物的科学,是化学中的一门重要学科。
有机化学的发展历程经历了几个重要的里程碑,下面我们来介绍有机化学的基础知识点以及其发展的历程。
一、有机化学的基础知识点有机化学基础知识点主要包括以下几个方面:碳原子的电子结构、共价键与化合价、轨道杂化理论、立体化学、有机反应机理以及有机合成方法等。
1. 碳原子的电子结构碳原子的电子结构决定了碳与其他元素的化学特性。
碳原子有6个电子,分布在2个能级上,第一能级有2个电子,第二能级有4个电子。
碳原子的电子排布是1s²2s²2px¹2py¹。
2. 共价键与化合价碳原子常以共价键形式连接其他元素。
共价键是由共用电子对形成的。
碳原子的化合价为4,即与其他原子可以形成4条共价键。
3. 轨道杂化理论轨道杂化理论是解释碳原子共价键的理论基础。
碳原子的杂化轨道包括sp³杂化和sp²杂化两种形式。
sp³杂化形成四面体结构,用于描述甲烷等化合物;sp²杂化形成平面三角形结构,用于描述乙烯等化合物。
4. 立体化学有机化合物中存在着空间异构体,立体化学研究了它们的空间结构和性质。
立体化学的基础概念包括手性、对映异构体等。
5. 有机反应机理有机反应机理研究了有机化合物发生化学变化的原理和过程。
有机反应的机理通常包括势能图、中间体和过渡态等概念。
6. 有机合成方法有机合成方法是有机化学研究的核心内容,涵盖了有机合成的各个方面,如取代反应、加成反应、消除反应、重排反应等。
二、有机化学的发展历程有机化学的发展历程可以分为三个阶段:发源阶段、成熟阶段和现代阶段。
1. 发源阶段有机化学的发源可以追溯到17世纪,当时发现了一些有机化合物,如醋酸、酒精等。
18世纪末至19世纪初,化学家开始系统地研究有机化合物,发现了化学反应的一些规律,如燃烧、酯化等。

设计材料化学知识点总结1. 材料的热力学性质在材料化学中,热力学性质是研究材料的物理性质和化学性质之间相互关系的一个重要部分。
热力学性质包括热容、热导率、热膨胀系数等。
热容是指物质在吸热或放热过程中所需要的热量,可以用于描述材料的热稳定性和热传导性。
热导率是指材料在热量传导过程中的导热能力,可以用于描述材料的热传导性能。
热膨胀系数是指材料在温度变化时的线性膨胀系数,可以用于描述材料的热膨胀性能。
了解材料的热力学性质可以帮助人们选择合适的材料,并设计出具有特定热稳定性、热传导性和热膨胀性能的材料。
2. 材料的结构性质材料的结构性质是指材料在原子、分子或离子水平上的结构特征。
包括晶体结构和非晶结构。
晶体结构是指材料中的原子、分子或离子按照一定的规则排列形成的有序结构,具有明确的晶体学特征。
非晶结构是指材料中的原子、分子或离子排列是无序的,没有明确的晶体学特征。
了解材料的结构性质可以帮助人们理解材料的物理性质和化学性质,并为材料的设计和制备提供重要的理论基础。
3. 材料的电化学性质材料的电化学性质是指材料在电场作用下的特性。
包括电导率、电化学稳定性、电化学活性等。
电导率是指材料在电场作用下的导电能力,可以用于描述材料的导电性能。
电化学稳定性是指材料在电化学反应过程中的稳定性,可以用于描述材料的防腐蚀性能。
电化学活性是指材料在电化学反应中的活性能力,可以用于描述材料的催化性能。
了解材料的电化学性质可以帮助人们设计和制备具有特定导电性能、防腐蚀性能和催化性能的材料。
4. 材料的表面性质材料的表面性质是指材料表面的物理和化学特性。
包括表面能、表面粗糙度、表面形貌等。
表面能是指材料表面吸附能力的大小,可以用于描述材料的表面活性。
表面粗糙度是指材料表面的粗糙程度,可以用于描述材料的表面质量和功能性。
表面形貌是指材料表面的形状和结构特征,可以用于描述材料的外观和几何形状。
了解材料的表面性质可以帮助人们设计和制备具有特定表面活性、表面质量和表面几何形状的材料。

九年级下册化学知识点总结第一章:金属与矿物一、金属的性质1. 概念:金属是一种具有金属光泽、良好导电和导热性能的元素。
它们在常温下通常是固体(汞除外)。
2. 物理性质:导电性:金属中的自由电子可以流动,使得金属具有良好的导电性。
导热性:金属中的原子排列紧密,热量可以迅速通过金属传递。
延展性:金属可以在受到外力时延展成薄片或拉成细丝。
3. 化学性质:大多数金属可以与氧反应形成金属氧化物,如铁生锈。
许多金属可以与酸或碱反应,生成相应的盐和氢气。
二、金属的冶炼1. 定义:金属的冶炼是指从矿石中提取金属的过程。
2. 常见金属的冶炼方法:铁:通过高炉冶炼,使用焦炭、石灰石和铁矿石。
铜:通过电解冶炼,将铜矿石转化为铜的硫酸盐溶液,然后电解得到铜。
三、矿物与资源的利用1. 矿物的概念:矿物是自然界中固态的无机自然体,具有一定的化学成分和晶体结构。
2. 矿物资源的利用:矿物资源是人类的重要资源,如煤、石油、天然气等。
矿产资源的开采和利用需要合理规划和保护,以避免资源浪费和环境破坏。
第二章:化学反应与能量一、化学反应中的能量变化1. 定义:化学反应中的能量变化是指化学反应过程中吸收或释放的能量。
2. 性质:吸热反应:反应过程中吸收热量,如碳酸钙分解。
放热反应:反应过程中释放热量,如燃烧反应。
二、燃烧与灭火1. 燃烧的条件:可燃物:如木材、煤炭等。
助燃物:通常是氧气。
达到着火点:即达到一定的温度。
2. 灭火的方法:清除可燃物。
隔绝助燃物,如使用二氧化碳灭火器。
降低温度至着火点以下。
三、化学电池与电能1. 化学电池的概念:化学电池是一种将化学能转化为电能的装置。
2. 化学电池的工作原理:通过化学反应产生电子流动,从而产生电流。
常见的化学电池有干电池、蓄电池等。
第三章:有机化合物一、有机化合物的概念1. 定义:有机化合物是指含有碳元素的化合物,通常与生命活动相关。
2. 特点:大多数有机化合物具有复杂的分子结构。
有机化合物具有广泛的生物活性,如药物、激素等。
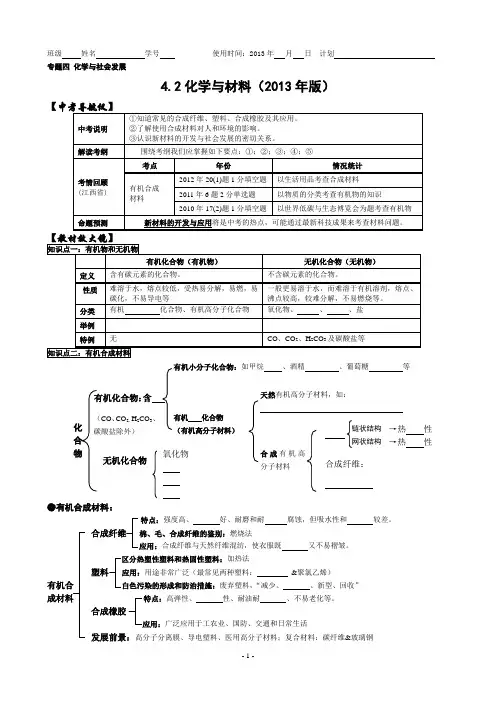
化合物(CO 、CO 2、H 2CO 碳酸盐除外) 无机化合物 有机化合物: 如甲烷 、酒精 、葡萄糖 等 有机 化合物 天然有机高分子材料,如:班级 姓名 学号 使用时间:2013年 月 日 计划 专题四 化学与社会发展4.2化学与材料(2013年版)【→热 性 →热 性●有机合成材料:特点:强度高、 好、耐磨和耐 腐蚀,但吸水性和 较差。
合成纤维 棉、毛、合成纤维的鉴别:燃烧法应用:合成纤维与天然纤维混纺,使衣服既 又不易褶皱。
加热法塑料 应用:用途非常广泛(最常见两种塑料: &聚氯乙烯)有机合 白色污染的形成和防治措施:废弃塑料,“减少、 、新型、回收” 成材料 特点:高弹性、 性、耐油耐 、不易老化等。
合成橡胶应用:广泛应用于工农业、国防、交通和日常生活发展前景:高分子分离膜、导电塑料、医用高分子材料;复合材料:碳纤维&玻璃钢■使用合成材料的利弊:“白色污染”及环境保护⑴危害:①破坏土壤,污染地下水;②危害海洋生物的生存;③如果焚烧含氯塑料会产生有毒的氯化氢气体,从而对空气造成污染。
⑵解决途径①使用塑料制品。
(现实中有哪些具体措施?);②利用某些塑料制品,如塑料袋、塑料盒等;③使用、的塑料,如微生物降解塑料和光降解塑料等;④各种废弃塑料。
(废弃塑料的回收存在什么样的障碍?当前有什么较好的措施解决这一问题?)⑶塑料的分类是回收和再利用的一大障碍【我的疑惑】请你将预习中未能解决的问题和有疑惑的问题写下来,待课堂上与老师和同学一起解决。
()①家用保鲜袋;②不锈钢;③淀粉;④尼龙布;⑤汽车轮胎A.①④⑤B.②③④C.②③⑤D.只有①⑤[分析]不锈钢不属于有机物;淀粉是有机高分子化合物,不是合成材料;家用保鲜袋、尼龙布、汽车轮胎都是有机高分子合成材料。
[解答]A[评析]要注意日常生活中常见的合成材料。
例题2:目前,我国急待解决的“白色污染”通常指( )A.冶炼中的白色烟尘B.石灰窑的白色粉末C.聚乙烯等塑料垃圾D.废弃橡胶制品[分析]“白色污染”主要是指由废弃塑料带来的环境污染,废弃橡胶制品不属于“白色污染”。

初中化学知识点总结8篇篇1一、基本概念1. 化学:化学是研究物质的组成、结构、性质以及变化规律的科学。
2. 物理变化:没有新物质生成的变化,如水的蒸发、固体熔化等。
3. 化学变化:有新物质生成的变化,如燃烧、酸碱中和等。
4. 物质的组成:物质由元素组成,如水由氢元素和氧元素组成。
5. 物质的性质:物质具有颜色、状态、气味等物理性质和可燃性、氧化性等化学性质。
二、常见元素及其化合物1. 氢气:无色无味易燃气体,密度小,难溶于水。
用途广泛,如燃料、化工原料等。
2. 氧气:无色无味气体,支持燃烧,供给呼吸。
用途广泛,如助燃剂、呼吸面具等。
3. 氮气:无色无味气体,难溶于水,不支持燃烧。
用途广泛,如保护气、氮肥原料等。
4. 碳:常温下为固态非金属,具有可燃性和还原性。
用途广泛,如燃料、还原剂等。
5. 硫酸:无色粘稠液体,具有吸水性和腐蚀性。
用途广泛,如干燥剂、催化剂等。
三、基本理论和实验1. 原子结构:原子由原子核和电子组成,原子核带正电,电子带负电。
了解原子结构有助于理解化学变化的本质。
2. 化学方程式:表示化学反应中各物质的量比关系的式子,通过化学方程式可以了解反应的实质和反应物的用量比。
3. 实验基本操作:包括仪器的使用、实验步骤、实验安全等,通过实验可以验证化学理论和探究化学规律。
四、能源和材料1. 能源:能源是提供能量的物质,如煤炭、石油、天然气等。
了解能源的种类和转化利用有助于合理使用和开发能源。
2. 材料:材料是制造产品的物质,如金属、塑料、玻璃等。
了解材料的性能和用途有助于选择合适的材料制造产品。
五、环境保护和绿色化学1. 环境保护:环境保护是指采取措施保护环境和资源,防止环境污染和生态破坏。
了解环境保护的意义和方法有助于培养环保意识。
2. 绿色化学:绿色化学是指设计和制造对环境友好的化学产品和方法,减少或消除对环境和人体的危害。
了解绿色化学的理念和技术有助于推动可持续发展。
总结:初中化学知识点涵盖了基本概念、常见元素及其化合物、基本理论和实验、能源和材料以及环境保护和绿色化学等方面。

完整版)初中化学金属知识点总结金属和金属材料复教案考点梳理]考点1:金属材料金属材料包括纯金属和合金两类。
金属是金属材料的一种,但金属材料不一定是纯金属,也可能是合金。
铁、铜、铝及其合金是人类使用最多的金属材料。
考点2:金属材料的发展史历史上,金属材料的发展经历了不同的阶段。
商朝时期,人们开始使用青铜器;春秋时期开始冶铁;战国时期开始炼钢。
铜和铁一直是人类广泛应用的金属材料。
在100多年前,铝开始被广泛使用,因为它具有密度小和抗腐蚀等优良性能,铝的产量已超过了铜,位于第二位。
金属分类:重金属:铜、锌、铅等轻金属:钠、镁、铝等黑色金属:铁、锰、铬及其合金。
Fe、Mn、Cr(铬)有色金属:除黑色金属以外的其他金属。
考点3:金属的物理性质金属具有一些共性:大多数金属都具有金属光泽,密度和硬度较大,熔沸点较高,具有良好的延展性和导电、导热性,在室温下除汞为液体,其余金属均为固体。
此外,不同的金属还有各自的特性:铁、铝等大多数金属都呈银白色,铜呈紫红色,金呈黄色;常温下大多数金属都是固体,汞却是液体;各种金属的导电性、导热性、密度、熔点、硬度等差异较大;银的导电性和导热性最好,锇的密度最大,锂的密度最小,钨的熔点最高,汞的熔点最低,铬的硬度最大。
检测一:金属材料1、金属的物理性质金属的物理性质包括色泽、状态、导电性、导热性、延展性、韧性和熔点等。
大多数金属呈银白色,有金属光泽,常温下为固态(汞为液态),具有良好的导电性、导热性、延展性和韧性,能够弯曲,熔点较高。
不同的金属还有各自的特性,如铜为固体,金呈黄色,钨的熔点最高,汞的熔点最低。
2、金属的用途金属材料广泛应用于各个领域,如首饰、电线、电缆、炊具、金属薄片、金属丝、曲别针等。
钨被用于电灯泡里的钨丝,铁被用于制造最大的铁锤等。
3、金属的分类金属可以分为重金属、轻金属、黑色金属和有色金属四类。
4、金属的发展史金属材料的发展经历了不同的阶段,从商朝时期的青铜器,到春秋时期的冶铁,再到战国时期的炼钢,铜和铁一直是人类广泛应用的金属材料。

化学与社会发展聚四氟乙烯(塑料王)耐低温、高温,耐化学腐蚀.耐溶剂性好.电绝缘性好,加工困难可制电气、航空、化学、医药、冷冻等工业的耐腐蚀、耐高温和耐低温的制品⑷合成纤维:棉、麻等植物纤维和动物的毛,木材、草类都是天然纤维。
用化学方法将竹、木材等加工制成的纤维是人造纤维。
合成纤维是用石油产品、煤、石灰石、水、空气等为原料,通过一系列的化学变化制成的纤维。
具有强度高、耐磨、弹性好、耐化学腐蚀等特点,但是吸水性不如天然纤维好。
⑸合成橡胶:合成橡胶是制造飞机、军舰、汽车、医疗器械等所必须的材料,与天然橡胶相比,合成橡胶具有高弹性,绝缘性好,耐油,耐高温等性能。
几种纤维、聚乙烯与聚氯乙烯的鉴别方法①聚乙烯与聚氯乙烯:点燃燃烧后产生刺激性气味的是聚氯乙烯。
②羊毛燃烧后有烧焦羽毛的气味。
例.有一块布料,请你鉴别是羊毛织物还是化纤织物。
4.复合材料(一般考点)⑴复合材料:是将两种或两种以上的材料复合成一体而形成的材料。
⑵优点:复合材料集中了组成材料的优点,具有更优异的综合性能。
⑶组成:复合材料由两部分组成,一部分称为基体,在复合材料中起黏结作用;另一部分称为增强体,在复合材料中起骨架作用。
⑷分类:按基体分为⑸常见的复合材料:钢筋混凝土、机动车的轮胎、玻璃钢等。
例1.材料是时代进步的重要标志,有机合成材料的出现更是材料发展史上的一次重大突破。
下面有关材料说法正确的是()A.合金、合成纤维都是有机合成材料B.水泥、玻璃钢、汽车轮胎都是常见的复合材料C.合成材料的大量使用给人类带来了严重污染,所以要禁止生产和使用D.开发使用可降解塑料能有效解决“白色污染”问题例2.科技文献中经常出现下列词汇,其中与相关物质的颜色并无联系的是( )A.赤色海潮 B.绿色食品 C.白色污染 D.棕色烟气例3.下列属于高分子合成材料的是()A.天然橡胶B.陶瓷C.合金D.合成纤维三.化学与环境1.空气的污染及防治(重点考点)⑵空气污染物的主要来源:煤、石油等燃料的燃烧,生产硫酸等工厂排放的尾气。


化学与材料概述
化学与材料是自然科学中两个重要的分支,它们在人类社会的发展和生活中起
着至关重要的作用。
化学是研究物质的组成、性质、结构、变化规律以及能量变化的科学,而材料科学则是研究材料的制备、性能、结构和应用的学科。
两者密切相关,相辅相成,共同推动着人类社会的进步。
首先,化学是一门研究物质的科学。
在化学中,我们可以了解到物质的组成,
比如元素和化合物的构成,以及它们之间的相互作用。
化学的研究范围广泛,涉及有机化学、无机化学、物理化学、分析化学等多个领域。
通过化学的研究,我们可以制备出各种各样的化合物,从而为人类社会的发展提供了无尽的可能性。
其次,材料科学是研究材料的制备、性能、结构和应用的学科。
材料是构成物
体的基本实体,它的性能直接影响着物体的使用效果。
材料科学的发展使得人类可以制备出各种各样的材料,如金属材料、非金属材料、高分子材料等,这些材料在建筑、交通、通信、医疗等领域都有着广泛的应用。
化学与材料的关系密切,它们相互促进,相辅相成。
化学为材料的制备提供了
基础,而材料的性能和应用也反过来促进了化学的发展。
比如,通过化学的研究,我们可以设计出更加优良的材料,从而提高物体的使用性能;而材料的性能和应用也可以带动化学的研究,促进新材料的开发和应用。
总之,化学与材料是自然科学中两个不可分割的部分,它们共同推动着人类社
会的发展和进步。
通过不断地研究和探索,我们可以更好地理解和利用化学与材料,为人类社会的可持续发展做出更大的贡献。
希望通过本文的介绍,读者能对化学与材料有更深入的了解,并对它们的重要性有更加清晰的认识。

高中化学知识点全部总结高中化学知识点总结一、基本概念与原理1. 物质的组成与分类- 物质由元素组成,分为纯净物和混合物。
- 纯净物包括单质和化合物,单质是由同种元素组成的纯净物,化合物是由不同种元素组成的纯净物。
2. 原子结构- 原子由原子核和核外电子构成。
- 原子核包含质子和中子,核外电子围绕原子核运动。
- 原子序数等于核内质子数,决定了元素的性质。
3. 化学式与化学方程式- 化学式表示物质的组成和分子的结构。
- 化学方程式表示化学反应的过程,包括反应物、生成物、反应条件和质量守恒。
4. 化学反应类型- 合成反应、分解反应、置换反应、还原-氧化反应等。
5. 物质的性质- 物理性质:密度、熔点、沸点、颜色、状态等。
- 化学性质:可燃性、氧化性、还原性、酸碱性等。
二、元素与化合物1. 元素周期表- 元素按照原子序数排列的表格,分为周期和族。
2. 主族元素- 包括碱金属、碱土金属、硼族、碳族、氮族、氧族、卤素和稀有气体。
3. 过渡金属- 包括第3至12族的金属元素,具有多种氧化态。
4. 化合物的性质- 酸碱盐的性质、氧化还原性质、配位化合物的性质等。
5. 无机化学- 研究无机化合物的化学分支,包括无机合成、无机结构、无机反应等。
6. 有机化学- 研究含碳化合物的化学分支,包括烃、醇、酚、醛、酮、酸、酯、胺等。
三、化学实验与计算1. 常见化学实验操作- 溶液的配制、酸碱滴定、气体的收集和检验、沉淀反应等。
2. 化学计算- 摩尔概念、物质的量浓度、反应热计算、化学平衡计算等。
3. 化学仪器的使用- 滴定管、天平、分液漏斗、蒸馏装置等。
四、化学与生活1. 化学与健康- 营养素的化学性质、药物的化学作用、环境污染的化学问题等。
2. 化学与能源- 化石燃料、核能、可再生能源的化学原理。
3. 化学与材料- 金属、塑料、陶瓷、复合材料的性质和应用。
4. 化学与环境- 化学反应对环境的影响、环境保护的化学技术。
五、化学安全与伦理1. 化学实验安全- 实验室安全规则、化学品的储存和处理、事故应急处理。
化学与材料科学知识点化学与材料科学是两个紧密相关的学科,涵盖了众多的知识点。
下面将介绍一些基础、重要和实用的化学和材料科学知识点。
1. 原子结构原子是化学和材料科学的基本单位,由质子、中子和电子组成。
质子和中子位于原子核中,电子绕核旋转,构成了稳定的原子结构。
原子的质子数称为原子序数,电子数和质子数相等时,原子是中性的。
2. 元素和周期表元素是由相同原子数的原子组成的,是化学和材料科学中的基本物质。
周期表是按照原子序数排列的元素表,包含了目前已知的所有元素。
周期表可根据元素的电子结构提供有关元素的重要信息。
3. 化学键化学键是原子之间形成的相互吸引力,能够将原子连接在一起形成分子或晶体。
常见的化学键包括共价键、离子键和金属键。
共价键是通过共享电子形成的,离子键是靠正负电荷吸引形成的,金属键则是金属中的自由电子共享。
4. 化学反应化学反应是物质之间发生转化的过程。
常见的化学反应类型包括合成反应、分解反应、置换反应和氧化还原反应。
反应的条件包括温度、压力、催化剂等因素,能够影响反应的速率和产物的选择。
5. 高分子材料高分子材料是由重复单元连接而成的长链聚合物。
常见的高分子材料包括塑料、橡胶和纤维。
高分子材料具有轻、强、耐热、耐化学腐蚀等特性,广泛应用于工业、建筑等领域。
6. 电化学电化学是研究电荷转移和物质转化之间关系的科学。
电化学可以应用于电池、电解以及电镀等领域。
电池通过化学反应将化学能转化为电能,而电解则是利用电能将化学物质分解为其它物质。
7. 材料表征技术材料表征技术用于研究材料的结构和性质。
常见的表征技术包括X射线衍射、扫描电子显微镜、透射电子显微镜等。
这些技术可以揭示材料的晶体结构、形貌和元素成分等信息。
8. 材料改性材料改性是通过调整材料的结构和组成,改变其性能和用途。
常用的改性方法包括添加增塑剂、填料或添加剂、改变处理条件等。
改性可以改善材料的强度、硬度、耐磨性、耐腐蚀性等性能。
9. 环境与可持续性化学与材料科学在环境保护和可持续发展方面发挥着重要作用。
绪论化学使世界变得更加绚丽多彩一、化学是什么化学是在分子、原子的基础上研究物质的、、以及的科学。
二、化学的作用1. 利用化学生产化肥、农药、合成药物、开发新能源和新材料。
2. 利用化学综合应用自然资源和保护环境。
三、化学发展史1. 古代化学图1 人面鱼纹彩陶盆图2 四羊青铜方尊图3 雁鱼青铜缸灯图4 酿酒画像砖图5 宋应星《天工开物》我国的某些化学工艺像、、,发明很早,对世界文明作出过巨大贡献。
2. 近代化学(1)的创立。
奠定了近代化学的基础。
和创立了,使化学成为一门独立的科学。
(2)元素周期律和元素周期表的发现。
组成物质的基本成分是。
发现了。
元素周期表的建立使学习与研究化学变得有规律可循。
元素周期表有横行即周期,个纵行但只有个族。
3. 现代化学(1)纳米技术1nm=10-9m纳米技术(nanotechnology)是用单个原子、分子制造物质的科学技术,研究结构尺寸在1至100纳米范围内材料的性质和应用。
(2)绿色化学绿色化学又称环境友好化学,其核心就是利用化学原理从源头上消除污染,绿色化学的主要特点有:①原料:充分利用资源和能源,采用无毒、无害的原料。
②条件:在无毒、无富的条件下进行反应,以减少度物向环境的。
③零排放:提高原于的利用率,力国使所有作为原料的原子都被产品所流纳,实现“零排放”。
④产品:生产出有利于环境保护,社区安全和人体健康的环境友好产品。
化学与国之重器中国航天火箭中国天宫空间站中国歼-20隐形歼击机中国大型盾构机中国“蛟龙”深海潜水器中国福建舰航母中国嫦娥六号探月车中国“羲和号”太阳探测器中国“天问”火星探测器化学是研究物质的、、、及的一门基础学科,其特征是从分子层次物质,通过化学变化物质。
1.常用化学元素12 3 4 5 6 7 8 9 10qīng hài lǐ pí péng tàn dàn yǎng fú nǎi2. 按元素周期表中元素的位置,临摹1~20号元素和另外10种常见元素的名称和符号。
高中化学材料知识点化学是一门研究物质的性质、结构、组成、变化规律以及能量变化的自然科学,是探讨物质基本单位和它们相互之间的联系以及变化过程的一门学科。
在高中化学课程中,化学材料是一个重要的知识点,涵盖了许多与材料结构、性质和应用相关的内容。
本文将系统地介绍高中化学中与材料相关的知识点,让读者更好地理解和掌握这部分内容。
1. 常见的材料类型在化学中,材料可以分为无机材料和有机材料两大类。
无机材料包括金属、非金属、无机非金属材料等,有机材料包括聚合物、生物材料等。
金属是一种电子互相共享的晶体结构,常见的金属有铁、铜、铝等;非金属则是由共价键或离子键连接起来的分子结构,如碳、氢、氧等元素;无机非金属材料多用于建筑、陶瓷、电子器件等领域;聚合物是由许多重复单体单元通过共价键连接而成的大分子化合物,如塑料、橡胶等;生物材料则是来源于生物体的材料,如木材、纤维素等。
2. 材料的结构特点材料的结构是决定其性质和用途的重要因素。
金属材料的结构呈现出金属晶体结构,其中金属离子排列在规则的晶格中,并存在自由电子,导致金属具有导电性、延展性等特点;非金属材料的结构多为分子或离子晶体,其中分子或离子通过共价键或离子键连接在一起,导致非金属常见的硬度大、脆性等特点;聚合物材料的结构呈现出大分子链状结构,其中聚合物分子通过共价键连接在一起,导致聚合物具有良好的可塑性、弹性等特点。
3. 材料的性质和应用材料的性质与其结构密切相关。
金属材料具有良好的导电性、导热性和延展性,常用于电线、导线、汽车零部件等领域;非金属材料具有较高的硬度、脆性和绝缘性,常用于建筑、陶瓷、电子器件等领域;聚合物材料具有良好的可塑性、弹性和绝缘性,常用于塑料制品、橡胶制品、纤维等领域;生物材料具有较好的生物相容性和可降解性,常用于医疗器械、食品包装等领域。
4. 材料的制备和性能控制在材料应用过程中,制备和性能控制是至关重要的环节。
金属材料的制备常采用熔炼、铸造、淬火等工艺;非金属材料的制备常采用矿石提炼、化学合成等方法;聚合物材料的制备常通过聚合反应、共聚反应等方式实现;生物材料的制备常通过天然生物体提取、人工合成等途径实现。
【初中化学】初中化学知识点:天然有机高分子材料有机物:含有碳元素的化合物称为有机化合物(一氧化碳、二氧化碳、碳酸钙等除外),简称有机物。
有机高分子:有些有机物的相对分子质量比较大,通常称它们为有机高分子化合物,简称有机高分子。
如淀粉、蛋白质、纤维素、塑料、橡胶等。
【有机高分子模型】有机高分子材料:用有机高分子化合物做成的材料就是有机高分子材料。
有机高分子材料分为:(1)天然有机高分子材料:比如:棉花、羊毛、天然橡胶等。
(2)合成有机高分子材料:例如:塑料、合成橡胶、合成纤维等,简称合成材料。
常用的天然有机高分子材料及其特点:1、棉花:棉花的主要成分是纤维素,纤维素含量高达90%以上。
棉纤维能制成多种规格的织物,用它制成的衣服具有耐磨并能在高温下熨烫,良好的吸湿性、透气性和穿着舒适的优点。
2、羊毛:羊毛主要南蛋白质形成,就是纺织工业的关键原料,织物具备弹性不好、吸湿性弱、保暖性不好等优点。
3、蚕丝:蚕丝是蚕结茧时形成的长纤维,也是一种天然纤维,其主要成分是蛋白质。
蚕丝质轻而细长,织物光泽好、穿着舒适、手感滑顺、导热性差、吸湿透气性好。
中国是世界上最早使用丝织物的国家。
4、天然橡胶:天然橡胶就是所指从橡胶树上收集的天然胶乳,经过凝同、潮湿等加工工序做成的弹性固状物。
天然橡胶就是一种以共聚异戊二烯为主要成分的天然高分子化合物。
分子式就是(c5h8)n,其成分中91%~94%就是橡胶烃(共聚异戊二烯),其余为蛋白质、脂肪酸、糖类等非橡胶物质,就是应用领域最广泛的通用型橡胶。
相关初中化学知识点:合成有机高分子材料定义:有机合成材料:常称聚合物,如聚乙烯分子是由成千上万个乙烯分子聚合而成的高分子化合物。
有机合成材料的基本性质:1、聚合物由于高分子化合物大部分就是由小分子生成而变成的,所以也常称作聚合物。
比如,聚乙烯分子就是由成千上万个乙烯分子生成而变成的高分子化合物。
2、合成有机高分子材料的基本性质①热塑性和热固性。
初中化学知识点总结整理一、基本概念与定义1. 物质:物质是构成宇宙万物的基本实体,具有质量和体积。
2. 元素:由相同类型的原子组成的纯物质。
3. 化合物:由两种或两种以上不同元素的原子以固定比例结合而成的纯物质。
4. 混合物:由两种或两种以上不同物质混合而成,各组成部分保持其原有性质。
5. 分子:由两个或多个原子通过化学键结合而成的稳定粒子。
6. 原子:物质的基本单位,由原子核和电子组成。
7. 原子核:位于原子中心,由质子和中子组成。
8. 电子:带有负电的粒子,围绕原子核运动。
9. 离子:带有正电或负电的原子或分子。
二、化学变化与方程式1. 化学反应:物质之间发生的化学变化,伴随着能量的吸收或释放。
2. 化学方程式:用化学符号表示化学反应的方程。
3. 质量守恒定律:在化学反应中,反应前后物质的总质量保持不变。
4. 能量守恒定律:能量既不会被创造也不会被消灭,只会从一种形式转换为另一种形式。
三、元素周期表1. 元素周期表:按照原子序数排列所有已知元素的表格。
2. 主族元素:周期表中A族和B族的元素,具有相似的化学性质。
3. 过渡元素:周期表中位于主族元素和稀有气体之间的元素。
4. 稀有气体:周期表最右侧的一组元素,化学性质非常稳定,不易与其他元素反应。
四、常见物质的性质与分类1. 气体:没有固定形状和体积,受压时体积可缩小的物质。
2. 液体:有一定体积,但没有固定形状的物质。
3. 固体:有固定形状和体积的物质。
4. 酸碱性:酸性物质能使蓝色石蕊试纸变红,碱性物质能使红色石蕊试纸变蓝。
5. 氧化还原反应:物质之间发生电子转移的反应。
五、常见实验操作与安全知识1. 实验操作:包括称量、溶解、过滤、蒸发、蒸馏等基本操作。
2. 实验室安全:了解化学品的性质,正确使用实验器材,佩戴适当的防护装备。
3. 事故处理:熟悉急救措施,了解化学品泄漏、火灾等事故的处理方法。
六、化学与生活1. 化学与健康:了解营养素的化学性质,认识药物的作用机理。