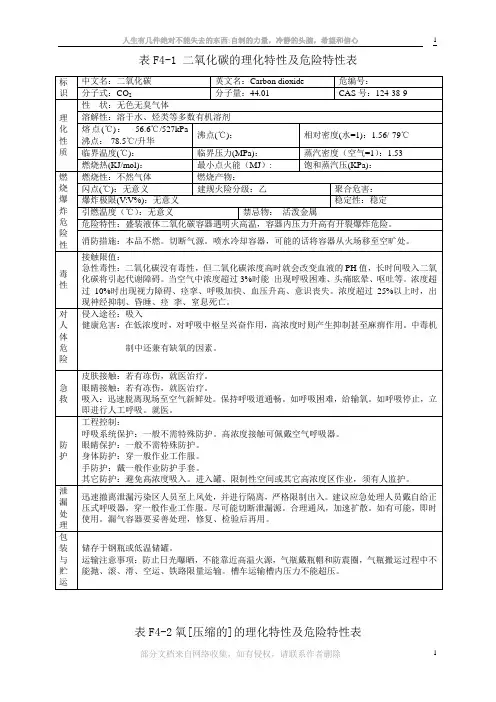
氨气理化性质表
- 格式:docx
- 大小:45.05 KB
- 文档页数:5

1.别名・英文名液氨;Ammonia、Liquid amlllorlia.2•用途氮肥、铁盐、硝酸、尿素、丙烯肠、三聚飢醜胺、丙烯酰胺、氢氤酸、无机试剂、药品、染料、酸性中和剂、橡胶氧化剂、金属表面氮化、制冷剂、半导体用气体、負化、氮化膜、化学气相淀积、标准气、校正气、在线仪表标准气。
3.制法氢和氮在高温高压时在催化剂的作用下合成而得氨。
4.理化性质分子量:熔点:°C沸点:。
C 液体密度。
C, : 729kg/m3气体密度(0V, : m3相对密度(气体,空气=°C,: 比容°C, : kg气液容积比:(15°C, lOOkPa): 947 L/L 临界温度:°C临界压力:11277kPa临界密度:235kg/m3压缩系数:压缩系数压力kPa420K300K 380K 580K熔化热°C, : kg气化热°C, : kg比热容,300K): Cp=(kg - K)比热比(气体,°C, : CP/Cv=蒸气压(-20°C):(0°C):(20X2): 829,9kPa粘度(气体,20°C, : - s (液体,°C):・s表面张力(20 °C): m导热系数(lOOkPa, 300K): W/(m・K)(液体,10°C): w/(m ・ K)折射率(气体,0。
(2,:(气体,25笙,:空气中可燃范围(20笙,:15%〜27%空气中最低自燃点:690°C負气中可燃范围(2(TC, : 14%〜79%氧气中化学当量燃烧热:17354 kJ/m3(高)14361 kJ/m3(低)毒性级别:2(液氨:3级)易燃性级别:1 易爆性级别:0 火灾危险:中等度氨在常温常压下为具有特殊刺激性恶臭的无色有毒气体,比空气轻。
氨在常温下稳定,但是在高温分解成氢和氮。
一般在一个大气压下450-500°C时分解,如果有铁、镰等催化剂存在,可在300€时分解。
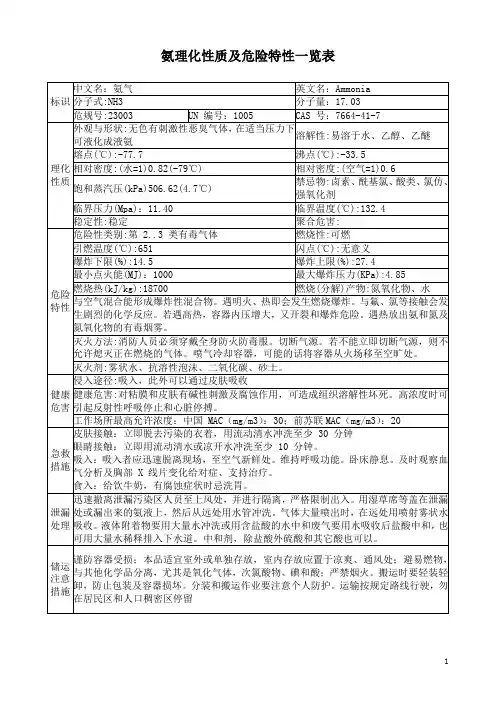

化工氨气废气处理技术方案一、废气特性氨气(NH3)废气由于其特殊化学性质和易挥发性,会对环境和人体造成极大威胁。
氨气是水溶性气体,不能直接燃烧,其化学性质与水分相似,是一种亲水性极强的气体,其分子量为17.032,熔点-77.7℃,沸点-33.34℃,相对密度(空气=1)0.589,属于碱性气体,能与酸反应,其理化性质如下表:表 1 氨气(NH3)理化性质物理性质化学性质分子式 NH3 氨气是一种无色、有刺激性气味、高度易燃物·分子量 17.03 许多物质(如氯、硝酸、氯气等)和氨气接触会发生剧烈化学反应。
密度 0.59 氨气可以与二氧化碳反应生成尿素。
沸点(℃) -33.4 氨气可以与许多有机化合物发生置换反应生成胺类化合物。
熔点(℃) -77.7 (NH3+HCl=NH4Cl)水溶解度好(NH3+H2O=NH4OH)二、NH3废气处理技术方案1.物理吸附+化学反应法该方法在氨气的吸收和化学反应方面具有很高的效率,但是由于吸附剂必须在连续循环中进行,所以过程中存在温度和湿度的限制,对吸附剂的选择也会对工艺的的稳定性和可操作性带来影响。
因此,该技术组合需要精细的控制和运营方案才能够达到理想的目标。
2.超高温焚烧法超高温焚烧法是一种高效的NH3废气治理技术。
该方法采用高温条件下将NH3 进行燃烧,这种化学反应会产生二氧化碳,三氧化硫(SO3)和氮氧化物。
这不仅使其解决了NH3废气问题,也能够减小其他化合物造成的影响。
3.湿法脱硫法湿法脱硫法是一种成熟的NH3废气治理技术。
该方法利用气液吸收原理,将NH3吸收在吸收液中,从而达到脱去NH3的目的。
该方法不仅适用于 NH3废气,也适用于其他含有硫化物的工业废气。
该方法相对其他技术成本较低,稳定性也比较高,可以生产相对稳定的废气。
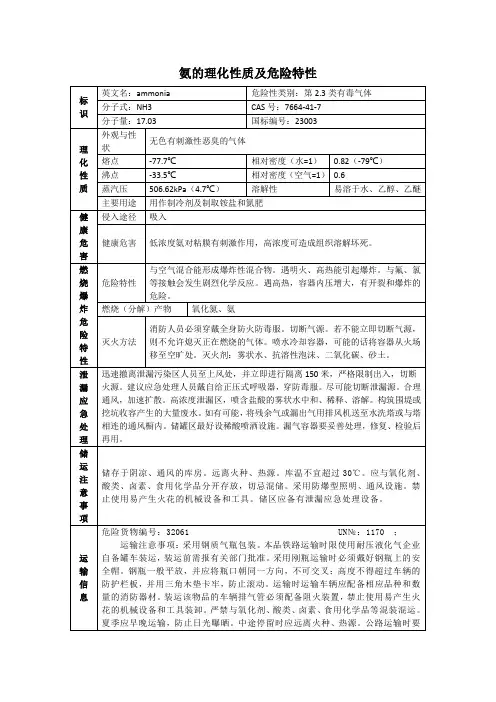

氨气的理化性质及危险特性
1. 理化性质
- 化学式:NH3
- 分子量:17.03 g/mol
- 物态:气体
- 密度:0.589 g/L
- 沸点:-33.34°C
- 熔点:-77.73°C
- 溶解性:易溶于水
- 颜色:无色
- 气味:刺鼻气味
2. 危险特性
- 氨气具有较强的腐蚀性,能够直接腐蚀皮肤、眼睛和呼吸道黏膜。
- 高浓度的氨气在空气中能形成爆炸性混合物,具有爆炸和燃烧危险。
- 氨气在空气中比空气重,易于聚集在低洼处,对于密闭空间
可能存在窒息和窒息危险。
- 氨气可与氧化剂和酸类物质发生剧烈反应,产生火灾和爆炸。
3. 安全措施
- 在处理氨气时,应尽量避免其接触皮肤、眼睛和呼吸道,使
用防护手套、护目镜和防护面罩等个人防护装备。
- 在储存和搬运氨气时,应选择密闭,并保持通风良好的储存
环境,避免气体泄漏。
- 避免氨气与氧化剂和酸类物质接触,以防止发生火灾和爆炸。
- 在使用氨气时,应保持操作区域通风良好,避免气体聚集。
如发现气味异常,应立即离开操作区域并寻求专业人员帮助。
以上是关于氨气的理化性质及危险特性的基本信息,请在使用
或处理氨气时务必严格遵守相关安全规定,保障人身和环境安全。
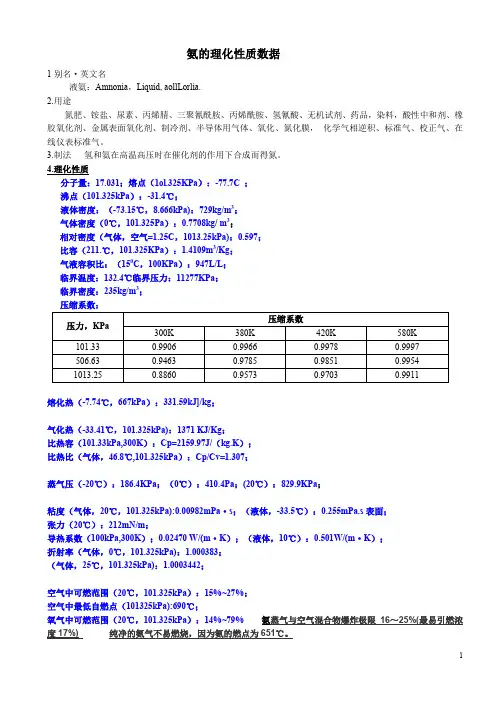
氨的理化性质数据1别名·英文名液氨:Amnonia,Liquid, aollLorlia.2.用途氮肥、铵盐、尿素、丙烯腈、三聚氰酰胺、丙烯酰胺、氢氰酸、无机试剂、药品,染料,酸性中和剂、橡胶氧化剂、金属表面氧化剂、制冷剂、半导体用气体、氧化、氮化膜,化学气相逆积、标准气、校正气、在线仪表标准气。
3.制法氢和氨在高温高压时在催化剂的作用下合成而得氮。
4.理化性质分子量:17.031;熔点(1ol.325KPa):-77.7C ;沸点(101.325kPa):-31.4℃;液体密度:(-73.15℃,8.666kPa):729kg/m3;气体密度(0℃,101.325Pa):0.7708kg/ m3;相对密度(气体,空气=1.25C,1013.25kPa):0.597;比容(211.℃,101.325KPa):1.4109m3/Kg;气液容积比:(150C,100KPa):947L/L;临界温度:132.4℃临界压力:11277KPa;临界密度:235kg/m3;压缩系数:熔化热(-7.74℃,667kPa):331.59kJ]/kg;气化热(-33.41℃,101.325kPa):1371 KJ/Kg;比热容(101.33kPa,300K):Cp=2159.97J/(kg.K);比热比(气体,46.8℃,101.325kPa):Cp/Cv=1.307;蒸气压(-20℃):186.4KPa;(0℃):410.4Pa;(20℃):829.9KPa;粘度(气体,20℃,101.325kPa):0.00982mPa·s;(液体,-33.5℃):0.255mPa.s表面;张力(20℃):212mN/m;导热系数(100kPa,300K);0.02470 W/(m·K);(液体,10℃):0.501W/(m·K);折射率(气体,0℃,101.325kPa):1.000383;(气体,25℃,101.325kPa):1.0003442;空气中可燃范围(20℃,101.325kPa):15%~27%;空气中最低自燃点(101325kPa):690℃;氧气中可燃范围(20℃,101.325kPa):14%~79% 氨蒸气与空气混合物爆炸极限16~25%(最易引燃浓度17%) 纯净的氨气不易燃烧,因为氨的燃点为651℃。

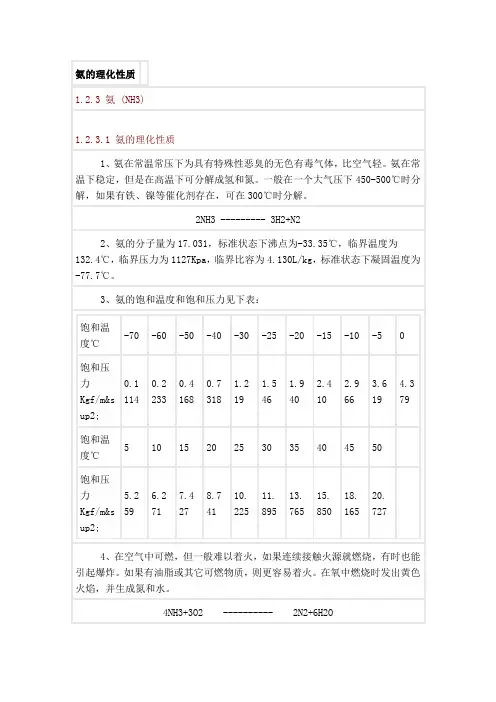
氨的理化性质、危害及应急处理知识1. 氨的理化性质和用途:分子式 NH3有毒气体沸点(℃) -33.5 易溶于水、乙醇、乙醚无色有刺激性恶臭的气体。
主要用途用做制冷剂及制取铵盐和氮肥。
储于耐压钢瓶或钢槽中由气态氨液化而得。
2. 燃烧爆炸特性:易燃、爆炸下限(%)15.7 爆炸上限(%)27.4 ,与空气混合能形成爆炸性混合物。
遇明火、高热能引起燃烧爆炸。
与氟、氯等接触会发生剧烈反应。
若遇高热,容器内压增大,有开裂和爆炸的危险。
3. 灭火方法:必须穿戴全身防火防毒服。
切断气源。
若不能立即切断气源,则不允许熄灭正在燃烧的气体。
喷水冷却容器,可能的话将容器从火场移至空旷处。
使用灭火剂:雾状水、干粉、二氧化碳、砂土。
4. 健康危害:吸入低浓度氨对粘膜有刺激作用,高浓度可造成组织溶解坏死。
高浓度氨可引起反射性呼吸停止。
5. 急救措施:皮肤接触,立即脱去被污染的衣着,应用2%硼酸液或大量清水彻底冲洗,就医。
眼睛接触,立即提起眼睑,用大量流动清水或生理盐水彻底冲洗至少15分钟,就医。
吸入迅速脱离现场至空气新鲜处,保持呼吸道通畅,如呼吸困难,给输氧,如呼吸停止,立即进行人工呼吸,就医。
6. 泄漏应急处理:迅速撤离泄漏污染区人员至上风处,并立即隔离150m ,严格限制出入。
切断火源。
建议应急处理人员戴自给正压式呼吸器,穿防毒服。
尽可能切断泄漏源。
合理通风,加速扩散。
漏气容器要妥善处理,废弃或修复、检验后再用。
爆炸下限(V%): 15.7 爆炸上限(V%): 27.4危险特性:与空气混合能形成爆炸性混合物,遇明火、高热能引起燃烧爆炸。
与氟、氯等能发生剧烈的化学反应。
若遇高热,容器内压增大,有开裂和爆炸的危险。
燃烧(分解)产物:氧化氮、氨。
稳定性:稳定禁忌物:卤素、酰基氯、酸类、氯仿、强氧化剂。
聚合危害:不能出现灭火方法:切断气源。
若不能立即切断气源,则不允许熄灭正在燃烧的气体。
喷水冷却容器,可能的话将容器从火场移至空旷处。

氨理化性质及其毒性表
氨的理化性质及其毒性表
氨是一种无色气体,具有特殊刺激性气味。
以下是氨的理化性质及其毒性表:
毒性方面,在高浓度下,氨对人体和动物的呼吸系统和眼睛有刺激作用。
以下是氨的毒性表:
因此,在使用氨时,应注意保持适当的通风条件,避免高浓度的氨暴露。
如发生氨中毒,应立即离开受污染区域,并寻求医疗救助。
以上是关于氨的理化性质及其毒性的简要信息。
如有进一步需要,请参阅相关文献和专业指南以获得更详细的信息。
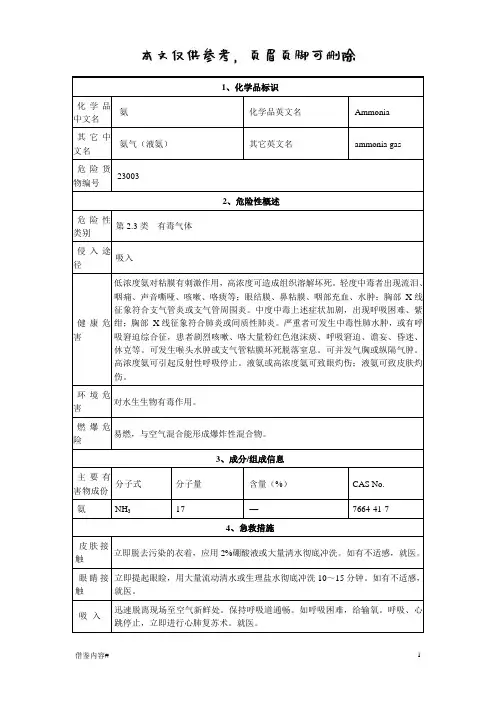
1、化学品标识化学品中文名氨化学品英文名Ammonia其它中文名氨气(液氨)其它英文名ammonia gas 危险货物编号230032、危险性概述危险性类别第2.3类有毒气体侵入途径吸入健康危害低浓度氨对粘膜有刺激作用,高浓度可造成组织溶解坏死。
轻度中毒者出现流泪、咽痛、声音嘶哑、咳嗽、咯痰等;眼结膜、鼻粘膜、咽部充血、水肿;胸部X线征象符合支气管炎或支气管周围炎。
中度中毒上述症状加剧,出现呼吸困难、紫绀;胸部X线征象符合肺炎或间质性肺炎。
严重者可发生中毒性肺水肿,或有呼吸窘迫综合征,患者剧烈咳嗽、咯大量粉红色泡沫痰、呼吸窘迫、谵妄、昏迷、休克等。
可发生喉头水肿或支气管粘膜坏死脱落窒息。
可并发气胸或纵隔气肿。
高浓度氨可引起反射性呼吸停止。
液氨或高浓度氨可致眼灼伤;液氨可致皮肤灼伤。
环境危害对水生生物有毒作用。
燃爆危险易燃,与空气混合能形成爆炸性混合物。
3、成分/组成信息主要有害物成份分子式分子量含量(%)CAS No.氨NH317 —7664-41-74、急救措施皮肤接触立即脱去污染的衣着,应用2%硼酸液或大量清水彻底冲洗。
如有不适感,就医。
眼睛接触立即提起眼睑,用大量流动清水或生理盐水彻底冲洗10~15分钟。
如有不适感,就医。
吸入迅速脱离现场至空气新鲜处。
保持呼吸道通畅。
如呼吸困难,给输氧。
呼吸、心跳停止,立即进行心肺复苏术。
就医。
食入不会通过该途径接触。
5、消防措施危险特性与空气混合能形成爆炸性混合物,遇明火、高热能引起燃烧爆炸。
与氟、氯等接触会发生剧烈的化学反应。
若遇高热,容器内压增大,有开裂和爆炸的危险。
有害燃烧产物氮氧化物、氨。
灭火方法切断气源。
若不能切断气源,则不允许熄灭泄漏处的火焰。
消防人员必须佩戴空气呼吸器、穿全身防火防毒服,在上风向灭火。
尽可能将容器从火场移至空旷处。
喷水保持火场容器冷却,直至灭火结束。
用雾状水、抗溶性泡沫、二氧化碳、砂土灭火。
灭火剂6、泄漏应急处理应急处理消除所有点火源。
氨的理化性质氨的理化性质:1、在常温常压下为具有特殊性恶臭的无色有毒气体,比空气轻。
氨在常温下稳定,但是在高温下可分解成氢和氮。
一般在一个大气压下450-500℃时分解,如果有铁、镍等催化剂存在,可在300℃时分解。
2NH3 =3H2+N22、氨的分子量为17.031,标准状态下沸点为-33.35℃,临界温度为132.4℃,临界压力为1127Kpa,临界比容为4.130L/kg,标准状态下凝固温度为-77.7℃。
3饱和温度℃饱和压力Kgf/m饱和温度℃饱和压力Kgf/m4、在空气中可燃,但一般难以着火,如果连续接触火源就燃烧,有时也能引起爆炸。
如果有油脂或其它可燃物质,则更容易着火。
在氧中燃烧时发出黄色火焰,并生成氮和水。
4NH3+3O2=2N2+6H2O5、氨在一氧化二氮中也能发生爆炸,爆炸浓度极限为2.2%-72%。
6、氨微溶于甲醇、乙醇、二氯甲烷和乙醚。
7、液氨的蒸发潜热仅次于水而很大,0℃时为301.8Cal/g。
因此具有类似水的性质,能溶解许多物质。
其溶液也显示出许多与水溶液类似的性质。
液氨能溶解铵盐,各种金属销盐酸、碘化物、酚类和胺类。
危险性:最高允许浓度:25ppm(18mg/m³)氨主要是通过呼吸道吸入,此外,也可以通过皮肤吸收。
吸入高浓度氨气引起喷嚏、流延、咳嗽、恶心、头痛、出汗、脸面充血、胸疼、呼吸急促、尿频、眩晕、窒息感、不安感、胃疼、闭尿等症状。
刺激眼睛引起流泪、眼疼、视觉障碍。
皮肤接触后引起皮肤刺激、皮肤发红、可导致灼伤和糜烂。
慢性中毒时患者出现头痛、噩梦、食欲不振、易于激动、慢性结膜炎、慢性支气管炎、血痰、耳鸣等。
吸入氨气的患者应立即转移到安全区安置休息并保暖。
咳嗽时可服可待因。
呼吸微弱或停止时立即进行输氧或人工呼吸。
并速叫医生来诊治。
皮肤接触时,立刻用水冲洗后再用肥皂水洗净,然后盖上用5%醋酸、柠檬酸、酒石酸或盐酸浸湿的敷料,也可用2%以上的硼酸水湿敷。
氨气物性参数1.别名·xx液氨;Ammonia、Liquid amlllorlia.2.用途氮肥、铵盐、硝酸、尿素、丙烯腈、三聚氰酰胺、丙烯酰胺、氢氰酸、无机试剂、药品、染料、酸性中和剂、橡胶氧化剂、金属表面氮化、制冷剂、半导体用气体、氧化、氮化膜、化学气相淀积、标准气、校正气、在线仪表标准气。
3.制法氢和氮在高温高压时在催化剂的作用下合成而得氨。
4.理化性质分子量:17.031熔点(101.325kPa):-77.7℃沸点(101.325kPa):-33.4℃液体密度(-73.15℃,8.666kPa):729kg/m3气体密度(0℃,101.325kPa):0.7708kg/m3相对密度(气体,空气=1.25℃,101.325kPa):0.597比容(21.1℃,101.325kPa):1.4109m3/kg气液容积比:(15℃,100kPa):947L/L 临界温度:132.4℃临界压力:11277kPa临界密度:235kg/m3 压缩系数:压缩系数压力kPa300K380K420K580K101.330.99060.99660.99780.9997506.630.94630.97850.985l0.99541013.250.88600.95730.97030.9911熔化热(-77.74℃,6.677kPa):331.59kJ/kg气化热(-33.41℃,101.325kPa):1371.18kJ/kg比热容(101.33kPa,300K):Cp=2159.97J/(kg·K)比热比(气体,46.8℃,101.325kPa):CP/Cv=1.307蒸气压(-20℃):186.4kPa(0℃):410.4kPa(20℃):829,9kPa粘度(气体,20℃,101.325kPa):0.00982mPa·s(液体,-33.5℃):0.255mPa·s 表面张力(20℃):21.2mN/m导热系数(100kPa,300K):0.02470 W/(m·K)(液体,10℃):0.501 w/(m·K)折射率(气体,0℃,101.325kPa):1.000383(气体,25℃,101.325kPa):1.空气中可燃范围(20℃,101.325kPa):15%~27%空气中最低自燃点(101.325kPa):690℃氧气中可燃范围(20℃,101.325kPa):14%~79%氧气中化学当量燃烧热:17354 kJ/m3(高) 14361 kJ/m3(低)毒性级别:2(液氨:3级)易燃性级别:1易爆性级别:0火灾危险:中等度氨在常温常压下为具有特殊刺激性恶臭的无色有毒气体,比空气轻。